Внимание! Статья адресована врачам-специалистам
DOI: 10.24412/2076-4812-2025-10373-24-30
Mokhort T.V.
Belarusian State Medical University, Minsk
Vitamin B12 deficiency in adults (the point оf view of an endocrinologist)
Резюме. Представлен анализ данных литературы распространенности дефицита витамина В12, фактора риска его развития и влияния на здоровье. Рассмотрены вопросы показаний для оценки статуса витамина В12, принципах его оценки с использованием различных биомаркеров. Отдельное внимание уделено критериям статуса витамина В12 по оценке различных методологических подходов и обоснованию показаний для профилактики и лечения дефицита витамина В12. Определены группы риска для проведения профилактических и лечебных мероприятий. Обоснована целесообразность использования витамина В12 при сахарном диабете 2-го типа и использовании метформина, в лечении диабетической невропатии, депрессии, когнитивном дефиците, анемии. Приведены данные, свидетельствующие о потенциале использования инъекционных и пероральных форм витамина В12, с указанием длительности лечения.
Ключевые слова: витамин В12, биомаркеры дефицита витамина В12, сахарный диабет 2-го типа, диабетическая невропатия, когнитивный дефицит, метформин, потенциал коррекции дефицита витамина В12.
Для цитирования: Мохорт Т.В. Дефицит витамина В12 у взрослых (точка зрения эндокринолога) // Медицинские новости. – 2025. – №10. – С. 24–30.
Summary. An analysis of the literature data on the prevalence of vitamin B12 deficiency, the risk factor for its development and its impact on health is presented. The issues of indications for assessing the status of vitamin B12, the principles of its assessment using various biomarkers are considered. Special attention is paid to the criteria for vitamin B12 status in assessing various methodological approaches and substantiating indications for the prevention and treatment of vitamin B12 deficiency. Risk groups have been identified for preventive and curative measures. The expediency of using vitamin B12 in type 2 diabetes mellitus and the use of metformin in the treatment of diabetic neuropathy, depression, cognitive deficits, anemia is substantiated. Data indicating the potential of using injectable and oral forms of vitamin B12 are presented, indicating the duration of treatment.
Keywords: vitamin B12, biomarkers of vitamin B12 deficiency, type 2 diabetes mellitus, diabetic neuropathy, cognitive deficits, metformin, potential correction of vitamin B12 deficiency.
For citation: Mokhort T.V. Vitamin B12 deficiency in adults (the point оf view of an endocrinologist) // Meditsinskie novosti. – 2025. – N10. – P. 24–30.
Витамин B12 (кобаламин) – общий термин для соединений с одинаковой биологической активностью, включающих цианокобаламин, гидроксикобаламин формы B12 – метилкобаламин [1]. Витамин В12 выполняет ряд важных функций в организме человека: участвует в процессах метилирования ДНК, деления, роста и созревания клеток, является коферментом, необходимым для синтеза белковых и жировых структур миелиновой оболочки нервных волокон, РНК, ДНК, нейротрансмиттеров, оказывает влияние на метаболизм аминокислот и углеводов. Перечисленные эффекты определяют роль витамина В12 в кроветворении, функционировании нервной системы и процессах старения [2–4]. и кобаламид, аквакобаламин, нитрокобаламин, диаквакобинамид, коферментные
Недостаточность витамина В12 в питании – достаточно распространенное явление, распространенность колеб-лется от 3 до 16% в общей популяции, однако может достигать 20% и выше у пожилых людей и в других группах риска [5–7]. К группам риска дефицита витамина В12 относятся:
>люди пожилого возраста (в возрасте 65–74 лет – распространенность дефицита витамина В12 составляет 56%, а у людей ≥75 лет – 93%);
>лица с особенностями питания (ограничение использования животного белка – веганы и вегетарианцы);
>пациенты с заболеваниями желудочно-кишечного тракта (воспалительные заболевания ЖКТ, пониженная кислотность желудка, хирургические вмешательства на ЖКТ, синдром мальабсорбции, лечение препаратами из группы ингибиторов протонной помпы и другими препаратами, снижающими кислотность желудочного сока);
>пациенты, длительно принимающие некоторые лекарственные средста (ингибиторы протонной помпы, антагонисты H2-рецептора, изониазид, метформин, фенобарбитал, прегабалин, топирамат и др.) [8–10].
До настоящего времени в мышлении клиницистов доминирует понимание связи дефицита витамина В12 и анемии, а полное понимание причин его возникновения, неспецифических проявлений, современных методов диагностики и эффективной терапии ограничено. В то же время неоспоримо доказано негативное влияние дефицита витамина В12 на нервную систему, обусловленное рядом факторов. Во-первых, это нарушение синтеза холина и холин-содержащих фосфолипидов (лецитин, сфингомиелин) с последующим накоплением токсичного для нервной системы метилмалоната, вызывающего жировую дистрофию нейронов и демиелинизацию нервных волокон. Второй фактор – накоп-ление в цереброспинальной жидкости нейротоксичных веществ и уменьшение содержания нейротрофических факторов, в частности уменьшение эпидермального фактора роста нервов [3, 11, 12]. Кроме того, дефицит витамина В12 сопровождается гипергомоцистеинемией, оказывающей влияние на сосудистый эндотелий, тромбообразование, активацию окислительного стресса, избыточное образование оксида азота и реактивных форм кислорода, что играет важную роль в нарушении микроциркуляции [13].
По мнению российских экспертов, у 30–50% пациентов с дефицитом витамина В12 наблюдается та или иная степень неврологического поражения, что имеет особое значение для лиц с сахарным диабетом (СД) [14, 15]. Неврологические симптомы могут проявляться симпотомокомплексом полинейропатии, когнитивными нарушениями, депрессивными проявлениями. Для пациентов с СД дефицит витамина В12 имеет особое значение, что связано с высокой распространенностью заболевания в пожилом возрасте, широким использованием метформина, актуальностью для этой категории пациентов различных проявлений нейропатии, акселерацией когнитивного дефицита, увеличением частоты выявления депрессивных нарушений и анемии, особенно часто манифестирующей при прогрессии хронической болезни почек [10, 16–19]. Как уже было указано, использование метформина связано со снижением концентрации витамина B12 в сыворотке крови. При этом эффект был продемонстрирован уже через 3 месяца после начала приема препарата, а его снижение связано с высокой частотой и худшими показателями нейропатии [10, 20–22]. Также доказана ассоциация дефицита витамина В12 и кардиоваскулярной автономной нейропатии [23]. Механизм влияния метформина на развитие дефицита витамина В12 включает снижение секреции внутреннего фактора Касла, повышение накопления витамина В12 в печени, изменение метаболизма желчных кислот с последующим развитием гипергомоцистеинемии и активацию оксидативного стресса (рис. 1) [24, 25].
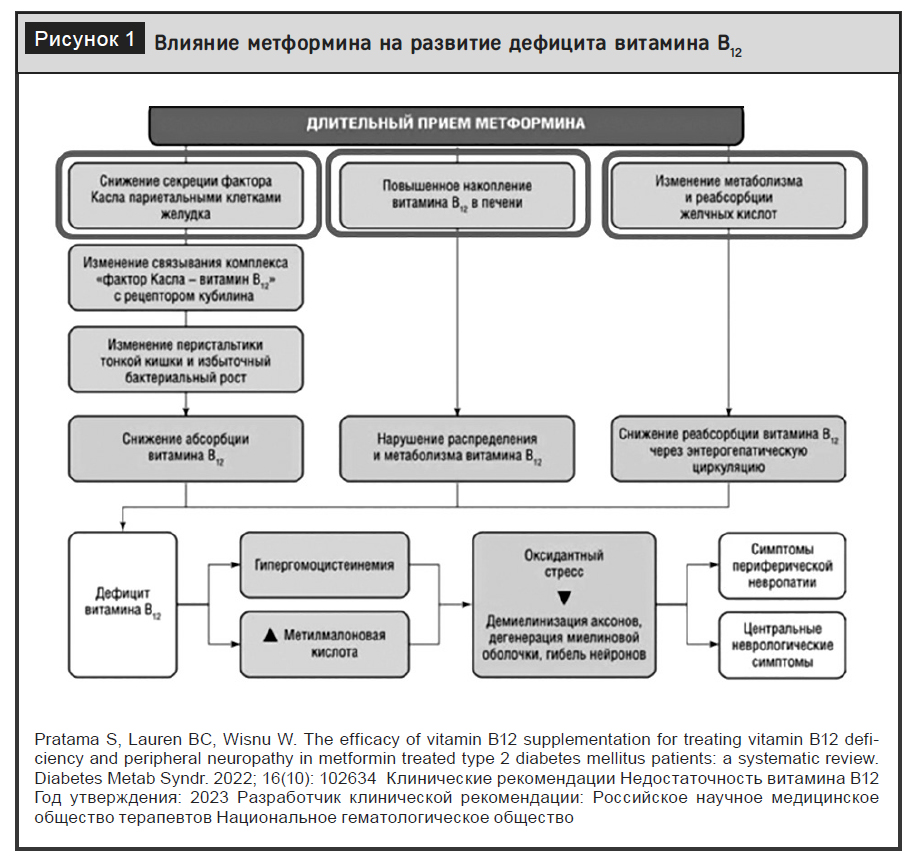
Средства, снижающие кислотность желудочного сока (ингибиторы протонной помпы, блокаторы гистаминовых Н2-рецепторов, антациды), часто принимаемые длительно, могут приводить к нарушению процессов всасывания витамина В12, поскольку негативно влияют на процесс его высвобождения из связи с пищевыми белками при поступлении в организм. Поэтому при длительном приеме лекарственных препаратов, снижающих кислотность желудочного сока, риск развития недостаточности В12 достигает 83%, а распространенность его дефицита – 29% [26].
Особую группу риска представляют пожилые, что обусловлено совокупностью нескольких причин для его формирования, включающих:
– хронические возраст-ассоциированные болезни органов пищеварения (хронический атрофический гастрит, дивертикулярная болезнь и др.);
– наличие хронических заболеваний, требующих постоянной медикаментозной поддержки (2–3 и более препаратами, что в свою очередь, негативно влияет на усвоение витамина В12 клетками-потребителями);
– заболевания ротовой полости;
– различные проблемы с приемом пищи, богатой кобаламином (текстура пищи, так и отсутствие у некоторых пациентов достаточных финансовых возможностей для полноценного питания), включая анемию [27–30].
Все перечисленное приводит к тому, что дефицит кобаламина разной степени выраженности может достигать у пожилых пациентов 90% (56% – в возрасте 65–74 лет и до 93% – у лиц старше 75 лет). Следует учитывать, что недостаток/дефицит витамина В12 может являться одной из причин развития когнитивных и психоэмоциональных расстройств у пожилых людей, в том числе имеющих эндокринную патологию (наличие жалоб пациентов на нарушение памяти, внимания, расстройства сна, усиливающуюся тревожность и депрессию). Аномально низкие уровни гемоглобина являются фактором риска развития болезни Альцгеймера, особенно, если параллельно есть и дефицит витамина В12 [31–33].
Группой экспертов после предварительного обзора литературы проведено обобщение результатов, касающихся различных аспектов диагностики и лечения дефицита витамина B12 с использованием модифицированного метода Дельфи для формирования экспертного консенсуса, ориентированного на практику и позволяющего определить подход к оказанию медицинской помощи людям с дефицитом витамина B12 и лицам с риском его развития [34]. Авторы пришли к согласованному заключению, позволившему сгруппировать данные по симптомам дефицита витамина В12 от наиболее часто встречающихся до более редких, свидетельствующему, что нейропсихиатрические симптомы доминируют по распространенности, но они менее специфичны, чем гематологические нарушения, что определяет сложности распознавания ассоциативных связей с дефицитом витамина В12 (рис. 2).

Понимание важности приведенных аргументов определило разработку рекомендаций по тактике диагностики и ведения дефицита витамина В12 [14, 35–37].
1. Кому показана оценка статуса витамина В12?
По мнению экспертов NICE, первичный диагностический тест показан людям, у которых имеется, по крайней мере, 1 общий симптом или признак, характерный для дефицита витамина В12 и, по крайней мере, 1 общий фактор риска для этого состояния (табл. 1) [37].
Таблица 1. Дефицит витамина B12: распространенные проявления и факторы риска
|
Распространенные симптомы и признаки
|
|
Отклонения в общем анализе крови – анемия или макроцитоз
|
|
Когнитивные трудности (нарушения концентрации внимания или кратковременная потеря памяти)
|
|
Проблемы со зрением, связанные с дисфункцией зрительного нерва: затуманенное зрение, атрофия зрительного нерва, скотома
|
|
Глоссит
|
|
Неврологические или двигательные проблемы, связанные с периферической нейропатией или заболеванием центральной нервной системы, включая миелопатию
|
|
Симптомы или признаки анемии и отсутствие эффекта лечения препаратами железа
|
|
Факторы риска
|
|
Диета с низким содержанием витамина В12 (малое количество продуктов животного происхождения)
Аллергия на некоторые продукты, такие как яйца, молоко или рыба, расстройства пищевого поведения
|
|
Семейный анамнез дефицита витамина B12 или аутоиммунного заболевания (атрофический гастрит, поражающий тело желудка, целиакия или другое аутоиммунное заболевание (заболевания щитовидной железы, синдром Шегрена или СД 1-го типа)
|
|
Использование лекарственных средств: колхицин, антагонисты H2-рецепторов, метформин, фенобарбитал, прегабалин, примидон, ингибиторы протонной помпы, топирамат
|
|
Предыдущая радиотерапия брюшной полости или таза
|
|
Предыдущие операции на желудочно-кишечном тракте (многие бариатрические операции (например, желудочное шунтирование по Ру или рукавная резекция желудка), гастрэктомия или резекция терминальной части подвздошной кишки
|
|
Рекреационное использование закиси азота
|
2. Современные биомаркеры недостаточности витамина В12
Биомаркеры недостаточности/дефицита витамина В12 – кобаламин, голотранскобаламин, или активный В12 (Holo-TC) и метаболиты витамина В12 метил-малоновая кислота (MMA) и гомоцистеин (ГЦС) [38]. В настоящее время считается, что измерение уровня кобаламина в сыворотке крови может не отражать его метаболический статус, хотя очевидно, что снижение уровней кобаламина и Holo-TC сопровождается повышением ГЦС и метил-малоновой кислоты, определение кобаламина остается наиболее доступным методом [39]. В то же время у 30–40% людей с неврологическими или гематологическими симптомами, связанными с дефицитом витамина B12, могут быть нормальные концентрации витамина B12. Активная форма витамина В12 – Holo-TC, наиболее точный маркер статуса витамина В12, так как только связанный транскобаламином витамин B12 обеспечивает его поступление во все клетки через специфические рецепторы.
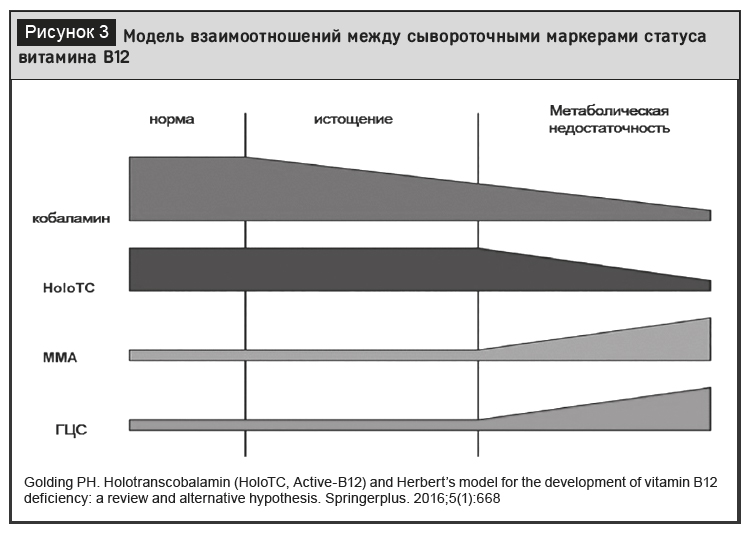
Таблица 2. Оценка статуса витамина В12 по комбинированным критериям
|
Комбинированный показатель
статуса
витамина В12
|
Эквивалентные показатели
и точки отсечения
|
Интерпретация
|
Рекомендации
|
|
Повышенный уровень витамина B12
|
В12 >650
Holo-TC >190
ГЦС <8,0
ММА <0,11
|
Биологические эффекты избытка витамина В12 полностью не понятны
|
Рассмотреть потенциальные причины (заболевания печени, использование витамина В12)
|
|
Адекватный статус
|
186 <В12 <650
37 <Holo-TC <190
13,6 >ГЦС >8,0
0,35 <ММА <0,11
|
Ожидается, что функции, зависимые от витамина В12, обеспечены
|
Никакие действия не рекомендуются
|
|
Низкий уровень витамина В12
|
119 <В12 <186
20 <Holo-TC <37
19,2 <ГЦС <13,6
0,84 <ММА <0,35
|
Субклинический дефицит, т.е. нет гематологических изменений, но есть субклинические неврологические нарушения
|
Рассмотреть возможность перорального приема витамина В12
|
|
Возможна недостаточность
|
116 <В12 <119
8,4 <Holo-TC <20
51 <ГЦС <19,2
1,7 <ММА <0,84
|
Потенциальные проявления дефицита
|
Необходимо назначение перорального приема витамина В12
|
|
Вероятна недостаточность
|
В12 <116
Holo-TC <8,4
ГЦС >51
ММА >1,7
|
Можно наблюдать клинические проявления
|
Рассмотреть возможность инъекционной терапии
|
Примечание: В12 и Нolo-TC – пмоль/л, ГЦС и MMA как μмоль/л.
В рекомендациях NICE указывается на необходимость сбора анамнеза по использованию препаратов витамина В12 и целесообразность использования общего B12 (сывороточный кобаламина), либо активного B12 (Holo-TC) в качестве первоначального теста, за исключением женщин во время беременности (предпочтительна оценка голотранскобаламина) или рекреационного использования закиси азота (рекомендовано оценивать гомоцистеин плазмы или метилмалоновую кислоту сыворотки) [37].
Таблица 3. Критерии оценки статуса витамина В12
|
Общая концентрация витамина B12
|
Holo-TC
|
Вероятность дефицита витамина B12
|
|
Менее 180 нг/л (133 пмоль/л)
|
Менее 25 пмоль/л
|
Подтвержденный дефицит витамина B12
|
|
180–350 нг/л (133–258 пмоль/л)
|
25–70 пмоль/л
|
Неопределенный результат теста – возможный дефицит витамина B12
|
Российские рекомендации указывают на сложности лабораторной диагностики дефицита витамина В12, в связи с низкой специфичностью уровня общего витамина В12, и достоверно не отражает статус витамина В12 в организме, тогда как определение в рутинной практике Holo-TC не всегда доступно, а определение метил-малоновой кислоты в крови практически не используется в связи с высокой стоимостью исследования. Однако, снижение уровня Holo-ТC является самым ранним и наиболее специфичным маркером дефицита В12: уровень менее 35 пмоль/л – указывает на дефицит витамина В12, а уровень Holo-TC от 35 до 50 пмоль/л – на пограничный субоптимальный запас (недостаточность) [14].
Альтернативная модель развития дефицита витамина B 12, отражающая взаимодействие между различными биомаркерами его статуса, приведена на рисунке 3 [40].
Авторы Дельфийского консенсуса, упомянутого ранее, в контексте выяснения причины дефицита витамина B12 согласились, что мальабсорбция пищевого кобаламина может вызывать дефицит витамина B12 у пожилых людей, даже если его диетическое потребление является достаточным, и у человека нет желудочно-кишечных расстройств. Для подтверждения определения причины дефицита витамина B12 необходимо учитывать особенности питания, анамнез заболеваний, регулярный прием определенных лекарств и рекреационное использование оксида азота. Существует общее мнение, что мальабсорбцию витамина B12 можно заподозрить у людей с аутоиммунными заболеваниями, у пациентов, перенесших операцию на желудке, у людей с семейным анамнезом пернициозной анемии или с положительными результатами тестов на сывороточные антитела против внутреннего фактора или париетальных клеток, а оценка статуса фолиевой кислоты и железа может помочь в дифференциальной диагностике [34].
Критерии статуса витамина В12
В настоящее время нет «золотого стандарта» оценки статуса витамина В12.Существующие рекомендации основаны на использовании различных биомаркеров и вариабельности их интерпретации.
В 2015 году было предложено понятие комбинированного статуса В12, включающего совокупную оценку витамина В12, Holo-TC, ГЦС и метил-малоновой кислоты (ММА) с выделением нескольких категорий обеспеченности витамином В12 и определением потенциала действий [41].
Предложенный подход основан на понимании взаимосвязи между различными биомаркерами статуса обеспеченности организма витамином В12, но его использование ограничено сложностями в тестировании и интерпретации, что повлекло за собой разработку альтернативных предложений. В таблице приведены критерии статуса витамина В12 по рекомендации Национального института здравоохранения и совершенствования медицинской помощи Великобритании [34].
Российские коллеги указывают несколько отличающиеся критерии, отмечая, что снижение уровня Holo-TC менее 35 пмоль/л указывает на дефицит витамина В12, а уровень Holo-TC в диапазоне 35–50 пмоль/л – на пограничный субоптимальный запас, то есть недостаточность. Косвенно о снижении уровня витамина В12 может свидетельствовать повышенное содержание метаболитов обмена витамина В12 – гомоцистеина и метил-малоновой кислоты. Уровень гомоцистеина в сыворотке крови >10 мкмоль/л указывает на возможный дефицит витамина В12. Однако этот метод используется редко в связи с высокой стоимостью исследования.
Таким образом, лабораторная диагностика недостаточности/дефицита витамина В12 имеет ряд ограничений и трудностей, как в реализации (доступность, стоимость), так и в интерпретации, в то время как клинические проявления являются значимыми при оценке результатов биологических маркеров недостаточности/дефицита витамина В12. По мнению ряда авторов, не рекомендуется дополнительная лабораторная диагностика недостаточности/дефицита В12 у пациентов из группы риска, имеющих клинические проявления [38, 42]. В то же время, хотя у трети пациентов с дефицитом витамина B12 его концентрация в сыворотке крови может быть нормальной, это исследование по-прежнему является удобным скрининговым тестом, при наличии показаний. Использование Holo-TC в качестве скринингового маркера увеличивает стоимость исследований и ограничивает их доступность.
Принципы лечения и профилактики недостаточности/дефицита витамина В12
Поскольку витамин B12 не синтезируется в организме человека в достаточном для его потребностей количестве (небольшое его количество синтезируется микрофлорой кишечника), стандартом профилактики и лечения В12-дефицитных состояний является заместительная терапия. Международные стандарты указывают на необходимость употребления 2,4 мкг/сут для взрослых, независимо от пола. Этот норматив, предложенный на основании исследования W. Darby и соавт. в 1958 году, был определен на малочисленной группе пациентов с пернициозной анемией и включал рекомендацию по диапазону использования 0,6–2,8 мкг в сутки для нормализации гемопоэза [43]. Более современные исследования, основанные на оценке уровней биомаркеров обеспеченности витамином В12,доказали, что для нормализации этих маркеров суточное потребление витамина В12 должно составить от 4 до 7 мкг [44]. Согласно рекомендациям Всемирной организации здравоохранения, достижение адекватной обеспеченности В12, как и многими другими витаминами, может быть достигнуто за счет рационального составления рациона питания и использования достаточного количества продуктов животного происхождения (мясо, печень, яйца, рыба), что является предпочтительным, или за счет использования добавок витаминов. Эта рекомендация оказывается трудновыполнимой для многих категорий пациентов, что определяет распространенность недостаточности/дефицита витамина В12 и диктует необходимость использования лечебных технологий. В большинстве клинических случаев, за исключением тяжелой В12-дефицитной анемии, существенными преимуществами обладает пероральный прием препарата, что обусловлено не только удобством его использования и возможностью избежать развития нежелательных постинъекционных осложнений, но и особенностями усвоения этого витамина.
Всасывание витамина B12 – сложный процесс, который происходит в подвздошной кишке и требует участия внутреннего фактора Кастла, вырабатываемого в желудке. Именно в желудке витамин B12, поступающий перорально, связывается с внутренним фактором Кастла и перемещается в тонкий кишечник, откуда он всасывается и попадает в системный кровоток. В крови витамин B12 связывается с транспортным белком транскобаламином, который доставляет его к клеткам, где оказывает свои биологические эффекты. Очевидно, что недостаток или отсутствие внутреннего фактора Кастла (атрофический гастрит или резекция желудка), заболевания тонкого кишечника (целиакия) и другие факторы (метформин, ингибиторы протонной помпы) могут нарушать всасывание B12 и результироваться в выраженные проявления его дефицита, среди которых доминирует анемия.
При назначении витамина В12 следует учитывать, что в клинической практике существуют разные лекарственные формы и биологически активные добавки, а также вариабельные схемы введения препарата. Максимальная суточная доза витамина В12 в биологически активных добавках, по мнению R. Green и соавт., не установлена, так как он считается безопасным, а его избыток выводится с мочой и калом [27]. В то же время доза витамина В12 ограничивается в биологически активных добавках 9 мкг. Рекомендуемые дозировки варьируют в зависимости от возраста и степени обеспеченности витамином В12. Общепринято, что профилактические дозы составляют 100–200 мкг/сутки. Для людей старше 50 лет может потребоваться дополнительный прием от 100 до 400 мкг/сутки.
В настоящее время не существует «золотого стандарта» для выбора дозы и пути введения витамина B12. В случаях, когда дефицит витамина B12 клинически проявляется или пациент не может его усваивать, следует использовать терапевтические дозы от 1000 до 2000 мкг/сутки перорально или 1000 мкг внутримышечно (например, ежедневно, затем еженедельно, затем ежемесячно для поддерживающего лечения). Доказано, что использование орального пути поступления в организм витамина В12 сравнимо с внутримышечным введением в получении краткосрочных гематологических и неврологических ответов у пациентов с его дефицитом [45–47]. В мета-анализе, проведенном H. Wang и соавт., было подтверждено, что пероральный и внутримышечный прием витамина B12 оказывает схожее действие с точки зрения нормализации его уровня в сыворотке крови,, но пероральное лечение обходится дешевле [48]. Прием цианокобаламина в высоких дозах per os обеспечивает пассивное или независимое от внутреннего фактора Касла всасывание 1% потребляемой дозы, что покрывает суточную потребность в витамине В12 и оказывает лечебный эффект у больных с его дефицитом [49] влияет на пассивный транспорт, и не требуется отмена или коррекция базовой терапии.. При этом прием лекарственных препаратов, нарушающих активный транспорт кобаламина, никак не
Продолжительность лечения, необходимая для устранения симптомов патологии, может варьировать. Отсутствие клинического улучшения через 4–12 недель при анемии и через 6–12 месяцев при неврологических симптомах может указывать на то, что симптомы не связаны с дефицитом витамина B12 или что его доза или способ введения должны быть скорректированы в соответствии с тяжестью симптомов. Поскольку концентрация витамина B12 в сыворотке крови не всегда отражает клиническую картину, этот маркер не является оптимальным для мониторинга эффективности лечения. Недостаточный клинический ответ на лечение витамином B12 в течение первых недель терапии не должен обычно приводить к прекращению лечения [27, 50, 51]. Обнаружение дефицита витамина B12, вызванного метформином, у пациентов с CД 2-го типа в условиях первичной медико-санитарной помощи, проведенной в Южной Каролине, подтвердил, что регулярный контроль уровня витамина B12 стал фактором, который инициировал включение рекомендации Американской ассоциации диабета по мониторингу уровня витамина B12 у пациентов, принимающих метформин [52, 53].
Для клинической практики необходимо четко понимать, что витамин В12 обладает анальгетическим эффектом, что широко используется при:
– болевых синдромах различной этиологии, включая болевую форму диабетической периферической нейропатии в качестве монотерапии и при сочетании с другими лекарственными средствами;
– анемии;
– особенностях пищевого поведения, в том числе при использовании вегетарианской или веганской диеты, при голодании, хронической алкогольной интоксикации;
– заболеваниях, которые сопровождаются синдромами мальдигестии и мальабсорбции (аутоиммунный атрофический гастрит; гастрит, ассоциированный с Helicobacter pylori; частичная или тотальная резекция желудка, двенадцатиперстной и подвздошной кишки; панкреатодуоденальная резекция; болезнь Крона; дивертикулярная болезнь; целиакия; лимфома; хронический панкреатит с внешнесекреторной недостаточностью поджелудочной железы; гастринома);
– использовании некоторых лекарственных средств (табл. 1).
Доказано, что витамин В12:
– способствует снижению развития когнитивного дефицита и депрессии, а также уменьшает проявления астении и депрессии;
– не вызывает повышения риска развития рака и не приводит к ухудшению прогноза при онкологических заболеваниях, несмотря на участие в синтезе нуклеиновых кислот и в процессе репликации клеток, может быть использован с целью уменьшения нейротоксического действия химиопрепаратов [54].
Пациенты с раком, как сообщается, демонстрируют повышенные концентрации витамина B12 в плазме крови, что вызывает неопределенности относительно безопасности использования витамина B12. Систематический обзор исследований по оценке связи между биомаркерами витамина B12 и раком выявил, что за исключением рака печени, связь между концентрацией кобаламина в плазме крови и раком не была последовательной (не отмечено связи между потреблением витамина B12 из пищи или добавок). В доступных рандомизированных контролируемых исследованиях использовались высокие дозы поливитаминных добавок, и рак был незапланированным исходом, поэтому причинно-следственная связь дефицита витамина B12 с раком не может быть оценена на основании этих исследований. Кроме того, у пациентов с раком часто наблюдалась не высокая, а низкая концентрация витамина B12 в плазме крови. Приведенные факты позволили авторам заключить, что нет достаточных доказательств, позволяющих предположить причинно-следственную связь между высоким содержанием витамина B12 в плазме крови, его высоким потреблением или применением фармакологических доз витамина B12 и раком. Низкий уровень витамина B12 у пациентов с раком необходимо диагностировать и лечить для предотвращения гематологических иневрологических последствий дефицита [54].
В заключении важно отметить, что эффекты витамина В12 многоплановы, что имеет важное значение для пациентов с СД. В исследование Национального исследования здоровья и питания (NHANES) были включены 3277 взрослых с СД 2-го типа. В результате не выявлена связь между смертностью от всех причин и содержанием кобаламина в сыворотке крови или потреблением пищевых продуктов или добавок В12, независимо от лечения метформином, но доказано, что удвоение ММА, маркера дефицита витамина B12, связано с более высокой смертностью от всех причин и от кардиоваскулярной патологии, а пациенты со сниженной чувствительностью к витамину B12 имели самый высокий риск смертности [55].
Таким образом, можно констатировать, что ликвидация дефицита витамина В12 обеспечивает улучшение общего состояния, качества жизни и прогноза. При этом важно понимать, что существуют доказательства различной степени достоверности, что клинические проявления дефицита витамина В12 могут быть минимизированы после ликвидации этого дефицита.
ЛИТЕРАТУРА
1. Волкова С.А., Боровков Н.Н. Основы клинической гематологии // Н. Новгород, 2013. – 400 с.
2. Richards J.B., Valdes A.M., Gardner J.P., et al. // Atherosclerosis. – 2008. – Vol.200. – P.271–277.
3. Scalabrino G. // Prog Neurobiol. – 2009. – Vol.88, N3. – P.203–220.
4. Röhrig G., Gütgemann I., Kolb G., Leischker A. // Z Gerontol Geriatr. – 2018. – Vol.51, N4. – P.446–452.
5. Dali-Youcef N., Andres E. // QJM. – 2009. – Vol.102. – P.17–28.
6. Allen L.H. // Am J Clin Nutr. – 2009. – Vol.89, N2. – P.6935–6965.
7. Wolffenbuttel B.H.R., Heiner-Fokkema M.R., Green R. et al. // BMC Med. – 2020. – Vol.18. – P.307.
8. Khodabandehlo N., et al. // Iran Red Crescent Med J. – 2015. – Vol.17, N8. – e13138.
9. Allen L.H. // Am J Clin Nutr. – 2009. – Vol.89, N2. – P.6935–6965.
10. Miyan Z., Waris N. // BMJ Open Diab Res Care. – 2020. – Vol.8. – e001151.
11. Golabi M., Kazemi D., Chadeganipour A.S., et al. // Inflammation. – 2025. – Vol.48, N2. – P.485–500.
12. Nardin R.A., Amic A.N., Raynor E.M. // Muscle Nerve. – 2007. – Vol.36, N4. – P.532–535.
13. Son P., Lewis L. Hyperhomocysteinemia. – 2022. In StatPearls [Internet]. Treasure Island (FL). StatPearls Publi-shing; 2025. PMID 32119295.
14. Мокрышева Н.Г., Шестакова М.В., Аметов А.С. и др. // Сахарный диабет. – 2024. – №27(3). – С.314–320.
15. Красновский А.Л., Григорьев С.П., Алехина Р.М. и др. // Клиницист. – 2016. – Т.10. – №3. – С.15–25.
16. Kim J., Ahn C.W., Fang S., et al. // Medicine (Baltimore). – 2019. – Vol.98, N46. – e17918.
17. Sebastian M.J., Khan S.K., Pappachan J.M., Jeeyavudeen M.S. // World J Diabetes. – 2023. – Vol.14, N2. – P.92–109.
18. Badescu S.V., Tataru C., Kobylinska L., et al. // J Med Life. – 2016. – Vol.9, N2. – P.120–125.
19. AlDallal S.M., Jena N. // J Hematol. – 2018. – Vol.7, N2. – P.57–61.
20. Yang R., Yu H., Wu J., et al. // Endocrinol. – 2023. – Vol.14. – CD1082720.
21. Gupta R., Jain A., Rohatgi A. // Diabetes Metab. Syndr. – 2018. – Vol.12. – P.51–58.
22. Hashem M.M., Esmael A., Nassar A.K., El-Sherif M. // Sci Rep. – 2021. – Vol.11, N1. – P.1940.
23. Hansen C.S., Jensen J.S., Ridderstråle M., et al. // J Diabetes Complications. – 2017. – Vol.31, N1. – P.202–208.
24. Pratama S., Lauren B.C., Wisnu W. // Diabetes Metab Syndr. – 2022. – Vol.16, N10. – P.102634.
25. Клинические рекомендации Недостаточность витамина В12. – 2023. Разработчик клинической рекомендации. – Российское научное медицинское общество терапевтов Национальное гематологическое общество.
26. Jung S.B., Nagaraja V., Kapur A., Eslick G.D. // Intern Med J. – 2015. – Vol.45, N4. – P.409–416.
27. Green R., Allen L.H., Bjorke-Monsen A.L., et al. // Nat Rev Dis Primers. – 2017. – Vol.3. – P.17040.
28. Stabler S.P. Vitamin B12. In Present Knowledge in Nutrition. 11th ed. – Washington, 2020. – P.257–271.
29. Ambrosy A.P., Gurwitz J.H., Tabada G.H., et al. // Eur Heart J Qual Care Clin Outcomes. – 2019. – Vol.5. – P.361–369.
30. Lanier J.B., Park J.J., Callahan R.C. // Am Fam Physician. – 2018. – Vol.98, N7. – P.437–442.
31. Min J.Y., Min K.B. // J Alzheimers Dis. – 2016. – Vol.52, N2. – P.705–712.
32. Zhang Y., Hodgson N.W., Trivedi M.S. // PLoS One. – 2016. – Vol.11, N1. – e0146797.
33. Tiemeier H., van Tuijl H.R., Hofman A., et al. // Am J Psychiatry. – 2002. – Vol.159, N12. – P.2099–2101.
34. Obeid R., Andrès E., Ceška R., et al. // J Clin Med. – 2024. – Vol.13, N8. – P.2176.
35. Herbert L., Ribar A., Mitchell S., Phillips C. // J Am Assoc Nurse Pract. – 2019. – Vol.33, N2. – P.174–180.
36. Langan R.C., Goodbred A.J. // Am Fam Physician. – 2017. – Vol.96, N6. – P.384–389.
37. NICE guideline Vitamin B12 deficiency in over 16s: diagnosis and management. Reference number. NG239 Published, 2024.
38. Hannibal L., Lysne V., Bjørke-Monsen A.L., et al. // Front Mol Biosci. – 2016. – Vol.3. – P.27.
39. Solomon L.R. // Eur J Clin Nutr. – 2015. – Vol.69. – P.687–692.
40. Golding P.H. // Springerplus. – 2016. – Vol.5, N1. – P.668.
41. Fedosov S.N., Brito A., Miller J.W., et al. // Clin Chem Lab Med. – 2015. – Vol.53, N8. – P.1215–1225.
42. Means R.T., Fairfield K.M. Clinical manifestations and diagnosis of vitamin B12 and folate deficiency. UpTjDate (доступ 07.08.2023). https://medilib.ir/uptodate/show/71552.
43. Darby W.J., Bridgforth E.B., le Brocquy J., et al. // JAMA. – 1958. – Vol.25, N5. – P.726–732.
44. Bor M.V., von Castel-Roberts K.M., Kauwell G.P., et al. // Am J Clin Nutr. – 2010. – Vol.91, N3. – P.571–577.
45. Favrat B., Vaucher P., Herzig L., et al. // BMC Fam Pract. – 2011. – Vol.12. – P.2.
46. Vidal-Alaball J., Butler C.C., Cannings-John R., et al. // Cochrane Database Syst Rev. – 2005. – Vol.3. – CD004655.
47. Bolaman Z., Kadikoylu G., Yukselen V., et al. // Clin Ther. – 2003. – Vol.25, N12. – P.3124–3134.
48. Wang H., Li L., Qin L.L., Song Y., et al. // Cochrane Database Syst Rev. – 2018. – Vol.3, N3. – CD004655.
49. Butler Ch.C., Vidal-Alaball J., Cannings-John R., et al. // Family Practice. – 2006. – Vol.23, N3. – P.279–285.
50. Sanz-Cuesta T., González-Escobar P., Riesgo-Fuertes R., et al. // BMC Public Health. – 2012. – Vol.12. – P.394.
51. Wang H., Li L., Qin L.L., et al. // Cochrane Database Syst Rev. – 2018. – Vol.3, N3. – CD004655.
52. Herbert L., Ribar A., Mitchell S., Phillips C. // J Am Assoc Nurse Pract. – 2019. – Vol.33, N2. – P.174–180.
53. American Diabetes Association Professional Practice Committee: Pharmacologic Approaches to Glycemic Treatment. Standards of Care in Diabetes–2025 // Diabetes Care. – 2025. – Vol.48, Suppl.1. – S181–S206.
54. Obeid R. // Nutrients. – 2022. – Vol.14, N21. – P.4476.
55. Wang S., Wang Y., Wan X., et al. // Diabetes Care. – 2021. – CD211674.
Медицинские новости. – 2025. – №10. – С. 24-30.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.