Статистические данные свидетельствуют о том, что в структуре онкозаболеваемости населения злокачественные новообразования наиболее часто поражают органы, непосредственно контактирующие с внешней средой, содержащей канцерогены.
В структуре смертности от онкологических заболеваний преобладает рак легких (рис. 1), причем наблюдается тенденция к росту этой патологии.
В случае рака легкого с момента возникновения болезни до ее диагностирования проходит в среднем 5—7 лет. Больного сначала лечат от бронхита, потом от воспаления легких, туберкулеза. И только когда опухоль достигает 3— 4 см в диаметре, ее может увидеть рентгенолог, имеющий в своем распоряжении хороший рентгенаппарат и качественную пленку. Но оперировать в большинстве случаев уже поздно, поскольку опухоль метастазирует. Вообще для легочной локализации характерно раннее метастазирование.
Установлено, что в 80—90% случаев в возникновении рака принимают участие химические факторы окружающей среды. Причем абсолютное большинство канцерогенов образуется в организме человека и животных из проканцерогенов с участием главным образом цитохромов Р450, особенно I семейства (рис. 2). Окисленные проканцерогены (эпоксиды и др.) могут подвергаться детоксикации эпоксидгидратазой, глутатионтрансферазой и в меньшей степени УДФ-глюкуронил- и сульфотрансферазами. Необезвреженные эпоксиды проникают в ядро клетки и связываются с ДНК. Происходит химическая мутация [1, 11]. ДНК может репарировать с восстановлением до исходного состояния либо мутация сохраняется. Промоторы выводят ДНК из состояния репрессии с развитием опухоли.
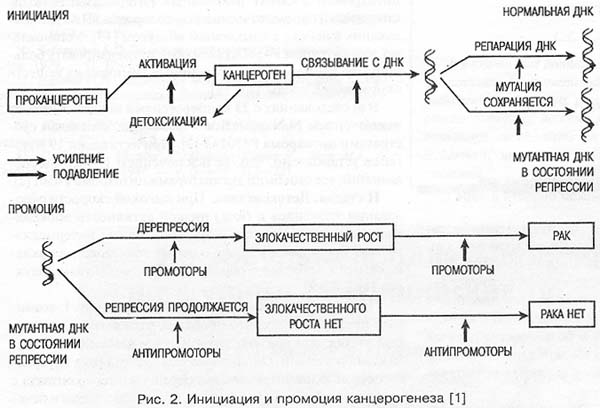
Мы представили лишь краткую схему, не учитывающую всего многообразия промежуточных этапов. Рассмотрим более подробно некоторые ее звенья.
I стадия. Активация проканцерогенов. Из большого семейства цитохромов Р450 наиболее причастен к развитию рака легкого цитохром P450IA1, который реализует свое действие по следующим механизмам: 1) запуская каскад протеинкиназы С с увеличением репликации ДНК и тканевой пролиферации; 2) генерируя радикалы кислорода; 3) образуя реактивные интермедиаты ксенобиотиков [24, 28]. Особенно важен в легочном канцерогенезе последний механизм. В его основе лежит образование цитохромом P450IA1 реактивных интермедиатов полициклических ароматических углеводородов (ПАУ), попадающих в легкие с вдыхаемым воздухом [13]. Установлено, что цитохром P450IA1 способен активизировать большинство канцерогенов и токсичных химических веществ окружающей среды [13, 14].
В исследованиях с 23 канцерогенами показано, что, за исключением N, N-диметилнитрозамина, они были субстратами цитохрома P450IA1 [9]. При активации 19 мутагенов установлено, что, за исключением N-нитрозосоединений, все они были активаторами цитохрома P450I [2].
II стадия. Детоксикация. При высокой скорости образования эпоксидов и (или) низкой активности эпоксидгидратазы и других конъюгаз "реактивные интермедиаты" могут проникать в ядро и взаимодействовать с нуклеиновыми кислотами с образованием ковалентных аддуктов [1].
При анализе данных, представленных на рис. 1, возникает предположение, что проблема рака легкого, на первый взгляд, обусловлена загрязнением вдыхаемого воздуха канцерогенами. Однако высокая частота рака внутренних органов, не имеющих непосредственного контакта с окружающей средой (например, молочной железы и печени), свидетельствует о том, что отдельные ткани и органы организма человека, по-видимому, имеют биохимические особенности, могущие привести к развитию в них опухолевого процесса.
Сравнительный анализ литературных данных о некоторых биохимических особенностях печени и легкого подтверждает это предположение. Печень в отличие от легкого получает ксенобиотики, в значительной степени прошедшие метаболическую трансформацию в кишечнике [32]. Неоднородность клеточной структуры легкого (около 40 различных типов клеток) является доказательством того, что отдельные его клетки могут более интенсивно активировать канцерогены, и их локальная концентрация и соответственно канцерогенная опасность могут быть весьма высокими. Показано, что наибольшей способностью активировать канцерогены обладают альвеолярные клетки II типа [4].
Несмотря на высокий метаболический потенциал печени, активность бензапиренгидроксилазы в легких выше. Ряд авторов вообще ставит под сомнение наличие этого фермента в печени [4, 8]. Отношение канцерогенного семейства цитохромов Р450 к другим его изоформам в легких намного выше, к тому же фермент в большей степени подвержен индукции. С уменьшением дозы индукторов активация фермента в печени (в отличие от легких) не выявляется. Синтез апоцитохрома P450IA1 в легких в меньшей степени подвержен действию ингибиторов, чем в печени [6]. То же самое можно сказать и в отношении синтеза цитохром-специфичной РНК. Таким образом, процессы активации канцерогенов в легких протекают более интенсивно и локально.
Что же происходит с ферментами детоксикации образовавшихся канцерогенных метаболитов? Эпоксигидратаза легких по своей активности значительно уступает печени [7, 25]. Фермент слабо индуцибелен [12]. Если сравнить соотношение детоксикация/активация бензапирена, то в печени оно более чем в 3 раза выше, чем в легких.
Следовательно, непосредственный контакт легких с канцерогенами, метаболическая гетерогенность клеток органа, высокая скорость активации канцерогенов в сочетании с низкой активностью ферментных систем их детоксикации способствуют развитию онкопроцесса преимущественно в легких, а не в печени.
Возникает, однако, вопрос: почему, несмотря на одинаковую степень воздействия канцерогенов на организм людей (например, у одинаково интенсивно курящих), рак легкого возникает далеко не у каждого? Очевидно, имеются генетические различия, могущие повлиять на реализацию ПАУ и другими канцерогенами их онкогенного действия у конкретного человека.
Многие лекарственно-метаболизирующие ферменты подвержены генетической вариабельности у людей, которые по этой причине могут быть устойчивы или чувствительны к химическим канцерогенам. Увеличение чувствительности к раку легкого наблюдается при высокой активности цитохрома P450IA1 [5] и низкой активности мю-класса глутатион-S-трансфераз [27]. Риск возрастает в 16—41 раз. В случае с одним генотипом мю-глутатион-трансферазы риск увеличивается только в 2,5 раза [16].
Кроме цитохрома P450IA1 к развитию рака легкого причастен и цитохром Р4502Д6, катализирующий метаболизм дебризохина [22].
Таким образом, индивидуальные вариации в активности канцероген-метаболизирующих ферментов в органах-мишенях — ключ к разгадке различной чувствительности людей к химическим канцерогенам. В отношении легких главную роль играют вариации в активности ферментов, метаболизирующих ПАУ. В связи с этим насущной задачей современной профилактической медицины является установление среди здоровых людей группы риска в плане легочной онкопатологии путем фенотипирования по способности клеток легких трансформировать ПАУ.
Адекватным, легко доступным объектом для оценки активности ферментных систем биотрансформации ксенобиотиков в легких могут быть лимфоциты. Эти клетки содержат развитую эндоплазматическую сеть, однако из-за небольшого объема цитоплазмы количество и активность локализованных в них ферментов незначительны. Но при инкубации лимфоцитов с митогенами (фитогемагглютинин и др.) объем цитозоля значительно возрастает, что достаточно для изучения в клетках процессов биотрансформации ксенобиотиков [28, 33].
В пользу правомочности использования лимфоцитов для оценки вероятности активации или детоксикации ксенобиотиков в легких свидетельствуют следующие факты. В исследованиях invitro с лимфоцитами, полученными из крови здоровых, не курящих людей, показано значительное (в 160—350 раз) увеличение активности цитохрома P450IA1 под влиянием ПАУ.
В лимфоцитах некоторых людей выявлены дефекты на уровне внутриклеточных рецепторов для ПАУ. Это выражается в слабой индукции канцерогенами цитохрома P450IA1, что укладывается в представление о существовании генетического полиморфизма в активности цитохрома P450IA1 в органах и тканях животных и человека [19, 31]. В лимфоцитах и альвеолярных макрофагах легких установлена положительная корреляция в индуцибельности цитохрома P450IA1 [21].
У здоровых курящих людей биотрансформация производных бензапирена до тетролов выше как в легких, так и в лимфоцитах по сравнению с бросившими курить и не курящими людьми. Параллельно отмечено увеличение количества аддуктов с ДНК [26]. Показано, что частота развития карцином гортани, например, в Швеции, коррелирует с высокой или промежуточной чувствительностью лимфоцитарных бензапиренгидроксилаз к индуцирующему влиянию ПАУ [23, 29]. Аналогичная закономерность установлена в случае бронхогенных карцином [10] и опухолей почек [30].
Сравнение индуцибельности бензапиренгидроксилазы в культурах лимфоцитов монозиготных и дизиготных близнецов показало, что межиндивидуальные различия у монозиготных близнецов не превышают 6%, хотя "базовый" и "индуцированный" уровни отличаются весьма значительно. Различия в индуцибельности бензапиренгидроксилазы у дизиготных близнецов были больше. На основании этих данных S. A. Atlas [3] и другие исследователи пришли к выводу, что наследственные факторы в большей степени, чем факторы внешней среды, ответственны за межиндивидуальные различия индуцибельности бензапиренгидроксилазы 3-метилхолантреном в культуре человеческих лимфоцитов.
При изучении межиндивидуальных различий индуцибельности бензапиренгидроксилазы под действием ПАУ в митоген-активированных лимфоцитах 353 человек выявлены следующие группы: 1) с высокой (риск рака легкого в 36 раз выше); 2) с промежуточной (риск рака легкого в 16 раз выше) и 3) с низкой индуцибельностью фермента [17, 18].
Таким образом, приведенные факты свидетельствуют о правомочности использования лимфоцитов для оценки скорости биотрансформации канцерогенов в легких и тем самым донозологического скринингового контроля на фактор риска развития опухолей легкого с целью проведения своевременной коррекции, направленной на снижение легочной онкопатологии.
Со списком литературы можно ознакомиться в бумажной версии журнала
Медицинские новости. – 1996. – №11. – С. 9-11.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.