|

Г.В. Илюкевич, О.И. Светлицкая, Е.Г. Оганова
Эффекты применения раствора гидроксиэтилированного крахмала у больных с острым распространенным перитонитом
Белорусская медицинская академия последипломного образования, 9-я городская клиническая больница, Минск
У больных с острым распространенным перитонитом (ОРП) на фоне прогрессирования синдрома системного воспалительного ответа (ССВО) развивается системная вазодилатация и повышенная проницаемость стенок капилляров, что приводит к интерстициальным отекам и внутрисосудистой гиповолемии. В связи с этим особое внимание уделяется качественному составу инфузионной терапии. Доказано, что ранняя и адекватная инфузионная терапия способствует выживанию пациентов в критических состояниях, поэтому в комплексной интенсивной терапии больных с ОРП перспективно использование препаратов, обладающих возможностью одновременного воздействия и на выраженность воспалительной реакции, и на систему коагуляции.
Исследования последних лет показали тесную взаимосвязь воспаления и системы свертывания крови у больных с ОРП. Воспалительно-коагуляционный ответ рассматривается как часть ССВО [7]. По литературным данным, растворы гидроксиэтилированного крахмала (ГЭК) помимо хорошего гемодинамического эффекта обладают также противовоспалительными свойствами и влияют на процессы свертывания крови в микроциркуляторном русле, что может оказаться благоприятным у больных с сепсисом, в том числе абдоминальным [1, 5, 6, 8, 9, 12].
Проблема оптимально сбалансированной инфузионной терапии в интенсивном лечении гнойно-септических заболеваний остается крайне актуальной [2, 3, 6, 8—12]. Общепризнано, что ранняя и адекватная инфузионная терапия в ряде случаев способствует выживанию септических больных, в том числе с острым распространенным перитонитом [4, 6, 8]. Большая площадь поражения брюшины и хорошая васкуляризация кишечника при данной патологии создают предпосылки для массивного поступления в кровоток медиаторов воспаления и быстрой генерализации воспалительной реакции, что приводит к нарушениям проницаемости и функции эндотелия капилляров, регионарному перераспределению кровотока и внутрисосудистой гиповолемии. Наличие двух и более признаков синдрома системного воспалительного ответа и верифицированного очага инфекции в брюшной полости позволяет поставить знак равенства между ОРП и абдоминальным сепсисом.
Цель исследования – оценить влияние раствора гидроксиэтилированного крахмала на выраженность воспалительной реакции и нарушений в системе гемостаза у больных с острым распространенным перитонитом.
Нами выполнен анализ результатов лечения 95 больных с ОРП. Критерии включения пациентов в исследование следующие: верифицированный диагноз «острый распространенный перитонит», возраст более 18 лет и менее 85 лет, отсутствие исходных тяжелых заболеваний, конкурирующих с ОРП по влиянию на тяжесть состояния больного. Анализ течения заболевания показал, что у всех пациентов, включенных в исследование, в первые сутки послеоперационного периода имело место сочетание не менее двух признаков ССВО. Однако необходимо отметить, что у абсолютного большинства больных (79; 83,2%) наблюдалось сочетание трех и более признаков ССВО.
Средний возраст пациентов составил 49,4±1,85 года (стандартное отклонение δ – 18,0). Мужчин было 56 (59%), женщин — 39 (41%).
У всех пациентов в послеоперационном периоде была проведена общепринятая комплексная интенсивная терапия, которая включала поддержание адекватной вентиляции и газообмена (при необходимости – продленная ИВЛ), обезболивание, антибактериальные препараты широкого спектра действия, которые назначались с учетом характера гнойного процесса, коррекцию гиповолемических и гемодинамических расстройств (суточный объем инфузии составил 4,5–7 л), нутритивную поддержку, иммунокоррекцию, ингибиторы протеолиза, препараты, нормализующие моторику кишечника. В программе базовой инфузионной терапии использовали кристаллоиды (0,9% раствор натрия хлорида, растворы Рингера, Рингера лактата, лактосоль), 5%, 10% и 20% растворы глюкозы, а также растворы аминокислот (инфезол, вамин) в общепринятых дозировках. Пациенты, которым вводились жировые эмульсии (липовеноз) и растворы декстранов (полиглюкин, реополиглюкин, неорондекс), из данного исследования были исключены в связи с потенциальной возможностью влияния этих препаратов на систему гемостаза.
В зависимости от характера интенсивной терапии, проведенной в послеоперационном периоде, больные разделены на три клинические группы. В первую группу (контроль) включены 24 пациента, которым была назначена общепринятая базовая интенсивная терапия. Вторую группу (СЗП) составили 34 пациента, которым в 1-е, 2-е и 3-и сутки послеоперационного периода были выполнены трансфузии свежезамороженной одногруппной донорской плазмы, средняя суточная доза — 280±32 мл. В третью группу вошли 37 больных, которым в 1-е, 2-е и 3-и сутки послеоперационного периода проводились инфузии раствора гидроксиэтилированного крахмала («Рефортан», 6% раствор) 500 мл 1 раз в сутки. Все 95 пациентов, которые были включены в анализируемые клинические группы, получали в послеоперационном периоде низкомолекулярный гепарин фрагмин в дозе 2500–5000 ЕД через 12 часов. Дозы фрагмина определялись в соответствии с общепринятыми группами риска тромбоэмболических осложнений для хирургических больных.
По стадиям заболевания пациенты распределились следующим образом: в первой группе реактивная фаза была диагностирована у 5 (20,8%), токсическая – у 17 (70,8%), терминальная – у 2 (8,3%) чел.; во второй группе реактивная фаза диагностирована у 9 (26,5%), токсическая — у 18 (52,9%), терминальная — у 7(20,6%) чел.; в третьей группе реактивная фаза зафиксирована у 11 (29,7%), токсическая — у 20 (54%), терминальная — у 6 (16,2%) чел.
Сравниваемые группы были сопоставимы по возрасту и полу. Так, в первую группу (контроль) вошли 14 мужчин (58,3%) и 10 женщин (41,7%), средний возраст – 54,1±3,1 года; вторую группу составили 21 мужчина (61,8%) и 13 женщин (38,2%), средний возраст – 48,2±3,1 года; третью группу представляли 21 мужчина (56,8%) и 16 женщин (43,2%), средний возраст – 47,3±3,15 года.
Количественное определение D-димеров выполнялось с использованием набора «D-Dimer – LIATEST» на автоматическом анализаторе гемостаза «STA Compact» фирмы «STAGO Diagnostica» (Франция). В качестве контроля использовали результаты, полученные на пулированной нормальной контрольной плазме. Уровень СРБ определяли иммунотурбодиметрическим методом с использованием набора «Roche Diagnostic» (Австрия) на биохимическом анализаторе «Konelab 30» (Финляндия).
Основные этапы обследования больных – первые, третьи и пятые сутки послеоперационного периода.
Полученные цифровые данные обработаны с применением статистических функций Excel 2000 и программы Statistica 6.0. Так как большинство изучаемых параметров характеризовалось непараметрическим распределением, результаты выражали в виде медианы (Ме) – значения, которое делит распределение пополам, 25-го и 75 процентилей (25%—75%) — значений, между которыми находятся 50% наблюдений. Проверка на нормальное распределение полученных результатов проводилась при помощи W-теста Шапиро—Уилка. Для сравнения двух независимых выборок с непараметрическим распределением использовали U-тест Манна—Уитни. При проведении сравнительного анализа нескольких независимых групп с непараметрическим распределением использовали тест ANOVA с применением критерия Крускала—Уоллеса.
Для оценки тяжести состояния больных в динамике была использована шкала оценки острых физиологических изменений — SAPS II (Simplified Acute Physiology Score II), для объективной оценки тяжести нарушений со стороны органов и систем больного – шкала оценки органной недостаточности, связанной с сепсисом, – SOFA (Sequential Organ Failure Assessment).
При сравнении результатов установлено, что во всех трех группах наибольшая сумма баллов по шкале SAPS II зарегистрирована в первые сутки послеоперационного периода — 22,7±1,9 для больных первой группы, 21,6±2,0 для пациентов второй группы и 22±2,0 — для третьей группы. На третьи сутки пребывания в ОИТР наблюдалось снижение суммы баллов по данной шкале в первой группе (контроль) до 17,7±1,9, во второй группе (СЗП) — до 20,8±2,9. Наименьшее количество баллов получено в третьей группе (Рефортан) — 14,9±1,4 (табл. 1).
Таблица 1. Оценка тяжести состояния больных с острым распространенным перитонитом в сравниваемых клинических группах
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22,7±1,9
|
21
[17,0-29,5]
|
21,6±2,0
|
19,5
[12,0-28,0]
|
22±2,0
|
19,0
[15,0-23,0]
|
|
3
|
17,7±1,9
|
16
[13,0-21,0]
|
20,8±2,9
|
15,0
[9,0-25,0]
|
14,9±1,4
|
13,0
[6,0-19,5]
|
|
SOFA
|
1
|
2,2±0,4
|
1,0
[1,0-3,5]
|
2,2±0,4
|
2,0
[1,0-3,0]
|
2,3±0,5
|
1,0
[1,0-3,0]
|
|
3
|
1,3±0,4
|
0,0
[0-2,0]
|
2,2±0,6
|
1,0
[0-2,0]
|
1,3±0,3
|
1,0
[0-2,0]
|
Примечание: здесь и в табл. 2: М – средняя, m – стандартная ошибка средней; Me – медиана, [25%-75%] – 25-й и 75-й процентили.
Суммы баллов по шкале SOFA были сопоставимы в первые сутки послеоперационного периода во всех трех группах и составили в первой группе 2,2±0,4, во второй 2,2±0,4, в третьей 2,3±0,5. К 3-м суткам отмечено снижение количества баллов в первой (1,3±0,4) и третьей группе (1,3±0,3), в то время как во второй группе количество баллов не изменилось (2,2±0,6).
Уровень СРБ во всех трех клинических группах в первые сутки послеоперационного периода был одинаково высоким (табл. 2). На третьи сутки пребывания в ОИТР в первой и второй группах наблюдалось повышение уровня СРБ. Так, у пациентов 1-й группы (контроль) уровень СРБ достиг 25,7±1,8 мг/л, а у пациентов 2-й группы (СЗП) – 28,7±1,9 мг/л. В то же время у больных 3-й клинической группы (Рефортан) уровень СРБ существенно не изменился и составил 21,1±1,2 мг/л. Зафиксированная разница в уровне СРБ между группами на 3-и сутки послеоперационного периода статистически значима (критерий Крускала—Уоллеса = 9,851250, Р= 0,0073).
Таблица 2. Содержание С-реактивного белка, D-димеров и антитромбина III у больных с острым распространенным перитонитом в зависимости от проводимой инфузионной терапии
|
|
|
|
|
|
|
|
|
|
|
|
|
СРБ, мг/л (норма 0—0,5 мг/л)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
D-димеры, мг/л (норма < 0,5 мг/л)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AT III, % (норма 80—120%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Разница между сравниваемыми группами статистически значима (Р<0,05).
К пятым суткам послеоперационного периода уровень СРБ в сравниваемых группах начинал одинаково прогрессивно снижаться и составил 19,9±1,8 мг/л в первой группе, 23,5±2,3 мг/л во второй и 14,3±1,2 мг/л — в третьей. Выявленная разница в концентрации СРБ между сравниваемыми группами на 5-е сутки послеоперационного периода статистически значима (критерий Крускала—Уоллеса = 17,39231, Р = 0,0002). Динамика СРБ представлена на рис. 1.
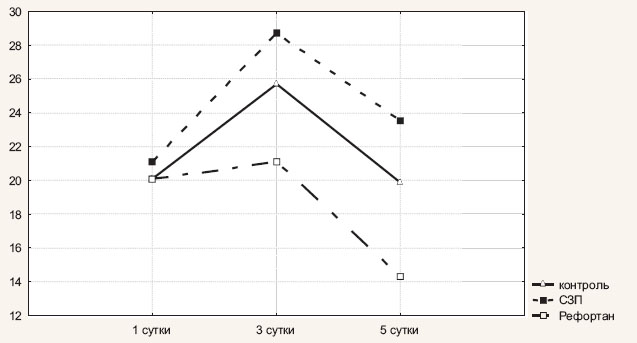
Рис. 1. Динамика изменения уровня СРБ у больных с острым распространенным перитонитом в зависимости от состава инфузионной терапии
Чтобы оценить влияние проводимой терапии на систему гемостаза, выбрано два показателя: D-димеры и антитромбин III.
D-димеры – это продукты расщепления поперечно-сшитого (нерастворимого) фибрина плазмином. Концентрация D-димеров в плазме пропорциональна количеству лизируемого фибрина и активности фибринолиза, что позволяет судить об интенсивности процессов образования и разрушения фибриновых сгустков. Период полувыведения их составляет около 24 часов. Антитромбин III, как основной физиологический антикоагулянт, быстро расходуется на нейтрализацию тромбина и активированных факторов процесса свертывания и является наиболее ранним маркером развивающегося ДВС-синдрома.
В сравниваемых группах в первые сутки послеоперационного периода уровень D-димеров существенно не различался и был одинаково повышен. Так, в первой группе концентрация D-димеров составила 4,3±0,55 мг/л, во второй – 3,6±0,3 мг/л, в третьей – 3,7±0,3 мг/л. К третьим суткам послеоперационного периода уровень D-димеров в первой и второй группах пациентов существенно не изменился и составил 4,4±0,67 мг/л и 3,5±0,4 мг/л соответственно. В третьей группе (Рефортан) уровень D-димеров начал снижаться и уже к третьим суткам составил 3,2±0,3 мг/л. К пятым суткам послеоперационного периода зарегистрировано снижение концентрации D-димеров у больных всех трех клинических групп, причем наименьшее значение данного показателя отмечено в третьей группе (2,1±0,3 мг/л).
Динамика изменения уровня D-димеров представлена на рис. 2.
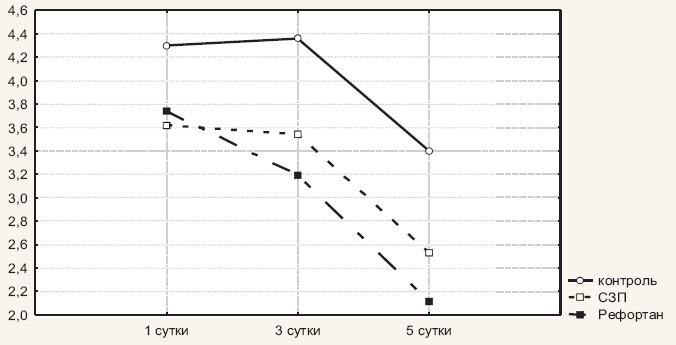
Рис. 2. Динамика изменения уровня D-димеров у больных с острым распространенным перитонитом в зависимости от состава инфузионной терапии
При оценке динамики изменения уровня AT III выявлено, что в первые сутки послеоперационного периода он был одинаково низким во всех анализируемых группах. Так, в первой группе активность AT III составила 68,3±2,5%, во второй – 71,5±1,95%, в третьей – 72,6±1,6%. К третьим суткам уровень AT III начал повышаться во всех группах и составил 76,7±2,3% в первой группе, 77,3±2,1% – во второй и 83,2±1,4% — в третьей. Выявленная разница в уровне AT III между сравниваемыми группами на 3-и сутки послеоперационного периода статистически значима (критерий Крускала—Уоллеса = 6,467046, Р = 0,0394). К пятым суткам уровень AT III во всех группах был в пределах нормы и составил в среднем 88,7±2,3% для пациентов группы контроля, 89,2±1,96% для пациентов группы СЗП и 93,1±1,3% для пациентов третьей группы (Рефортан).
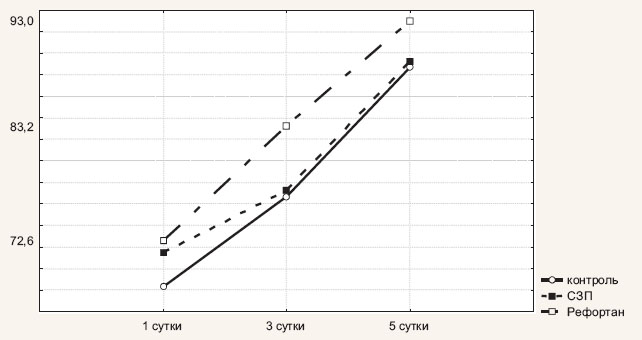
Рис. 3. Динамика изменения уровня антитромбина III у больных с острым распространенным перитонитом в зависимости от состава инфузионной терапии
На основании проведенного исследования сформулируем следующие выводы:
1. Растворы гидроксиэтилированного крахмала (Рефортан, 6%) обладают выраженным противовоспалительным эффектом, что подтверждается более быстрым (Р<0,05) снижением уровня С-реактивного белка по сравнению с использованием только кристаллоидных растворов или кристаллоидных растворов в сочетании со свежезамороженной плазмой у больных с острым распространенным перитонитом.
2. Растворы гидроксиэтилированного крахмала (Рефортан, 6%) оказывают положительное влияние на систему гемостаза, проявляющееся прогрессивным снижением уровней D-димеров к третьим и пятым суткам послеоперационного периода, сопоставимым с таковым на фоне трансфузий свежезамороженной плазмы. Активность антитромбина III на фоне инфузии Рефортана увеличивалась быстрее (Р<0,05) по сравнению с использованием свежезамороженной плазмы и (или) кристаллоидов.
3. Растворы гидроксиэтилированного крахмала обладают высокой клинической эффективностью и могут применяться в интенсивной терапии острого распространенного перитонита.
1. Борисов Д.Б., Недашковский Э.В. // Вестник интенсивной терапии. – 2005. – № 1. – С. 5–10.
2. Буланов А.Ю. // Вестник интенсивной терапии. – 2007. – № 4. – С. 39–41.
3. Григорьев Е.В., Трашахо М.В., Чурляев Ю.А., Кондранин Г.В. // Вестник интенсивной терапии. – 2000. – №5–6. – С. 204–205.
4. Ерюхин И.А., Шляпников С.А. // Consilium medicum. – 2005. – № 6. – С. 468–472.
5. Молчанов И.В., Гольдина О.А., Горбачевский Ю.В. Растворы гидроксиэтилированного крахмала — современные и эффективные плазмозамещающие средства инфузионной терапии. – М.: Изд-во НЦ ССХ им. А.Н. Бакулева РАМН, 1998.
6. Петриков С.С. // Вестник интенсивной терапии. – 2007. – № 1. – С. 95–96.
7. Суханов В.А. // Интенсивная терапия. – 2006. – № 1. – С. 46–48.
8. Шифман Е.М., Флока С.Е. // Вестник интенсивной терапии. – 2007.– № 4. – С. 41–46.
9. Kozek-Langenecker S.A. // Anesthesiology. – 2005. – Vol. 103. – Р. 654–660.
10. Nisanevich V., FelsensteinI., Almogy G. // Anesthesiology. – 2005. – Vol.103. – P. 25–32.
11. Schorr M., Siebeck M., Zugel N. // Eur. J. Clin. Invest. – 2000. – Vol. 30, N 4. – P. 359–366.
12. Winter V., Czeslic E., Sablotzki A. // Анестезиология и реаниматология. – 2007. – № 5. – С. 66–72.
Медицинские новости. – 2008. – №12. – С. 99-102.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Содержание »
Архив »
|
|