Neurologic disorders in oncological hematological patients
Ponomaryov V.V., Zharikova A.V.
Болезнь Паркинсона (БП) – наиболее распространенное нейродегенеративное заболевание, поражает преимущественно нейроны базальных ганглиев [2, 9, 11]. Впервые описано английским врачом Джеймсом Паркинсоном в 1817 г. Болезнь Паркинсона встречается по всему миру, в разных этнических группах, чаще у мужчин. Начинает развиваться в среднем в возрасте 55 лет. Однако в 10% случаев заболевание начинается до 20 лет (ювенильная болезнь Паркинсона) или до 40 лет (БП с ранним началом). Заболеваемость и распространенность БП увеличиваются с возрастом. Так, у лиц старше 65 лет эта патология встречается с частотой 150 случаев на 100 тысяч населения [2].
Одним из величайших открытий XX века признано раскрытие патогенетических механизмов, лежащих в основе БП, что отмечено присвоением Нобелевской премии в 2000 г. Установлено, что патоморфологической основой заболевания является избирательная прогрессирующая дегенерация дофаминергических нейронов черной субстанции вследствие накопления в них белка a-синуклеина, образующего характерные внутриклеточные включения – тельца Леви. Эти нарушения приводят к дефициту синтеза дофамина и его дисбалансу с другим нейротрансмиттером – ацетилхолином [8].
Причины развития болезни Паркинсона до конца не изучены. Рассматривается воздействие на мозг сочетания нескольких патогенных факторов, обсуждается роль оксидантного стресса [4–6]. У некоторых больных выявляется наследственная предрасположенность к БП, вследствие повышенной чувствительности дофаминергических нейронов к воздействию внешних патогенных факторов. В последние годы в развитии заболевания признается большая роль нейропластичности – способности нервной системы к адаптации путем оптимальной структурно-функциональной перестройки [1].
Исходя из известных патогенетических механизмов формирования болезни Паркинсона, очевидно ведущее место нейропротективной терапии, направленной на приостановление болезненного процесса и уменьшение нейродегенерации. К сожалению, большая часть медикаментов, широко используемых в клинической практике с целью коррекции симптомов паркинсонизма (ДОФА-препараты, амантадины, некоторые дофаминовые агонисты), не обладает значимым нейропротективным эффектом [6]. В связи с этим перспективным и научно обоснованным направлением в лечении болезни Паркинсона может считаться применение фармакологических препаратов, избирательно предотвращающих свободно-радикальные процессы, снижающие потребность головного мозга в кислороде, увеличивающих его толерантность к ишемической гипоксии и оказывающих антиоксидантное действие [5, 9].
Среди медикаментов с предполагаемым нейропротективным действием препарат «Тиоцетам» производства корпорации «Артериум». Тиоцетам – комбинированный препарат, в его состав входят пирацетам и тиотриазолин. В экспериментальных исследованиях показано, что фармакологические эффекты тиоцетама обусловлены взаимопотенцирующим действием его ингредиентов. Тиоцетам обладает противоишемическими, антиоксидантными, мембраностабилизирующими и ноотропными свойствами. Он способен ускорять окисление глюкозы в реакциях аэробного и анаэробного окисления, нормализовать биоэнергетические процессы, стабилизировать метаболизм в тканях мозга. Тиоцетам препятствует образованию активных форм кислорода, активизирует антиоксидантную систему ферментов, тормозит свободно-радикальные процессы в тканях мозга, улучшает реологические свойства крови и процессы межнейрональной передачи, а также регенерацию поврежденных нейронов [3]. В ряде клинических испытаний доказано положительное влияние препарата на когнитивные функции у больных с острыми и хроническими формами нарушений мозгового кровообращения, черепно-мозговыми травмами, различными интоксикациями [7].
Тиоцетам выпускают в двух формах: ампулы по 5 мл и таблетки по 400 мг. Дозы препарата и кратность его приема при различных неврологических заболеваниях обсуждаются в литературе [3, 7].
На базе I и II неврологических отделений 5-й клинической больницы г. Минска с мая по октябрь 2010 г. проводилось клиническое испытание препарата «Тиоцетам» в комплексном лечении пациентов с болезнью Паркинсона.
Цель настоящего исследования – изучение динамики клинических и нейропсихологических показателей, изучение безопасности и возможного нейропротективного эффекта тиоцетама в комплексном лечении у пациентов с болезнью Паркинсона.
Проведено параллельное открытое клиническое исследование в течение одного месяца в двух группах больных (основная и контрольная) с диагнозом болезнь Паркинсона. В основную группу вошло 40 больных с БП (27 женщин, 13 мужчин, средний возраст 68,7± 7,6 года). Контрольную группу составили 30 больных с БП, сопоставимых с основной группой по тяжести клинических проявлений, возрасту, полу. Во всех случаях диагнозы соответствовали международным критериям диагностики БП [2, 11]. Рандомизация больных по группам проведена методом случайной выборки. Длительность заболевания составляла 4,2±2,9 года.
Критерий включения в исследование: указание пациентов и (или) их родственников на снижение памяти и внимания.
Критерии исключения из исследования: больные в возрасте старше 80 лет, с декомпенсацией сопутствующих соматических заболеваний, выраженным снижением когнитивных функций, нарушением зрения, препятствующим выполнению нейропсихологических тестов, и наличием индивидуальной переносимости к компонентам препарата.
Дизайн исследования включал соматический и традиционный неврологический осмотр. Особое внимание обращали на выраженность основных симптомов паркинсонизма: гипокинезию, повышение мышечного тонуса по типу «зубчатого колеса», тремор покоя и постуральную неустойчивость, который определяли с помощью пробы Тавенарда. Оценивали латерализацию этих симптомов и их влияние на способность пациентов к самообслуживанию. Выраженность симптомов заболевания в количественном отношении определяли с помощью унифицированной рейтинговой шкалы оценки проявлений паркинсонизма (UPDRS), состоящей из четырех разделов: 1) мышление, поведение, настроение; 2) повседневная активность; 3) оценка; 4) осложнения проводимого лечения. Максимальная суммарная оценка состояния больных по этой шкале – 203 балла. Чем выше балл, тем более выражены проявления БП [9].
Когнитивные нарушения оценивали, используя нейропсихологические тесты: краткую шкалу оценки психического статуса (MMSE), батарею лобной дисфункции (FAB), методику Мюнстенберга и тест «10 слов». По методике Мюнстенберга высчитывали показатель успешности «А»: его максимум – 1, снижение указывает на ослабление внимания.
Тест «10 слов»: пациентам предъявляли 10 слов и фиксировали сначала количество слов, которые они запоминали с первой попытки, затем количество слов после повторения со второй и третьей попыток и количество запомнившихся слов отсроченно (спустя 30 мин).
Нейропсихологическое тестирование проводили до начала терапии, через 10 и 30 дней.
Больные основной группы получали тиоцетам первоначально в виде внутривенных инфузий в дозе 10 мл внутривенно (2 ампулы) 10 дней, затем по 2 капсулы три раза в сутки в течение трех недель. Все пациенты продолжали принимать базисную терапию – противопаркинсонические средства (мадопар, ПК-Мерц, мирапекс или их сочетание). При необходимости в комплекс лечения включали адекватные дозы гипотензивных (эналаприл, атенолол), сахароснижающих средств (метформин), антиагреганты (аспирин, дипиридамол), физиотерапию (озокерит, магнит, массаж) и гипербарическую оксигенацию. Исключали одновременный прием других медикаментов с нейропротективным эффектом.
Переносимость, побочные реакции, осложнения тиоцетама и его эффективность регистрировали при помощи анкет.
Контрольная группа больных получала только базисную терапию противопаркинсоническими препаратами и физиотерапию.
Результаты лечения по количественным оценочным шкалам обработаны с помощью программ Exсel и Statistica-6.0. Рассчитывали среднее арифметическое и стандартное отклонения. Степень достоверности определяли с помощью «t» критерия Стьюдента. За уровень статистической достоверности принимали результаты при P<0,05.
До начала исследования в клинической картине у больных основной группы преобладал экстрапирамидный синдром, который проявлялсяакинезией (гипокинезией), скованностью (пластической ригидностью), тремором покоя и постуральной неустойчивостью (невозможностью удержать равновесие), которые встречались в различных сочетаниях. Выраженность данных симптомов по шкале UPDRS составляла 28,8±1,9 балла, что соответствовало I–II степени тяжести БП.
Гипокинезия являлась облигатным признаком БП у всех больных и включала замедленность движений (брадикинезию), затруднение первых произвольных движений, обеднение их структуры, утрату физиологических синкинезий, снижение скорости и амплитуды повторных альтернирующих движений (сжимание-разжимание кистей рук) или сведение-разведение большого и указательного пальцев кисти (олигокинезия). С акинезией были связаны такие частые проявления заболевания, как гипомимия, редкое мигание, монотонная приглушенная речь, слюнотечение (за счет замедленного сглатывания слюны), микрография, ахейрокинез (отсутствие содружественного движения рук при ходьбе) и шаркающая походка.
Скованность (пластическая ригидность) имела место у 32 больных. Была обусловлена повышением мышечного тонуса при пассивном растяжении мышцы и проявлялась классическим феноменом «зубчатого колеса». Этот симптом преобладал в пронаторах и супинаторах кисти с одной стороны в равной степени справа либо слева.
Дрожание (тремор) отмечено нами у 24 больных. Тремор носил стереотипический, ритмичный характер, усиливался в покое и уменьшался при активных движениях. Поражались преимущественно дистальные отделы верхних, реже – нижних конечностей и нижняя челюсть. У 12 больных тремор кистей носил классический тип «катания пилюль» или «счета монет».
Постуральная неустойчивость имела место у 14 больных. При пробе Тавенарда врач становился позади больного и за плечи подталкивал его вперед, на себя и в стороны. Положительным этот симптом считали в тех случаях, если больной с трудом удерживал равновесие, делал несколько мелких неэффективных шажков вперед (пропульсия), назад (ретропульсия), в сторону (латеропульсия) или падал без всякой попытки удержать равновесие.
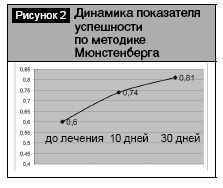
Когнитивные нарушения различной степени выраженности обнаружены у 32 (80%) больных. Они проявлялись снижением кратковременной или долговременной памяти, ослаблением внимания, замедленностью мышления, трудностью в подборе слов, «забывчивостью». При проведении нейропсихологического тестирования в исследуеой группе обращало на себя внимание минимальное снижение показателей MMSE (до 26,7±0,5 балла) при умеренном уменьшении FAB (до 13,8±0,5 балла). Такое соотношение тестов указывало на подкорковый тип деменции легкой – умеренной степени. Эти данные подтверждали результаты, полученные при выполнении методики Мюнстенберга, показатель успешности которой в исследованной группе был сниженным до 0,6±0,05.
Результаты выполнения теста «10 слов». С 1-й попытки пациенты воспроизводили 4,6±0,3 слова, со 2-й – 6,1±0,2 слова, с 3-й – 6,6±0,3 слова, отсроченно – 5,6±0,3 слова (таблица). Такая динамика запоминания отражала снижение памяти и внимания у больных.
Динамика показателей запоминания слов при тесте "10 слов"
|
Попытка
|
Начало терапии
|
10-й день
|
30-й день
|
|
1-я попытка
|
4,6±0,3
|
5,2±0,3
|
6,1±0,3*
|
|
2-я попытка
|
6,1±0,2
|
6,4±0,2
|
7,1±0,2*
|
|
3-я попытка
|
6,6±0,3
|
6,7±0,2
|
7,5±0,2*
|
|
Отсроченное воспроизве-дение
|
5,6±0,3
|
6,1±0,3
|
7,4±0,3*
|
П р и м е ч а н и е: *– различия достоверны по сравнению с оценкой до начала терапии.
Спустя 10 дней терапии большинство пациентов отметили улучшение своего общего самочувствия, однако количественное изменение (в балах) симптомов паркинсонизма по шкале UPDRS было недостоверным. Результаты нейропсихологического тестирования обнаружили повышение результатов выполнения только теста FAB – до 15,6±0,4 балла, P<0,05 (рис. 1). Динамика остальных нейропсихологических тестов также оказалась недостоверной.
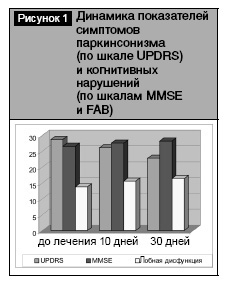
Через 30 дней лечения наблюдался значимый регресс симптомов паркинсонизма по шкале UPDRS – до 22,9±1,6 балла (P<0,05). Пациенты указывали на уменьшение общей скованности, уверенности походки, облегчение самообслуживания, несколько уменьшилось дрожание. Кроме того, большинство больных отметили улучшение памяти, запоминания, внимания, общего состояния и возможности к самообслуживанию. Субъективное улучшение состояния пациентов подтверждали результаты нейропсихологического тестирования (рис. 1, 2). Показатель MMSE в исследованной группе увеличился и не отличался от здоровых (28,2±0,3 балла, P<0,05), а результаты FAB выросли до 16,5±0,3 балла (P<0,05), что типично для легкой степени подкорковой деменции. Показатель успешности методики Мюнстенберга возрос до 0,8±0,04, P<0,05 (рис. 2). Также достоверно увеличилось количество запомнившихся слов в тесте «10 слов» (см. таблицу). В комплексе полученные результаты свидетельствовали об улучшении кратковременной и долговременной памяти, внимания.
Результаты терапии тиоцетамом 30 (75%) больных оценили как хорошие, 8 (20%) чел. – как удовлетворительные.
В 2 (5%) случаях отмечены побочные эффекты препарата: у одной больной повысилось АД, во втором случае появились боли в желудке. После отмены препарата эти нежелательных проявления исчезли, дополнительной коррекции не потребовалось.
В контрольной группе пациентов в процессе терапии также выявлена положительная динамика в плане регресса симптомов паркинсонизма, однако значимых изменений когнитивной функции у них не отмечено.
Диагностические подходы к распознаванию болезни Паркинсона существенно изменились. Данное заболевание диагностируют при наличии гипокинезии (обязательный критерий), которая сопровождается любым из следующих трех симптомов: экстрапирамидная ригидность, тремор покоя и постуральная неустойчивость. Кроме того, во внимание принимают ряд клинических особенностей течения заболевания: в частности, одностороннее преобладание симптомов паркинсонизма, относительно медленный темп прогрессирования и обычно высокий результат терапии левадопа-препаратами [2, 11].
Проведенное нами исследование подтверждает полученные ранее литературные данные о том, что БП характеризуется полиморфизмом симптоматологии за счет различных комбинаций и разной степени проявления указанных выше основных симптомов паркинсонизма. Причины полиморфизма клинических проявлений у больных с болезнью Паркинсона объясняют различной топической локализацией дегенеративных изменений в головном мозге и специфичными нейромедиаторными нарушениями. Так, брадикинезию у пациентов с БП связывают с сочетанным поражением полосатого тела. Другие проявления паркинсонизма при этой патологии (постуральная неустойчивость, ахейрокинез, укороченная длина шага) могут быть следствием не только поражения базальных ганглиев, но и дисфункции лобных долей [11].
Проблема когнитивных нарушений при БП весьма актуальна в современной неврологии. Сопровождая двигательные расстройства, эти нарушения ощутимо ухудшают качество жизни пациентов. Механизмы формирования деменции при болезни Паркинсона также напрямую зависят от процессов нейродегенерации, преобладающих в базальных ганглиях, и снижения нейропластичности. Кроме того, развитие когнитивного дефицита при БП связано с нарушением фронтостриарных путей, проходящих через бледный шар, которые участвуют в познавательной деятельности [9]. Именно эти особенности когнитивного дефицита определяют преобладание в клинической картине пациентов с БП нарушений внимания и памяти, что отличает их от больных с кортикальной деменцией, у которых превалируют нарушения высших корковых функций (речи, праксиса, гнозиса и др.).
В наших исследованиях подтвержден подкорковый характер когнитивных нарушений при БП. Несомненно взаимоотягощающее влияние на когнитивный дефицит при БП сопутствующих цереброваскулярных нарушений, частота которых увеличивается с возрастом больных [2, 5]. Нарушения в системе регуляции кровообращения головного мозга (ишемия) усугубляют процесс репарации нейронов, включают другие повреждающие механизмы, в том числе высвобождение возбуждающих нейротрасмиттеров (глутамата, аспартата, серотонина и др.) [4, 5].
Исходя из патогенеза развития когнитивных нарушений при БП, очевидна необходимость целенаправленной нейропротекции с помощью различных медикаментозных и немедикаментозных средств [1]. Защита мозга от повреждающих факторов и ишемии в настоящее время проводится в трех направлениях: 1) блокада глутаматных рецепторов с помощью прямых ингибиторов; 2) воздействие на ионный гомеостаз путем применения антагонистов Са2+ и Na+ каналов, агонистов К+ каналов; 3) использование антиоксидантов, подавляющих апоптоз [5]. Основная задача этих средств, с одной стороны – сохранять подвергающиеся дегенерации нейроны, с другой – усиливать функции сохранившихся нейронов. Общепринятой сегодня является комбинированная нейропротекция с воздействием на различные механизмы и этапы патологического процесса [4, 5]. Среди широкого перечня традиционно применяемых в неврологии лекарственных средств с реальным и предполагаемым нейропротективным эффектом преимущество, вероятно, будут иметь комбинированные препараты. Один из них – тиоцетам.
Каждая из составляющих тиоцетама (пирацетам и тиотриазолин) рассматривается как потенциальный нейропротектор и антиоксидант, а их сочетание приводит к взаимопотенцирующему эффекту [3].
Результаты проведенного нами исследования показали достоверное влияние препарата «Тиоцетам» на улучшение интегративных и когнитивных функций головного мозга у больных с БП. Принципиально важен с практической стороны обнаруженный нами факт, что для достижения максимальной эффективности тио-цетама недостаточно 10-дневного курса, требуется его более длительный прием (не менее 30 дней). Учитывая хорошую переносимость и минимальное число побочных эффектов, тиоцетам заслуживает более широкого применения в качестве курсового нейропротектора при болезни Паркинсона.
ЛИТЕРАТУРА
1. Боголепова А.Н., Чуканова Е.И. //Журн. неврол. и психиатр.– 2010.– №8.– С. 72–75.
2. Голубев В.Л., Левин Я.И., Вейн А.М. Болезнь Паркинсона и синдром паркинсонизма.– М., 2000.– 414 с.
3. Дзяк Л.А., Сирко А.Г. //Междунар. неврол. журн.– 2007.– № 5.– С. 104–110.
4. Мурешану Д. //Междунар. неврол. журн.– 2007.– № 6.– С. 63–66.
5. Суслина З.А., Максимова М.Ю., Федорова Т.Н. // Неврол. журн.– 2007.– №4.– С. 4–8.
6. Федорова Н.В., Ким И.П. // Журн. неврол. и психиатр.– 2002.– №2.– С. 68–72.
7. Черний Т.В., Андронова И.А., Черний В.И. и др. // Междунар. неврол. журн.– 2010.– № 1.– С. 29–37.
8. Galvin J. // Neurochem. Research.– 2004.– №6.– P. 1041–1051.
9. European Handbook of Neurological Management / ed. R. Hughes, M. Brainini, N. Gilhus. – 2007.
10. Herndon R.M. Handbook of Neurological Rating Scales. – New York, 1997.
11. Parkinson’s Disease / ed. M. Simuni, R. Pahwa. – Oxford, 2010.
Медицинские новости. – 2011. – №1. – С. 60–63.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.