Gorbich U.L., Karpov I.A., Krechikova O.I.
Infections, induced by Acinetobacter baumannii: risk factors, diagnostics, treatment, prevention approaches
Нозокомиальные инфекции (лат. nosocomium – больница, греч. nosocmeo – больница, ухаживать за больным) – это инфекции, развившиеся у пациента не менее чем через 48 ч после госпитализации, при условии что при поступлении в стационар инфекция не существовала и не находилась в инкубационном периоде; инфекции, явившееся следствием предыдущей госпитализации, а также инфекционные заболевания медицинских работников, связанные с их профессиональной деятельностью.
По данным различных авторов, число пациентов, у которых развиваются нозокомиальные инфекции, колеблется от 3 до 15% [1–3]?. Из них 90% имеют бактериальное происхождение; вирусные, грибковые возбудители и простейшие встречаются значительно реже [2].
С начала эры антибиотиков и до 60-х годов ХХ в. примерно 65% внутрибольничных инфекций (ВБИ) имели стафилококковую природу. С появлением в арсенале врачей пенициллиназостабильных антибактериальных препаратов они отступили на второй план, уступив лидерство инфекциям, вызванным грамотрицательными бактериями [4].
В настоящее время, несмотря на несколько возросшую этиологическую роль грамположительных микроорганизмов и грибов как возбудителей нозокомиальных инфекций, штаммы грамотрицательных микроорганизмов со множественной резистентностью к антибактериальным препаратам представляют серьезную проблему в стационарах различных стран мира [1, 2]. По данным ряда авторов, их частота варьируется от 62 до 72% всех нозокомиальных инфекций [5–7]. Наиболее актуальными возбудителями всех ВБИ (кроме ангиогенных) и сепсиса являются микроорганизмы семейства Enterobacteriaceae и неферментирующие бактерии, к которым относятся Pseudomonasaeruginosa и Acinetobacterspp. [4].
Наиболее клинически значимым видом рода Acinetobacter является Acinetobacter baumannii (геномовид 2) [8], который вызывает 2–10% грамотрицательных инфекций в Европе и США [9], до 1% всех нозокомиальных инфекций [10].
Факторы риска
В качестве общих факторов риска инфекций, вызванных A. baumannii, выделяют:
– мужской пол;
– пожилой возраст;
– наличие сопутствующих заболеваний (злокачественные заболевания крови, сердечно-сосудистая или дыхательная недостаточность, диссеминированное внутрисосудистое свертывание крови);
– длительность использования инвазивных методов лечения и мониторинга (ИВЛ более 3 дней; ингаляционное введение лекарственных препаратов; введение назогастрального зонда; трахео-стомия; катетеризация мочевого пузыря, центральной вены, артерии, оперативное вмешательство);
– длительное нахождения в стационаре или отделении реанимации и интенсивной терапии (ОРИТ);
– предшествующая антибактериальная терапия с использованием цефалоспоринов, фторхинолонов или карбапенемов [11, 12–20].
Предшествующее госпитализации в ОРИТ хирургическое вмешательство повышает риск инфицирования примерно в 5 раз [15].
В качестве факторов риска инфицирования карбапенемрезистентным штаммом A. baumannii для взрослых к настоящему моменту описаны: большой размер стационара (более 500 коек); госпитализация в ОРИТ или госпитализация по экстренным показаниям; длительное пребывание в стационаре; высокая плотность пациентов с CRAB в палате; мужской пол; иммуносупрессия; ИВЛ, катетеризация мочевыводящих путей или артерии, проведение гемодиализа; недавнее оперативное вмешательство; пульс-лаваж ран; предшествующее использование меропенема, имипенема или цефтазидима [16, 18, 21, 22–27].
В Республике Беларусь в качестве факторов риска колонизации/инфицирования нозокомиальным изолятом Acinetobacter baumannii, устойчивым к карбапенемным антибиотикам, были выделены предшествующее использование «антисинегнойных» карбапенемов, катетеризация мочевыводящих путей, госпитализация в отделение нетерапевтического профиля и возраст до 40 лет (табл. 1).
Таблица 1 Факторы риска колонизации/инфицирования карбапенемрезистентным штаммом A. baumannii в больнич ных организациях здравоохранения г. Минска (персональные неопубликованные данные)
|
Фактор риска
|
ОШ* (95% доверительный интервал)
|
|
Предшествующее использование «антисинегнойных»** карбапенемов
|
ОШ 16 (95% ДИ 4,1; 62,4)
|
|
Катетеризация мочевыводящих путей
|
ОШ 5,4 (95% ДИ 1,5; 19)
|
|
Госпитализация в отделение нетерапевтического профиля
|
ОШ 10,6 (95% ДИ 1,7; 65,4)
|
|
Возраст до 40 лет
|
ОШ 4,21 (95% ДИ 1,3; 13,3)
|
* Отношение шансов (ОШ) – определяется как отношение шансов события в одной к шансам события в другой или как отношение шансов того, что событие произойдет, к шансам того, что событие не произойдет; ** меропенем, имипенем, дорипенем.
Ацинетобактерассоциированные
инфекции
A. baumannii в большинстве случаев вызывает заболевания у тяжелобольных иммуноскомпрометированных пациентов[4, 10, 11, 14, 16, 23, 28, 29]. Данный микроорганизм может являться причиной инфекций дыхательных путей (синусит, трахеобронхит, пневмония), кровотока (сепсис, эндокардит естественных и искусственных клапанов), мочевыводящих путей, раневой и хирургической инфекций, инфекций кожи и мягких тканей (включая некротизирующий фасциит), нервной системы (менингит, вентрикулит, абсцесс мозга), интраабдоминальных (абсцессы различной локализации, перитонит), опорно-двигательного аппарата (остеомиелит, артрит) [11, 21, 28–30].
По данным собственных исследований, проведенных в 15 больничных организациях здравоохранения г. Минска, в структуре A. baumannii-ассоциированных инфекций превалируют инфекции кровотока, составляя 39,4% от всех инфекций, вызванных данным возбудителем. Второе место занимают инфекции дыхательных путей (35,4%), третье (19,7%) – инфекции кожи и мягких тканей (включая инфекции хирургической раны). Остеомиелиты наблюдались в 4,7% случаев, инфекции мочевыводящих путей – 0,8% случаев.
Инфекции кровотока. Клинические проявления инфекций кровотока, вызванных A. baumannii, варьируются от транзиторной бактериемии до крайне тяжелого заболевания с высоким уровнем смертности [31]. Воротами инфекции чаще всего являются дыхательные пути, однако при первичном развитии септического процесса основную роль играют внутрисосудистые катетеры [31–33]. Реже входными воротами служат мочевыводящие пути, кожа и мягкие ткани, ожоговые раны, органы брюшной полости и центральная нервная система [31]. Внутрибольничный сепсис, вызванный A. baumannii, в 73% случаев развивается после 15-го дня госпитализации [34]. Септический шок развивается примерно у 30% пациентов с ацинетобактерассоциированным сепсисом [35]. В то же время, больные с бактериемией, связанной с внутрисосудистыми катетерами, характеризуются лучшим прогнозом, предположительно потому, что источник инфекции может быть элиминирован из организма при удалении катетера [7, 36].
Факторами риска развития инфекций кровотока, вызванных A. baumannii, являются экстренная госпитализация, длительное пребывание в стационаре, предшествующая колонизация ацинетобактериями, высокий коэффициент инвазивных процедур, проведение ИВЛ, пожилой возраст или возраст менее 7 дней, вес менее 1500 г (для новорожденных), иммуносупрессия, злокачественные заболевания, сердечно-сосудистая недостаточность, почечная недостаточность, дыхательная недостаточность во время поступления в ОРИТ, наличие в анамнезе эпизода сепсиса, развившегося в ОРИТ, предшествующая антибактериальная терапия (особенно цефтазидим или имипенем) [7, 19, 24, 33, 34].
Инфекции дыхательных путей. A. baumannii, наряду с Pseudomonas aeruginosa, Stenotrophomonasmaltophilia и MRSA, является возбудителем поздних (развивающихся позже 5 дней с момента госпитализации) эпизодов нозокомиальной пневмонии. Кроме времени манифестации инфекции имеют значение также предшествующая антибактериальная терапия и госпитализация в течение последних 60 дней [37].
Нозокомиальные ацинетобактерассоциированные пневмонии чаще всего полисегментарные. Может наблюдаться формирование полостей в легких, плевральный выпот, образование бронхоплевральной фистулы [35].
Независимыми факторами риска развития ВАП, вызванной A. baumannii, являются предшествующая антибактериальная терапия и наличие острого респираторного дистресс-синдрома [12, 16, 37, 38]. Предшествующий эпизод сепсиса, использование антибактериальных препаратов до развития инфекции (особенно имипенема, фторхинолонов и цефалоспоринов III поколения, пиперациллина/тазобактама), продолжительность ИВЛ более 7 дней, реинтубация, длительность пребывания в стационаре определены в качестве факторов риска развития ВАП, вызванной мультирезистентным штаммом A. baumannii [12, 16, 21, 38, 39].
A. baumannii является третьей по частоте причиной нозокомиального трахеобронхита (НТБ) у пациентов на ИВЛ, обуславливая 13,6 и 26,5% случаев НТБ у пациентов с хирургической и терапевтической патологией соответственно. Развитие НТБ достоверно приводило к увеличению срока пребывания в ОРИТ и продолжительности проведения ИВЛ даже в случаях, если у пациентов впо-следствии не развивалась нозокомиальная пневмония[40].
Инфекции кожи и мягких тканей. A. baumannii является значимым патогеном при травматических повреждениях, ожогах, а также в отношении инфекционных осложнений послеоперационных ран [35, 41, 42]. Инфекции кожи и мягких тканей, вызванные A. baumannii, в большинстве случаев осложняются бактериемией [43].
Ацинетобактерии способны вызывать инфекции подкожной жировой клетчатки в месте постановки внутривенного катетера, разрешения которых можно достичь только после его удаления [35].
Инфекции нервной системы. Acinetobacter baumannii способен вызывать внутрибольничные менингиты, абсцессы головного мозга [44–46]. Менингит может развиться остро или иметь по-степенное начало. На кожных покровах может наблюдаться петехиальная сыпь (до 30% случаев) [35]. Изменения спинномозговой жидкости при менингите, вызванном A. baumannii, не отличаются от соответствующих изменений при менингитах другой этиологии и представлены: плейоцитозом с преобладанием нейтрофилов, увеличением уровня белка и молочной кислоты, снижением уровня глюкозы [46].
Факторы риска развития ацинетобактерного менингита включают: экстренное нейрохирургическое вмешательство, наружную вентрикулостомию (особенно проводимую ³5 дней), наличие цереброспинальной фистулы, нерациональное использование антибактериальных препаратов в нейрохирургических ОРИТ [46, 47].
Инфекции мочевыводящих путей (ИМП). Несмотря на частую колонизацию нижних отделов мочевыводящих путей ацинетобактерии редко являются этиологическим агентом ИМП [35]. Acinetobacter spp. выделяются в 1–4,6% случаев нозокомиальных ИМП [47, 48].
Факторами риска ацинетобактерассоциированных ИМП являются наличие катетера в мочевом пузыре и нефролитиаз [35].
Другие инфекции. Ацинетобактерии вызывают перитонит у пациентов, находящихся на длительном амбулаторном перитонеальном диализе; а также холангит на фоне чреспеченочной холангиографии или дренирования желчевыводящих путей [12, 47]. Остеомиелиты и артриты, вызванные A. baumannii, связаны с внедрением искусственных имплантатов или травмой [12]. Описаны также ацинетобактерассоциированные поражения глаз, связанные с контаминацией мягких контактных линз (изъязвление и прободение роговицы). Возможно развитие других поражений органа зрения от конъюнктивита до эндофтальмита [35].
Диагностика и определение
чувствительности к антимикробным препаратам
В клинической практике инфекции, вызванной A. baumannii, предшествует колонизация кожных покровов, дыхательных и мочевыводящих путей, желудочно-кишечного тракта пациентов [16, 18, 29, 46, 49]. Значительное распространение A. baumannii как колонизирующего микроорганизма требует объективной оценки ситуации при выделении из биологического материала пациента [12]. В то же время, следует отметить, что выделение Acinetobacterspp. в качестве колонизирующего микроорганизма является прогностически значимым для определения этиологии последующей нозокомиальной инфекции (положительная/отрицательная предиктивная ценность – 94/73% для ВАП, 43/100% для инфекций кровотока соответственно) [49].
Диагностика нозокомиальной инфекции, в т.ч. A. baumannii-ассоциированной, с клинических позиций условно подразделяется на 4 этапа:
1. Забор и транспортировка клинического материала.
2. Идентификация возбудителя.
3. Определение этиологической значимости выделенного микроорганизма.
4. Определение чувствительности к антимикробным препаратам и интерпретация полученных результатов.
Правильный сбор и транспортировка клинического материала позволяют свести к минимуму вероятность недостоверных результатов лабораторных исследований, а следовательно, и уменьшить «неадекватное» назначение антимикробных препаратов.
Общие правила забора клинического материала на микробиологическое исследование ([50] с изменениями):
1. Забор, по возможности, необходимо проводить до начала антибактериальной терапии. Если больной уже получает антибактериальную терапию, то клинический материал следует брать непосредственно перед очередным введением препарата.
2. Материал для бактериологического исследования необходимо забирать непосредственно из очага инфекции. При невозможности – использовать другой клинически значимый биологический материал.
3. Строго соблюдать правила асептики, не допуская контаминации материала посторонней микрофлорой.
4. Для взятия отделяемого из раны, мазков со слизистых оболочек, из глаза, уха, носа, зева, цервикального канала, влагалища, анального отверстия следует использовать стерильные ватные тампоны. Для крови, гноя, ликвора и экссудатов – стерильные шприцы и специализированные транспортные среды; для мокроты, мочи, кала – стерильные плотно закрывающиеся контейнеры.
5. Количество материала должно быть достаточным для проведения исследования.
6. Нативный материал доставляют в лабораторию в максимально короткие сроки (не позднее 1,5–2 ч после их получения). Допускается хранение материала в холодильнике при 4 оС (кроме биологического материала, полученного из стерильных в норме локусов: ликвора, крови, внутрисуставной и плевральной жидкости). При использовании транспортных сред клинический материал можно хранить в течение 24–48 ч.
7. Жидкий биологический материал можно транспортировать непосредственно в шприце, на кончик которого надет стерильный колпачок или загнутая под углом игла.
Идентификация возбудителя. Род Acinetobacter (семейство Moraxellaceae) состоит из строгих аэробных, неподвижных грамотрицательных лактозанеферментирующих оксидазаотрицательных, каталазаположительных коккобактерий размером 1–1,5 х 1,5–2,5 мкм, окисляющих глюкозу до кислоты только в присутствии кислорода и способных расти на обычных питательных средах [11, 21, 28, 32, 47, 51–53]. На плотных питательных средах колонии гладкие, непрозрачные, несколько меньшие по размерам, чем представители энтеробактерий.
Типичные морфологические формы эти микроорганизмы имеют в мазках, сделанных из клинического материала или из жидких питательных сред. При росте на плотных средах в присутствии антибиотиков в мазках бактерии имеют форму палочек [54, 55]. Некоторые изоляты ацинетобактерий могут задерживать кристаллический виолет, плохо обесцвечиваясь при окраске по Граму, что приводит к их ошибочной интерпретации как грамположительных бактерий [52].
Трактовка результатов([50] с изменениями и дополнениями). По глубокому убеждению авторов, достоверным критерием инфекции, связанной с условно-патогенной внутрибольничной микрофлорой, в том числе и Acinetobacter baumannii, является выделение культуры из стерильного источника.
Кровь. Материал для исследования необходимо брать как минимум из двух периферических вен в разные флаконы. Не допускается взятие крови из венозного катетера за исключением случаев, когда имеется подозрение на катетерассоциированную инфекцию. При сравнении посевов двух порций крови, взятых из катетера и периферической вены и засеянных количественным методом, получение роста колоний из катетера, превышающего в 5–10 раз число идентичных колоний при посеве венозной крови, свидетельствует о наличии инфекции, связанной с катетером.
Ликвор. Выделение A. baumannii в низких концентрациях затрудняет интерпретацию результатов, особенно в отделениях, где этот микроорганизм часто колонизирует кожные покровы пациентов. Вероятность его этиологической значимости значительно повышается в случае выделения ацинетобактерий из ликвора у пациентов с уже имеющейся инфекцией, вызванной A. baumannii, вне центральной нервной системы (так называемый вторичный менингит), после проведения нейрохирургических вмешательств, у пациентов с проникающими повреждениями черепа, особенно на фоне имеющихся факторов риска ацинетобактерассоциированных инфекций.
Интерпретация клинического значения ацинетобактерий, выделенных из нестерильных локусов, – многофакторный процесс, зависящий от квалификации клинициста, микробиолога, специалиста забиравшего материал, состояния пациента. Нижеприведенные критерии в определенной мере являются условными, но в то же время позволяют повысить вероятность адекватной трактовки выделенного микроорганизма, как колонизирующего агента или возбудителя инфекции.
Мокрота. Выделение ацинетобактерий в количестве ³106 КОЕ/мл (из бронхиальных смывов ³104 КОЕ/мл) является диагностически значимым при условии соблюдения правил забора мокроты. Однако эти значения не являются абсолютными, так как на фоне антибактериальной терапии количество причинно значимых бактерий в мокроте снижается и, наоборот, возрастает концентрация колонизирующей микрофлоры.
При исследовании мокроты ее бактериоскопия является обязательной, так как позволяет судить о качестве взятого материала. Наличие в одном поле зрения при малом увеличении более 10 эпителиальных клеток и/или менее 25 полиморфно-ядерных лейкоцитов указывает на контаминацию образца слюной, поэтому дальнейшее исследование этого материала нецелесообразно. В таком случае мокроту следует взять повторно с соблюдением всех правил забора.
Материал при раневой инфекции. Следует исключить возможную контаминацию исследуемого материала изолятами A. baumannii с поверхности кожи, особенно при использовании тампонов. При выделении смешанных культур, предпочтение следует отдавать микроорганизмам, выделенным в большей концентрации.
Моча. Диагностически значимым является выделение бактерий в концентрации ³105 КОЕ/мл при наличии симптомов заболевания. При взятии мочи из непосредственно мочевого пузыря без катетеризации мочевыводящих путей выделение ацинетобактерий в любом титре считается значимым. Наличие трех и более видов микроорганизмов в больших концентрациях указывает на контаминацию во время сбора мочи или на ее неправильное хранение.
Дополнительным маркером этиологической значимости Acinetobacter baumannii является положительная динамика общего состояния пациента на фоне противоацинетобактерной терапии [37].
Интерпретация антибиотикограммы ([56, 57] с изменениями и дополнениями). После получения результатов тестирования возбудителя на чувствительность к антибактериальным препаратам, не следует назначать этиотропную терапию формализованно, опираясь лишь на показания антибиотикограммы. Чувствительнось организма к тому или иному антимикробному препарату in vitro не всегда коррелирует с его активностью in vivo. Это может быть связано как с индивидуальными особенностями фармакокинетики и/или фармакодинамики препарата у данного конкретного пациента, так и с погрешностями в методике исследования, качеством используемых материалов и т.д.
При анализе антибиотикограммы следует обращать внимание не на какой-либо конкретный препарат(ы), к которому(ым) возбудитель чувствителен/резистентен, а на всю картину в целом. Это позволяет, сопоставив вероятный фенотип резистент-ности ацинетобактерий с фактическими данными, скорректировать последние, избежав тем самым назначения малоэффективных препаратов.
В частности, для выявления штаммов, продуцирующих бета-лактамазы расширенного спектра действия (БЛРС) следует обращать внимание на чувствительность возбудителя к цефокситину и азтреонаму. Если изолят продуцирует БЛРС цефокситин сохраняет активность, а азтреонам нет. В этом случае изолят необходимо расценивать, как резистентный ко всем цефалоспоринам I–IV поколения и азтреонаму вне зависимости от фактических результатов антибиотикограммы. Если штамм устойчив к цефокситину, но чувствителен к азтреонаму, он является продуцентом хромосомных бета-лактамаз. В этом случае цефалоспорины IV поколения могут сохранять свою активность.
В случае определения чувствительности только к одному из «антисинегнойных» карбапенемов, не следует оценивать чувствительность остальных по аналогии с ним. Различные представители карбапенемов в неодинаковой степени подвержены действию того или иного механизма резистентности. A. baumannii, резистентный, например, к меропенему, может сохранять чувствительность к имипенему и/или дорипенему и наоборот.
При обнаружении штамма, резистентного к колистину, необходимо с осторожностью относиться к такому результату и повторно определить чувствительность с параллельным тестированием контрольных штаммов.
В отношении аминогликозидов интерпретационная оценка антибиотико-граммы крайне затруднительна ввиду большого количества аминогликозидмодифицирующих ферментов и вариабельности их субстратного профиля. Поэтому для аминогликозидов допустимы самые различные сочетания чувствительности/резистентности внутри класса.
Большинство клинических изолятов A. baumannii резистентно к фторхинолонам и хлорамфениколу, поэтому необходимо с осторожностью подходить к выбору данных препаратов в качестве этиотропных для лечения ацинетобактерассоциированных инфекций, несмотря на результаты определения чувствительности к антибиотикам. Кроме того, оценивая чувствительность Acinetobacter baumannii к хинолонам, следует учитывать, тот факт, что для формирования резистентности к нефторированным хинолонам достаточно одной мутации в гене либо ДНК-гиразы (gyrA) либо топоизомеразы IV (parC). Для развития резистентности к фторхинолонам необходимы мутации в обоих генах. Поэтому при получении результатов антибиотикограммы, указывающих на чувствительность штамма к налидиксовой или пипемидовой кислоте при одновременной резистентности к фторированным хинолонам, следует крайне скептически подходить к данной антибиотикограмме в целом.
При интерпретации антибиотико-грамм также необходимо учитывать, что Acinetobacterspp. в целом обладают природной резистентностью к цефалоспоринам I и II поколения, природным и аминопенициллинам, триметоприму, фосфамицину.
Для характеристики резистентности Acinetobacter baumannii рекомендуется использовать следующие понятия [58]:
– резистентный (resistant) Acinetobacterbaumannii – нечувствительный к одному антимикробному препарату;
– мультирезистентный (multidrug-resistant – MDR) Acinetobacterbaumannii – нечувствительный к ³1 препарату в ³3 классах, перечисленных в табл. 2;
Таблица 2. Антимикробные препараты, используемые для классификации Acinetobacter spp. по степени резистентности [103 с изменениями и дополнениями]
|
Класс
|
Антимикробный препарат
|
|
Аминогликозиды
|
Гентамицин
|
|
Тобрамицин
|
|
Амикацин
|
|
Нетилмицин
|
|
«Антисинегнойные» карбапенемы
|
Имипенем
|
|
Меропенем
|
|
Дорипенем
|
|
«Антисинегнойные» фторхинолоны
|
Ципрофлоксацин
|
|
Левофлоксацин
|
|
«Антисинегнойные» пенициллины + ингибиторы β-лактамаз
|
Пиперациллин/та-зобактам
|
|
Тикарциллин/клаву-ланат
|
|
Цефалоспорины
|
Цефотаксим
|
|
Цефтриаксон
|
|
Цефтазидим
|
|
Цефепим
|
|
Ингибиторы мета-болизма фолиевой кислоты
|
Ко-тримоксазол
|
|
Монобактамы
|
Азтреонам
|
|
бета-лактамы + сульбактам
|
Ампициллин-суль-
|
|
бактам
|
|
Цефоперазон-суль-
|
|
бактам
|
|
Полимиксины
|
Колистин
|
|
Полимиксин В
|
|
Тетрациклины
|
Тетрациклин
|
|
Доксициклин
|
|
Миноциклин
|
– экстенсивно резистентный (extensivelydrug-resistant – XDR) Acinetobacterbaumannii – нечувствительный к ³1 препарату в ³8 классах, перечисленных в табл. 2;
– панрезистентный (pandrug-resistant – PDR) Acinetobacterbaumannii – нечув-ствительный ко всем перечисленным в табл. 2 антимикробным препаратам.
При анализе антибиотикограммы не менее важное значение, чем интерпретация качественных характеристик резистентности, имеет оценка минимальной подавляющей концентрации (МПК). В ряде случаев, особенно если микроорганизм является промежуточно-резистентным (т.е. значение МПК превышает порог чувствительности, но не достигает порогового значения резистентности), исходя из фармакокинетических особенностей препарата, возможно достижение концентрации препарата, превышающей МПК в очаге инфекции, при назначении максимальной дозы и/или использовании пролонгированного режима введения. В частности, по данным рандомизированных контролируемых исследований постоянная концентрация препарата, достигаемая в сыворотке при непрерывном введении, в 5,8 раза превосходит минимальную концентрацию, которая достигается при интермиттирующем режиме [59]. А в исследовании D. Wang при сравнении использования меропенема в дозе 1 г каждые 8 часов внутривенно в течение одночасовой инфузии и в дозе 0,5 г каждые 6 часов в течении трехчасовой инфузии при лечении вентиляторассоциированной пневмонии, вызванной мультирезистентными штаммами A. baumannii, было установлено, что концентрация препарата в сыворотке крови превышала МПК в течение 54 и 75,3% времени между введениями соответственно; стоимость антибактериальной терапии достоверно была в 1,5 раза ниже во второй группе [60]. В табл. 3 приведены критерии интерпретации чувствительности по МПК и соответ-ствующие зоны задержки роста микроорганизмов на твердой питательной среде в соответствии с рекомендациями Европейской комиссии по определению чувствительности к антимикробным препаратам (The European Committee on Antimicrobial Susceptibility Testing – EUCAST) [61].
Таблица 3 Критерии интерпретации чувствительности Acinetobacter spp. к антимикробным препаратам по МПК и зонам задержки роста (EUCAST)
|
Антимикробныйпрепарат
|
МПК (мг/л)
|
Содержание АМП
в диске (мкг)
|
Зона задержки роста(мм)
|
|
S≤
|
R>
|
S≥
|
R<
|
|
Карбапенемы
|
|
Дорипенем
|
1
|
4
|
10
|
21
|
15
|
|
Имипенем
|
2
|
8
|
10
|
23
|
17
|
|
Меропенем
|
2
|
8
|
|
10
|
21
|
15
|
|
Фторхинолоны
|
|
Ципрофлоксацин
|
1
|
1
|
|
5
|
21
|
21
|
|
Левофлоксацин
|
1
|
2
|
|
5
|
21
|
21
|
|
Аминогликозиды
|
|
Амикацин
|
8
|
16
|
|
30
|
18
|
15
|
|
Гентамицин
|
4
|
4
|
|
10
|
15
|
15
|
|
Нетилмицин
|
4
|
4
|
|
10
|
15
|
15
|
|
Тобрамицин
|
4
|
4
|
|
10
|
15
|
15
|
|
Другие
|
|
Колистин*
|
2
|
2
|
|
|
–
|
–
|
|
Триметоприм-сульфаметоксазол
|
2
|
4
|
1,25–23,75
|
16
|
13
|
* Плохо диффундирует в твердые питательные среды. Исключительно определение МПК!
Лечение
Терапия нозокомиальных инфекций, вызванных Acinetobacter baumannii, проводится в соответствии с общими правилами ведения инфекций, ассоциированных с оказанием медицинской помощи (рис. 1). Эмпирическое назначение антиацинетобактерной терапии при подозрении на развитие нозокомиальной инфекции оправдано в тех организациях здравоохранения или их структурных подразделениях, где A. baumannii является одним из ведущих возбудителей данных инфекций, с учетом факторов риска.
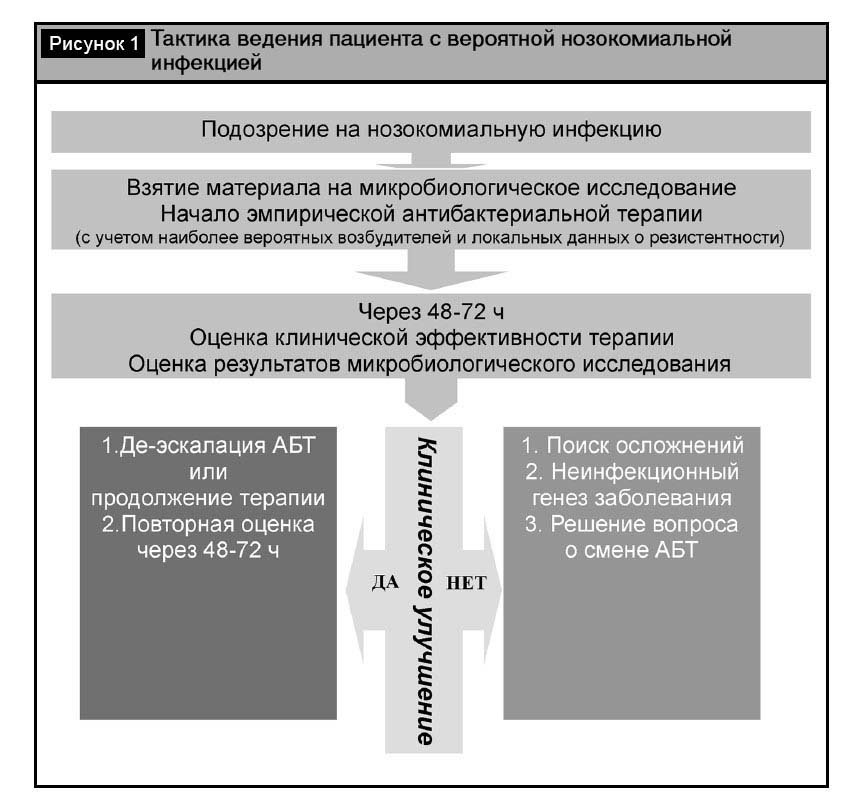
Оценка эффективности проводимой терапии должна проводиться через 48–72 ч после ее начала вне зависимости от того, назначена была терапия эмпирически или после выделения возбудителя. Она должна базироваться на динамике клинической картины и результатах микробиологических исследований (в том числе повторных), причем превалирующим фактором для оценки должна служить клиническая картина.
Несмотря на ряд исследований, указывающих на возможность уменьшения длительности антибиотикотерапии, не следует сокращать продолжительность антимикробной терапии при инфекциях, вызванных A. baumannii. Так в мультицентровом рандомизированном исследовании было выявлено, что сокращение сроков антибактериальной терапии ВАП, вызванной неферментирующими грамотрицательными микроорганизмами, с 15 до 8 дней связано с возрастанием частоты рецидивов [53].
При выборе терапии следует учитывать, что во всем мире наиболее активными антибактериальными препаратами в отношении A. baumannii являются сульбактам, карбапенемы, аминогликозиды, полимиксины, тайгециклин и миноциклин [3, 11, 21]. Однако выбор конкретного антимикробного препарата, который может быть использован для эмпирической терапии A. baumannii-ассоциированных инфекций, должен основываться на локальных данных отделения или организации здравоохранения, где развилась нозокомиальная инфекция.
В том случае, если антимикробная терапия назначается после выделения ацинетобактерий из патологического материала, выбор антибиотика должен базироваться на антибиотикограмме, с учетом интерпретационного анализа ее результатов (раздел «Диагностика и определение чувствительности к антимикробным препаратам»).
Сульбактам. Сульбактам в настоящее время является препаратом выбора для лечения ацинетобактерассоциированных инфекций [11, 28, 62]. В Республике Беларусь к данному антимикробному препарату чувствительны 84,8% госпитальных изолятов A. baumannii.
Сульбактам обладает внутренней антимикробной активностью против A. baumannii, которая не зависит от находящегося с ним в комбинации бета-лактамного препарата [31, 32, 62].
В экспериментальных исследованиях на животных эффективность сульбактама была сравнима с эффективностью карбапенемов в отношении карбапенемчувствительных ацинетобактерий. В клинических исследованиях комбинация сульбактам/бета-лактам показала аналогичную эффективность в сравнении с карбапенемами при ВАП и сепсисе, вызванными мультирезистентными изолятами A. baumannii. Исходы лечения сепсиса, обусловленного мультирезистентным штаммом A. baumannii, с использованием сульбактама не отличались от исходов, наблюдаемых при лечении другими антибактериальными препаратами сепсиса, вызванного нерезистентными A. baumannii [28].
При парентеральном введении концентрация сульбактама в сыворотке крови 20–60 мг/л, в тканях – 2–16 мг/л [62, 63]. Оптимальным режимом дозирования сульбактама является 2 г в виде 30-минутной инфузии через 6 ч или 1 г в виде 3-часовой инфузии через 6–8 ч. При использовании высоких доз сульбактама (3 г на одно введение) возможно развитие нежелательных лекарственных реакций в виде диареи, сыпи, поражения почек [64].
В результате ряда исследований установлено синергичное действие сульбактама с меропенемом, имипенемом, рифампицином, цефпиромом, амикацином [21, 28, 32, 65].
Карбапенемы. Для лечения тяжелых инфекций, вызываемых A. baumannii, могут использоваться имипенем, меропенем и дорипенем [21, 28, 37, 59, 66]. Эртапенем не обладает активностью против Acinetobacterspp. в целом [67, 68].
В связи с возрастанием числа карбапенемрезистентных штаммов A. bauma-nnii, в том числе и в Республике Беларусь, использование карбапенемных антибиотиков для лечения ацинетобактерассоциированных инфекций в режиме монотерапии в настоящее время является нецелесообразным. Исключение составляют больничные организации здравоохранения, где по данным локального мониторинга антибиотикорезистентности госпитальных патогенов абсолютное большинство последних сохраняет чув-ствительность к карбапенемам.
В исследованиях in vitro установлено синергичное или аддитивное действие комбинаций имипенем + амикацин + колистин, дорипенем + амикацин, дорипенем + колистин, меропенем + сульбактам, меропенем + колистин [69–71]; in vivo – имипенем + тобрамицин [28].
Применение комбинации карбапенем + бета-лактам/сульбактам для лечения инфекций кровотока, вызванных мультирезистентным A. baumannii, ассоциируется с лучшими результатами лечения, чем использование монотерапии карбапенемом или сочетания карбапенем + амикацин [31]. Однако сочетание имипенема с сульбактамом было ассоциировано с более низкой частотой выживаемости на модели пневмонии у мышей по сравнению с комбинацией имипенем + рифампицин [28].
При выборе препарата из данного класса для лечения ацинетобактерассоциированных инфекций необходимо учитывать, что в Республике Беларусь имипенем обладает несколько большей активностью в отношении нозокомиальных изолятов A. baumannii в сравнении с меропенемом (44,1 и 38,6% чувствительных штаммов, соответственно). Активность дорипенема превышает активность имипенема и меропенема только лишь в отношении изолятов A. baumannii, имеющих ген OXA-58, активность имипенема – в отношении OXA-23-продуцирующих штаммов A. baumannii [72, 73]. Однако в Республике Беларусь превалируют OXA-40-продуцирующие штаммы ацинетобактерий, что не позволяет говорить о преимуществах данного препарата перед другими представителями класса в лечении инфекций, вызываемых A. baumannii.
Аминогликозиды. Аминогликозиды часто используются в лечении инфекций, вызываемых грамотрицательными микроорганизмами, однако госпитальные изоляты A. baumannii имеют высокий уровень устойчивости к данному классу антибактериальных препаратов [28]. В Республике Беларусь к гентамицину резистентны 64,4%, к амикацину – 89% исследованных штаммов A. baumannii. Относительно низкий уровень резистентности к гентамицину вероятнее всего связан со снижением использования этого антимикробного препарата в организациях здравоохранения на протяжении ряда последних лет.
Назначение данного класса препаратов возможно только в комбинациях с более активными в отношении ацинетобактерий антибиотиками на основании локальных данных о чувствительности возбудителя.
Рифампицин. Учитывая наличие чув-ствительности у госпитальных штаммов ацинетобактерий к рифампицину, данный препарат может добавляться к терапии инфекций, вызванных мультирезистентными штаммами [65]. Ряд авторов показали эффективность рифампицина в режиме монотерапии, а также в комбинации с имипенемом или сульбактамом [65, 74, 75]. Синергизм характерен также для комбинации рифампицина с колистином [74]. Показана эффективность рифампицина и комбинации рифампицина с колистином при менингите, вызванном имипенемрезистентным изолятом A. baumannii [75].
По данным ряда исследований в процессе лечения развивается резистентность к рифампицину как при применении его в режиме монотерапии, так и в сочетании с имипенемом, однако при использовании комбинации рифампицин + колистин было показано отсутствие изменений в МПК рифампицина [74, 76].
Тетрациклины. Тетрациклины (миноциклин, доксициклин, тетрациклин) в исследованиях invitro обладают активностью против A. baumannii [28, 59, 71, 73]. Наибольшую активность проявляет миноциклин (не зарегистрирован в Республике Беларусь), который также активен в отношении изолятов, резистентных к другим тетрациклинам. В целом экспериментальные и клинические данные, характеризующие использование тетрациклинов при инфекциях, вызванных A. baumannii, крайне малочисленны [28]. Поэтому назначение препаратов данного класса обоснованно только на основании данных антибиотикограммы при отсутствии другой альтернативы.
Полимиксины. Из пяти известных препаратов данного класса (полимиксины А-Е) для клинического использования в настоящее время доступны только полимиксин В и полимиксин Е (колистин). Колистин используется в двух формах: колистин сульфат (для деконтаминации кишечника и для местного применения при инфекциях мягких тканей; редко для внутривенного введения) и колистиметат натрия (для парентерального и ингаляционного введения). Колистиметат натрия (неактивный предшественник колистина) обладает меньшей токсичностью и антибактериальной активностью по сравнению с колистина сульфатом [21, 28].
Полимиксины обладают высокой активностью против штаммов A. baumannii, включая мультирезистентные и карбапенемрезистентные изоляты [18, 28, 31, 74]. По данным различных исследований уровень клинической эффективности колистина составляет 20–83%, микробиологической 50–92% [21, 65, 77–79]. По данным фармакокинетических исследований концентрация колистина в плазме крови после внутривенного введения находится в пределах 1–6 мг/л [80, 81], в ликворе – 25% от сывороточной концентрации [77].
Вследствие плохого проникновения через гистогематические барьеры у пациентов с инфекциями нижних дыхательных путей полимиксины более предпочтительно назначать ингаляционно, а при лечении инфекций центральной нервной системы – интравентрикулярно или интратекально, в сочетании с их парентеральным введением или системным использованием других антимикробных препаратов [28, 30, 45, 77].
Частота развития нефротоксичности при применении полимиксинов, по данным современных исследований, сравнима с другими классами антибактериальных препаратов и составляет 0–37% [11, 21, 23, 28, 76, 77, 79]. Риск развития нефротоксичности при применении полимиксинов является дозозависим [78]. При этом наибольшая частота развития побочных эффектов со стороны почек наблюдалась у пациентов с предшествующим нарушением их функции, однако развивающаяся почечная недостаточность обычно являлась обратимой [11, 28, 65].
По данным исследований in vitro отмечается синергизм колистина с рифампицином, имипенемом, миноциклином и цефтазидимом; полимиксина В с имипенемом, меропенемом и рифампицином [21, 28, 65, 69, 78, 82–84].
В настоящее время парентеральные формы полимиксинов не зарегистрированы для применения в Республике Беларусь.
Тайгециклин. Тайгециклин оказывает бактериостатическое или бактерицидное действие на A. baumannii, не подвержен механизмам резистентности, характерным для тетрациклинов [28, 63, 85].
По результатам ряда исследований тайгециклин может сохранять активность в отношении миноциклинрезистентных, имипенемрезистентных, колистинрезистентных, мультирезистентных штаммов A. baumannii [21, 28, 59, 63, 65, 74].
Тайгециклин имеет большой объем распределения и создает высокие концентрации в тканях организма, включая легочную, однако, по мнению ряда авторов, концентрация препарата в крови и спинномозговой жидкости при рекомендуемом режиме введения является субоптимальной и не обеспечивает достаточной антибактериальной активности [21, 28, 59, 85]. Вследствие низких концентраций препарата в моче, не рекомендуется использовать тайгециклин при ИМП [85].
По мнению экспертов Food and Drug Administration (США), доказана эффективность тайгециклина для лечения тяжелых интраабдоминальных инфекций, вызванных MSSA и VSE, тяжелых инфекций кожи и мягких тканей, вызванных MSSA и MRSA, внебольничной пневмонии [21, 29, 59, 63]. В то же время, использование тайгециклина для лечения нозокомиальной пневмонии (особенно ВАП) сопряжено с повышенным риском летального исхода у тяжелых пациентов[86]. В Республике Беларусь препарат в настоящее время не зарегистрирован.
Таблица 4. Дозы антибактериальных препаратов и кратность их введения
при лечении A. baumannii-ассоциированных инфекций [87]
|
Препарат
|
Доза и кратность введения
|
|
Ампициллин/сульбактам
|
в/в 12 г/сут в 3–4 введения
|
|
Цефоперазон/сульбактам
|
в/в 8,0 г/сут в 2 введения
|
|
Имипенем
|
в/в капельно в течение 30 мин в 100 мл 0,9% раствора хлорида натрия по 1,0 г каждые 6–8 часов
|
|
Меропенем
|
в/в капельно в течение 15–30 мин в 100 мл 0,9% раствора хлорида натрия по 2,0 г каждые 8 часов
|
|
Дорипенем
|
в/в 1,5 г/сут в 3 введения
|
|
Нетилмицин
|
в/в 4–6,5 мг/кг/сут в 1–2 введения
|
|
Амикацин
|
в/в 15–20 мг/кг/сут в 1–2 введения
|
|
Тобрамицин
|
в/в 3–5 мг/кг/сут в 1–2 введения
|
|
Рифампицин
|
в/в 0,5 г/сут в 2–4 приема
|
|
Тайгециклин*
|
в/в в нагрузочной дозе 0,1 г, с последующим введением 50 мг каждые 12 часов
|
|
Колистин (колистиметат натрия*)
|
в/в 2,5–5 мг/кг/сут в 2–4 введения; ингаляци-онно 1–3 млн ЕД каждые 12 часов
|
* Препарат не зарегистрирован на территории Республике Беларусь.
Перспективы терапии инфекций, вызываемых A. baumannii. В исследованиях in vitro описана эффективность нового цефалоспорина – цефтобипрола ? против Acinetobacterspp., однако данные клинических исследований отсутствуют [59, 88]. Активность цефтобипрола превосходит активность цефтазидима и цефепима при отсутствии или низкой экспрессии генов, ответственных за синтез ADC-бета-лактамаз [88]. Британские авторы в исследовании invitro показали активность нового монобактама BAL30072 в отношении 73% CRAB при концентрации 1 мг/л и 89% при 8 мг/л [89].
В исследовании invivoс моделированием ожоговых поражений на мышах показана эффективность фотодинамиче-ской терапии для лечения локализованных инфекций, вызванных мультирезистентными A. baumannii [90].
Среди принципиально новых разрабатываемых препаратов потенциальной активностью против A. baumannii обладают ингибиторы эффлюксного насоса, ингибиторы ферментов биосинтеза бактериальных жирных кислот (FabI- и FabK-ингибиторы), ингибиторы пептидной деформилазы металлоэнзимов, антимикробные пептиды (буфорин II, A3-APO), ингибиторы бета-лактамаз класса D на основе бороновой кислоты [65, 91–95]. В исследовании invitro продемонстрирована способность экспериментального препарата NAB741, содержащего циклический полипептидный фрагмент идентичный аналогичному участку полимиксина В, повышать чувствительность Acinetobacterbaumannii к препаратам, для которых неповрежденная наружная мембрана является эффективным барьером [96]. В другом invitro исследовании была показана эффективность ванкомицина в отношении A. baumannii при использовании технологии фузогенных липосом для его доставки в периплазматическое пространство [97]. Описана способность веществ, разрушающих биопленку (в частности, на основе 2-аминоимидазола), восстанавливать чувствительность мультирезистентных изолятов ацинетобактерий к антибиотикам [98]. Обсуждается возможность разработки так называемых «антигенов», направленных на ингибирование генов, отвечающих за формирование механизмов резистентности; активной и пассивной иммунизации [99–101]. В ряде работ показана активность вытяжек и экстрактов из растений, секретов животных в отношении мультирезистентных ацинетобактерий [91, 102, 103]. В частности, масло Helichrysumitalicum, дубильная и эллаговая кислоты значительно снижает уровень резистентности A. baumannii к антибактериальным препаратам за счет ингибирования эффлюкса [91, 103].
В ряде исследований были показаны лизис ацинетобактерий invitro, а также эффективность применения бактериофагов в лечении экспериментальных инфекций, вызванных Acinetobacter spp., у животных [65, 104].
Профилактика
Учитывая высокую резистентность Acinetobacter baumannii к антимикробным препаратам, а также способность этого микроорганизма быстро вырабатывать механизмы устойчивости, большое значение приобретает профилактика A. baumannii-ассоциированных инфекций в организации здравоохранения, в основе которой лежат принципы и нормы инфекционного контроля.
A. baumannii способны колонизировать обычно стерильные объекты, выживать как в сухих, так и во влажных условиях госпитальной среды [21, 28]. Колонизации обычно подвергаются предметы, окружающие больного (перья в подушках, матрацы, постельное белье, занавески, кровати, прикроватные столики и тумбочки, кислородные и водопроводные краны, вода, использующаяся в аппаратах ИВЛ или для назогастрального введения), а также использующиеся для ухода за ним, контроля его состояния, осуществления лечебных манипуляций. Среди предметов, использующихся для ухода и осуществления лечебных манипуляций A. baumannii выделяется из аппаратов искусственной вентиляции легких и механических отсосов, также могут колонизироваться объекты, связанные с внутрисосудистым доступом (инфузоматы, измерители давления, системы для длительной гемофильтрации, сосудистые катетеры). Среди остального оборудования колонизации могут подвергаться каталки для транспортировки больных, медицинские перчатки, халаты, манжетки тонометров, пикфлоуометры, пульсоксиметры, клинки ларингоскопов, система вентиляции и кондиционирования воздуха [21, 28, 95, 105–109]. Благодаря способности существовать во влажной среде A. baumannii контаминируют самые разнообразные растворы, в том числе и некоторые дезинфектанты (фурацилин, риванол) [28]. Предметы госпитальной среды часто контактирующие с руками персонала (дверные ручки, клавиатуры компьютеров, истории болезни, столы на медицинских постах, раковины и даже уборочный инвентарь), покрытие пола также служат дополнительным резервуаром A. baumannii [28, 105, 106, 109, 110].
Во время внутрибольничных вспышек инфекций, вызванных A. baumannii, медицинские манипуляции также могут быть связаны с распространением возбудителя в основном за счет контаминации используемых материалов. Такими манипуляциями могут быть гидротерапия или пульс-лаваж ран, хирургические вмешательства, катетеризация, трахеостомия, спинальная пункция [21, 28, 46].
Для адекватного осуществления инфекционного контроля нозокомиальных A. baumannii-ассоциированных инфекций необходимо постоянно поддерживать меры, направленные на предотвращение передачи возбудителя от пациента к пациенту (рис. 2), так как основным резервуаром A. baumannii в стационаре являются колонизированные/инфицированные пациенты [15, 105].
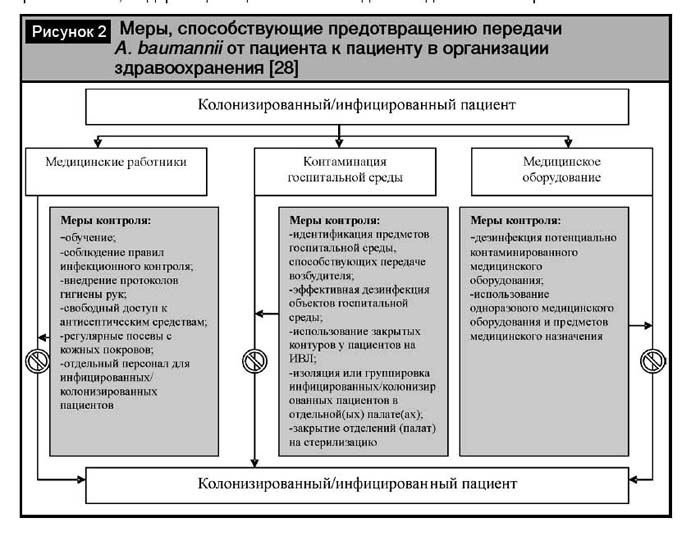
За исключением вышеуказанных мероприятий, немаловажное значение имеет введение жестких показаний для назначения антимикробных препаратов не входящих в первую линию антимикробной терапии (например, карбапенемов, цефалоспоринов и фторхинолонов IV поколения и др.), что снижает частоту неадекватного назначения антибиотиков в больничной организации здравоохранения в целом и, как следствие, уровни резистентности госпитальных изолятов в том числе и A. baumannii.
В целом, следует сказать, что Acinetobacter baumannii, является в настоящее время «проблемным» возбудителем нозокомиальных инфекций, поражающим преимущественно пациентов находящихся в тяжелом клиническом состоянии, хорошо адаптированный к обитанию в госпитальной среде и обладающим высокой резистентностью к большинству антисептических и антимикробных препаратов. При назначении антибактериальной терапии, направленной на A. baumannii, следует обязательно учитывать локальные данные о его чувствительности в конкретной организации здравоохранения, а более предпочтительно в каждом конкретном отделении.
Медицинские новости. – 2011. – №5. – С. 31-39.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.