Romanov G.N., Rudenko E.V.
Republican Scientific Practical Center of Radiation Medicine and Human Ecology, Gomel, Belarus, Belarusian Medical Academy of Post-Graduate Education, Minsk
Modern problems of age-associated diseases: osteoarthritis and osteoporosis
Резюме. Остеоартроз (ОА) и остеопороз (ОП) относятся к наиболее распространенным возраст-ассоциированным заболеваниям в популяции. С увеличением возраста доля лиц, у которых возможно сочетание указанных заболеваний, увеличивается, что требует изучения особенностей оказания лечебно-диагностической помощи данной категории пациентов. Изучение частоты встречаемости ОА у пациентов с низкотравматическими переломами шейки бедренной кости (ШБК) проведено в РНПЦ радиационной медицины и экологии человека. Согласно полученным данным, у 43,6% женщин и 35,3% мужчин с переломами ШБК отмечено наличие в анамнезе ОА. При анализе частоты падений выявлено двукратное увеличение вероятности падений у пациентов с ОА в сравнении с группой пациентов, у которых отсутствуют заболевания суставов. Пациенты с ОА, несмотря на повышенные значения минеральной плотности костной ткани, имеют риск развития низкотравматических переломов, превышающий общепопуляционный. Одним из ключевых моментов в увеличении риска развития переломов при ОА является наличие дефицита витамина Д. Основная роль в медикаментозной коррекции (снижении) риска падений принадлежит комбинированным препаратам витамина Д в сочетании с препаратами кальция.
Ключевые слова: остеопороз, остеоартроз, витамин Д, препараты кальция.
Summary. Osteoarthritis (OA) and osteoporosis (OP) are the most common age-associated diseases in the population. With increasing age the proportion of people who have a combination of these diseases is increasing, which requires the study of management in this category of patients. The study of the incidence of OA in patients with low-energy fractures of femoral neck carried out in the Republican research centre of radiation medicine and human ecology. According to our data 43.6% of women and 35.3% of men with femoral neck fractures pointed to a previous history of OA. When analysing the incidence of falls revealed a two-fold increase in the probability of falls in patients with OA compared with patients who have no problem of the joints. Patients with OA, in spite of the increased values of bone mineral density, have the higher risk of low-energy fractures than in the general population. One of the key factors in increasing the risk of fractures in OA is a deficiency of vitamin D. The primary role of pharmacology correction to reduce the risk of falls belongs to a combination of vitamin D with calcium supplementation.
Key words: osteoporosis, osteoarthritis, vitamin D, calcium.
Взаимосвязь между остеоартрозом (ОА) и остеопорозом (ОП) является предметом пристального изучения специалистов многих медицинских направлений. Длительное время существовало стойкое убеждение об отсутствии всякой связи между ОА и ОП как о взаимоисключающих нозологических единицах [1, 2]. Однако в последние несколько лет был опубликован ряд статей о наличии точек соприкосновения не только в этиологии и патогенезе, но и в лечении этих двух заболеваний [3, 4].
Согласно статистическим данным, ОА и ОП относятся к наиболее распространенным возраст-ассоциированным заболеваниям со значительным преобладанием лиц женского пола. ОА встречается у каждого третьего пожилого человека, достигая 70% среди лиц старше 65 лет [5]. ОП ввиду отсутствия выраженных клинических проявлений регистрируется гораздо реже, но его распространенность прогрессивно увеличивается от 20% у женщин в возрасте 55 лет до 50% в популяции старше восьмидесяти лет [6, 7]. Из приведенных данных следует, что с возрастом увеличивается доля пациентов, у которых возможно сочетание указанных заболеваний, другими словами, у пациента с остеопорозом может диагностироваться остеоартроз и наоборот.
К ведущим этиологическим факторам в развитии постменопаузального ОП относятся дефицит эстрогенов, а также генетическая предрасположенность к ОП, ассоциированная с полиморфизмом гена ESR2 [8]. Вместе с тем, согласно проведенным эпидемиологическим исследованиям, рост заболеваемости ОА также тесно связан с наступлением менопаузы у женщин и, соответственно, с дефицитом эстрогенов [9]. Выявленная схожесть в развитии ОА и ОП положила начало изучению общих этиологических и патогенетических звеньев этих двух широко распространенных заболеваний.
Оценка минеральной плотности костной ткани у пациентов с ОА
Основным методом диагностики ОП в настоящее время является рентгеновская осевая двухэнергетическая денситометрия (ДРА). Метод позволяет с высокой точностью количественно измерить минеральную плотность костной ткани (МПК). Стандартные зоны исследования: поясничный отдел позвоночника и проксимальные отделы бедер. Выбор этих участков скелета обусловлен возможностью дифференцированно прогнозировать риск наиболее значимых переломов позвоночника и/или шейки бедренной кости (ШБК). У пациентов с ОА часто рентгенологически регистрируются остеофиты, особенно при ОА коленных и тазобедренных суставов. Наличие остеофитов связано с прямым или косвенным увеличением МПК не только в зоне выявления остеофитов, но и в поясничном отделе позвоночника [10]. Однако увеличение костной плотности не только не приводит к снижению количества переломов у пациентов с ОА, но даже может быть связано с некоторым увеличением риска переломов [11]. Данные денситометрических исследований широко применяются для прогнозирования риска переломов. Для оценки 10-летнего риска переломов с использованием системы FRAX® необходимо учитывать данные Т-критерия ШБК. У пациентов с ОА этот показатель заведомо выше, чем у пациентов без ОА. Это может привести к существенной недооценке риска развития низкотравматического перелома и неправильному выбору тактики мониторинга и лечения [12].
Субхондральная костная ткань при ОА
Субхондральная кость (СК) находится в области эпифиза под суставным хрящом и включает в себя пластину СК, трабекулярную и субартикулярную части. Пластина СК в свою очередь состоит из кальцинированного хряща и тонкого кортикального слоя, отделенного от гиалинового хряща демаркационной линией, которую невозможно определить in vivo современными методами визаулизации. При нормальном функционировании сустава СК обеспечивает важные амортизирующие функции и ослабляет около 30% нагрузки на сустав. Кроме этого, СК является проводником питательных веществ для хряща и способствует удалению продуктов метаболизма. В процессе развития ОА субхондральная кость подвергается структурным изменениям, включая увеличение скорости метаболизма костной ткани, нарушение архитектоники с микропереломами, а также неоваскуляризацию и костный склероз на более поздних стадиях ОА. В результате СК утолщается, изменятся ее структура и вследствие этого нарушается метаболизм одной из важнейших функциональных субъединиц сустава. Таким образом, изменения в СК – решающий фактор в патогенезе ОА.
Независимо от локального взаимодействия между СК и суставными хрящами системный ОП может участвовать в прогрессировании ОА посредством увеличения ремоделирования субхондральной кости, что изменяет ее свойства и может способствовать раннему проявлению признаков ОА. Таким образом, у пациентов со сниженной МПК или с установленным диагнозом ОП может быть повышен риск нарушения целостности хряща. В соответствии с полученными данными, следует ожидать положительный эффект у пациентов с ОА при назначении препаратов, предназначенных для лечения остеопороза [13].
Риск переломов у пациентов с ОА
Итак, основным методом диагностики ОП является ДРА с определением Т-критерия согласно рекомендациям ВОЗ. Низкие значения Т-критерия служат достоверным и наиболее существенным фактором риска развития остеопоротического перелома. Интуитивно следует предположить, что нормальные или повышенные значения Т-критерия будут способствовать снижению риска переломов, в частности у пациентов с ОА. Однако, согласно исследованиям G.Jones et al., несмотря на статистически значимо более высокие показатели МПК позвоночника и ШБК, у пациентов с ОА обоих полов не выявлено достоверного снижения риска переломов в сравнении с группой пациентов без ОА [14].
Результаты наиболее масштабного исследования по выявлению риска переломов у женщин с ОА были опубликованы в 2011 г. в рамках исследования Women’s Health Initiative [15]. В исследование было включено более 146000 женщин в менопаузе, разделенных на две группы по наличию ОА в анамнезе. Установлено, что риск переломов костей скелета в группе пациенток с ОА превышает таковой у женщин без ОА и составляет 1,09 (95% ДИ 1,05–1,13; p<0,001). При изолированной оценке подгруппы с переломами ШБК отмечено увеличение риска в сравнении с контрольной группой, однако не был достигнут необходимый уровень статистической значимости (рис. 1).
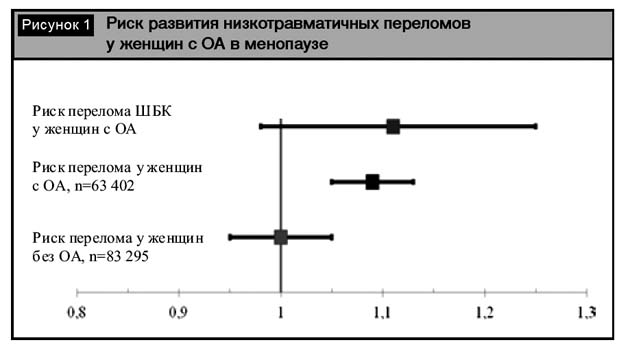
Важную роль в этологии и прогрессировании ОА играет избыточный вес. Частота встречаемости избыточного веса и ожирения у пациентов с ОА достигает 90–100%. Существует прямая зависимость между индексом массы тела (ИМТ) и МПК: с увеличением ИМТ изменяются геометрические параметры костей скелета с перераспределением нагрузки. При проведении сравнительного анализа частоты переломов конечностей у пациентов с нормальным ИМТ и ожирением 3-й степени не выявлено статистически значимого увеличения частоты переломов в группе пациентов с ожирением в сравнении с контрольной группой, за исключением переломов ШБК (рис. 2).
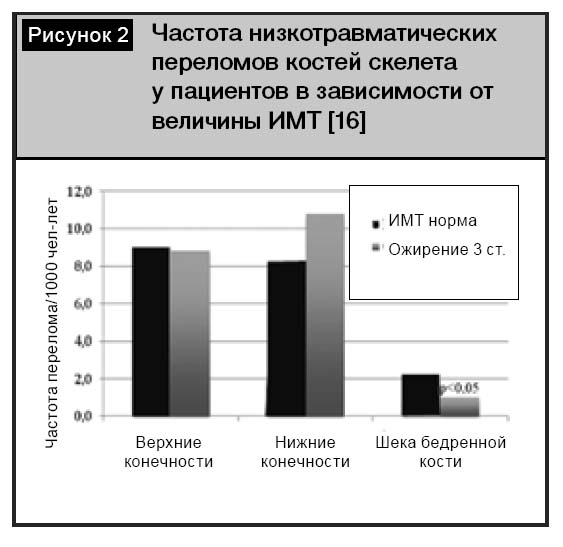
В другом международном крупномасштабном исследовании, которое включало более 60000 женщин из 10 европейских стран, доказано увеличение риска переломов верхних конечностей и лодыжки у пациенток с ожирением в сравнении с женщинами с нормальным ИМТ. Одним из важных выводов данного исследования было установление причинной связи между риском падения и увеличением частоты переломов конечностей у пациенток с ожирением [16].
Дефицит витамина Д и остеоартроз
Классические эффекты витамина Д в организме изучены достаточно хорошо и в основном связаны с поддержанием кальций-фосфорного гомеостаза через действие паратироидного гормона. Кроме перечисленных эффектов существуют другие, не менее важные, функции витамина Д в организме человека. Витамин Д участвует в дифференцировке остеобластов и остеокластов, способствует увеличению мышечной силы и увеличению подвижности суставов. Указанные свойства исключительно важны для поддержания мышечного баланса и, соответственно, предотвращают падения. В рамках Роттердамского исследования была изучена взаимосвязь между дефицитом витамина Д и особенностями течения ОА. На большой когорте пациентов (n=1248) показано, что в подгруппе с лабораторно подтвержденным дефицитом витамина Д в 1,5 раза чаще регистрировались падения и в 1,8 раза чаще отмечалось рентгенологическое сужение суставной щели [17].
Проведено большое количество рандомизированных плацебо-контролируемых исследований (РКИ) по изучению влияния приема витамина Д на склонность к падениям. Всего в этих исследованиях приняло участие более 45000 пациентов, большинство из которых составили лица женского пола. В результате мета-анализа установлено, что статистически значимого снижения риска падений можно достичь только с помощью приема комбинированных препаратов кальция и витамина Д. Наибольшее количество элементарного кальция в процентном соотношении содержится в карбонатной соли, – в этом ее преимущество перед другими лекарственными формами. Сравнительный анализ влияния витамина Д на склонность к падениям показал, что суммарная суточная дозировка 800 IU является достаточной для снижения риска падений. Применение витамина Д в более высокой дозировке не приводит к дополнительному снижению риска падений (таблица).
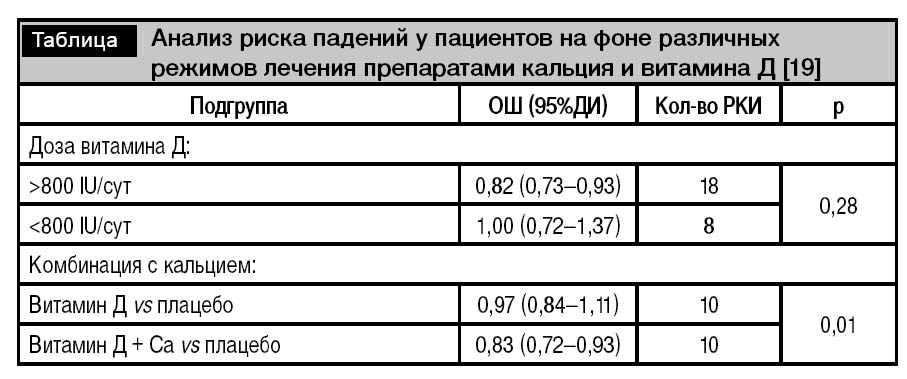
Таким образом, прием препаратов витамина Д в суточной дозировке 800 IU в виде комбинированного препарата с карбонатом кальция снижает риск падений у пациентов, тем самым снижая риск развития низкотравматических переломов.
Низкотравматические переломы ШБК и остеоартроз (результаты собственных исследований)
Частота встречаемости ОА у пациентов с низкотравматическими переломами ШБК изучалась согласно дизайну исследования, разработанному в ГУ «РНПЦ радиационной медицины и экологии человека». Проведено анкетирование пациентов, перенесших с 2007 по 2010 г. перелом ШБК в возрасте старше 50 лет, который был документально верифицирован в медицинском учреждении. Критерии исключения из исследования: наличие тяжелых травм, связанных с ДТП, падение с высоты и др.
Анкета включала вопросы о наличии в анамнезе ОА, склонности к падениям (более одного раза в месяц), перенесенные переломы другой локализации и прием препаратов для лечения ОП до и после перелома. Всего было разослано 300 анкет, получено обратно 158 (52,7%). В дальнейший анализ было включено 135 заполненных анкет, из которых 101 (74,8%) принадлежала пациентам женского пола, 34 (25,2%) – мужского. Средний возраст на момент перелома: 72,9 года – для женщин, 70,3 – для мужчин, (р=0,488).
На вопрос о наличии в анамнезе ОА положительно ответили 43,6% женщин и 35,3% мужчин с переломами ШБК. Из них 20% пациентов имели ОА преимущественно тазобедренных суставов, 35% – ОА коленных суставов, 40% – сочетанное поражение тазобедренных и коленных суставов. На долю других локализаций ОА пришлось только 5%. Статистически значимых различий по частоте встречаемости ОА у мужчин и женщин не было (хи2=0,72; p=0,399). Частота встречаемости ОА у пациентов с изолированным переломом ШБК составила 36,6%. В группе пациентов с дополнительным указанием в анамнезе перелома предплечья частота встречаемости ОА увеличилась до 58,3%.
Одной из причин высокой частоты переломов верхних конечностей у пациентов с ОА может являться увеличение склонности к падениям. В связи с этим пациенты были разделены на две подгруппы согласно наличию ОА в анамнезе. Склонность к падениям (одно и более в месяц) отмечена у 33,9% пациентов с ОА и у 17,7% пациентов без ОА; ОШ (95% ДИ) – 2,35 (1,07–5,40), р=0,049. Полученные результаты свидетельствуют о более чем двукратном увеличении вероятности падений у пациентов с ОА в сравнении с группой пациентов, у которых отсутствуют заболевания суставов.
В процессе исследовательской работы проводился анализ лечебных консервативных мероприятий до наступления перелома ШБК и после травмы в амбулаторных условиях. Из перечня специ-фических средств лечения остеопороза пациенты применяли комбинированные препараты кальция и витамина Д. Оценить их эффективность не представлялось возможным ввиду небольшого количества пациентов, принимавших препараты. Только 2,2% пациентов (с их слов) до наступления перелома принимали препараты кальция и витамина Д. После выписки из стационара количество пациентов, получающих данный вид терапии, увеличилось лишь до 18,5%, что является крайне низким показателем для оценки положительных эффектов лекарственного препарата.
Особенность современной ситуации в здравоохранении такова, что с ростом доли пожилых людей в популяции и увеличением продолжительности жизни растет распространенность возраст-ассоциированной патологии. Остеоартроз и остеопороз являются наиболее значимыми заболеваниями опорно-двигательного аппарата ввиду их трудности патогенетической терапии и эффективного предотвращения осложнений в виде переломов и ограничения мобильности. Ситуация осложняется тем обстоятельством, что ОА и ОП могут сосуществовать и каждое из заболеваний ухудшает прогноз для конкретного пациента. Наличие ОА у пациента с ОП может маскировать истинное состояние МПК и препятствовать правильной диагностике и, что самое важное, недооценке риска возможного перелома. Состояние костного метаболизма субхондральной кости при ранних стадиях ОА очень напоминает процессы, протекающие у пациентов с ОП. Уже существуют экспериментальные работы и клинические исследования по эффективности применения антиостеопоротических препаратов в лечении ранних стадий ОА [19–20]. Однако эти лечебные технологии еще не доступны практическому здравоохранению. Наиболее перспективна в настоящее время коррекция дефицита витамина Д у пациентов с ОА. Общая схема патогенеза развития переломов при ОА в большей мере связана именно с недостаточным содержанием витамина Д в организме пациента (рис. 3).
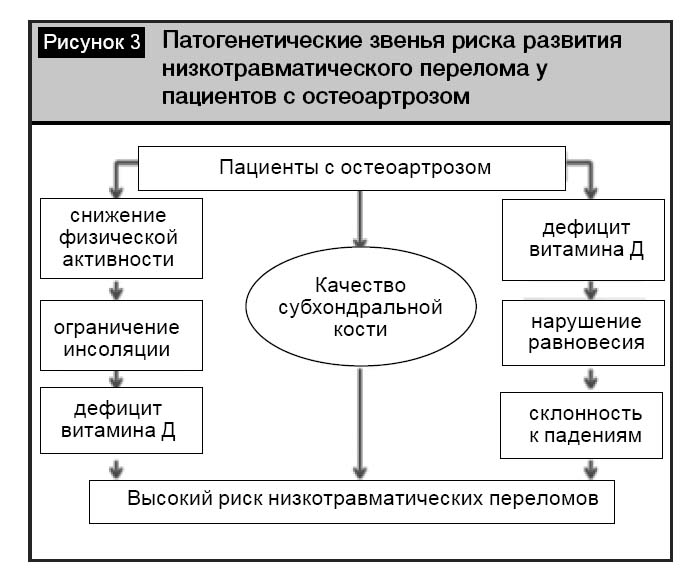
Таким образом, пациенты с остеоартрозом, несмотря на повышенные значения МПК, имеют риск развития низкотравматических переломов, превышающий общепопуляционный. Одним из ключевых моментов в увеличении риска развития переломов при остеоартрозе является наличие дефицита витамина Д. Основная роль медикаментозной коррекции с целью снижения риска падений принадлежит комбинированным препаратам витамина Д в сочетании с препаратами кальция.
Л И Т Е Р А Т У Р А
1. Sambrook, P. What is the relationship between osteoarthritis and osteoporosis? / P.Sambrook, V.Naganathan // Baillieres Clin. Rheumatol. – 1997. – Vol. 11. – P. 695–710.
2. Dequeker, J. Osteoarthritis and osteoporosis: clinical and research evidence of inverse relationship / J.Dequeker, J.Aerssens, F.P.Luyten // Aging Cli Ex Res. – 2003. – Vol. 15. – P. 426–439.
3. Hochberg, M.C. Bone mineral density and osteoarthritis: data from the Baltimore Longitudinal Study of Aging / M.C.Hochberg, M.Lethbridge-Cejku, J.D.Tobin // Osteoarthritis Cartilage. – 2004. – Vol. 12A. – S. 45–48.
4. Iwamoto, J. Effects of Risedronate on Osteoarthritis of the Knee / J.Iwamoto // Yonsei Med. J. – 2010. – Vol. 51, N 2. – P. 164–170.
5. Arden, N. Osteoarthritis: Epidemiology / N.Arden, M.C.Nevitt // Best Pract. Research Clin. Rheumatol. – 2006. – Vol. 20, № 1. – P. 3–25.
6. Руденко, Э.В. Аудит состояния проблемы остеопороза в странах Восточной Европы и Центральной Азии. – IOF, 2011.
7. Diagnosis of osteoporosis and fracture threshold in men / J.A.Kanis [et al.] // Calcif Tissue Int. – 2001. – Vol. 69. – P. 218–221.
8. The ESR2 AluI gene polymorphism is associated with bone mineral density in postmenopausal women / M.Curro [et al.] // J. Steroid Biochem. Mol. Biol. – 2011. – Vol. 127. – P. 413–417.
9. Christgau, S. Sex hormones in the regulation of bone and cartilage metabolism: an old paradigm and a new challenge / S.Christgau, P.A.Cloos // Minerva Ginecol. – 2005. – Vol. 57, N6. – P. 611–617.
10. Radiographic osteoarthritis of the hip and bone mineral density. The Study of Osteoporotic Fractures Research Group / M.C.Nevitt [et al.] // Arthritis Rheum. – 1995. – Vol. 38. – P. 907–916.
11. Osteoarthritis of the knee is associated with vertebral and nonvertebral fractures in the elderly: the Rotterdam Study / A.P.Bergink [et al.] // Arthritis Rheum. – 2003. – Vol. 49. – P. 648–657.
12. Underestimated Fracture Probability in Patients With Unilateral Hip Osteoarthritis as Calculated by FRAX / N. Setty [et al.] // J. Clin. Densitom. – 2011. – Vol. 14, N 4. – P. 447–452.
13. Subchondral bone as a key target for osteoarthritis treatment / S.Castaneda [et al.] // Biochem. Pharmacol. – 2012. – Vol. 83. – P. 315–323.
14. Osteoarthritis, bone density, postural stability, and osteoporotic fractures: a population based study / G. Jones [et al.] // J. Rheumatol. – 1995. – Vol. 22, N 5. – P. 921–925.
15. Arthritis increases the risk for fractures – results from the Women’s Health Initiative / N.C.Wright [et al.] // J. Rheumatol. – 2011. – Vol. 38, N 8. – P. 1680–1688.
16. Obesity Is Not Protective against Fracture in Postmenopausal Women: GLOW / J.E.Compston [et al.] // Am. J. Med. – 2011. – Vol. 124, N 11. – P. 1043–1050.
17. Vitamin D Status, Bone Mineral Density, and the Development of Radiographic Osteoarthritis of the Knee: The Rotterdam Study / A.Bergink [et al.] // J. Clin. Rheumatol. – 2009. – Vol. 15. – P. 230–237.
18. The effect of vitamin D on falls: a systematic review and meta-analysis / M.H.Murad [et al.] // J. Clin. Endocrinol. Metab. – 2011. – Vol. 96. – P. 2997–3006.
19. Relationships between biochemical markers of bone and cartilage degradation with radiological progression in patients with knee osteoarthritis receiving risedronate: the Knee Osteoarthritis Structural Arthritis randomized clinical trial / P.Garnero [et al.] // Osteoarthritis Cartilage. – 2008. – Vol. 16. – P. 660–666.
20. Strontium ranelate effect in postmenopausal women with different clinical levels of osteoarthritis / P.Alexandersen [et al.] // Climacteric. – 2011. – Vol. 14, N 2. – P. 236–243.
Медицинские новости. – 2012. – №8. – С. 26-29.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.