Mazurenka A.N.
Republic Scientific-Practical Center of Traumatology and Orthopedics, Minsk, Belarus
Posterior lumbar interbody fusion utilizing titanium implants
Резюме. Заболевания поясничного отдела позвоночника, в первую очередь деформации и дегенеративные поражения, представляют собой важную медицинскую проблему. Спондилодез – один из методов хирургического лечения данной патологии. Задний межтеловой спондилодез в сочетании с транспедикулярной фиксацией является альтернативным методом переднему и чаще всего используемому заднему спондилодезу. Быстро растет популярность применения межтеловых имплантатов. Статья посвящена методам заднего межтелового спондилодеза поясничного отдела позвоночника и техническим аспектам использования титановых кейджей. В работе также рассматриваются различные группы имплантатов и особенности их применения. Данные последних исследований указывают на преимущества межтелового спондилодеза перед задним, поэтому рассматриваемая методика имеет хорошие перспективы в хирургии позвоночника.
Ключевые слова: задний межтеловой спондилодез, кейджи, титановые имплантаты, хирургия поясничного отдела позвоночника.
Summary. Lumbar spine disorders attributed to deformities and degenerative disc pose a serious problem. Spinal fusion is one from the surgical options. The posterior lumbar interbody fusion as an alternative to the anterior and traditional posterior fusion combined with pedicle screw instrumentation. Interbody implants, used to assist interbody fusion, are rapidly gaining popularity in obtaining lumbar fusion. This is a review article on methods to obtain posterior interbody fusion of the lumbar spine, to describe aspects related to the techniques utilizing titanium cages. Article also provides a classification of main interbody cages and assesses indications to correct implantation. There is recent evidence suggesting better outcomes after interbody fusion than after posterolateral fusion and procedure offers advantages for spinal surgery.
Keywords: posterior lumbar interbody fusion, cages, titanium implants, lumbar spine surgery.
Ортопедическая патология позвоночника находится среди наиболее часто встречающихся хронических заболеваний, ограничивающих трудоспособность. Деформации и заболевания позвоночника, в том числе дегенеративно-дистрофические поражения, приводят к нарушению его стабильности и требуют, как правило, хирургического лечения. Современные исследования продемонстрировали, что положительные клинические результаты находятся в прямой зависимости от успешного выполнения спондилодеза позвоночника, который может осуществляться различными способами. В последнее время появляется всё больше сообщений об эффективности межтелового спондилодеза в сочетании с транспедикулярной фиксацией.
Показаниями к межтеловому спондилодезу служат спондилолистез, рецидивы грыжи диска (более двух); остеохондроз поясничного отдела позвоночника с дискогенным болевым синдромом; постдискэктомический синдром с «коллапсом» диска, вторичным стенозом корешковых каналов; ложный сустав после заднего спондилодеза, постламинэктомический кифоз; деформации позвоночника. Не рекомендуется выполнять межтеловой спондилодез в случае поясничного остеохондроза, сопровождающегося радикулопатией без болей в позвоночнике и нестабильности, при поражении более трех сегментов, выраженном остеопорозе, когда имеется риск проседания трансплантатов или имплантатов в тело позвонка.
При межтеловом спондилодезе наблюдается более высокая частота костных сращений, чем при заднем. В ряде публикаций даются результаты до 96% успешных сращений [9]. Метод имеет преимущества. Трансплантаты устанавливаются в зоне переднего и среднего опорных столбов позвоночника – эта часть позвонков несет 80% нагрузки позвоночного сегмента и составляет 90% костной поверхности между позвонками [16]. Тела кровоснабжаются лучше, чем дуги позвонков, губчатая кость тел позвонков содержит большое количество клеточных элементов, обладающих остеогенным потенциалом. Использование титановых имплантатов позволяет в ряде случаев восстановить высоту межтелового промежутка, опосредованно расширить межпозвонковые отверстия. Расположенный под компрессией костный трансплантат быстрее перестраивается. Высокая частота наступления спондилодеза приводит к хорошим клинически результатам.
Существуют следующие основные методики осуществления межтелового спондилодеза. Это прежде всего межтеловой спондилодез из переднего доступа. Межтеловой спондилодез можно выполнить и из заднего хирургического доступа. Межтеловой спондилодез, осуществляемый из заднего хирургического доступа (ЗМТС), был предложен сравнительно давно – в 1940-х гг. [4]. Операция существует в двух разновидностях. Первая – задний межтеловой спондилодез – в англоязычной литературе называется PLIF (posterior lumbar interbody fusion). Суть методики заключается в установке пары трансплантатов (имплантатов) из заднего доступа после выполнения двусторонней интерламинэктомии, но без резекции суставных отростков. Накопленный опыт выявил основное преимущество способа – возможность осуществлять циркулярный спондилодез в течение одного хирургического вмешательства. Однако метод PLIF имеет и свои осложнения, связанные с осуществлением хирургического доступа [8]. В первую очередь это повреждение корешков спинного мозга из-за значительной тракции дурального мешка при доступе к межтеловому промежутку и др.
Модифицированную методику PLIF в 1990-е гг. разработал немецкий хирург Harms и назвал ее «трансфораминальный поясничный межтеловой спондилодез» [6]. В англоязычной литературе обозначается аббревиатурой TLIF (transforaminal lumbar interbody fusion). Методика обладает рядом преимуществ. Дискэктомия и спондилодез выполняются с одной стороны – максимального стеноза. Таким образом, интактная часть позвоночного двигательного сегмента не подвергается хирургическому воздействию. Доступ к позвоночному каналу и межпозвонковому диску лежит через латеральную часть межпозвонкового отверстия и осуществляется путем односторонней интерламинэктомии, резекции суставных отростков. Поскольку требуется минимальное натяжение дурального мешка и нервных корешков, снижается риск неврологических осложнений и повреждения оболочек спинного мозга. Кроме того, метод обеспечивает одномоментный переднезадний спондилодез из одного доступа [10, 20].
Поскольку межтеловой спондилодез обладает преимуществами в достижении сращения, увеличивается потребность в этой методике, растет количество подобных операций. Исходя из данных литературы, подавляющее большинство операций межтелового спондилодеза выполняется по различным методикам ЗМТС. Модифицированный метод ЗМТС благоприятен не только для осуществления циркулярного спондилодеза, но и безопаснее, связан с меньшим разрушением задних опорных структур позвоночника [5, 14, 19]. Применение метода возможно даже после выполненных операций на фоне выраженного рубцового процесса [3, 11].
Межтеловой спондилодез требует использования структурно целостного трансплантата, способного нести нагрузку, осуществить распределение осевых напряжений на оперируемый сегмент. Метод ЗМТС значительное развитие получил в 1990-е гг. благодаря разработке специальных имплантатов-кейджей (от англ. cage – клетка). Изготавливаются они чаще всего из титановых сплавов, реже из полимерного материала (PEEK-полимера или углепластика). Кейджи могут устанавливаться из переднего или заднего хирургических доступов. Основное преимущество – возможность восстановления и поддержания нормальной или близкой к таковой высоты межпозвонкового диска. Имплантат обеспечивает только механическую опору и, соответственно, требует параллельного использования пластического материала в виде костных трансплантатов. При этом требуется небольшое количество губчатой кости, которое может быть получено из резецированных задних элементов позвоночника или из небольшого доступа путем трепанации подвздошной кости без резекции ее кортикальных слоев с минимальным риском побочных эффектов и осложнений. Есть сообщения о достижении спондилодеза путем использования кейджей, заполненных костным морфогенетическим белком и коллагеновым матриксом [2]. Однако подобные методики сертифицированы в США лишь для вентрального межтелового спондилодеза. Таким образом, при использовании ЗМТС для достижения и переднего и заднего сращения требуется только одно вмешательство: одновременно выполняется задняя декомпрессия, межтеловой спондилодез и фиксация позвоночника.
Цилиндрические резьбовые стальные межтеловые кейджи впервые были использованы для спондилодеза позвоночника американским ортопедом Bagby в ветеринарной практике для хирургического лечения цервикальной миелопатии у лошадей. Имплантат был усовершенствован совместно с Kuslich [7]. Это устройства первого поколения, представляющие собой титановые полые цилиндры, которые могут быть установлены как из переднего, так и из заднего хирургического доступа. Имплантат «BAK» фирмы «Zimmer» (англоязычное сокращение, производное от имен авторов Bagby And Kuslich) представлен на рис. 1. Соответственно методике операции ЗМТС и при применении из вентрального хирургического доступа имплантаты устанавливаются попарно (рис. 2).
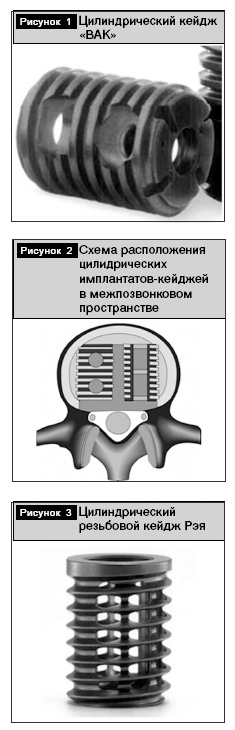
Имплантаты второго поколения обладают улучшенной формой с целью оптимизации подгонки к межпозвонковому пространству, улучшения конфигурации позвоночного двигательного сегмента, большего объема для костных трансплантатов. На рис. 3 представлен имплантат, названный по имени автора, – резьбовой кейдж для спондилодеза Рэя фирмы «Stryker» (англоязычное название «Ray Threaded Fusion Cage») [13].
Резьбовые кейджи третьего поколения благодаря своей форме обеспечивают повышенную площадь для прорастания костной ткани. Трапециевидная форма позволяет восстановить поясничный лордоз, но делает возможным установку кейджа только из переднего доступа. На рис. 4 представлен кейдж «LT» фирмы «Medtronic».

Широко используются для заднего межтелового спондилодеза титановые сетчатые имплантаты (в английской аббревиатуре TMCC – titanium mesh cylindrical cages) малого диаметра (10–12 мм), устанавливаемые в межпозвонковый промежуток попарно. На рис. 5 представлен имплантат Хармса (Harms titanium-mesh cage, «DePuy»), на рис. 6 – имплантат «Медбиотех». Позже разработаны вертикальные межтеловые имплантаты в виде коробки: прямоугольные кейджи, которые могут устанавливаться как из переднего, так и из заднего хирургического доступа, но чаще используются для операций из заднего доступа. Поясничный кейдж «Медбиотех» представлен на рис. 7.
В последующем, основываясь на экспериментальных биомеханических исследованиях и на опыте хирургического лечения, было выяснено, что применение пары или одного кейджа одинаково эффективно [17, 18]. Для лучшей подгонки к форме межпозвонкового пространства и с целью установки из одностороннего заднебокового доступа, т.е. для осуществления заднего межтелового спондилодеза, предложены кейджи, по форме напоминающие бумеранг (рис. 8).

Важным преимуществом заднего межтелового спондилодеза является то, что не требуется выполнения вентрального доступа. Соответственно отсутствует риск связанных с ним осложнений: повреждения крупных артерий, вен, брюшины, симпатических сплетений, стволов поясничного сплетения, мочеточника и других анатомических образований. Однако ЗМТС для своего выполнения требует смещения дурального мешка и корешков спинного мозга. Это может осложняться разрывом твердой мозговой оболочки, ликвореей, травмой корешков спинного мозга. Для заднего доступа к межпозвонковому пространству требуется обширная резекция суставных отростков, в послеоперационном периоде может развиваться обширный эпидуральный спаечный процесс. Методику нельзя использовать проксимальнее уровня L3, так как это может сопровождаться тяжелыми неврологическими расстройствами.
Следует отметить, что во многих странах Европы и в США нейрохирурги и ортопеды, занимающиеся спинальной хирургией, не оперируют самостоятельно. В большинстве случаев операция разделена на два этапа. Первый – вентральный доступ к поясничным позвонкам – выполняется общим или сосудистым хирургом, а второй этап – собственно операция на позвоночнике – спинальным хирургом. Поэтому специалисты-вертебрологи при прочих равных условиях отдают предпочтение дорсальным вмешательствам, о чем свидетельствует количество выполняемых операций. Однако несмотря на рост количества операций (каждое десятилетие число их удваивается) и большой выбор имплантатов, в русскоязычных периодических изданиях и монографиях недостаточно публикаций на эту тему. Учитывая то, что методики операций на позвоночнике активно осваивают травматологи-ортопеды и нейрохирурги областных больниц страны, считаем целесообразным изложить основные особенности, касающиеся непосредственно техники выполнения операции, и познакомить читателей с отечественными разработками.
В РНПЦ травматологии и ортопедии задний межтеловой спондилодез используется с 1990-х гг. Мы использовали аутотрансплантаты, аллотрансплантаты. С 1999 г. применяли цилиндрические резьбовые имплантаты, созданные совместно с фирмой «Медбиотех» (см. рис. 7). Впоследствии сотрудниками РНПЦ травматологии и ортопедии совместно с фирмой «Медбиотех» разработаны имплантаты для осуществления межтелового спондилодеза позвоночника нового поколения (см. рис. 6, 7). Материалом для имплантатов служит титановый сплав. Имплантаты при выполнении корпородеза заполняются аутокостью, получаемой в процессе резекции элементов позвонка (декомпрессии корешков спинного мозга и резекции суставных отростков). Можно использовать неструктурный губчатый аутотрансплантат, получаемый из подвздошной кости без резекции последней. В данной публикации мы подробно описываем методику с применением разработанных в нашем центре имплантатов.
Операция выполняется заднего хирургического доступа. Выделяются дугоотростчатые суставы и поперечные отростки. Уровень хирургического доступа уточняется с помощью электронно-оптического преобразователя. Особое внимание уделяется сохранению заднего опорного комплекса проксимальнее зоны вмешательства, на уровне L5 рекомендуется сохранять пояснично-подвздошную связку.
Затем выполняется установка транспедикулярных винтов. Резецируются нижние и верхние суставные отростки, формирующие дугоотростчатый сустав на стороне декомпрессии. В случае необходимости декомпрессии с обеих сторон вначале выполняется двусторонняя интерламинэктомия, обширная резекция суставных отростков производится со стороны планируемой установки имплантата. В фораминальной зоне выделяется межпозвонковый диск. На этом этапе особое внимание уделяется коагуляции вен эпидурального сплетения, часто имеющих относительно большой диаметр и занимающих существенную часть эпидурального пространства.
При работе в межпозвонковом пространстве необходимо защитить дуральный мешок. С целью отведения дурального мешка в медиальном направлении и обнажения задней части диска используется узкий шпатель. В большинстве случаев данный инструмент устанавливают в области выхода нижележащего нервного корешка. Необходимо, чтобы нервные структуры постоянно находились в поле зрения в ходе данного этапа операции.
Фиброзное кольцо рассекается скальпелем, удаляются выпавшие фрагменты диска. Диск субтотально резецируется с помощью кусачек, костных ложек, кюреток (рис. 9). В процессе операции выполняется дистракция сегмента винтами противоположной стороны по временно установленному стержню.

Для удаления диска и хрящевых замыкательных пластинок используется особый инструмент «ример» (от англ. reamer – развертка). Инструмент имеет противоположно направленные режущие грани и при вращении позволяет срезать мягкую часть межпозвонкового диска (рис. 10, а). Кроме того, использование римера позволяет создать дистракцию межпозвонкового пространства. Это облегчает удаление материала диска и выполнение межтелового спондилодеза, а также восстанавливает высоту межпозвонкового промежутка. Ример, начиная с меньшего размера, устанавливается горизонтально в межпозвонковое пространство. Затем поворотом инструмента на 90° расширяется межпозвонковое пространство на величину, соответствующую размеру римера (рис. 10, б).
Завершается дискэктомия зачисткой замыкательных пластинок кюреткой с полным удалением хряща до появления точечных кровотечений. Нельзя удалять подлежащую костную часть пластинки, на которую будет опираться имплантат. Это особенно важно у пациентов старшего возраста при наличии остеопороза.
Далее в межпозвонковое пространство поочередно устанавливаются шаблоны с гладкой поверхностью до выбора оптимального по длине и высоте варианта (рис. 11). Пространство диска частично заполняется костной щебенкой. В центральную часть устанавливается заполненный костной щебенкой имплантат (рис. 12). Конструкция имплантатов для поясничного отдела позвоночника соответствует форме замыкательных пластинок тел позвонков данного уровня (см. рис. 8). Размеры имплантата подбираются в соответствии со средними значениями высоты и ширины межпозвонковых промежутков данного отдела позвоночника: длиной 20, 25, 30, 35 мм и высотой 7, 9, 11, 13 мм. Поверхности, обращенные к телам позвонков, снабжены выступами, препятствующими смещению имплантата из межпозвонкового промежутка. Боковые поверхности имеют специальное резьбовое отверстие для установочного инструмента.

Выполняется рентгеновский контроль. Оставшееся пространство заполняется аутотрансплантатами. При кровотечении из костной ткани осуществляется гемостаз воском и гемостатической губкой. Выполняется монтаж стержней транспедикулярного фиксатора с умеренной компрессией. Выполняется декортикация задних элементов позвоночника, укладывается костная щебенка, т.е. выполняется и задний спондилодез. В большинстве случаев для выполнения спондилодеза достаточно получаемых в результате резекции задних элементов позвонка костных фрагментов. При необходимости можно использовать дополнительно аутотрансплантаты из дорсальных отделов гребня подвздошной кости, зачастую доступных из уже имеющего разреза или губчатых аллотрансплантатов.
В обязательном порядке операционная рана дренируется на срок 24–48 ч. В послеоперационном периоде используются полужесткие или жесткие ортезы в течение 3–4 мес. Рентгенологический или компьютерный томографический (КТ) контроль проводится через 1, 3, 6, 9 и 12 мес. после вмешательства.
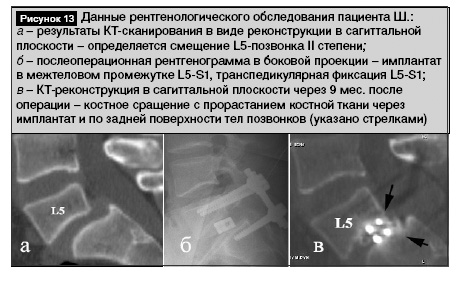
Клинический пример. Пациент Ш., 21 года. Диагноз: Диспластический спондилолизный спондилолистез L5 II степени, двусторонняя стойкая люмбоишиалгия. Боли беспокоят в течение года. На рис. 13 представлены предоперационные обследования: данные КТ-сканирования в виде реконструкции в сагиттальной плоскости (рис. 13, а), послеоперационная рентгенограмма в боковой проекции (рис. 13, б). Выполнена операция: задняя декомпрессия L5, задний межтеловой спондилодез L5-S1 имплантатом-кейджем и аутотрансплантатами в сочетании с транспедикулярной фиксацией. Трансплантатами послужили резецированные в процессе декомпрессии части дуг и суставных отростков позвонков. Послеоперационный период протекал без осложнений. Вертикализирован на 2-е сутки после операции. Рана зажила первичным натяжением. Болевой синдром прогрессивно уменьшался. Выписан из отделения для прохождения реабилитационного лечения на 12-е сутки в удовлетворительном состоянии. При осмотрах в течение периода наблюдения жалоб не предъявлял, рентгенологически имплантат и транспедикулярный фиксатор стабильны. При обследовании через 10 мес. выявлено отсутствие болевого синдрома. Выполнена компьютерная томография: реконструкция в сагиттальной плоскости. Определяется костное сращение с прорастанием костной ткани через имплантат и по задней поверхности тел позвонков (рис. 13, в, указано черными стрелками).
Поскольку целью операции является достижение костного сращения, важной становится рентгенологическая оценка состояния оперированного сегмента в различные сроки после хирургического вмешательства. В литературе нет указаний на однозначные критерии наступления межтелового спондилодеза. Использование имплантатов еще больше затрудняет оценку состояния межтелового промежутка. В связи с этим вопросам рентгенологической диагностики в послеоперационном периоде уделяется значительное внимание.
Традиционным методом является рентгенография, выполняемая в прямой, боковой проекции, под различными углами. Используется функциональная рентгенография. Ray определял сращение по следующим критериям: отсутствие подвижности или подвижность между позвонками менее 3 мм в соответствии с функциональными рентгенограммами; отсутствие зоны резорбции вокруг имплантата; минимальная потеря высоты диска, указывающая на устойчивость губчатой кости к проседанию; отсутствие видимого повреждения имплантата или позвонков; отсутствие склеротических изменений в подлежащей костной ткани; наличие костной ткани внутри цилиндрического имплантата на прямой рентгенограмме [13].
Исследование у пациентов, которым через 9 мес. после операции удалялся задний транспедикулярный фиксатор, выявило, что ошибки при оценке сращения по рентгенограммам достигали 20% [1]. Поэтому наиболее ценным методом оценки консолидации является КТ [15]. Авторы делают вывод, что через 6 мес. после операции имеется прорастание кости через кейдж в 95% и вне кейджа между позвонками в 90% случаев. Соответствующие рентгенологические данные составили лишь 4 и 7%. КТ в 4 раза чаще выявляет резорбцию костной ткани вокруг имплантата, что является ранним симптомом формирования ложного сустава. Установление сращения по КТ-данным более достоверно и позволяет точнее выбирать сроки внешней иммобилизации и ограничения нагрузок.
В настоящий момент использовать ЗМТС с применением кейджей рекомендуется при следующих патологических состояниях [12]: остеохондрозе с неврологическими проявлениями; дегенеративном спондилолистезе; спондилолизном спондилолистезе I–II степени; ятрогенной нестабильности (постламинэктомический синдром, постфасетэктомический синдром); псевдоартрозе (после заднего спондилодеза); срединной грыже диска; рецидивной грыже диска.
При выполнении спондилодеза имплантаты обеспечивают две функции: являются «емкостью» для костно-пластического материала и обеспечивают восстановление опороспособности передних отделов позвоночника. Успешный спондилодез требует таких местных условий, как достаточная площадь соприкосновения с пластическим материалом и достаточный объем материала трансплантата. Поэтому имплантаты должны в максимальной степени подходить по диаметру к опорным замыкательным пластинкам позвонков оперируемого сегмента, а также соответствовать по высоте межтеловому промежутку при межтеловом спондилодезе или высоте тела позвонка и смежных дисков при корпородезе.
Следует использовать имплантат оптимальной площади, максимально увеличивая поверхность соприкосновения трансплантата с замыкательными пластинками позвонков. Это позволяет распределить осевые нагрузки на большую площадь и избегать локальных стрессовых перегрузок. Необходимо дифференцированно использовать вид межтелового трансплантата. Использование титанового кейджа при остеопорозе нецелесообразно: это может привести к его смещению, перелому замыкательных пластинок, несращению. Имплантат должен предусматривать возможность извлечения в случае послеоперационных осложнений. Форма имплантатов и трансплантатов должна соответствовать клиновидной форме межпозвонкового пространства, чтобы избегать микроподвижности и потери стабильности.
Таким образом, различные типоразмеры кейджей позволяют хирургу решать различные задачи. Обеспечивается восстановление высоты, конфигурации и опорности позвоночного сегмента в передних его отделах, несущих 80% осевой нагрузки на позвоночник. Для заполнения кейджа используется резецируемая ткань тела позвонка. Используемая костная щебенка служит хорошим материалом для достижения костного сращения. Отпадает необходимость в нанесении дополнительной травмы во время взятия костного кортикально-губчатого трансплантата. Передне-задний спондилодез выполняется в процессе одного оперативного вмешательства.
Л И Т Е Р А Т У Р А
1. Blumental S.L., Gill K. // Spine. – 1993. – Vol. 18. – P. 1186–1189.
2. Burcus J.K. // J. Neurosurg. Spine. – 2004. – Vol. 1. – P. 254–260.
3. Chen Z., Zhao J., Li Z. // Int. Orthopaedics. – 2009. – Vol. 33. – P. 197–201.
4. Cloward R.B. // J. Neurosurgery. – 1953. – Vol. 10. – P. 154–168.
5. Hackenberg L., Halm H., Bullmann V. et al. // Eur. Spine J. – 2005. – Vol. 14. – P. 551–558.
6. Harms J., Rolinger H. // Z. Orthop. Ihre Grenzgeb. – 1982. – Vol. 120. – P. 343–347.
7. Kuslich S.D., Ulstrom C.L., Griffith S.L. et al. // Spine. – 1998. – Vol. 23. – P. 1267–1279.
8. McAfee P.C. // J. Bone Joint Surg. (Am.). – 1999. – Vol. 81. – P. 859–880.
9. Mummaneni P.V., Haid R.W., Rodts G.E. // J. Neurosurg. Spine. – 2004. – Vol. 1. – P. 24–30.
10. Mura P.P., Costaglioli M., Piredda M. et al. // Eur. Spine J. – 2005. – Vol. 14. – P. 551–558.
11. Niemeyer T., Halm H., Hackenberg L., Bцvingloh A.S. // Int. Orthopaedics. – 2006. – Vol. 30. – P. 163–166.
12. Oliver M.D., Cahill D.W., Hajjar M.V. // Techniques in Neurosurgery. – 2001. – Vol. 7, N 2. – P. 127–139.
13. Ray C.D. // Spine. – 1997. – Vol. 22. – P. 667–680.
14. Rosenberg W.S., Mummaneni P.V. // Neurosurgery. – 2001. – Vol. 48. – P. 569–575.
15. Shah R.R., Mohammed S., Saifiddin A., Taylor B.A. // Eur. Spine J. – 2005. – Vol. 14. – P. 551–558.
16. Ugokwe K.T., Lu J.J., Benzel E.C. Biomechanjcs of the spine // Spinal deformity: a guide to sufgical planning and management / ed. by P.V. Mummaneni, L.G. Lenke, R.W. Haid. – Quality Medical Publishing, 2008. – P. 3–46.
17. Zhao J.Z., Hai Y., Ordway N.R. et al. // Spine. – 2000. – Vol. 25, N 4. – P. 425–430.
18. Zhao J.Z., Wang X., Hou T., He S. // Spine. – 2002. – Vol. 27, N 24. – P. 2753–2757.
19. Weiner B.K., Fraser R.D. // Spine. – 1998. – Vol. 23. – P. 634–640.
20. Yan D., Pei F., Li J. // Eur. Spine. J. – 2008. – Vol. 17. – P. 1311–1316.
Медицинские новости. – 2012. – №7. – С.36-41.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.