Famina M.P., Divakova T.S., Rzheusskaya L.D.
Vitebsk State Order of Peoples’ Friendship Medical University, Belarus
Effect of otilonium bromide on intensity of chronic abdominal pain
Резюме. Проведен анализ исходов одноплодной маточной беременности у 80 женщин, родивших детей с гипоксически-ишемической энцефалопатией. В 18–22 и 30–34 недели гестации были исследованы содержание васкулярного эндотелиального фактора роста, плацентарного фактора роста, растворимые рецепторы-1 к васкулярному эндотелиальному фактору роста в крови беременных. Преобладание антиангиогенного состояния и высокий уровень эндотелина-1 (>1,8 пг/мл) в материнской крови во II триместре свидетельствовал о плацентарных нарушениях и эндотелиальной дисфункции, проявляясь в III триместре гестационными и перинатальными осложнениями. Перспективным подходом к эффективной терапии таких осложнений следует рассматривать прием дидрогестерона и низких доз ацетилсалициловой кислоты в I–II триместрах осложненной беременности.
Ключевые слова: плацентарные нарушения, ангиогенез, эндотелиальная дисфункция, дидрогестерон, ацетилсалициловая кислота.
Медицинские новости. – 2014. – №3. – С. 63–67.
Summary. The analysis of singleton pregnancy outcomes was made in 80 women who delivered babies with hypoxic-ischemic encephalopathy. We have investigated maternal blood levels of vascular endothelial growth factor, placental growth factor, and soluble receptors-1 to the vascular endothelial growth factor at 18 – 22 and 30 – 34 gestation weeks’. Predominant anti-angiogenic status and high levels of endothelin-1 (>1.8 pg/ml) in maternal blood at the second trimester demonstrated placental disorders and endothelial dysfunction, which manifested as gestational and perinatal complications at the third trimester. A promising approach to the effective treatment of these complications should be considered oral dydrogesterone and oral low-dose acetylsalicylic acid at the first and the second trimesters in cases of complicated pregnancy.
Keywords: placental disorders, angiogenesis, endothelial dysfunction, dydrogesterone, acetylsalicylic acid.
Meditsinskie novosti. – 2014. – N3. – P. 63–67.
Физиологическое развитие и рост плаценты обеспечивается полноценной инвазией трофобласта, адекватными васкулогенезом и ангиогенезом [7, 11, 15]. В основе полноценной инвазии трофобласта в I–II триместрах гестации лежит дилатационная трансформация спиральных артерий в маточно-плацентарные сосуды, которая определяет оптимальный кровоток в области плацентарного ложа [7, 12, 45]. Васкулогенез является эмбриональным процессом формирования de novo первичной капиллярной сети из дифференцированных эндотелиальных клеток, тогда как ангиогенез включает развитие новых сосудов из этой первичной сети в результате процессов ремоделирования (элонгация, инвагинация, капиллярное почкование) [2, 7, 44]. Активность плацентарного ангиогенеза контролируется спектром факторов роста с проангиогенными и антиангиогенными свойствами [7]. Источником проангиогенных факторов роста (васкулярный эндотелиальный фактор роста, или VEGF, плацентарный фактор роста, или PlGF) является цитотрофобласт плаценты, тогда как экспрессия растворимых рецепторов-1 васкулярного эндотелиального фактора роста (sVEGFR-1) преобладает в клетках эндотелия сосудов [7, 60]. VEGF продуцируется эндотелием сосудов, способствует миграции эндотелиоцитов и ремоделированию сосудистого русла [3, 9, 60]. PlGF в I триместре стимулирует синтез трофобластической ДНК, увеличивая количество клеток трофобласта и улучшая условия для его инвазии [15]. sVEGFR-1 является высокоаффинитивным рецептором-«ловушкой» для VEGF и PlGF, вызывая их блокаду, тормозя формирование новых кровеносных сосудов и способствуя созреванию уже сформированных [31].
Баланс между VEGF и PlGF в основном регулируется содержащимся в плаценте кислородом [15]. В течение III триместра беременности секреция VEGF постепенно снижается, тогда как экспрессия PlGF достигает максимума к 28–30 неделям гестации [3]. Смена баланса между VEGF и PlGF на протяжении беременности объясняет смену ангиогенеза в ворсинах от преимущественно разветвляющего типа (определяет быстрый рост плаценты в I–II триместрах) к неразветвляющему (увеличение длины капилляров для образования терминальных ворсин в III триместре) [18, 22, 23, 46]. Гипоксические состояния, сопровождающие развитие плаценты во II триместре гестации, увеличивают в плаценте экспрессию VEGF и sVEGFR-1, снижая продукцию PlGF [9, 15, 31, 35, 63]. Такое нарушение баланса факторов ангиогенеза обусловливает антиангиогенное состояние с угнетением роста плацентарных сосудов, стимулирует пролиферацию цитотрофобласта, подавляет инвазию трофобласта во II триместре, усугубляет плацентарную ишемию, индуцирует эндотелиальную дисфункцию, клинически манифестируя в III триместре в виде гестоза, синдрома задержки роста плода (СЗРП), преждевременных родов и других гестационных осложнений [8, 14, 33, 34, 43, 53, 57, 59, 62].
О развитии дисфункции эндотелия свидетельствует повышение экспрессии на поверхности эндотелиоцитов молекул адгезии (VCAM-1, ICAM-1) и рост сывороточной концентрации эндотелина-1 (ЭТ-1) [1]. Молекулы адгезии ответственны за прилипание к эндотелию циркулирующих лейкоцитов, что играет принципиальную роль в развитии иммунного воспаления, способствуя возникновению васкулопатий [4, 10]. ЭТ-1 – вазоконстрикторный пептид, который образуется эндотелиоцитами и субэндотелиальными структурами, участвует в ремоделировании кровеносных сосудов, повышает артериальное давление и продукцию цитокинов, снижает маточно-плацентарный кровоток, вызывает гемоконцентрацию и протеинурию [5, 24, 36].
Завершение второй волны плацентации к 24–26-й неделе гестации объясняет неэффективность проводимой медикаментозной терапии проявлений плацентарной недостаточности в III триместре беременности, заставляя рассматривать возможность диагностики и терапии плацентарных нарушений и эндотелиальной дисфункции только в I–II триместрах гестации [32, 61]. Перспективным подходом в терапии плацентарных нарушений в I–II триместрах гестации считают применение прогестерона и аналогов, низких доз ацетилсалициловой кислоты (аспирин) [17, 19, 21, 47]. Прием дидрогестерона (ретропрогестерон) с ранних сроков до 16–20 недель гестации значительно снижает частоту осложнений 1-й половины беременности (самопроизвольные аборты, ретроплацентарные и субхориальные гематомы) при высоком риске невынашивания, препятствует развитию гестационных осложнений во II–III триместрах (преждевременные роды, гестоз), способствует улучшению перинатальных исходов [19, 56]. Такой эффект достигается благодаря стимуляции роста и ремоделирования спиральных артерий матки, подавлению сократительной активности миометрия в результате снижения содержания интерлейкина-8 (медиатор нейтрофильной инфильтрации и некроза при отслойке хориона) и циклооксигеназы (ЦОГ) в децидуальной оболочке [30, 34, 37]. Экспериментальные исследования показали, что дидрогестерон и его метаболит 20-альфа-дигидро-дидрогестерон активируют синтез NO эндотелиальными клетками, препятствуют воспалительному повреждению эндотелия путем блокады экспрессии молекул адгезии (VCAM-1, ICAM-1) [55]. Концепция действия дидрогестерона на эндотелиоциты определяет прямой вазопротекторный эффект, препятствующий развитию эндотелиальной дисфункции [25].
Применение низких доз аспирина с ранних сроков гестации способствует снижению риска гестоза, СЗРП и перинатальной смертности [6, 27, 47, 49]. Аспирин подавляет сокращения миометрия и вызывает вазодилатацию в области плацентарного ложа за счет блока циклооксигеназы, снижающей синтез простагландинов (PGЕ1, PGЕ2) и тромбоксана А2 [39, 47, 50, 51]. Ацетилсалициловая кислота в низкой дозе (75–100 мг в сутки) подавляет экспрессию VEGF, тем самым уменьшая агрегационную активность тромбоцитов и блокируя синтез проангиогенного PGE2. Все вместе усиливает активность неразветвляющего ангиогенеза и формирование терминальных ворсин в плаценте на протяжении III триместра [28, 42, 50, 51].
Оптимизации миграции трофобласта способствуют низкомолекулярные гепарины (НМГ), которые применяются для профилактики осложнений у беременных с антифосфолипидным синдромом (АФС) [29]. НМГ предотвращают невынашивание беременности у женщин с АФС в результате снижения продукции ИЛ-8 и ИЛ-1?, индуцированной антифосфолипидными антителами [13]. Наряду с таким полезным эффектом НМГ вызывают снижение секреции VEGF и рост продукции sVEGFR-1, индуцируя тем самым антиангиогенное состояние в плацентарной ткани. Вышеперечисленное закладывает основу неполноценной плацентации с угнетением ангиогенеза [52]. Такие изменения ангиогенеза могут объяснить невозможность НМГ предотвратить в ряде случаев неблагоприятные исходы (гестоз, СЗРП) поздних сроков беременности.
Цель исследования – изучение роли эндотелиальной дисфункции и ангиогенного статуса крови беременных в механизмах плацентарных нарушений.
Материалы и методы
Проведен анализ течения одноплодной маточной беременности у 119 женщин в возрасте 28,7±4,1 года, которые были подразделены на 2 группы. В основную группу вошли женщины, родившие детей, у которых была диагностирована гипоксически-ишемическая энцефалопатия (n=80). Контрольную группу составили женщины с физиологическим течением беременности, родов и послеродового периода, родившие здоровых доношенных детей (n=39). Критерием исключения беременных из исследуемых групп было наличие у плода хромосомных и генных аномалий, врожденных пороков развития, гемолитической болезни и инфекции, специфичной для перинатального периода.
Всем женщинам на протяжении беременности проводилось общеклиническое обследование, 2D стандартное ультразвуковое исследование плода с фетометрией, оценкой экстраэмбриональных структур (околоплодные воды, плацента, пуповина), допплерометрией маточно-плацентарного и плодового кровотока на аппарате Voluson 730 Expert (GE Medical Systems, Austria) трансабдоминальным датчиком (АВ2-7). У каждого новорожденного определяли перцентили его веса с учетом роста, веса и паритета матери, гестационного срока и пола ребенка [26].
В основной и контрольной группах забор крови для исследования уровня ангиогенных факторов (VEGF, PlGF, sVEGFR-1) и ЭТ-1 был выполнен с 8 до 10 часов утра натощак из локтевой вены в 18–22 недели у 63 беременных, в 30–34 недели – у 56 женщин. Уровень VEGF в сыворотке крови определяли методом иммуноферментного анализа (ИФА) с помощью наборов Вектор-Бест (Россия). Концентрацию PlGF, рецепторов sVEGFR-1 и ЭТ-1 в материнской сыворотке крови исследовали методом ИФА с использованием наборов Quantikine (R&D Systems, USA&Canada).
Статистический анализ выполнен с использованием прикладных компьютерных программ SPSS v11.5 StatSoft Statistica v6.0 и Microsoft Excel 2007 непараметрическими методами анализа с описанием медианы, 25-го и 75-го перцентилей: Ме (25–75‰). Для оценки различий значений клинических параметров применялся U-критерий Манна–Уитни. При анализе таблиц сопряженности двух качественных признаков использован критерий ?2 с поправкой Йетса. Степень корреляционной связи оценивали по величине коэффициента ранговой корреляции Спирмена «rs», учитывая силу связей: сильная – при значениях модуля коэффициента корреляции |r| ≥ 0,70, средняя – при 0,50 ≤ |r| ≤ 0,69, умеренная – при 0,30 ≤ |r| ≤ 0,49, слабая – при 0,20 ≤ |r| ≤ 0,29, очень слабая – при |r| ≤ 0,19. Медианы концентраций ангиогенных факторов для каждой недели беременности во II триместре рассчитывали с помощью линейной регрессии с представлением коэффициента детерминации (R2). Для всех видов анализа статистически достоверными считали значения при р<0,05.
Результаты и обсуждение
У 63 (78,8%) беременных женщин основной группы в 28 – 34 недели гестации диагностировали СЗРП при предполагаемом весе плода ниже 10‰ для соответствующего гестационного срока по данным ультразвуковой фетометрии. Во всех случаях после рождения подтвержден диагноз маловесного для гестационного возраста плода при среднем весе этих новорожденных 2128±492 г в сроке гестации 35,3±2,7 недели (соответствует 8,6±1,2‰). В 17 (21,2%) случаях в основной группе вес новорожденных соответствовал гестационному возрасту (3607±411 г в сроке гестации 38,7±1,6 недели, что соответствует 78,5±5,5‰), но дети перенесли асфиксию интранатально. Анализ гестационных осложнений и акушерских исходов показал, что основная группа достоверно отличалась от контроля частотой гестоза и преждевременного оперативного родоразрешения (табл. 1).
Таблица 1. Гестационные осложнения и акушерские исходы в основной группе
|
Гестационные осложнения и акушерские исходы
|
Основная группа (n=80)
|
р*
|
|
Гестоз
|
15 (18,8%)
|
0,01
|
|
Гестоз средней и тяжелой степени
|
8 (10,0%)
|
0,1
|
|
Преждевременные роды самопроизвольные
|
5 (6,3%)
|
0,27
|
|
Преждевременное оперативное родоразрешение
|
62 (77,5%)
|
0,000001
|
|
Предлежание плаценты
|
4 (5,0%)
|
0,38
|
|
Плотное прикрепление плаценты
|
8 (10,0%)
|
0,1
|
|
Преждевременная отслойка нормально расположенной плаценты
|
2 (2,5%)
|
0,8
|
П р и м е ч а н и е: * – достоверность различий с контрольной группой.
Исследование содержания ангиогенных факторов в сыворотке крови беременных основной группы в 18–22 недели гестации показало увеличение уровней VEGF и sVEGFR-1 в 2,7 раза с одновременным снижением концентрации PlGF в 3,5 раза по сравнению с контролем (табл. 2). Такой дисбаланс факторов роста в крови беременных основной группы соответствовал антиангиогенному статусу и свидетельствовал о развитии плаценты во II триместре гестации в условиях гипоксии, препятствующей трансформации спиральных артерий в маточно-плацентарные сосуды.
Таблица 2. Содержание факторов роста и ЭТ-1 в сыворотке крови беременных в 18–22 и 30–34 недели гестации в исследуемых группах
|
Уровень
ангиогенных факторов
|
Срок 18–22 недели гестации
|
Срок 30–34 недели гестации
|
|
Основная
группа (n=41)
|
Контрольная группа (n=22)
|
Основная
группа (n=39)
|
Контрольная группа (n=17)
|
|
VEGF, пг/мл
|
54,9
(28,0–69,9)**
|
20,0
(7,1–39,9)
|
28,0
(10,1–54,9)*
|
51,9
(45,9–69,9)
|
|
sVEGFR-1, пг/мл
|
2478,6
(2243,0–2587,4)*
|
919,6
(654,4–1421,3)
|
2064,4
(853,3–2396,3)
|
1246,9
(760,1–2120,2)
|
|
PlGF, пг/мл
|
69,5
(23,0–78,5)*
|
242,3
(225,3–252,3)
|
144,8
(105,9–201,8)
|
184,8
(83,9–216,9)
|
|
ЭТ-1, пг/мл
|
1,33
(0,69–1,84)
|
1,01
(0,79–1,2)
|
1,41
(0,86–1,63)*
|
0,82
(0,69–0,98)
|
П р и м е ч а н и е: достоверность различий с контрольной группой по U-критерию: * – p<0,05, ** – p<0,01.
В III триместре беременности, напротив, в основной группе на фоне нарастания гипоксии и снижения маточно-плацентарной перфузии концентрация циркулирующего в крови беременных VEGF была в 1,9 раза ниже (p<0,05), а уровень антиангиогенных рецепторов sVEGFR-1 в 1,7 раза выше (p>0,05), чем в контроле. Падение уровня циркулирующего VEGF в III триместре гестации можно объяснить длительной гиперпродукцией sVEGFR-1 и увеличением образования комплексов sVEGFR-1/VEGF, что согласуется с данными Munaut C. et al. (2008) и Bridges J.P. et al. (2009) [16, 40]. Рядом исследователей было установлено, что повышение уровня циркулирующего VEGF связано с ростом концентрации ЭТ-1 в сыворотке крови, а последующее снижение экспрессии VEGF на фоне высокого содержания ЭТ-1 ассоциировано с повреждением эндотелия и развитием эндотелиальной дисфункции [38, 41, 48, 60].
В основной группе в 18–22 недели гестации регистрировали уровень ЭТ-1 в сыворотке крови в 1,3 раза выше, чем в контроле (p>0,05). Этот факт свидетельствует о возникновении эндотелиальной дисфункции у беременных основной группы уже во II триместре. Развитие дисфункции эндотелия у беременных основной группы на фоне падения уровня циркулирующего VEGF подтверждалось в III триместре гестации ростом концентрации ЭТ-1 в 1,7 раза в их крови по сравнению с контролем (p<0,05). Между концентрацией ЭТ-1, превосходящей 1,8 пг/мл во II триместре гестации, и последующим проявлением гестоза с СЗРП наблюдалась средняя степень корреляционной связи (rs=0,61, р=0,00002). Таким образом, высокий уровень ЭТ-1 рассматривался нами как прогностический признак гестоза средней и тяжелой степени. Дисбаланс про- и антиангиогенных факторов роста и ЭТ-1 в сыворотке крови беременных основной группы во II–III триместрах отражал высокую активность разветвляющего и угнетение неразветвляющего ангиогенеза в плаценте, обусловливая плацентарную и эндотелиальную дисфункцию с клинической манифестацией СЗРП, гестоза, преждевременных родов, преждевременной отслойки нормально расположенной плаценты и/или интранатальной асфиксии плода.
Существование корреляционной зависимости сильной, средней и умеренной степени между факторами роста и ЭТ-1 в контрольной группе во II и III триместрах беременности подтверждало наличие патогенетических связей между плацентарным ангиогенезом и функциональным состоянием эндотелия (табл. 3).
Таблица 3. Показатели корреляционных связей между факторами роста и ЭТ-1 в сыворотке крови беременных в исследуемых группах в 18–22 и 30–34 недели гестации
|
Корреляционная связь
|
Коэффициент корреляции, rs
|
|
Срок 18–22 недели гестации
|
Срок 30–34 недели гестации
|
|
Основная группа (n=41)
|
Контрольная группа (n=22)
|
Основная
группа (n=39)
|
Контрольная группа (n=17)
|
|
VEGF – PlGF
|
0,37*
|
–
|
0,36*
|
–
|
|
VEGF – ЭТ-1
|
–
|
0,52**
|
–
|
–0,7**
|
|
VEGF – sVEGFR-1
|
–
|
–0,67***
|
–
|
–0,74***
|
|
PlGF – sVEGFR-1
|
–0,54***
|
–0,57**
|
–0,58***
|
–0,5*
|
|
sVEGFR-1 – ЭТ-1
|
–
|
–0,73***
|
–
|
–
|
П р и м е ч а н и е : достоверность различий с контролем: * – р<0,05, ** – p<0,01, *** – p<0,001.
Инверсия корреляционной связи VEGF – ЭТ-1, отрицательная корреляция sVEGFR-1 – ЭТ-1 в контроле во II и III триместрах указывала на то, что повышение уровня ЭТ-1 во II триместре активирует плацентарный ангиогенез (рост VEGF, снижение sVEGFR-1). Этот факт подтверждается данными зарубежных исследователей об увеличении продукции VEGF под действием ЭТ-1 [20, 54, 58]. Однако в III триместре беременности корреляционные связи в контрольной группе показывали, что рост уровня ЭТ-1 сопровождался снижением концентрации VEGF в крови беременных, свидетельствуя лишь о минимуме проявлений эндотелиальной дисфункции при физиологической гестации [10].
В основной группе зависимость между факторами роста, их растворимыми рецепторами и ЭТ-1 была выражена слабее по сравнению с контролем (2 корреляционные связи против 4 во II триместре, 2 связи против 3 в III триместре). Утрата корреляционных связей между про- и антиангиогенными факторами в крови беременных основной группы отражала нарушение плацентарного ангиогенеза. Выявленный в основной группе распад корреляций между факторами роста и ЭТ-1 свидетельствовал о переходе ангио-генеза в автономный режим и потере патогенетической связи между экспрессией факторов роста и функциональным состоянием эндотелия. В то же время в исследуемых группах не было выявлено значимых корреляций между PlGF и ЭТ-1.
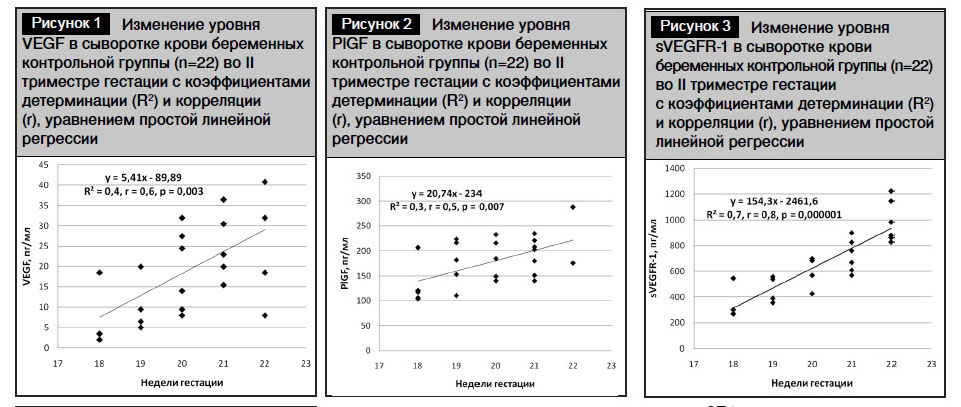
Достоверно значимые изменения проангиогенных факторов (VEGF, PlGF) и антиангиогенных рецепторов sVEGFR-1 в крови беременных основной группы во II триместре позволяют рассматривать их в качестве прогностических маркеров плацентарных нарушений в 18–22 недели гестации. Полученные концентрации VEGF, PlGF и sVEGFR-1 в сыворотке крови беременных контрольной группы в 18–22 недели гестации позволили представить медианы концентраций этих факторов роста в виде линий трендов, описанных уравнениями простой линейной регрессии (рис. 1–3). Уравнения дали возможность рассчитать медианы концентраций факторов роста для каждой недели гестации во II триместре (табл. 4).
Таблица 4. Медианыконцентрацийфакторовроставсывороткекровибеременныхконтрольнойгруппы
|
Неделягестации
|
PlGF,
пг/мл
|
VEGF, пг/мл
|
sVEGFR-1, пг/мл
|
|
14
|
56,3
|
0
|
0
|
|
15
|
77,0
|
0
|
0
|
|
16
|
97,7
|
0
|
7,2
|
|
17
|
118,5
|
2,1
|
161,5
|
|
18
|
139,2
|
7,5
|
315,8
|
|
19
|
159,9
|
12,9
|
470,1
|
|
20
|
180,7
|
18,3
|
624,4
|
|
21
|
201,4
|
23,8
|
778,7
|
|
22
|
222,1
|
29,2
|
933,0
|
Для стандартизации значения концентраций факторов роста (VEGF, PlGF, sVEGFR-1) были трансформированы в кратные медианы (МоМ) путем расчета отношения концентраций VEGF, PlGF и sVEGFR-1 в сыворотке крови беременных основной группы к медиане концентраций этих факторов роста для установленного срока беременности во II триместре гестации. У беременных основной группы в 18–22 недели гестации содержание VEGF и sVEGFR-1 в сыворотке крови было более 2,5 МоМ (2,8 [1,8; 3,9] и 2,7 [1,8; 3,4] МоМ соответственно), а уровень PlGF составил менее 0,5 МоМ (0,28 [0,26; 0,31] МоМ), что соответствовало формированию плацентарных нарушений.
Выводы:
1. Антиангиогенный статус крови беременных женщин в сроки 18–22 недели гестации (высокий уровень VEGF и sVEGFR-1 (более 2,5 МоМ), низкий уровень PlGF (менее 0,5 МоМ)) ассоциирован с плацентарными нарушениями во II и III триместрах, формированием синдрома задержки роста плода, интранатальной асфиксии при нормальном весе плода, гипоксически-ишемической энцефалопатии новорожденных.
2. Высокий уровень эндотелина-1 (более 1,8 пг/мл) в сыворотке крови беременных во II триместре гестации является прогностическим признаком плацентарной и эндотелиальной дисфункции и связан с последующей манифестацией длительно текущего гестоза в сочетании с синдромом задержки роста плода (rs = 0,61, р = 0,00002).
3. Сочетанный прием дидрогестерона и низких доз ацетилсалициловой кислоты на протяжении I и II триместров при осложненном течении беременности может улучшить условия плацентации, препятствовать повреждению эндотелия сосудов, тормозить развитие гестационных осложнений и оптимизировать тем самым перинатальные исходы.
Л И Т Е Р А Т У Р А
1. Антонова Т.В., Романова М.А., Лымарь Ю.В. // Журн. инфектологии. – 2012. – Т.4, №4. – С.46–51.
2. Волкова Л.В., Аляутдина О.С. // Акушерство и гинекология. – 2011. – №4. – С.126–129.
3. Лукьянова Е.В., Волощук И.Н., Липман А.Д. и др. // Акуш. и гин. – 2009. – № 2. – С.5–8.
4. Петухов В.А. // Хирургия. Приложение Сonsilium Medicum. – 2008. – №1. – С.3–11.
5. Рубахова Н.Н. Лечебно-профилактические мероприятия у родильниц, перенесших поздний гестоз: автореф. дис. … канд. мед. наук. – Минск, 2009. – 20 с.
6. Савоневич Е.Л. Клиническое значение раннего выявления антифосфолипидных антител при невынашивании беременности: автореф. …дис. канд. мед. наук. – Гродно, 2004. – 21 с.
7. Соколов Д.И. // Журн. акушерства и женских болезней. – 2007. – Т.56, вып.3. – С.129–133.
8. Стрижаков А.Н., Игнатко И.В., Тимохина Е.В. и др. // Вестн. Рос. АМН. – 2008. – №11. – С.50–59.
9. Сухих Г.Т., Вихляева Е.М., Ванько Л.В. и др. // Акуш. и гин. – 2008. – №5. – С.3–7.
10. Шестакова М.В. // Рус. мед. журн. – 2001. – Т.9, №2. – С.88–90.
11. Щегловитова О.Н. // Вопр. вирусологии. – 2005. – Т.50, №5. – С.4–9.
12. Экстраэмбриональные и околоплодные структуры при нормальной и осложненной беременности: коллект. монография / под ред. В.Е.Радзинского и А.П.Милованова. – М.: МИА, 2004. – 393 с.
13. Abrahams V.M. // Thromb. Res. – 2009. – Vol.124. – P.521–525.
14. Banek C.T., Bauer A.J., Gingery A., Gilbert J.S. // Am. J. Physiol. Regul. Integr. Comp. Physiol. – 2012. – Vol.303, N6. – P.658–664.
15. Blajiс J., Dijakoviс A., Ivanisevic M. et al. // Gynaecol. Perinatol. – 2010. – Vol.19, N1. – P.10–15.
16. Bridges J.P., Gilbert J.S., Colson D. et al. // Am. J. Hypertens. – 2009. – Vol.22, N5. – P.564–568.
17. Bujold E., Morency A.M., Roberge S. et al. // J. Obstet. Gynaecol. Can. – 2009. – Vol.31, №9. – P.818–826.
18. Burton G.J., Charnock-Jones D.S., Jauniaux E. // Reproduction. – 2009. – Vol.138. – P.895 – 902.
19. Carp H. // Gynecol. Endocrinol. – 2012. – Vol.28, N12. – P.983–990.
20. Cruz A., Parnot C., Ribatti D. // J. Vasc. Res. – 2001. – Vol.123. – P.1–10.
21. Czajkowski K., Sienko J., Mogilinski M. et al. // Fertil. Steril. – 2007. – Vol.87, N3. – P.613–618.
22. Dubova E.A., Alieva L.B., Baibarina E.N. et al. // Bull. Exp. Biol. Med. – 2012. – Vol.153, N3. – P.389–392.
23. Dubova E.A., Pavlov K.A., Lyapin V.M. et al. // Bull. Exp. Biol. Med. – 2013. – Vol.154, N6. – P.792–795.
24. Fiore G., Florio P., Micheli L. et al. // J. Clin. Endocrin. & Metab. – 2005. – Vol.90, N7. – P.4205–4210.
25. Fu X.-D., Garibaldi S., Gopa S. et al. // Molec. Hum. Reprod. – 2012. – Vol. 18, N1. – P.44–51.
26. Gardosi J., Clausson B., Francis A. // BJOG. – 2009. – Vol.116. – P.1356–1363.
27. Gauer R., Atlas M. // J. Family Practice. – 2008. – Vol.57, N1. – P.54–56.
28. Goertz O., Ring A., Buschhaus B. et al. // Burns. – 2011. – Vol.37, N4. – P.656–664.
29. Han C.S., Mulla M.J., Brosens J.J. et al. // Obstet. Gynecol. – 2011. – Vol.118, N5. – P.1021–1028.
30. Hernandez-Hernandez O.T., Gonzalez-Garcia T.K., Camacho-Arroyo I. // J. Steroid Biochem. Mol. Biol. – 2012. – Vol.132, N1-2. – P.127–134.
31. Jacobs M., Nassar N., Roberts C.L. et al. // Reprod. Biol. Endocrinol. – 2011. – Vol.9, N77. – P.1–8.
32. Lakhkar B.N., Ahamed S.A. // Indian J. Radiol. Imaging. – 1999. – Vol.9. – P.119–125.
33. Lamarca B. // Minerva Ginecol. – 2012. – Vol.64, N4. – P.309–320.
34. Lockwood C.J., Paidas M., Murk W.K. et al. // Thromb. Res. – 2009. – Vol.124, N5. – P.516–520.
35. Lockwood C.J., Toti P., Arcuri F. et al. // Am. J. Pathol. – 2007. – Vol.170, N4. – P.1398–1405.
36. Maeda S., Miyauchi T., Goto K. // Nihon. Rinsho. – 2006. – Vol.64, №5. – P.112–116.
37. Marx S.G., Wentz M.J., Mackay L.B. et al. // J. Histochem. Cytochem. – 2006. – Vol.54, N6. – P.623–639.
38. Maynard S.E., Min Y.H., Merchan J. et al. // J. Clin. Invest. – 2003. – Vol. 11. – P.649–658.
39. Meher S., Alfirevic Z. // JUOG. – 2013. – Vol.41, N5. – P.479–485.
40. Munaut C., Lorquet S., Pequeux C. et al. // Human Reproduction. – 2008. – Vol.23, N6. – P.1407–1415.
41. Murphy S.R., LaMarca B.B.D., Cockrell K., Granger J.P. // Hypertension. – 2010. – Vol.55, N2. – P.394–398.
42. Nadar S., Blann A.D., Lip G.Y. // Am. J. Hypertens. – 2006. – Vol.19, N9. – P.970–977.
43. Nagi A.H. // Biomedica. – 2011. – Vol. 27. – P.81–99.
44. Odorisio T., Schietroma C., Zaccaria M.L. et al. // J. Cell Science. – 2002. – Vol. 115, N12. – P.2559–2567.
45. Pijnenborg, R., Brosens I., Romero R. Placental bed disorders: basic science and its translation to obstetrics. – Cambridge University Press, 2010. – 320 p.
46. Regnault T.R.H., de Vrijer B., Galan H.L. et al. // J. Physiol. – 2003. – Vol. 550. – P.641–656.
47. Roberge S., Nicolaides K.H., Demers S. et al. // JUOG. – 2013. – Vol.41, N5. – P.491–499.
48. Roberts J.M., Taylor R.N., Goldfien A. // Am. J. Hypertens. – 1991. – Vol.4. – P.700–708.
49. Ruano R., Fontes R.S., Zugaib M. // Clinics. – 2005. – Vol.60, N5. – P.407–414.
50. Salcedo R., Zhang X., Young H.A. et al. // Blood. – 2003. – Vol. 102, N6. – P.1966–1977.
51. Schror K. // Best Pract. Res. Clin. Gastroenterol. – 2011. – Vol.25, N4-5. – P.473–484.
52. Searle J., Mockel M., Gwosc S. et al. // Arterioscler. Thromb. Vasc. Biol. – 2011. – Vol.31, N12. – P.2972–2974.
53. Sebire N.J., Sepulveda W. // J. Clin. Pathol. – 2008. – Vol.61. – P.1276–1284.
54. Shimojo N., Jesmin S., Zaedi S. et al. // Am. J. Physiol. Heart Circ. Physiol. – 2007. – Vol.293. – P.474–481.
55. Simoncini T., Caruso A., Giretti M.S. et al. // Fertil. Steril. – 2006. – Vol.86, Suppl.4. – P.1235–1242.
56. Siriwachirachai T., Piriyasupong T. // Thai J. Obstet. Gynaecol. – 2011. – Vol.19. – P.97–104.
57. Soto E., Romero R., Kusanovic J.P. et al. // J. Matern. Fetal. Neonatal. Med. – 2012. – Vol.25, N5. – P.498–507.
58. Spinella F., Rosano L., Di Castro V. et al. // J. Biol. Chemist. – 2002. – Vol.277, N31. – P.27850–27855.
59. Straughen J.K., Kumar P., Misra V.K. // J. Matern. Fetal. Neonatal. Med. – 2012. – Vol.25, N10. – P.1879–1883.
60. Takahashi H., Shibuya M. // Clin. Science. – 2005. – Vol.109. – P.227–241.
61. Van Oppenraaij R.H.F., Jauniaux E., Christiansen O.B. et al. // Hum. Reprod. Update. – 2009. – Vol.15, N4. – P.409–421.
62. Veas C.J., Aguilera V.C., Munoz I.J. et al. // J. Matern. Fetal Neonatal Med. – 2011. – Vol.24, N11. – P.1371–1377.
63. Zhao Y., Koga K., Osuga Y. et al. // Fertil. Steril. – 2012. – Vol.98, N4. – P.917–921.
Медицинские новости. – 2014. – №3. – С. 63-67.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.