Krastsialiova I.M.1, Shishko G.A.1, Seuruk O.V.2, Timoshina L.A.2
1Belarusian Medical Academy of Post-Graduate Education, Minsk
2National Research Center «Mother and child», Minsk, Belarus
Problems in the treatment of hemorrhagic disease in newborns
Резюме. На основании литературных данных и результатов собственных наблюдений проанализированы причины недостаточной терапевтической эффективности свежезамороженной плазмы при лечении геморрагической болезни новорожденных. Установлено, что отсутствие эффекта от плазмотрансфузии компенсируется назначением концентрата протромбинового комплекса, обеспечивающего быструю нормализацию витамин К-зависимых факторов.
Ключевые слова: геморрагическая болезнь новорожденного, новорожденные, концентрат протромбинового комплекса, свежезамороженная плазма.
Медицинские новости. – 2014. – №9. – С. 60–62.
Summary. On the basis of the literary data and the results of own observations, authors analyze the reasons of insufficient therapeutic efficiency of fresh frozen plasma at treatment of hemorrhagic disease of newborn. It is established that the insufficient effect of plasma transfusions is compensated by using of prothrombin complex concentrate (PCC), increasing quickly the level of the vitamin K-dependent clotting factors.
Keywords: hemorrhagic disease of newborn, newborn, prothrombin complex concentrate.
Meditsinskie novosti. – 2014. – N9. – P. 60–62.
В настоящее время у новорожденных актуальна проблема нарушений в системе гемостаза, сопровождающихся гипокоагуляцией. Наиболее часто эти нарушения встречаются у детей, нуждающихся в проведении интенсивной терапии, в том числе у недоношенных детей, у новорожденных, перенесших внутриматочную гипоксию, или рожденных в асфиксии. Нарушения в системе гемостаза следует рассматривать как общую патологическую закономерность тяжелых состояний новорожденных и фактор повышенного риска летальности и инвалидизации [1, 2].
Среди коагулопатий, специфичных для периода новорожденности, клинически проявляющихся развитием геморрагического синдрома и представляющих определенные сложности в прогнозировании, профилактике, диагностике и лечении, необходимо выделить кровотечения, обусловленные дефицитом витамина К (геморрагическая болезнь новорожденного, витамин К-дефицитные кровотечения).
Геморрагическая болезнь новорожденного или витамин К-дефицитные кровотечения (ВКДК) – заболевание детей в неонатальном периоде, проявляющееся повышенной кровоточивостью, связанной с нарушением протромбинообразования (дефицит факторов II фазы свертывания крови) вследствие недостаточности факторов коагуляции, активность которых зависит от содержания витамина К. Совокупность особенностей плазменного звена гемостаза у новорожденных в виде дефицита витамин К-зависимых факторов коагуляции (II, VII, IX, X), дефицита факторов контакта (XI, XII) в ассоциации с определенной незрелостью сосудисто-тромбоцитарного звена гемостаза предопределяют высокий риск геморрагических осложнений, особенно у недоношенных детей [3, 4].
ВКДК – патология преимущественно периода новорожденности, особенно это касается детей, находящихся исключительно на грудном вскармливании, но может встречаться и у детей более старшего возраста, особенно при наличии определенного патологического фона: синдром короткой кишки, дисбактериоз, генетические аномалии и др.
У новорожденных, не получавших профилактику витамином К сразу после рождения, частота ВКДК на первой неделе жизни составляет от 0,25 до 1,7%. Введение программ профилактики в странах Европы и Азии привело к снижению частоты поздних форм ВКДК с 4,4–7,2 до 1,4–6,4 на 100 000 рождений [4–6].
В Беларуси частота ВКДК составляет 3 случая на 1000 новорожденных. Ежегодно в Республике Беларусь от осложнений геморрагической болезни новорожденных умирает 5–15 детей (данные формы 32 за 2010–2011 гг.). Каждый год примерно у 150–200 новорожденных развиваются внутричерепные кровоизлияния, у 260–350 новорожденных – тяжелые кровотечения на фоне ВКДК.
Процесс свертывания крови лимитируется противосвертывающей или антикоагулянтной системой крови. Большинство факторов, а именно IXa, Xa, XIa и XIIа, тормозятся антитромбином III в присутствии гепарина. Протеин С, являясь также витамин К-зависимым фактором, регулирует свертывание крови, воздействуя на факторы Va и VIIIa и рассматривается как основной компонент антикоагулянтной системы [7]. Протеин S поддерживает антикоагулянтную активность протеина С.
Пролонгирование протромбинового времени (ПТВ) до 16 секунд (чувствительность 0,7, специфичность 0,57, при положительной прогностической значимости 0,62), а также удлинение АПТВ (активированное парциальное тромбопластиновое время) до 55 секунд (чувствительность 0,8, специфичность 0,95, при положительной прогностической значимости 0,8) сопровождается высоким риском геморрагического синдрома [8].
Констатация у пациента гипокоагуляции и латентной формы геморрагического синдрома является однозначным показанием к коррекции гемостазиологических нарушений. Лечение геморрагической болезни включает назначение витамина К1 в дозе 1–10 мг внутривенно под контролем ПТВ и международного нормализованного отношения (МНО) через 2–4 часа после введения для оценки эффективности терапии. При отсутствии эффекта назначается свежезамороженная плазма (СЗП). В ряде случаев использование СЗП не дает стабильного эффекта.
Описание клинических случаев
витамин К-зависимых состояний
Случай 1. Ребенок О., мальчик, родился от 4 беременности, 2 родов, в сроке 281 день. У матери имелся отягощенный акушерский анамнез: 1 беременность – срочные роды, вес ребенка при рождении – 2500 г (маловесный к сроку гестации), 2 и 3 беременности – медицинский аборт. Экстрагенитальная патология матери – узловой зоб, двусторонняя нейросенсорная тугоухость. Беременность протекала на фоне ОРВИ с повышением температуры в сроке 34 недели; в 36 недель при ультразвуковом исследовании плода выявлен гидронефроз. Роды через естественные родовые пути, отмечен длительный безводный период, оценка по шкале Апгар при рождении – 8/8 баллов. Ребенок родился с массой тела 3480 г, длиной тела 52 см, окружность головы – 35 см, окружность грудной клетки – 34 см.
На 6 сутки ребенок переведен для дальнейшего обследования и лечения в ГУ РНПЦ «Мать и дитя» с диагнозом: врожденная аномалия мочевыделительной системы (ВАМС) – гидронефроз справа, мегалоуретер справа.
Диагноз при поступлении: ВАМС – гидронефроз справа, мегалоуретер справа; ОРИ (острый ринит); неонатальная желтуха неуточненная; церебральная ишемия средней степени тяжести.
Результаты обследования плаценты: зрелая плацента, мелкоочаговый серозный хориодецидуит.
До 16 суток жизни у ребенка отмечалась плоская весовая кривая, частое отхождение неизмененного по цвету и консистенции стула. Тест с лактазной нагрузкой выявил наличие лактазной недостаточности, в связи с чем ребенок был переведен на питание безлактозной молочной смесью. После этого он начал набирать массу тела с ее восстановлением к 18 суткам жизни.
На 23 сутки жизни у ребенка в стуле появилась примесь свежей крови. Консилиум коллегиально выставил диагноз:
Основной: Внутриутробная инфекция неуточненная.
Осложнения: Геморрагическая болезнь, поздняя форма. Кишечное кровотечение. Синдром эндогенной интоксикации. Лимфаденопатия. ИДС.
Сопутствующий диагноз: Лактазная недостаточность. ВАМС: гидронефроз справа. Мегалоуретер справа. ОРИ (ринит, затяжное течение). Омфалит новорожденного. Церебральная ишемия средней степени.
Проведено обследование: коагулограмма (табл. 1), общий анализ крови, анализ кислотно-основного состояния (КОС), кал на скрытую кровь, биохимический анализ крови, ультразвуковое исследование органов брюшной полости. В общем анализе крови выявлен лейкоцитоз (20,5?109/л), эритроциты – 5,0?1012/л, гемоглобин – 164 г/л, тромбоциты – 606?109/л (тромбоцитоз). КОС: рН-7,4, рО2 – 76,5 мм рт. ст., рСО2 – 33,5 мм рт. ст., лактат – 3,2 ммоль/л, глюкоза – 4,5 ммоль/л, АВЕ – 1,0 ммоль/л. Отменено энтеральное питание. К лечению добавлены этамзилат 0,3 мл в/в, инфузионная терапия, концентрат протромбинового комплекса 10 мл в/в однократно.
Таблица 1. Данные коагулограммы пациента О. в динамике
|
Показатель
|
Дни жизни
|
Референтные значения [1]
|
|
23 день
|
24 день
|
26 день
|
|
АЧТВ, с
|
72,1
|
Не определяется
|
62,1
|
40–50
|
|
ПВ, с
|
16,8
|
16,0
|
16,8
|
15–19
|
|
Активность по Квику, %
|
54
|
63,3
|
54
|
|
|
МНО, с
|
1,204
|
1,138
|
1,204
|
0,53–1,26
|
|
ТВ, с
|
28,8
|
Не определяется
|
29,2
|
13–21
|
|
Фибриноген, г/л
|
6,0
|
5,0
|
5,4
|
2–4
|
В коагулограмме при возникновении геморрагического синдрома (23 сутки жизни) отмечаются: удлинение АЧТВ, тромбинового времени (ТВ), повышение уровня фибриногена. В динамике после однократного внутривенного введения концентрата протромбинового комплекса произошла стабилизация клинического состояния пациента, нормализация данных коагулограммы.
Следующий клинический случай – пример рецидивирующего желудочного кровотечения у ребенка с экстремально низкой массой тела с сепсисом и гипокоагуляцией на фоне лечения СЗП.
Случай 2. Ребенок А., девочка, родилась 24.11.2010 г. путем экстренного кесарева сечения от 4 беременности, 3 родов, осложнившихся преждевременной отслойкой плаценты, тугим обвитием пуповины вокруг шеи, в сроке гестации 25–26 недель. Беременность протекала на фоне хронического пиелонефрита, дисплазии шейки матки, осложненная краевым предлежанием плаценты. Околоплодные воды зеленые, окрашенные кровью. Оценка по Апгар 1/ИВЛ. Вес при рождении 600 г, длина 29 см. С рождения ребенок находился на ИВЛ, проводилась кардиотоническая поддержка. С 26.11.10 состояние ухудшилось до крайне тяжелого за счет легочного кровотечения. Переливалась отмытые эритроциты, СЗП, тромбоцитарный концентрат. Кровотечение было купировано, состояние ребенка стабилизировалось, однако в дальнейшем оставалось очень тяжелым за счет дыхательной недостаточности и тяжелого поражения ЦНС, судорожного синдрома. На фоне ДВС-синдрома сформировалось внутрижелудочковое кровоизлияние (ВЖК) 4 степени с последующим формированием окклюзионной гидроцефалии, был поставлен вентрикулосубгалеальный дренаж.
Клинический диагноз: Внутриутробный сепсис, бронхолегочная дисплазия тяжелой степени тяжести. Постгеморрагическая окклюзионная гидроцефалия, состояние после вентрикулосубгалеального шунтирования. Судорожный синдром, внутрижелудочковое кровоизлияние 4 в стадии лизиса.
25.02.11 в возрасте 3 месяцев 2 дней состояние ребенка ухудшилось. 28.02.11 ребенок повторно был переведен в отделение реанимации с клиникой желудочного кровотечения из отделения для недоношенных новорожденных, где он выхаживался. Состояние при поступлении тяжелое. Кожа бледно-розовая, слизистые чистые. Дыхание симметричное, проводится по всем полям. Дыхательная недостаточность 1 ст. Пульс 170 ударов в минуту. Артериальное давление 68/46 мм рт. ст. Тоны сердца ритмичные. Живот мягкий, перистальтика удовлетворительная, содержимое желудка в виде «кофейной гущи». Была проведена декомпрессия желудка, поставлен зонд, прекращено энтеральное питание.
После проведенной трансфузии СЗП кровотечение было купировано, однако в последующем оно повторялось трижды. Проводимая плазмотрансфузия не обеспечила нормализацию показателей гемостаза, в связи с чем 21.04.11 было принято решение об использовании концентрата протромбинового комплекса внутривенно: первая доза – 5–6 мл/кг, вторая – 3–4 мл/кг, третья – 3–4 мл/кг c интервалом введения 6 часов. Применение концентрированных факторов протромбинового комплекса обеспечило положительный клинико-лабораторный результат (рис. 1).
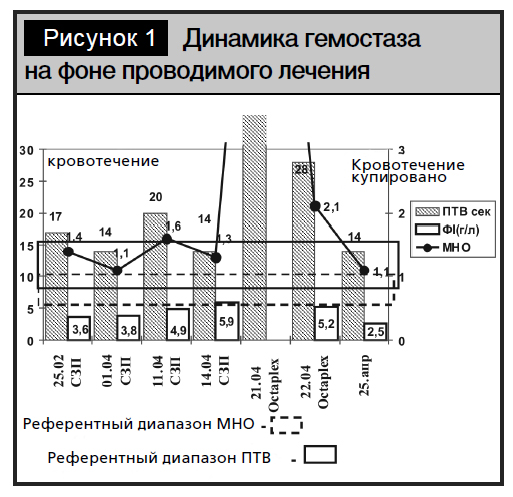
В табл. 2 представлена динамика изменений коагулограммы пациента А.
Таблица 2. Данные коагулограммы пациента А. в динамике
|
Показатель
|
25.04.2011
|
26.04.2011
|
28.04.2011
|
Референтные значения*
|
|
АЧТВ, с
|
36,9
|
33,1
|
44,8
|
40–50
|
|
ПВ, с
|
13,9
|
44,2
|
16,9
|
15–19
|
|
Активность по Квику, %
|
64,4
|
60,6
|
39,5
|
|
|
МНО, с
|
1,145
|
1,171
|
1,40
|
0,53–1,26
|
|
ТВ, с
|
18,0
|
19
|
38,0
|
13–21
|
|
Фибриноген, г/л
|
2,5
|
2,8
|
4,9
|
2–4
|
Исходя из изложенного выше, мы считаем, что ранняя и своевременная диагностика нарушений гемостаза в комплексе с ультразвуковыми (нейросонография) и рентгенологическими (компьютерная томография мозга) методами исследования до появления клинических признаков церебральных кровоизлияний (или на этапе минимальных проявлений) – необходимая предпосылка успешной патогенетической терапии и профилактики инвалидизирующих последствий. Исследования системы гемостаза должны стать ургентным и рутинным методом мониторинга в программе обследования новорожденного ребенка, требующего интенсивной терапии.
Упорное, остро возникшее кровотечение, представляющее угрозу для жизни, – показание к использованию препаратов концентрата протромбинового комплекса с протеинами C и S для нормализации уровней факторов коагуляции, которые не всегда могут быть достигнуты при переливании свежезамороженной плазмы, которая не гарантирует стабильный клинический и лабораторный эффект. Это может быть связано с недостаточным коагуляционным потенциалом донорской плазмы, поскольку коагуляционный потенциал очень разнится не только у представителей разных возрастных групп, но и в пределах совокупности людей одного возраста [9] (рис. 2).
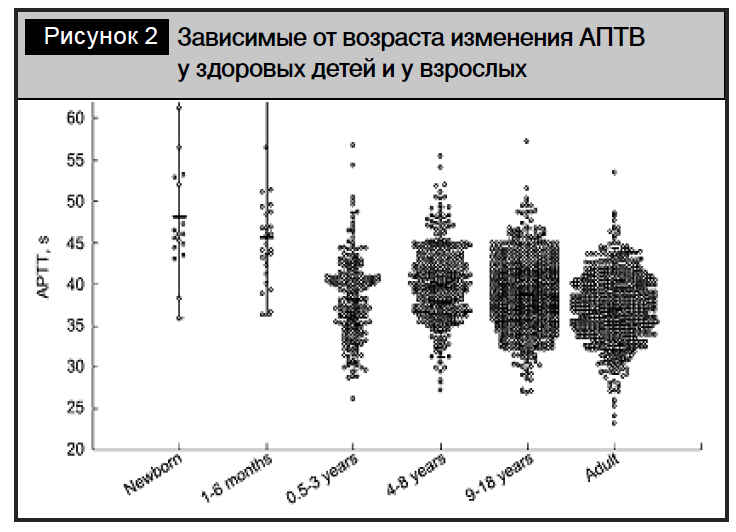
Вследствие этого концентрация факторов свертывания в донорской плазме может оказаться недостаточной для лечения геморрагического синдрома у новорожденного ребенка. B cлучае глубокого дефицита факторов свертывания, обычно сопровождающего тяжелые формы геморрагической болезни новорожденных, может потребоваться трансфузия значительных объемов СЗП, что сложно выполнить со скоростью, достаточной для эффективной остановки кровотечения без развития серьезных посттрансфузионных осложнений.
В таких случаях решением проблемы может стать назначение концентрата протромбинового комплекса. Концентрат протромбинового комплекса содержит II, VII, IX, X факторы свертывания и протеины С и S. Переливание концентрата протромбинового комплекса не только исправляет дефицит факторов коагуляции более быстро и эффективно, чем свежезамороженная плазма, но также обусловливает более низкий уровень объемной перегрузки и минимальный риск вирусной передачи [10]. Коагуляционные тесты после применения концентрата протромбинового комплекса показывают повышение протромбиновой активности от 19% (INR 2.9) до 54% (INR 1.5). Такая технология позволяет получить концентрацию II, VII, IX и X факторов свертывания в 25 раз выше, чем в плазме [11].
Л И Т Е Р А Т У Р А
1. Дати, Ф. Белки. Лабораторные тесты и клиническое применение / Ф.Дати, Э.Метцман / пер. с англ. – М.: Лабора, 2007. – 560 с.
2. Дмитриев, В.В. Диагностика и терапия нарушений гемостаза у детей: метод. рекоменд. / В.В.Дмитриев, Г.А.Шишко, Н.С.Богданович. – Минск, 2000. – 59 с.
3. Шабалов, Н.П. Основы перинатологии / Н.П.Шабалов, Ю.В.Цвелев. – М., 2002. – 575 с.
4. Darlow, B.A., Phillips, A.A., Dickson, N.P. New Zealand surveillance of neonatal vitamin K deficiency bleeding (VKDB): 1998-2008 // J. Paediatr. Child. Health. – 2011. – Vol.47(7). – 460–464. [Medline].
5. Ozdemir, M.A. Late-type vitamin K deficiency bleeding: experience from 120 patients / M.A.Ozdemir [et al.] // Childs Nerv. Syst. – 2012. – Vol.28(2). – P.247–251. [Medline].
6. Takahashi, D. Vitamin K prophylaxis and late vitamin K deficiency bleeding in infants: fifth nationwide survey in Japan / D.Takahashi [et al.] // Pediatr. Int. – 2011. – Vol.53(6). – P.897–901. [Medline].
7. Дмитриев, В.В. Практическая коагулология / В.В.Дмитриев. – Мн.: Бел.наука. – 2004. – 544 с.
8. Tan K., Booth D., Newell Sj. et al. Point-of-Care Testing of Neonatal Coagulation // Clin. Lab. Haematol. – 2006. – Vol.28(2). – P.117–121.
9. Jianxin Li, Xin Lai, Cunliang Yan et al. Age-associated developmental change activated Partial thromboplastin time (APTT) and causes of prolonged APTT values in healthy Chinese children Introduction // Clin. Chem. Lab. Med. – 2009. – Vol.47 (12). – P.1531–1537.
10. Meeks S.L., Abshire T.C. Abnormalities of prothrombin: a review of the pathophysiology, diagnosis, and treatment // Haemophiliа. – 2008. – Vol.14. – P.1159–1163.
11. Franchini M., Lippi G. Prothrombin complex concentrates an update // Blood Transfus. – 2010. – Vol.8. – P.149–154.
Медицинские новости. – 2013. – №9. – С. 60-62.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.