Davidouskaya A.1, Ruzanau D.2, Baranouskaya T.1
1Belarusian Medical Academy of Post-Graduate Education, Minsk, Belarus
2Gomel State Medical University, Belarus
Ciclesonide (Alvesco®) in the treatment of bronchial asthma:
lessons learned in adults
Резюме. Представлены данные об эффективности и безопасности применения циклесонида в лечении бронхиальной астмы с учетом фармакологических свойств препарата, доказательной базы и собственного клинического опыта. Клиническое наблюдение включало 46 взрослых пациентов с бронхиальной астмой, 28 из них со среднетяжелым течением заболевания. В качестве базисной терапии всем был назначен циклесонид, длительность терапии составила 5±1,2 месяца. В клиническом наблюдении продемонстрированы эффективность и безопасность циклесонида, что позволило добиться хорошего клинического результата при высокой приверженности к лечению.
Ключевые слова: бронхиальная астма, циклесонид, степень контроля, клиническая эффективность, безопасность.
Медицинские новости. – 2015. – №2. – С. 62–64.
Summary. The article presents data on the effectiveness and safety of using ciclesonide in the treatment of bronchial asthma with regard to the pharmacological properties of the drug, the evidence and their own clinical experience. Clinical follow-up consisted of 46 adult patients with bronchial asthma, 28 of them with moderate disease. As a basic therapy was assigned ciclesonide, the duration of therapy was 5±1.2 months. In clinical observation demonstrated the efficacy and safety ciclesonide, which resulted in a good clinical outcome with high compliance.
Keywords: bronchial asthma, ciclesonide, degree of control, clinical efficacy, safety.
Meditsinskie novosti. – 2015. – N2. – P. 62–64.
Бронхиальная астма (БА) относится к числу широко распространенных хронических заболеваний органов дыхания и остается важной медико-социальной проблемой. Несмотря на значительные успехи в ее лечении в последние десятилетия, астма оказывает значительное влияние на качество жизни как пациентов, так и их семей и требует значимых затрат на лечение. Достижение и поддержание контроля над заболеванием, предупреждение обострений, отсутствие побочных эффектов, связанных с применением лекарственных средств являются основными целями фармакотерапии.
В международных и национальных рекомендациях, а также в клинических протоколах лечения БА четко сформулирована стратегия ступенчатой базисной терапии [1, 6]. Противовоспалительная базисная терапия позволяет контролировать симптомы болезни, уменьшает частоту обострений и число госпитализаций, снижает гиперреактивность бронхов и улучшает вентиляционную функцию легких, снижает потребность в симптоматической терапии и повышает качество жизни пациентов. Вот уже более 40 лет препаратами первой линии в лечении персистирующей БА любой степени тяжести остаются ингаляционные глюкокортикостероиды (ИГКС). Все ИГКС в эквивалентных дозах обладают существенными преимуществами перед системными стероидами, сочетая высокую эффективность и безопасность проводимого лечения. Выбор осуществляется индивидуально в зависимости от клинической ситуации и доступности лекарственных средств. Терапевтический индекс, или соотношение эффективность/безопасность, определяется фармакокинетическими и фармакодинамическими свойствами ИГКС, устройством для их доставки и техникой ингаляции, а также приверженностью пациентов рекомендуемой терапии.
В последние годы в клинической практике появился новый экстрамелкодисперсный ИГКС с высокой местной противовоспалительной активностью и улучшенным фармакокинетическим профилем – циклесонид (торговое наименование Альвеско®). В 2012 г. циклесонид включен в клинические протоколы лечения БА в Республике Беларусь [1].
Негалогенизированный ИГКС циклесонид обладает рядом фармакологических преимуществ:
1. Циклесонид – пролекарство и проявляет биологическую активность после превращения в легочной ткани в активный метаболит дезциклесонид. Это значительно уменьшает вероятность и степень выраженности местных (орофарингеальный кандидоз, осиплость голоса) нежелательных эффектов (НЭ), связанных с внелегочным (системным) действием ИГКС [2, 8, 9]. При этом для циклесонида характерно более высокое депонирование в легких – 52%, по сравнению с 16% у флутиказона и 18–29% у будесонида [4, 7].
2. Активный метаболит дезциклесонид обладает высоким сродством к глюкокортикоидным (ГК) рецепторам и, как следствие, выраженным ГК-эффектом, реализующимся через активацию противовоспалительных генов и торможение транскрипции провоспалительных генов.
3. Для дезциклесонида характерна высокая степень (98,4–99%) связывания с белками плазмы крови, что обеспечивает низкую (меньше или равно 1,5%) фармакологически активную фракцию препарата, поступающего в кровоток (таблица). Для профилактики системных НЭ ИГКС степень связи препарата с белками плазмы крови имеет большое значение, так как активна только свободная фракция препарата. Кроме того, высокая связь с белками плазмы предотвращает поступление ИГКС в ткани. Циклесонид и дезциклесонид обладают высоким клиренсом (объем плазмы крови, который очищается от препарата за единицу времени) – 152 и 225 л/ч соответственно [7, 9]. Все это препятствует развитию системных нежелательных эффектов.
Таблица. Связывание ингаляционных глюкокортикостероидов с белками плазмы [2, 7, 8, 9].
|
ИГКС
|
Степень связывания с белками плазмы (%)
|
|
Беклометазон
|
87
|
|
Будесонид
|
88
|
|
Флутиказон
|
90
|
|
Дезциклесонид
|
99
|
4. За счет обратимой эстерификации (образованию эфиров жирных кислот), которые отличаются высокой липофильностью, значительно превышающей таковую у других ИГКС, дезциклесонид формирует внутриклеточные депо в легочной ткани [7]. Конъюгация с длинноцепочечными жирными кислотами является важной особенностью препарата. При снижении концентрации свободного дезциклесонида в клетке активируются внутриклеточные липазы, которые высвобождают из эфиров жирных кислот дезциклесонид. Высвобождающийся препарат вновь связывается с ГК-рецептором. Данный механизм способствует пролонгированию противовоспалительного эффекта, делает возможным назначение препарата 1 раз в сутки и является не менее значимым фактором, определяющим активность дезциклесонида, чем его сродство к рецептору.
5. Доказана связь недостаточного контроля БА с персистирующим воспалительным процессом на уровне мелких бронхов, внутренний диаметр которых составляет менее 2 мм [4, 5]. Лишь некоторые препараты достигают дистальных отделов мелких дыхательных путей. Максимальная доля мелкодисперсных частиц – существенная характеристика лекарственного средства для ингаляционного введения. Поэтому важным фактором, определяющим эффективность ИГКС, является способ ингаляционной доставки препарата. Доставка лекарственного средства и его депозиция в мелких бронхах зависят от доли мелкодисперсных частиц в общем объеме ингалируемого препарата. Используемый для доставки циклесонида дозированый аэрозольный ингалятор с HFA-пропеллентом (Альвеско®) способен генерировать высокий процент частиц размером менее 1,1 мкм. Это обеспечивает депозицию препарата и реализацию его противовоспалительного действия на уровне мелких дыхательных путей (рисунок) [11].
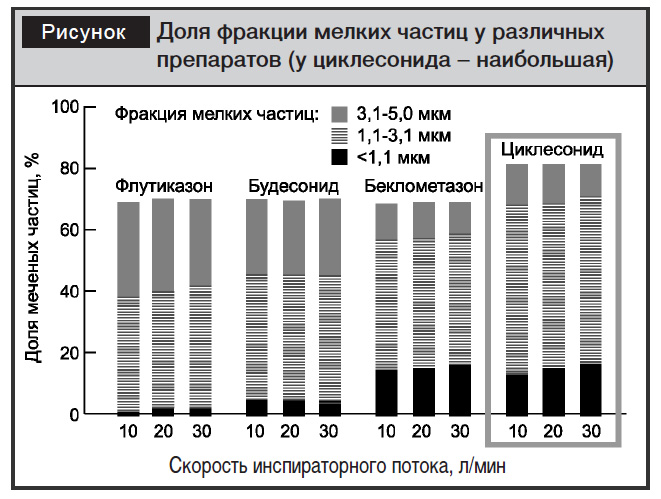
Опубликованы результаты ряда рандомизированных сравнительных клинических исследований, в которых продемонстрирована эффективность циклесонида в лечении БА различной степени тяжести. Так, например, в сравнительном исследовании у 111 пациентов в возрасте от 18 до 75 лет оценивали эффективность применения циклесонида и флутиказона пропионата. Переменными первичной эффективности было процентное соотношение дней с контролем астмы, дней без симптомов астмы, дней без приема препаратов и дней без ночных просыпаний. Авторы пришли к выводу, что циклесонид в дозе 160 мкг 1 раз в день эффективен так же, как флутиказона пропионат 250 мкг 2 раза в день (суточная доза 500 мкг)[8].
В сравнительном исследовании с участием 30 взрослых пациентов с легкой персистирующей БА изучалось влияние проводимой терапии на функцию мелких дыхательных путей и содержание эозинофилов в индуцированной мокроте. Пациенты были распределены на группы, принимавшие циклесонид 160 мкг 1 раз в сутки или флутиказона пропионата 100 мкг 2 раза в сутки в течение 8 недель. Полученные результаты показали, что циклесонид, по сравнению с флутиказоном, достоверно уменьшал степень эозинофильного воспаления, сопротивление МБ и их гиперреактивность [9].
Сравнение частоты местных нежелательных явлениий (орального кандидоза и дисфонии) у 528 пациентов со среднетяжелой и тяжелой БА в возрасте 12–75 лет при проведении терапии циклесонидом (640 мкг) и флутиказона пропионатом (660 мкг/сут) в течение 6 месяцев показало, что в группе циклесонида достоверно реже возникали местные нежелательные эффекты [14].
В исследовании Ukena D. и соавт. у 399 пациентов с персистирующей БА средней степени тяжести оценивалось влияние циклесонида на легочную функцию по сравнению с будесонидом. Пациенты получали циклесонид 320 мкг 1 раз в сутки и будесонид 320 мкг 1 раз в сутки в течение 12 недель. Первичным критерием эффективности была ОФВ1; вторичные критерии – пиковая скорость выдоха (ПСВ), форсированная жизненная емкость легких (ФЖЕЛ), баллы астматических симптомов, использование средств резервной терапии. Как Альвеско, так и будесонид значительно улучшили все вторичные переменные эффективности по сравнению с исходными показаниями (p<0,0001 по сравнению с исходными показаниями для всех). Различия в группах с разными вариантами лечения были значительными в ФЖЕЛ и ПСВ в пользу Альвеско (p=0,034 и 0,019 соответственно). Также значительно сократилось количество симптомов астмы и применения средств экстренной терапии (p<0,0001 по сравнению с исходными показаниями для всех) без значительных различий между группами. Действие Альвеско проявилось на третий день посредством улучшения утренней ПСВ (p=0,004), а будесонид не изменил утреннюю ПСВ до второй недели применения (p=0,0001). Выводы данного исследования: Альвеско в дозе 320 мкг 1 раз в день превосходит будесонид в дозе 320 мкг 1 раз в день в улучшении функции легких у пациентов с персистирующей астмой. Альвеско сравним с будесонидом в отношении улучшения симптомов астмы и сокращения применения средств экстренной терапии. Более того, Альвеско демонстрирует более быстрое действие со статистически значимым улучшением утренней ПСВ уже на третий день, а будесонид только на второй неделе. В настоящем исследовании оба варианта лечения были безопасными и хорошо переносились [12].
В плацебо-контролируемом исследовании с участием 141 больного с тяжелой персистирующей стероидзависимой БА взрослого и подросткового возраста (?12 лет) пациенты получали циклесонид (640 мкг/сут, или 1280 мкг/сут, или плацебо в течение 12 недель). Еженедельно проводили обследование пациентов для определения показаний к снижению дозы преднизолона. Полученные результаты продемонстрировали, что переход с различных ИГКС в высокой дозе на циклесонид 320 мкг или 640 мкг 2 раза в сутки достоверно уменьшал дозу перорального стероидного препарата в среднем на 62,5%. Было также показано, что в группе циклесонида у 30% пациентов преднизолон отменили; у 85,4% пациентов дозу стероидного препарата уменьшили; ОФВ1 достоверно не снижался; подавление кортизола в сыворотке было значительно меньше по сравнению с исходным значением. Таким образом, добавление циклесонида в высоких дозах к терапии ИГКС приводит к раннему и продолжительному снижению дозы стероидного препарата. Это позволяет поддерживать контроль БА при минимальном системном воздействии [13].
В Республике Беларусь Альвеско присутствует на фармацевтическом рынке с 2011 г., что позволило нам получить собственный клинический опыт по ведению БА с использованием циклесонида. На базе трех клинических центров (пульмонологические отделения Минской областной клинической больницы, 10-й городской клинической больницы Минска и Гомельской областной противотуберкулезной клинической больницы) в 2013–2014 гг. наблюдались 46 взрослых пациентов с БА (27 женщин и 19 мужчин, средний возраст 47,8±4,2 года). 18 пациентам с легкой персистирующей астмой назначался циклесонид в дозе 160 мкг 1 раз в сутки; 22 пациентам с впервые установленной среднетяжелой БА и 6 пациентам со среднетяжелой частично контролируемой или неконтролируемой астмой и давностью заболевания от 2 до 6 лет был назначен циклесонид в дозе 640 мкг 1 раз в сутки. Длительность терапии наблюдения составила 5±1,2 месяца. Контрольное обследование проводилось спустя 1 месяц (для всех пациентов), 3 месяца (38 пациентов) и 6 месяцев (8 пациентов) терапии. Оценивались общеклинические параметры, показатели спирометрии, пиковой скорости выдоха, потребность в ситуационной терапии и степень контроля заболевания по опроснику контроля астмы.
Четыре пациента со среднетяжелой БА на протяжении первого месяца наблюдения продолжали использовать в качестве ситуационной терапии сальбутамол (100–200 мкг 1–3 раза в неделю), еще три пациента ингалировали 200 мкг сальбутамола ежедневно утром перед ингаляцией циклесонида. Спустя 3 месяца терапии в 45 случаях (98%) были достигнуты все критерии контроля БА. Приверженность приему препарата составила 100%, нежелательные эффекты за время наблюдения отмечены не были.
Таким образом, сочетание высокой эффективности и безопасности циклесонида, а также возможность применения препарата 1 раз в сутки позволяют добиться лучшего клинического результата – лучшего контроля БА при высокой приверженности к лечению. Альвеско®(циклесонид) открывает новые возможности для применения ИГКС в качестве базисной терапии БА любой степени тяжести для обеспечения полного контроля заболевания, в том числе среднетяжелого частично контролируемого или неконтролируемого варианта течения данной социально значимой патологии.
Л И Т Е Р А Т У Р А
1. Приказ МЗ РБ №768 от 05.07.2012. Клинические протоколы диагностики и лечения бронхиальной астмы. http://minzdrav.gov.by/ ru/static/ spavochnoinfirm/ protololy_lechenia/ protokoly_2012
2. Baptist A.P., Reddy R.C. // J. Clin. Pharm. Ther. – 2009. – Vol.34. – P.1–12.
3. Bateman E.D., Linnhof A.E., Homik L. et al. // Pulm. Pharmacol. Ther. – 2008. – Vol.21(2). – P.264–275.
4. Burgel P.-R. // Eur. Respir. Rev. – 2011. – Vol.20, N119. – Р.23–33.
5. Cohen J., Douma W.R., ten Hacken N.H.T. et al. // Eur. Respir. J. – 2008. – Vol.31. – Р.1213–1220.
6. GINA 1993–2013. Global Initiative for the diagnosis and management of asthma. – www. ginasthma.org
7. Mutch E., Nave R., McCracken N. et al. // Biochem. Pharmacol. – 2007. – Vol.73, N10. – P.1657–1664.
8. Knox A., Langan J., Martinot J.-B. et al. // Curr. Res. Med. Opin. J. – 2007. – Vol.23, N10. – P.2387–2394.
9. Hoshino M. Comparison of effectiveness in ciclesonide and fluticasone propionate on small airway function in mild asthma. Allergol Int. – 2010. – Vol.59, N1. – P.59–66
10. Berg A. et al. // Pediatr. Allergy Immunol. – 2007. – Vol.18. – P.391.
11. de Vries T.W. et al. // Respir. Med. – 2009. – Vol.103. – P.1167.
12. Ukena D., Biberger C., Steinijans V. et al. // Pulm. Pharmacol. Ther. – 2007. – Vol.20, N5. – P.562–570.
13. Bateman E., Karpel J., Casale T. et al. // Chest. – 2006. – Vol.129. – P.1176–1187.
14. Bateman E.D., Linnhof A.E., Homik L. et al. // Pulm. Pharmacol. Ther. – 2008. – Vol.21, N2. – P.264275
Медицинские новости. – 2015. – №2. – С. 62-64.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.