Karazei E.A.
Belarusian Medical Academy of Post-Graduate Education, Minsk
Proton pump inhibitors in the treatment of acid peptic disorders:
focus on Esomeprazole
Резюме: Кислотозависимые заболевания (КЗЗ) широко распространены в популяции и занимают лидирующее место среди болезней органов пищеварения. С ними приходится сталкиваться врачам различных специальностей. КЗЗ объединяет общее патогенетическое звено – кислотная агрессия желудочного сока, а в основе их лечения лежит антисекреторная терапия. Благодаря своей способности эффективно подавлять желудочную секрецию ингибиторы протонной помпы (ИПП) являются препаратами выбора при КЗЗ. В зависимости от конфигурации атомов молекулы ИПП в пространстве их разделяют на рацематы – смеси оптических изомеров и моноизомеры. Эзомепразол – первый ингибитор протонной помпы, синтезированный в виде чистого оптического изомера. Благодаря феномену стереоселективности он обладает некоторыми фармакокинетическими особенностями, обеспечивающими его высокую клиническую эффективность при КЗЗ. Сегодня на белорусском фармацевтическом рынке наиболее приемлемым с позиций высокого качества (производство по стандартам GMP) и успешного опыта применения в Республике Беларусь (с 2008 года) является эзомепразол производства компании «Pharmacare Int. Co» под торговым названием «Эзокар».
Ключевые слова: кислотозависимые заболевания, ингибиторы протонной помпы, эзомепразол.
Медицинские новости. – 2015. – №9. – С. 14–19.
Summary: Acid peptic disorders (APD) are widespread in the population and occupy a leading position among the diseases of the digestive system. The doctors of different specialties have to face them. APD share a common pathogenetic link – acid activity in the gastric secretions, that’s why the antisecretory therapy is the basis of their treatment. Proton pump inhibitors (PPIs), with their ability of effective inhibition of the gastric secretion, are the drugs of choice in the APD. Depending on the configuration of the atoms in the molecules of PPIs in the space PPIs are separated into racemates – mixtures of optical isomers and monoizomers. Esomeprazole – the first proton pump inhibitor, synthesized as a pure optical isomer. Due to the phenomenon of stereoselectivity it has some pharmacokinetic characteristics, providing its high clinical effectiveness in APD. Today, Esomeprazole by «Pharmacare Int. Co» (under the trade name «Ezocare») is the most acceptable one in the Belarusian pharmaceutical market in terms of high quality (compliance with GMP standards) and successful practical application in Belarus since 2008.
Keywords: acid peptic disorders, proton pump inhibitors, esomeprazole.
Meditsinskie novosti. – 2015. – N9. – P. 14–19.
Заболевания верхних отделов пищеварительного тракта, связанные с повреждающим воздействием соляной кислоты и пепсина на слизистую оболочку пищевода, желудка и двенадцатиперстной кишки (ДПК), называют кислотозависимыми [1]. К ним прежде всего относят гастроэзофагеальную рефлюксную болезнь (ГЭРБ), пептические язвы желудка и двенадцатиперстной кишки (ДПК), ассоциированные и не ассоци-ированные с Helicobacter pylori (H. рylori), симптоматические эндокринные язвы (синдром Золлингера – Эллисона, язвы при гиперпаратиреозе), функциональную диспепсию (чаще эпигастральный болевой синдром), а также гастропатии и дуоденопатии, обусловленные приемом нестероидных противовоспалительных препаратов (НПВП-гастропатии) и еще ряд заболеваний, синдромов и болезненных состояний, обозначенных в МКБ 10-го пересмотра [1].
Эта патология широко распространена среди взрослого населения. По материалам статистических исследований, ГЭРБ встречается у 40–50% взрослых. Клинические проявления в виде диспепсии отмечаются у 30–35% пациентов, из них на долю функциональных нарушений приходится до трети случаев. Пептические язвы выявляются у 5–10% обследованных. Гастро- и дуоденопатии формируются в 70% случаев на фоне длительного (более 6 недель) приема нестероидных противовоспалительных препаратов [1–3].
В основе развития кислотозависимой патологии верхних отделов желудочно-кишечного тракта лежат различные причины: дисбаланс между механизмами кислотопродукции и кислотонейтрализации, недостаточность кардиального или пилорического сфинктеров, иррациональное питание и злоупотребление алкоголем и др. Однако объединяет эту гетерогенную группу заболеваний общее патогенетическое звено – кислотно-пептическая агрессия желудочного сока.
Наличие соляной кислоты в желудочном соке доказал в 1823 г. английский врач и химик Уильям Праут. Спустя семьдесят лет, в 1893 г., итальянский гистолог и патолог Камилло Гольджи установил, что соляная кислота синтезируется париетальными клетками, расположенными в наружной части фундальных (главных) желез желудка. Общее количество таких клеток в желудке здорового человека около миллиарда [4]. Механизм секреции соляной кислоты париетальными клетками обусловлен наличием на их плазматической мембране белка – Н+/К+-АТФазы или «протонной помпы», которая является специфическим трансмембранным переносчиком ионов водорода. На начальном этапе с помощью энергии, полученной в результате гидролиза молекулы АТФ, осуществляется транспорт иона Н+ через апикальную мембрану из цитозоля париетальной клетки в просвет секреторного канальца в обмен на ион К+. Последующий выход ионов К+ из цитозоля сопряжен с выходом ионов Cl– по типу симпорта (транспорта двух веществ в одном направлении через один переносчик). В дальнейшем, уже в просвете канальцев, происходит взаимодействие ионов H+ и Cl– с образованием соляной кислоты. Кроме того, в секреции соляной кислоты задействованы переносчик ионов НСО3–/Cl– по типу антипорта (перемещение двух веществ в разных направлениях через один переносчик) и фермент карбоангидраза (рис. 1).
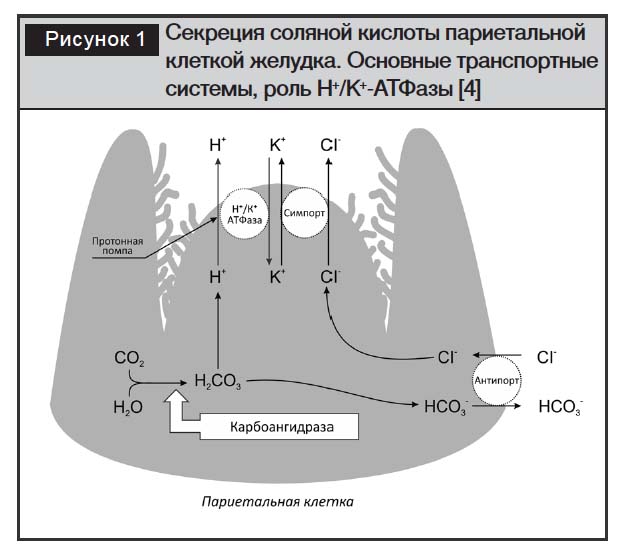
Процесс секреции непрерывен и регулируется нервной и эндокринной системами. В нем также принимают участие биогенные вещества – гистамин, гастрин, ацетилхолин – оказывающие стимулирующее действие на рецепторы париетальной клетки, что приводит к активации протонных помп. Соматостатин, простагландин и эпидермальный фактор роста, наоборот, подавляют кислотную продукцию [5].
Соляная кислота играет важную роль в процессах пищеварения, однако избыточная ее продукция в результате генетически детерминированного увеличения массы париетальных клеток, повышенного высвобождения гастрина в ответ на прием пищи, нарушения нейроэндокринной регуляции кислотообразования является сильным фактором агрессии, истощая возможности кислотопротекции различных структур желудочно-кишечного тракта и приводя к развитию КЗЗ [4].
Таким образом, выделение КЗЗ не только подчеркивает важное патогенетическое звено объединенных в особую группу болезней (гиперпродукция соляной кислоты), но и выделяет ведущую задачу терапии – снижение кислотопродукции.
Успех терапии КЗЗ напрямую зависит от степени и продолжительности повышения значений рН. Идеальным уровнем подавления желудочной секреции для большинства КЗЗ принято считать такой, при котором рН в желудке удерживается выше 4,0 в течение 16 часов в сутки или более. Так, для лечения ГЭРБ оптимальным является значение рН более 4, для эрадикации Helicobacter pylori – рН более 5 [6]. Добиться этой цели возможно только при использовании таких мощных кислотоснижающих препаратов, как ингибиторы протонной помпы.
Общая характеристика и механизм действия ИПП. На современном этапе в клинической практике используются следующие представители группы ИПП: омепразол, лансопразол, пантопразол, рабепразол, эзомепразол, представленные на фармацевтическом рынке Республики Беларусь, и декслансопразол.
ИПП являются производными бензимидазола, липофильными слабыми основаниями, в кислой среде секреторного канальца париетальной клетки образуют активную форму – тетрациклический сульфенамид, который необратимо (ковалентно с помощью дисульфидных связей), связывается с цистеином Н+/К+-АТФазы и блокирует транспорт иона водорода из париетальной клетки в просвет желудка до тех пор, пока не будет синтезирована новая молекула Н+/К+-АТФазы. Продолжительность эффекта блокирования зависит от скорости обновления протонных помп. Как правило, половина помп обновляется у взрослого человека в среднем за 30–48 часов [3]. Прием ИПП натощак или перед едой обеспечивает достижение пиковой концентрации препарата в крови к тому времени, когда наибольшее количество протонных помп активировано. Время суток, когда пациент должен принимать ИПП, зависит от того, каким КЗЗ он страдает. Пациентам с ГЭРБ, в патогенезе которой наиболее значима дневная секреция, и особенно после приема пищи, необходимо принимать ИПП до завтрака с целью обеспечения наилучшего подавления желудочной секреции днем. При проведении антихеликобактерной терапии ИПП назначаются обязательно два раза в день (утром и вечером), так как только в этом случае достигается примерно равное подавление желудочной секреции в дневные и ночные часы, что важно для действия антибактериальных препаратов, применяемых в схемах тройной терапии. Так, и амоксициллин и кларитромицин быстро теряют свою активность в кислой среде, поэтому чем сильнее подавляется желудочная секреция, тем дольше, а значит, и эффективнее они действуют на H. pylori. Также при выраженном подавлении секреции часть популяции H. pylori, находящаяся в теле желудка, переходит из покоящегося состояния к размножению, а амоксициллин и кларитромицин воздействуют именно на активно делящиеся микробные клетки. Кроме того, ИПП и кларитромицин взаимно замедляют метаболизм друг друга в печени, что обеспечивает более выраженное антибактериальное и антисекреторное действие [6]. При назначении ИПП следует также учитывать возраст пациента, наличие у него сопутствующих заболеваний. Так, при заболеваниях почек нет необходимости корректировать дозу ИПП. Не требуется ее коррекции и у пожилых пациентов вследствие очень короткого периода полувыведения препаратов этой группы. Тем не менее существует необходимость в снижении дозы ИПП у пациентов с печеночной недостаточностью, поскольку в этом случае происходит удлинение периода полувыведения препарата [6]. Опыта для определения безопасности применения ИПП у беременных пока недостаточно. Результаты ретроспективного анализа случаев применения омепразола в течение первого триместра беременности продемонстрировали отсутствие тератогенного риска [38]. Однако, учитывая то, что все ИПП проникают через плацентарный барьер, назначение этой группы препаратов во время беременности возможно только в случае, когда предполагаемая польза для матери превышает потенциальный риск для плода [6].
ИПП не стойки в кислой среде, быстро в ней инактивируются, поэтому выпускаются в виде таблеток, содержащих кишечнорастворимые микросферы; кишечнорастворимых таблеток; желатиновых капсул с кишечнорастворимыми микросферами [6].
В зависимости от конфигурации атомов молекулы ИПП в пространстве выделяют ИПП рацематы – смеси оптических изомеров R (лат. rectus – правый, по часовой стрелке) и S (лат. sinister – левый, против часовой стрелки) в пропорции 1:1 (омепразол, лансопразол, пантопразол, рабепразол) и ИПП моноизомеры или энантиомеры (эзомепразол и декслансопразол).
Особенности моноизомеров. Рецепторы клеток человеческого организма селективны и предпочтительно связываются с одним из изомеров энзимов или лекарственных веществ. То есть только один из энантиомеров подходит данному рецептору. Зачастую изомеры обладают разной биологической активностью и могут оказывать различное действие на клетки, поэтому очень важно уметь получать каждую из форм в чистом виде [7]. Синтез моноизомеров стал возможным после 2001 г., когда трое ученых – Уильям Ноулз, Барри Шарплесс и Рьойи Нойори стали лауреатами Нобелевской премии по химии за создание новых технологий разделения оптических изомеров. Они развили каталитический асимметричный синтез, позволяющий получать избыточное количество одной из энантиомерных форм [6]. Примером внедрения этих разработок является эзомепразол – S-изомер омепразола – первый блокатор протонной помпы париетальных клеток желудка, созданный в виде чистого оптического изомера. С 2008 г. на фармацевтическом рынке Республики Беларусь эзомепразол представлен препаратом «Эзокар» производства компании «Pharmacare Int. Co».
Фармакокинетические особенности эзомепразола. По литературным данным, эзомепразол, в сравнении с ИПП – рацематами, обладает некоторыми фармакокинетическими особенностями [6–8]. В рамках феномена стереоселективности метаболизм эзомепразола печеночным ферментом цитохромом Р450 (CYР), в частности его изоформами CYP3A4 и преимущественно CYP2C19 (S-мефенитоин гидроксилаза), протекает в 3 раза медленнее, чем метаболизм его рацемата (омепразола). При этом происходит увеличение такого показателя, как площадь под кривой «концентрация в плазме – время» (AUC), что определяет более высокую биодоступность эзомепразола, то есть большее количество изомеров в кровотоке достигает париетальных клеток [6–8]. Это позволило предположить, что эзомепразол обладает способностью более мощно подавлять желудочную секрецию [19]. Так, в своем исследовании T. Andersson и соавт. сравнивали действие 20 мг эзомепразола и 20 мг омепразола, на кислотную продукцию, стимулированную пентагастрином, у здоровых добровольцев и отметили, что уже в первый день приема эзомепразола было достигнуто подавление кислотной продукции на 46%, а при приеме омепразола только на 35% [19].
Важно отметить, что различия в метаболизме и клинической эффективности ИПП могут быть также объяснены генетическим полиморфизмом CYP2C19 и зависят от активности этого фермента у человека [8]. Данный полиморфизм проявляется мутацией с заменой одного нуклеотида в 5 экзоне гена CYP2C19, вследствие чего в гене образуется стоп-кодон (терминальный кодон), при этом синтезируется укороченная на 20 аминокислот, функционально неактивная гидроксилаза CYP2C19 [8, 18]. В настоящее время выделяют три группы лиц в зависимости от активности CYP2C19: первая – быстрые метаболизаторы (метаболайзеры) (homozygous extensive metabolizers – homEM) – мутация CYP2C19 отсутствует и метаболизм лекарственных препаратов осуществляется быстро; у второй группы мутация имеется в одной аллели гена и метаболизм осуществляется медленнее – промежуточные метаболизаторы – гетерозиготы (heterozygous extensive metabolizers – hetEM); в третьей группе мутация имеется в обеих аллелях гена и метаболизм выраженно замедлен – это медленные метаболизаторы (poor metabolizers – PM) [8]. Врожденный генетический полиморфизм CYP2C19 встречается в популяции с различной частотой и имеет межэтнические различия: он наблюдается у 2–5% европейцев и белых североамериканцев, больше его распространенность среди корейцев – 13%, китайцев – 15% и японцев – 19–23% [14, 15]. Полиморфизм гена CYP2C19 оказывает влияние на фармакокинетику ИПП, в особенности – рацематов, что имеет важное значение для клинического эффекта этой группы лекарственных средств при КЗЗ [9–11]. Представители азиатской этнической группы являются в основном медленными метаболизаторами [15]. Этим, вероятно, можно объяснить повышение у них уровней ИПП в плазме крови и более выраженную эффективность препаратов данной группы [16]. У пациентов – быстрых метаболизаторов стандартные дозы ИПП подавляют желудочную секрецию хуже, чем у лиц с мутантным фенотипом, и основные показатели эффективности лечения КЗЗ у них также снижены [8]. Так, среди российских и европейских пациентов с ГЭРБ и пептическими язвами, по результатам исследований, преобладают быстрые метаболизаторы. У них подавление секреции соляной кислоты ИПП, по сравнению с медленными метаболизаторами, выражено в меньшей мере [16–18].
В основе метаболизма эзомепразола лежит феномен стереоселективности: левовращающиеся изомеры ИПП метаболизируются CYP2C19 в несколько раз медленнее правовращающихся и, соответственно, медленнее препаратов, представляющих собой рацемические смеси право- и левовращающих изомеров. Это обеспечивает лучший контроль над секрецией, а также более длительное действие эзомепразола у пациентов, быстро метаболизирующих ИПП [8, 18]. Данные эффекты эзомепразола были продемонстрированы в перекрестном исследовании С.В. Морозова и соавт. [18]. Изучали антисекреторное действие рабепразола и эзомепразола в дозе 20 мг у пациентов с ГЭРБ, инфицированных Helicobacter pylori (HP) и быстро метаболизирующих ИПП. При этом эзомепразол в дозе 20 мг обеспечивал лучший контроль за секрецией с первого дня применения по сравнению с рабепразолом в дозе 20 мг, а также обладал более длительным, по сравнению с рабепразолом, действием в течение суток после прекращения приема препарата [18].
Выраженный антисекреторный эффект эзомепразола обеспечивает его доказанную высокую клиническую эффективность при КЗЗ, приобретающую особое значение при необходимости качественного контроля кислотопродукции в популяциях, где преобладают люди, быстро метаболизирующие ИПП.
Клиническая эффективность эзомепразола при ГЭРБ.В исследованиях с перекрестным дизайном эзомепразол в стандартной дозе 40 мг/сут у пациентов с ГЭРБ имел более выраженное антисекреторное действие по сравнению с другими ИПП [20, 21] (рис. 2).
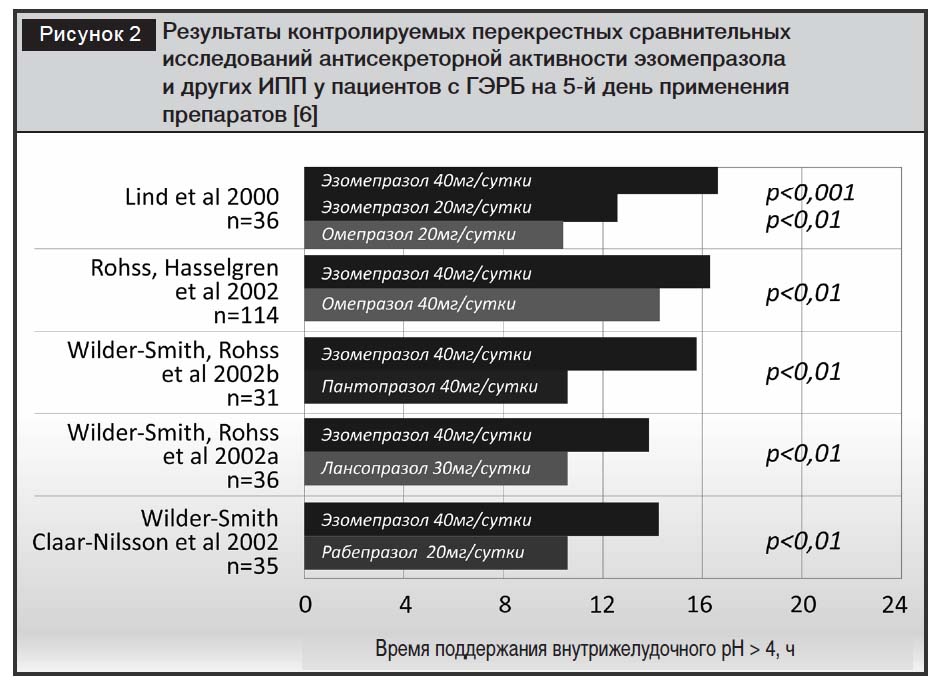
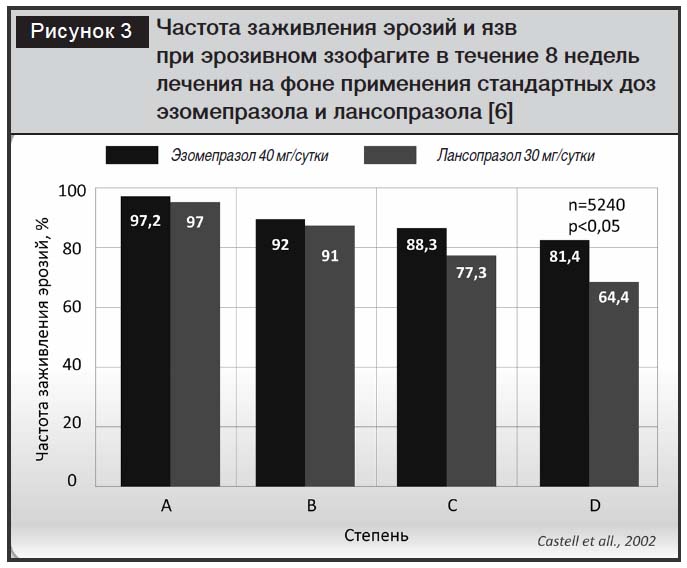
По данным метаанализа, проведенного I.M. Gralnek и соавт., включающего 10 исследований (n=15316), частота заживления язв и эрозий при эрозивном эзофагите была достоверно выше при использовании эзомепразола в дозе 40 мг/сут (за 4 и 8 недель лечения) по сравнению с омепразолом, лансопразолом и пантопразолом [6, 28]. В контролируемых исследованиях с участием 3729 пациентов с рефлюкс-эзофагитом сравнивали эффективность эзомепразола (в дозе 40 мг) с омепразолом (в дозе 20 мг). Было продемонстрировано преимущество эзомепразола и в купировании симптомов, и в заживлении эзофагита независимо от степени эзофагита (оцененной в соответствии с критериями Лос-Анджелесской классификации), зафиксированной в начале лечебного курса [23, 24]. Однако в контролируемом исследовании D.O. Castell и соавт. [22] с участием 5240 пациентов было показано, что особенно велики различия в антисекреторной активности эзомепразола (более 20%) при тяжелых стадиях эзофагита (С и D по Лос-Анджелесской классификации), то есть в тех случаях, когда важна длительность антисекреторного эффекта (рис. 3).
Отдельно изучали эффективность длительного применения эзомепразола у пациентов с эндоскопически негативной ГЭРБ и в качестве поддерживающей терапии для профилактики рецидивов ГЭРБ после проведенного успешного стартового лечения [25–27]. N. Talley и соавт. определяли эффективность терапии эндоскопически негативной ГЭРБ с помощью эзомепразола у 721 пациента в режиме «по требованию», длительность терапии составляла 6 месяцев [25]. Пациентов разделили на 3 группы: эзомепразола 20 мг/сут (n=282), 40 мг/сут (n=293) и плацебо (n=146). Обе дозы эзомепразола были значительно эффективнее по сравнению с плацебо. Так, в группах эзомепразола около 90% пациентов закончили 6-месячный курс лечения с положительной динамикой и улучшением качества жизни, а в группе плацебо частота прекращения лечения превышала 40% [25].
Эффективность поддерживающей противорецидивной терапии ГЭРБ с помощью эзомепразола после проведенного успешного стартового лечения эрозивного эзофагита изучали в двух испытаниях со сходными дизайнами (D. Johnson et al., 2001 и N. Vakil et al., 2001). Была показана высокая эффективность эзомепразола в половинной суточной дозе (20 мг) для профилактики рецидивов ГЭРБ [26, 27]. Исходя из результатов вышеперечисленных исследований, можно говорить о высокой эффективности эзомепразола не только в лечении ГЭРБ, но и в профилактике ее рецидивов.
Эффективность эзомепразола в схемах антихеликобактерной терапии.I.M. Subei и соавт. сравнивали эффективность терапии эзомепразолом и омепразолом у 374 пациентов с клинически активной дуо-денальной язвой. Наличие инфекции Helicobacter pylori подтверждали дыхательным тестом [29]. В течение одной недели пациенты получали эзомепразол по 20 мг 2 раза в сутки или омепразол в той же дозе, а также амоксициллин по 1000 мг 2 раза в сутки и кларитромицин по 500 мг 2 раза в сутки. После завершения курса антихеликобактерной терапии группа омепразола еще в течение 3 недель продолжала монотерапию этим препаратом, а в группе эзомепразола назначали плацебо на тот же период. Состояние язвенного дефекта контролировали эндоскопически через 4 и 8 недель после начала лечения. Частота заживления язвы была сравнима в обеих группах и составила через 4 недели 74 и 76%, а через 8 недель – 87 и 88% в первой и второй группах соответственно. То есть недельный курс применения эзомепразола позволил достичь результатов, аналогичных 3-недельному курсу лечения омепразолом. Эффективность эзомепразола в схемах антихеликобактерной терапии изучалась еще в двух исследованиях (n=446): в первом исследовании принимали участие пациенты с клинически активной хронической дуоденальной язвой [30], а во втором – с ремиссией [31]. Дизайн исследований был схож и повторял таковой I.M. Subei и соавт. Через 4 недели после прекращения терапии рубцевание язвенного дефекта в группах, получавших эзомепразол в течение 7 дней и омепразол на протяжении 28 дней, наблюдалось в 91 и 92% случаев, при этом частота эрадикации Н. pylori по данным дыхательного теста и гистологического исследования составила 86 и 88% соответственно [31]. У пациентов с язвой в фазе ремиссии частота эрадикации Н. pylori составила 89,7 и 87,8% при приеме эзомепразола и омепразола соответственно [31]. Таким образом, 7-дневная эрадикационная терапия с применением эзомепразола обеспечивает высокую частоту эрадикации. При этом частота рубцевания дуоденальных язв при недельном курсе эзомепразолом сопоставима с трехнедельной монотерапией омепразолом, проводимой после завершения эрадикационной терапии, основанной на омепразоле. Это свидетельствует о высокой эффективности применения эзомепразола в схемах антихеликобактерной терапии.
Эзомепразол высокоэффективен в профилактике и лечении НПВП-гастропатий.С. Hawkey и соавт. провели два мультицентровых рандомизированных клинических исследования (РКИ) (NASA и SPACE) для оценки эффективности эзомепразола, назначаемого для облегчения связанных с приемом НПВП симптомов [32, 33]. В испытаниях приняли участие 604 пациента, которые по медицинским показаниям длительно принимали НПВП, не имели в прошлом язв или эрозивных эзофагитов, а также были H. pylori-отрицательными. Они были разделены на группы эзомепразола 20 мг/сут, 40 мг/сут и плацебо. Через 6 месяцев первоначальные симптомы в группах эзомепразола сохранились лишь в 29% (р=0,006) и 26% (р=0,001) случаев, тогда как в группе плацебо – в 39% [33].
Еще в двух масштабных 6-месячных РКИ (n=854) проводили изучение эффективности фиксированной комбинации эзомепразола и напроксена (ЭНК) с целью снижения частоты желудочно-кишечных осложнений [34, 35]. Сравнивали ЭНК и обычный кишечнорастворимый напроксен. При этом частота язв желудка и ДПК, возникших на фоне ЭНК, составила в первом исследовании 4,6%, во втором – 8,1%. У пациентов, получавших только напроксен, язвы выявлялись в несколько раз чаще – 28,2 и 30% случаев соответственно (р<0,001) [35].
Эзомепразол также был изучен в качестве препарата для профилактики и лечения диспепсии на фоне приема НПВП [32, 33]. Он показал свою эффективность в заживлении язв на фоне продолжающегося приема НПВП [34, 35], а также и для профилактики возникновения язв у лиц с множественными факторами риска [36]. Эти результаты свидетельствуют об эффективности эзомепразола в лечении осложнений длительной терапии НПВП. Кроме того, его применение может значительно повысить качество жизни пациентов, вынужденных принимать НПВП.
Безопасность применения эзомепразола и взаимодействие с другими лекарственными средствами.В большинстве случаев ИПП, в том числе и эзомепразол, считаются безопасными и хорошо переносимыми препаратами. Наиболее распространенными побочными эффектами являются головная боль, тошнота, боль в животе, метеоризм и диарея. Встречаются они, по данным контролируемых исследований, лишь в 1–3% случаев [37]. Также у лиц, инфицированных H. pylori, при непрерывном длительном приеме ИПП на протяжении года и более существует риск возникновения атрофического гастрита, развитие которого можно предупредить проведением эрадикационной терапии до назначения ИПП на длительный период [6].
Эзомепразол, как и все ИПП, может взаимодействовать с другими лекарственными средствами, влияя на их абсорбцию вследствие уменьшения желудочной секреции. Существует также взаимодействие, связанное с изоформами цитохрома Р450. Пример такого вида взаимодействия – повышение плазменных концентраций фенитоина, варфарина и диазепама при одновременном приеме их с ИПП, в том числе с эзомепразолом. Тем не менее данные Американской службы контроля за пищевыми продуктами и лекарствами (FDA) подтверждают, что клиническое значение этих потенциальных взаимодействий очень низко и составляет менее 0,1–0,2% на 1 миллион выданных рецептов [6].
Особое внимание следует уделить взаимодействию эзомепразола и других ИПП с клопидогрелем за счет ингибирования ферментов цитохрома P450, включая CYP2C19, что, по всей вероятности, может приводить к снижению антиагрегантного эффекта клопидогреля и, как следствие, к увеличению риска неблагоприятных кардиальных исходов [39]. Однако сведения о сердечно-сосудистых событиях во время приема комбинации «клопидогрель – ИПП» противоречивы. Так, по результатам проведенного в США широкомасштабного исследования, при анализе базы данных Medco оказалось, что риск возникновения неблагоприятных сердечно-сосудистых осложнений у пациентов, принимавших ИПП совместно с клопидогрелем (n=9862), составил 25%, в то время как у не принимавших ИПП (n=6828) риск был ниже – 17,9% [40]. Также в марте 2009 г. было опубликовано популяционное когортное исследование типа «случай – контроль» среди жителей города Онтарио в возрасте 66 лет и старше, перенесших острый инфаркт миокарда (ОИМ), которым назначали прием клопидогреля после выписки из больницы. Пациенты были разделены на две группы: основную и контрольную. Основную группу составили 734 человека, умерших или повторно госпитализированных с ОИМ в течение 90 дней после выписки из стационара. В группу контроля вошли 2057 пациентов, которые были соотнесены с основной по возрасту и предсказанной вероятности ранней смерти (в пределах 0,05), определяемой с помощью модели предсказания кардиального риска. Проводили учет приема ИПП во время терапии клопидогрелем. В ходе первичного анализа была установлена связь повторной госпитализации по поводу ОИМ с приемом ИПП (скорректированное отношение шансов (ОШ) 1,27, 95% доверительный интервал (ДИ) 1,03–1,57) [40]. Результатом еще одного годичного наблюдения за пациентами, выписанными на клопидогреле после имплантции стента и получавшими одновременно ИПП (эзомепразол и пантопразол), было увеличение количества госпитализаций в связи с повторным инфарктом миокарда (ИМ) [46].
С другой стороны, по данным исследований PRINCIPLE -TIMI-44 (n=201), TRITON-TIMI-38 (n=13608), в которых оценивалась связь между использованием ИПП, количественными характеристиками функции тромбоцитов и неблагоприятными кардиальными исходами у пациентов, леченных клопидогрелем или прасугрелом, не было получено доказательств того, что прием ИПП может негативно сказываться на клинических исходах у лиц, получающих дезагрегантную терапию [41].
Тем не менее в 2009 г. FDA опубликовало информацию для профессиональных работников здравоохранения о возможном уменьшении эффекта клопидогреля при приеме ИПП (омепразола) и о нежелательности использовании такой комбинации. По той же причине рекомендовалось избегать совместного назначения с клопидогрелем и других лекарственных средств: циметидина, флуконазола, вориконазола, кетоконазола, эзомепразола, этравирина, флуоксетина, фелбамата, флувоксамина, тиклопидина [41].
Интересные данные были представлены в 2011 г. Kishore J. Harjai и соавт.: за шесть месяцев наблюдения за пациентами (n=2651) после чрескожных коронарных вмешательств, получавшими и не получавшими ИПП одновременно с клопидогрелем, не было отмечено различий ни по общему числу основных коронарных событий, ни по частоте ИМ, тромбозов стентов, повторных реваскуляризаций, ни по смертности. Кроме того, при рассмотрении отдельно группы принимавших омепразол и эзомепразол выявлено, что частота основных коронарных событий у этих пациетов была ниже, чем у не получавших ИПП, а при многофакторном анализе использование омепразола или эзомепразола оказалось независимо связанным с меньшей частотой таких событий (относительный риск (ОР) 0,51, 95% ДИ 0,28–0,92). Одним из объяснений данного факта было то, что эти пациенты чаще продолжали или не прерывали прием клопидогреля [44].
Пятого октября 2011 г. на сайте РУП «Центр экспертиз и испытаний в здравоохранении» (Минск) в разделе «Безопасность лекарственных средств» рекомендации по медицинскому применению клопидогреля были дополнены новой информацией в отношении его одновременного назначения с блокаторами протонной помпы: «...следует исключать одновременное назначение клопидогреля с блокаторами протонной помпы, для которых имеются данные в отношении их способности ослаблять терапевтическую эффективность клопидогреля. Омепразол является одним из таких лекарственных средств. Если пациенту необходимо принимать блокаторы протонной помпы на фоне приема клопидогреля, следует назначать те из препаратов данной группы, которые обладают наименее выраженной способностью к взаимодействию...» [42].
Текущее состояние проблемы соотношения ИПП и клопидогреля хорошо охарактеризовано в публикации M.E. Griswold и соавт.: «...учитывая наличие множественных исследований с противоречивыми и неопределенными результатами, мы считаем, что безопасность одновременного назначения ИПП и клопидогреля остается вопросом, ответ на который отсутствует...» [45].
Заключение
Кислотозависимые заболевания относятся к одним из наиболее распространенных среди болезней органов пищеварения. Общим для них патогенетическим звеном является кислотно-пептическая агрессия желудочного сока.
Чтобы уменьшать кислотно-пептическую агрессию желудочного содержимого при КЗЗ, необходимо заблокировать продукцию соляной кислоты париетальными клетками желудка с помощью антисекреторных лекарственных средств.
Успех терапии КЗЗ напрямую зависит от степени и продолжительности повышения значений рН. Идеальным условием для эффективного лечения большинства КЗЗ является удержание рН в желудке выше 4,0 в течение 16 часов в сутки или более. Добиться этой цели возможно только при использовании таких мощных кислотоснижающих препаратов, как ингибиторы протонной помпы.
Эзомепразол – эффективный, безопасный и хорошо переносимый препарат. Это первый ингибитор протонной помпы, синтезированный в виде моноизомера. Данная его особенность определяет более высокую биодоступность и тем самым обусловливает мощный антисекреторный эффект. Доказана высокая клиническая эффективность эзомепразола в лечении КЗЗ: препарат эффективно и быстро позволяет добиться стойкого купирования симптомов, заживления эрозий и язв, а также надежно защищает от рецидивов кислотозависимых заболеваний.
Сегодня на белорусском фармацевтическом рынке наиболее приемлемым с позиций высокого качества (производство по стандартам GMP) и длительности опыта применения в Республике Беларусь (с 2008 г.), является эзомепразол производства компании «Pharmacare Int. Co» под торговым названием «Эзокар». Субстанция производится американской компанией «Sigma-Aldrich». Препарат выпускается в виде капсул, содержащих пеллеты эзомепразола, по 20 и 40 мг, без добавления сахара. Эзокар можно рекомендовать при КЗЗ, особенно при необходимости лучшего контроля над секрецией соляной кислоты, а также у пациентов, быстро метаболизирующих ИПП.
Л И Т Е Р А Т У Р А
1. Платошкин Э.Н. // Мед. новости. – 2007. – №10. – С.25–30.
2. Карасёва Г.А. // Мед. новости. – 2012. – №8. – С.21–26.
3. Воронина Л.П. // Мед. новости. – 2009. – №8. – С.29–32.
4. Маев И.В., Андреев Д.Н., Гончаренко А.Ю., Дичева Д.Т. // Справочник поликлинич. врача. – 2013. – №7–8. – С.12–14.
5. Wallace J.L., Sharkey K.A. // Goodman and Gilman’s The Pharmacological Basis of Therapeutics (12th ed.) / B.A.Chabner., L.L.Brunton, B.C.Knollman (eds). – New York: McGraw-Hill, 2011.
6. ИсаковВ.А. // Consilium Medicum. – 2006.– №7. – C.21–26.
7. Лапина Т.Л. // Клинич. фармакология и терапия. – 2002. – Т.11, №2. – C.54–57.
8. Абдулганиева Д.И. // Лечащий врач. – 2011. – №10. – C.54–57.
9. De Morals S.M., Wilkinson G.R., Blaisdell J. et at. // J. Biol. Chem. – 1994. – Vol.269, N22. – P.15419–15422.
10. Chang M., Tybring G., Dahl M.L. et at. // Br. J. Clin. Pharmacol. – 1995. – Vol.39, N5. – P.511–518.
11. Adachi K., Katsube Т., Kawamura A. et al. // Aliment. Pharmacol. Ther. 2000. – Vol.14, N10. – P.1259–1266.
12. Steinijans V.W., Huber R., Hartmann M. et al. // Int. J. Clin. Pharmacol. Ther. 1996. – Vol.34, suppl. – P.S31–S50.
13. Abelo A., Andersson T. B., Antonsson M. et al. // Drug. Metab. Dispos. – 2000. – Vol.28, N8. – P.966–972.
14. Edeki T., Goldstein J., de Morais S.M.F. et al. // Pharmacogenetic. – 1996. – Vol.6. – P.357–360.
15. Kubota T., Chiba K., Ishizaki T. // Clin. Pharmacol. Ther. – 1996. – Vol.60. – P.661–666.
16. Goldstein J.A. // Br. J. Clin. Pharmacol. – 2001. – Vol.52. – P.349–355.
17. Pang S.H., Graham D.Y. // Ther. Adv. Gastroenterol. – 2010. – Vol.3, N1. – Р.11–22.
18.МорозовС.В., ЦодиковаО.М., ИсаковВ.А. и др. // Эксперим. и клинич. гастроэнтерология. – 2003. – №6. – С.58–63.
19. Andersson T., Bredberg E., Sunzel M. et al. // Gastroenterology. – 2000. – Vol.118. – P.A1210.
20. Miner P., Jr., Katz P.O., Chen Y., Sostek M. // Am. J. Gastroenterol. – 2003. – Vol. 98(12). – P.2616–2620.
21. Rohss K., Lind T., Wilder-Smith C. // Eur. J. Clm. Pharmacol. – 2004. – Vol.160, N8. – P.531–539.
22. Castell D.O., Kabrilas P.J., Richter J.Е. et al. // Am. J. Gastroenterol. – 2002. – Vol.97, N3. – P.575–583.
23. Kahrilas P.J., Falk J.V., Johnson D.A. et al. // Aliment. Pharmacol. Ther. – 2000. – Vol.14. – P.1249–1258.
24. Richter J.E., Kahrilas P.J., Johanson J. et al. // Amer. J. Gastroenterol. – 2001. – Vol.96. – P.656–665.
25. Talley N., Venables Т., Green J. // Gastroentero-logy. – 2000. – N118. – P.A658.
26. Vakil N., Shaker R., Johnson D. et al. // Aliment. Pharmacol. Ther. – 2001. – N15. – P.927–935.
27. Johnson D., Benjamin S., Vakil N. et al. // Amer. J. Gastroenterol. – 2001. – N96. – P.27–34.
28. Gralnek I.M., Dulai G.S., Fennerty M.B., Spiegel B.M. // Clin. Gastroenterol. Hepatol. – 2006. – Vol.4, N12. – P.1452–1458.
29. Subei I.M., Cardona H.J., Bachelet E. et al. // Dig. Dis. Sci. – 2007. – Vol.52, N6. – P.1505–1512.
30. Tulassay Z., Kryszewski A., Dite P. et al. // Eur. J. Gastroenterol. Hepatol. – 2001. – N3. – P.1457–1465.
31. Veldhuyzen van Zanten S., Lauritsen K., Delchier J.-C. et al. // Aliment. Pharmacol. Ther. – 2000. – N14. – P.1605–1611.
32. Hawkey C., Talley N.J., Yeomans N.D. et al. // Am. J. Gastroenterol. – 2005. – Vol.100. – P.1028–1036.
33. Hawkey C.J., Talley N.J., Scheiman J.M. et al. // Arthritis Res. Ther. – 2007. – N9. – P.R17.
34. Roberts D., Miner P. // Drug Health Patient Saf. – 2011. – Vol.3. – Р.1–8.
35. Goldstein J., Hochberg M., Fort J. et al. // Aliment. Pharmacol. Ther. – 2010. – Vol.32, N3. – Р.401–413.
36. Scheiman J.M., Yeomans N.D., Talley N.J. et al. // Am. J. Gastroenterol. – 2006.– Vol.101. – P.701–710.
37. Wilhelm Sh.M., Rjater R.G., Kale-Pradhan P.B. // Rev. Clin. Pharmacol. – 2013. – Vol.6, N4. – P.443–451.
38. Diav-Citrin О., Аrnon J., Shechtman S. et al. // Aliment. Pharmacol. Ther. – 2005. – Vol.21, N3. – P.269–275.
39. Конорев М.Р., Тябут Г.Д. // Мед. новости. – 2011. – №9. – С.58–60.
40. Щербаков П.Л. // Лечащий врач. – 2013. – №7.
41. O’Donoghue M.L. et al. //Lancet. – 2009; DOI:10.1016/S0140-6736(09)61525-7.
42. Information for Healthcare Professionals: Update to the labeling of Clopidogrel Bisulfate (marketed as Plavix) to alert healthcare professionals about a drug interaction with omeprazole (marketed as Prilosec and Prilosec OTC). http://www.fda.gov/Drugs/DrugSafety/
43. http://rceth.by/ru/Safety/DrugSafety
44. Harjai K.J., Shenoy Ch., Orshaw P. et al. // Circulation: Cardiovasc. Intervent. – 2011. – Vol.4, N2. – Р.162–170.
45. Griswold M.E., Localio A.R., Mulrow C. // Ann. Intern. Med. – 2010. – Vol.152, N6. – P.393–395.
46. Evanchan J., Donnally M.R., Binkley Ph., Mazzaferri E. // Clin. Cardiol. – 2010. – Vol.33, issue 3.– P.168–171.
Медицинские новости. – 2015. – №9. – С. 14-19.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.