Baiko S.V., Sukalo A.V., Rudenko E.V.
Belarusian State Medical University, Minsk
Vitamin D deficiency and peculiarities of calcium phosphorus metabolism in healthy children
Резюме. Уровень витамина Д исследован у 113 здоровых детей (55 мальчиков и 58 девочек) одного из административных районов города Минска с разделением обследуемых на три возрастные группы: 5–9, 10–13 и 14–17 лет. Средний уровень витамина Д составил 32,6±9,2 нг/мл, без различий по полу. Дефицит витамина Д определялся у 7,1%, недостаточности – у 31,9% детей. У 70,6% девочек в возрасте 14–17 лет обнаружен дефицит и недостаточность витамина Д. Выявлена значимая разница в уровнях 25(ОН)Д в зависимости от материального положения семьи.
Ключевые слова: витамин Д, дефицит и недостаточность витамина Д, здоровые дети, кальций (Са), фосфор (РО4).
Медицинские новости. – 2015. – №11. – С. 69–72.
Summary. The levels of vitamin D have been studied in 113 healthy children (55 boys and 58 girls) from one of the Minsk districts who were divided into 3 age groups: 5–9, 10–13 and 14–17 years. The average level of vitamin D was 32.6±9.2 ng/ml, with no differences by sex. The vitamin D deficiency was found in 7,1%, and insufficiency in 31.9% of children. 70,6% of girls aged 14–17 years had the deficiency and insufficiency of vitamin D. Revealed significant differences in the levels of 25(OH)D, depending on the financial situation of the family.
Keywords: vitamin D, vitamin D deficiency and insufficiency, healthy children, calcium (Са), phosphorus (PO4).
Meditsinskie novosti. – 2015. – N11. – P. 69–72.
Изучение витамина Д продолжается уже более 100 лет, со времени открытия McCollum с соавт. в 1913 г. некоего «жирорастворимого фактора роста», который они обнаружили в рыбьем жире. Воздействие этого фактора при лечении рахита оказалось настолько эффективным, что сделало рыбий жир почти панацеей и дало мощный толчок научным исследованиям витамина Д во всем мире. Последние 15 лет показали, что биологические эффекты витамина Д не ограничиваются участием в кальциевом обмене. Наряду с общеизвестными патологическими состояниями и заболеваниями, такими как рахит, остеопороз, остео-маляция, обнаружены новые механизмы влияния витамина Д на физиологические процессы [3, 5, 7, 8].
Витамин Д является основным регулятором кальций-фосфорного метаболизма, поддерживая нормальный уровень данных элементов для адекватного остеогенеза. Кальцитриол (1,25(OH)2Д) усиливает абсорбцию кальция в тонкой кишке, в почках стимулирует реабсорбцию кальция и фосфора за счет взаимодействия со специфическим рецептором (VDR), что в совокупности приводит к повышению содержания кальция и фосфора в сыворотке до уровня, обеспечивающего адекватную минерализацию остеоида. В присутствии достаточного количества витамина Д абсорбция кальция в кишечнике достигает 30% (у детей в периоды активного роста – 60–80%). Об эффективности данного механизма свидетельствует тот факт, что без участия витамина Д лишь 10–15% пищевого кальция и 60% фосфора абсорбируются в кишечнике. Взаимодействие между 1,25-дигидроксивитамином Д и VDR повышает эффективность кишечной абсорбции кальция до 30–40%, то есть в 2–4 раза, а фосфора – до 80%. При дефиците витамина Д абсорбция кальция снижается, что усиливает секрецию паратиреоидного гормона, который в свою очередь приводит к стимулированию синтеза 1,25-дигидроксивитамина Д и усилению потерь фосфора с мочой [1, 4, 6].
Рецепторы к витамину Д присутствуют в большинстве тканей и клеток человеческого организма [10, 14]. Спектр биологического действия кальцитриола включает ингибирование клеточной пролиферации и влияние на их конечную дифференцировку, подавление ангиогенеза, стимулирование выработки инсулина b-клетками поджелудочной железы и синтеза кателицидина макрофагами, угнетение продукции ренина. Некоторые ткани и клетки обладают активностью 1a-гидроксилазы. Локальная выработка 1,25(OH)2Д может отвечать за регулирование до 200 генов, обеспечивающих многие плейотропные эффекты, необходимые для поддержания здоровья ребенка [9, 10, 12–14].
Обеспеченность организма витамином Д определяется по уровню печеночного метаболита 25(ОН)Дtotal (25(ОН)Д2+25(ОН)Д3) в крови, период полувыведения которого составляет 2–3 недели. Измерение уровней 1,25(OH)2Д не рекомендуется в рутинной клинической практике, поскольку он относится к короткоживущим гормонам с периодом полувыведения 4 часа и не отражает запасы витамина Д в организме [13].
В соответствии с международными рекомендациями [16], дефицит витамина Д определяется при уровне 25(ОН)Дtotal в крови менее 20 нг/мл, недостаточность – 20–29 нг/мл. Дефицит витамина Д встречается среди здоровых детей, по данным некоторых авторов достигая 14–25% [11, 15, 17, 18]. Факторы риска развития дефицита витамина Д: грудное вскармливание ребенка без дополнительного приема витамина Д, темная пигментация кожи, женский пол, проживание в северных климатических широтах и осенне-зимний период [13, 16].
Цель исследования – определить распространенность дефицита и недостаточности витамина Д среди здоровых детей одного из районов города Минска; оценить уровни кальция, магния, фосфора и щелочной фосфатазы, паратиреоидного гормона, маркеров костного метаболизма в крови, экскрецию кальция и фосфора с мочой в зависимости от возраста и социального положения ребенка; выявить взаимосвязи между изучаемыми параметрами.
Материалы и методы
В исследовании приняли участие 113 практически здоровых детей в возрасте 5–17 лет одной из поликлиник Московского района города Минска (55 мальчиков и 58 девочек). Все исследуемые были разделены на три возрастные группы: 5–9, 10–13 и 14–17 лет. У всех оценивались антропометрические данные (рост, масса тела) и рассчитывался индекс массы тела.
Анализировались биохимические показатели крови (уровни общего и ионизированного кальция (Са общ. и Са ион.), фосфора (РО4), ионизированного магния (Mg ион.) и общей щелочной фосфатазы (ЩФ). В первой утренней порции мочи оценивались соотношение кальций/креатинин и фосфор/креатинин, проба Сулковича. Дефицит витамина Д диагностировался в зависимости от уровней 25(ОН)Дtotal в плазме крови (определялся методом электрохемилюминесценции (Cobas e 411, Roche Diagnostics GmbH, Германия). Оценка костного метаболизма проводилась на основании динамики изменений маркеров костного формирования (остеокальцина) и резорбции (b-Cross Laps – С-концевые телопептиды коллагена I типа). Биохимические параметры крови, уровни витамина Д и паратиреоидного гормона (ПТГ), маркеров костного метаболизма определялись в летние месяцы.
Для определения социального статуса ребенка, особенностей физической нагрузки и питания проводилось анкетирование родителей. Нами разработана и предложена собственная шкала оценки материального положения семьи на основе балльной системы (табл. 1): выше среднего – сумма баллов 11–13; достаточное – 8–10, недостаточное – 7 и менее баллов (1, 2 и 4 вопросы – только один вариант ответа).
Таблица 1. Система оценки материального положения семьи в баллах
|
Вопрос анкеты
|
Варианты ответа
|
Количество баллов
|
|
1. Состав семьи
|
полная
|
1
|
|
неполная
|
0
|
|
2. Собственная оценка материального
положения
|
оптимальное
|
2
|
|
хорошее
|
1
|
|
плохое
|
0
|
|
3. Имеете ли Вы?
|
телевизор
|
1
|
|
автомобиль
|
2
|
|
стиральную машину-автомат
|
1
|
|
собственный дом или квартиру
|
3
|
|
4. Можете ли Вы
позволить себе
ежегодный отдых
с семьeй?
|
в дальнем зарубежье
|
3
|
|
в ближнем зарубежье
|
2
|
|
в Беларуси
|
1
|
|
нет
|
0
|
В процессе проведения исследования рассчитывались средние величины и стандартное отклонение (M±d) при нормальном распределении признака, медиана и квартили (Me (P25; P75) при распределении, отличном от нормального. Для сравнения переменных с нормальным распределением использовались параметрические методы статистической обработки данных, при неправильном – непараметрические: U-критерий Манна – Уитни для сравнения двух независимых групп, хи-квадрат (c2) с поправкой Йейтса для анализа таблиц сопряженности. Различия считали достоверными при p<0,05. Взаимосвязь переменных оценивали по коэффициенту корреляции Пирсона (r) и Спирмена (rs). Обработка данных проводилась с использованием программы Statistica 10.
Результаты и обсуждение
Средний уровень 25(ОН)Дtotal в плазме крови составил 32,6±9,2 нг/мл для всех обследованных. Уровни витамина Д не различались межу мальчиками (33,7±10 нг/мл) и девочками (31,7±8,4 нг/мл). Дефицит витамина Д выявлен у 8 (7,1%) человек, недостаточность – у 36 детей (31,9%). Различий в уровне 25(ОН)Дtotalмежду возрастными группами у мальчиков не отмечалось (5–9 лет – 33,5±8,5; 10–13 – 31,5±8,5, 14–17 – 36,5±12,7 нг/мл). Среди девочек выявлено значимое снижение в возрастной группе 14–17 лет (5–9 лет – 35,9±8,8; 10–13 – 30,1±6,6, 14–17 – 27,8±7,7 нг/мл (p5–9/14–17<0,05).
Распространенность дефицита и недостаточности витамина Д среди различных возрастных групп у мальчиков и девочек представлена на рис. 1.
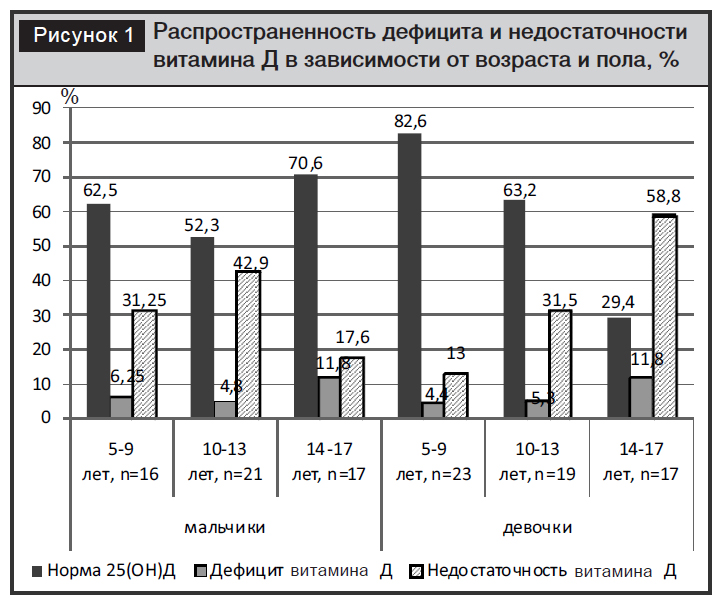
Наиболее часто дефицит и недостаточность витамина Д выявлялись у девочек в возрасте 14–17 лет по сравнению с мальчиками соответствующего возраста (70,6% против 29,4%, c2=4,24, р<0,05) и девочками в возрасте 5–9 лет (70,6% против 17,4%, c2=9,42, р<0,01).
Уровни общего и ионизированного кальция, а также ионизированного магния и 25(ОН)Дtotal не различались между возрастными группами. По мере взросления детей отмечается снижение экскреции фосфора с мочой, что отражает соотношение фосфора и креатинина в моче и может использоваться в качестве критерия гиперфосфатемии (95-й перцентиль для возраста 5–9 лет – 1,6, 10–13 лет – 1,23 и 14–17 лет – 1,1). Также отмечается снижение нормальных уровней фосфора плазмы крови с наступлением пубертата. Наибольшие значения b-Cross Laps выявлены в препубертате, что, по-видимому, связано с высокой скоростью костного обмена (табл. 2).
Таблица 2. Уровни общего и ионизированного кальция, ионизированного магния, фосфора, витамина Д, b-Cross Laps, в крови и соотношение фосфор/креатинин в моче у здоровых детей в зависимости от возраста (M±d)
|
Параметр
|
Возраст, лет
|
Р
|
|
5–9
(n=37)
|
10–13
(n=36)
|
14–17
(n=33)
|
|
Са общ., ммоль/л
|
2,53±0,06
|
2,53±0,06
|
2,5±0,07
|
–
|
|
Са ион., ммоль/л
|
1,21±0,06
|
1,19±0,06
|
1,19±0,06
|
–
|
|
Mg, ион., ммоль/л
|
0,55±0,04
|
0,53±0,04
|
0,53±0,04
|
–
|
|
РО4, ммоль/л
|
1,66±0,15
|
1,68±0,18
|
1,46±0,16
|
5–9/14–17, 10–13/14–17 <0,001
|
|
25(ОН)Дtotal, нг/мл
|
34,4±8,5
|
30,7±7,3
|
32,4±11,4
|
|
|
b-Cross Laps, нг/мл
|
1,15±0,26
|
1,42±0,47
|
0,92±0,54
|
5–9/10–14, 5–9/14–17 <0,05
|
|
РО4/ креатинин (моча)
|
1,15±0,45
|
0,93±0,3
|
0,85±0,25
|
5–9/10–14<0,01
5–9/14–17 <0,001
|
При проведении корреляционного анализа не выявлено связи между значениями 25(ОН)Дtotal и другими параметрами, представленными в табл. 2. Статистически значимая связь средней силы была выявлена между уровнями фосфора и b-Cross Laps (r=0,52, р<0,05).
Общая щелочная фосфатаза в крови представлена в основном костным и печеночным изоферментами. Рост концентрации костной фракции коррелирует с остеобластической активностью, поэтому самый высокий уровень этого изофермента наблюдается в период активного роста ребенка. Это объясняет высокие уровни ЩФ в возрасте 5–9 и 10–13 лет. Максимальная активность ремоделирования костной ткани в 10–13 лет также подтверждается высокими уровнями остеокальцина, отражающего процессы формирования кости. С увеличением возраста ребенка снижается экскреция кальция с мочой, направленная на его сохранение для построения костной ткани (табл. 3).
Таблица 3. Уровни ЩФ, ПТГ, остеокальцина, витамина Д в крови, соотношение Са/креатинин и проба Сулковича в моче у здоровых детей в зависимости от возраста (Me (P25; P75)
|
Параметр
|
Возраст, лет
|
Р
|
|
5–9 (n=36)
|
10–13 (n=36)
|
14–17 (n=32)
|
|
ЩФ, МЕ/л
|
271,2
(238,8; 312,7)
|
276,4
(244,6; 322,9)
|
115,9
(78,4; 188,7)
|
5–9/14–17, 10–13/14–17 <0,001
|
|
ПТГ, нг/мл
|
19
(17; 23,3)
|
23,8
(19,2; 31,2)
|
27,6
(20,9; 30,4)
|
5–9/10–13, 5–9/14–17 <0,01
|
|
Остеокальцин, нг/мл
|
83,8
(70,3; 98,7)
|
118
(78,6; 140,8)
|
45,7
(33,8; 82,5)
|
5–9/10–13<0,05
10–13/14–17 <0,001
|
|
25(ОН)Дtotal, нг/мл
|
32,9
(28,6; 41,4)
|
30,6
(25,3; 34,2)
|
29,9
(23,5; 40,8)
|
–
|
|
Са/креатинин (моча)
|
0,13
(0,1; 0,2)
|
0,09
(0,05; 0,17)
|
0,1
(0,06; 0,12)
|
5–9/10–13, 5–9/14–17 <0,05
|
|
Проба Сулковича
|
2 (2; 3)
|
2 (1; 3)
|
2 (1; 3)
|
–
|
При проведении корреляционного анализа была выявлена статистически значимая отрицательная связь средней силы между уровнями 25(ОН)Дtotalи ПТГ (rs= –0,46, р<0,05), положительная связь средней силы межу ЩФ и остеокальцином (rs= 0,67, р<0,05), соотношением Са/креатинин мочи и пробой Сулковича (rs= 0,63, р<0,05), слабая положительная связь между ПТГ и остеокальцином (rs= 0,24, р<0,05).
Оценка материального положения семей детей проводилась по разработанной нами балльной шкале. Большинство обследованных детей были из полных семей (85,5%), хорошим свое материальное положение считали 68,2%, оптимальным – 29,1% опрошенных, основную бытовую технику имели 99,1% семей, автомобиль – 78,2%, собственное жилье – 88,2%. Возможность отдыхать за рубежом и в Беларуси имелась у 70,9% детей.
На основании представленных результатов опроса, материальное положение семей было оценено в баллах с последующей градацией на: выше среднего – 39 (35,4%); достаточное – 54 (49,1%) и недостаточное – 17 (15,5%).
Также были исследованы физическая активность обследованных детей (рис. 2) и потребление ими продуктов, богатых кальцием и фосфором, а также препаратов кальция и фосфора за последние 6 месяцев (рис. 3).
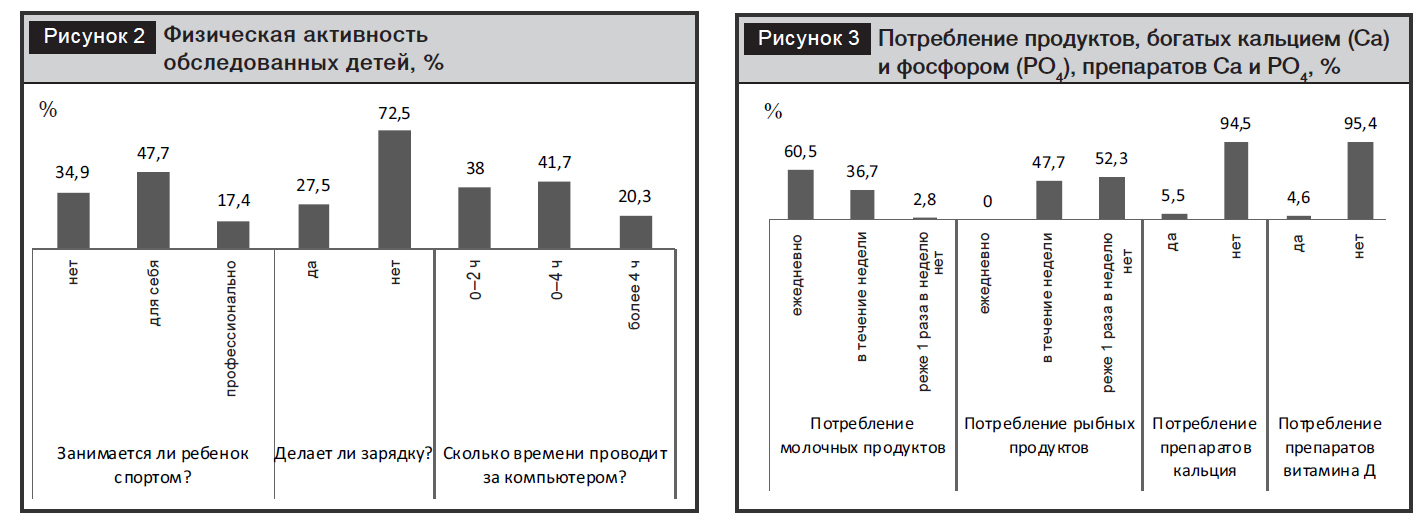
Анализ физической активности показывает, что треть детей не занимается каким-либо спортом, зарядку делают только 27,5%. При этом 62% опрошенных проводят за компьютером более 2 часов в день. Молочные продукты имеются в рационе не каждый день или еще реже у 39,5% детей. Потребление рыбы и продуктов на ее основе реже 1 раза в неделю отметили 52,3% обследованных. Очень мало детей принимали препараты кальция, витамина Д.
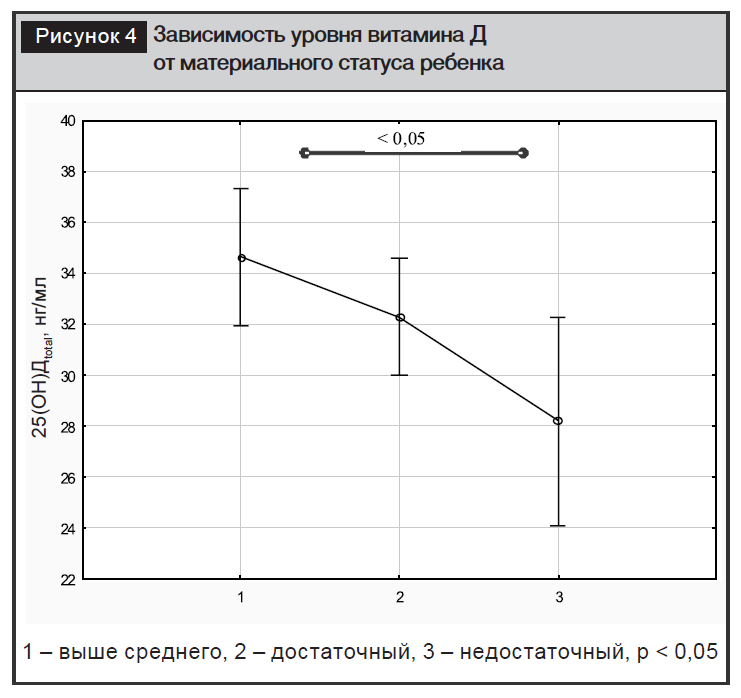
Выявлена тенденция к снижению уровней витамина Д в зависимости от материальной обеспеченности детей (рис. 4), с достижением значимых различий между крайними группами – наиболее и наименее обеспеченными материально (1 группа: материальное положение выше среднего: 25(ОН)Дtotal – 34,6±8,7 нг/мл, 2 группа: достаточное – 32,3±8,5 нг/мл, 3 группа: недостаточное 28,2±8,2 нг/мл, р1–3< 0,05).
Выводы:
1. Распространенность дефицита витамина Д среди здоровых детей одного из районов Минска составляет 7,1%, недостаточность витамина Д составляет 31,9%. Критическим по развитию недостаточности или дефицита витамина Д (до 70,6% случаев) является возраст 14–17 лет у девочек.
2. Несмотря на благополучное материальное положение семей большинства обследуемых, отмечается недостаточное потребление детьми продуктов, богатых кальцием и фосфором. С учетом высокого процента недостаточности витамина Д, особенно у девочек пубертатного возраста, этот факт говорит о необходимости назначения препаратов кальция и витамина Д с целью как профилактики, так и коррекции этих нарушений.
3. Выявлена существенная разница в обеспеченности витамином Д детей в зависимости от материального положения семьи.
4. Учитывая важность плейотропного действия витамина Д, нужна своевременная диагностика гиповитаминоза Д и ее коррекция.
Л И Т Е Р А Т У Р А
1. Адрианов Н.В. Витамин Д. // Электронная медицина. http://www.elm.su/vit_d.html.
2. Ляликов С.А., Сукало А.В., Кузнецов О.Е. Центильные характеристики антропометрических и лабораторных показателей у детей в современный период: инструкция по применению – Гродно, 2009. – 94 с.
3. Мальцев С.В., Мансурова Г.Ш. // Практич. медицина. – 2014. – Т.85, №9. – С.12–18.
4. Новиков П.В. Рахит и наследственные рахитоподобные заболевания у детей. – М.: Триада-Х, 2006. – 336с.
5. Риггз Б.Л., Мелтон Л.Д. Остеопороз. Этиология, диагностика, лечение. – М. – СПб., 2000. – 560 с.
6. Смирнова Г.Е., Витебская А.В., Шмаков Н.А. // Consilium medicum. – 2010. – №34. – С.7–12.
7. Шварц Г.Я. Витамин Д и Д-гормон. – М., 2005. – 152 с.
8. Шестерикова В.В., Иванова И.Е., Стержанова Н.В. // Лечение и профилактика – 2014. – Т.9, №1. – С.57–61.
9. Adams J.S., Hewison M.J. // J. Clin. Endocrinol. Metab. – 2010. – Vol.95, N2. – P.471–478.
10. Bouillon R., Bischoff-Ferrari H., Willett W. // J. Bone Miner. Res. – 2008. – Vol.23, N7. – P.974–979.
11. Gordon C.M. et al. // Arch. Pediatr. Adolesc. Med. – 2004. – Vol.158, N6. – P.531–537.
12. Holick M.F. // N. Engl. J. Med. – 2007. – Vol.357, N3. – P. 266–281.
13. Holick M.F. et al. // J. Clin. Endocrinol. Metab. – 2011. – Vol.97, N7. – P.1911–30.
14. Liu P.T. // Science. – 2006. – Vol.311, N5768. – P. 1770–1773.
15. Mansbach J.M., Ginde A.A., Camargo C.A. // Pediatrics. – 2009. – Vol.124, N5. – P.1404–1410.
16. Pludowski P. et al. // Endokrynologia Polska. – 2013. – Vol.64, N4. – P.319–327.
17. Saintonge S., Bang H., Gerber L.M. // Pediatrics. – 2009. – Vol.123, N3. – P.797–803.
18. Weng F.L. et al. // Am. J. Clin. Nutr. – 2007. – Vol.86, N1. – P.150–158.
Медицинские новости. – 2015. – №11. – С. 69-72.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.