Mokhort T.V., Velesevich E.I., Mokhort E.G.
Belarusian State Medical University, Minsk
Pheochromocytoma: new approaches to diagnosis and management
Резюме. Одной из наиболее сложных проблем эндокринологии в настоящее время считается лечение пациентов с опухолями, секретирующими катехоламины. Многообразие патофизиологических механизмов развития заболевания, вызванное действием гормонов, вырабатываемых опухолью, обусловливает широкую вариабельность симптоматики и сложности в диагностике. При этом своевременный диагноз непосредственно влияет на прогноз и качество жизни пациентов.
Ключевые слова: феохромоцитома, катехоламины,надпочечники, диагноз, лечение.
Summary. One of the most difficult problems of endocrinology is the treatment of patients with catecholamines secreting tumors. The variety of pathophysiological mechanisms of the disease caused by hormones action leads to wide variability of symptoms and difficulty in diagnosis. This early diagnosis directly affects the prognosis and quality of life of patients.
Keywords: pheochromocytoma, catecholamines, adrenal glands, diagnosis, management.Первое описание феохромоцитомы (ФХ) датируется 1886 годом, когда немецкий патологоанатом Frankel впервые описал ФХ, найденную при аутопсии в двух надпочечниках у 18-летней девушки, внезапно умершей от коллапса. Однако до сих пор одной из наиболее сложных и интересных проблем эндокринологии и в настоящее время считается лечение больных с опухолями, секретирующими катехоламины (КА). Многообразие патофизиологических механизмов развития заболевания, вызванное действием гормонов, вырабатываемых опухолью, обусловливает широкую вариабельность симптоматики и сложности в диагностике. При этом своевременно установленный диагноз непосредственно влияет на прогноз и качество жизни пациентов.
В последние десятилетия произошли изменения в диагностической и лечебной тактике при ведении ФХ, которые нашли отражение в клинических рекомендациях Европейского общества эндокринологов, выпущенных в 2014 году [5].
Феохромоцитома – гормонально (МЭН) [3].-активная опухоль хромаффинных клеток симпато-адреналовой системы надпочечниковой или вненадпочечниковой локализации, секретирующая избыточное количество КА (адреналин, норадреналин (НА), дофамин). Параганглиома – опухоль, происходящая из вненадпочечниковых хромаффинных клеток симпатического паравертебрального ганглия грудной клетки, брюшной полости и таза или парасимпатических ганглиев (нехромаффинная ткань), расположенных вдоль языкоглоточных и вагусных нервов шеи и основания черепа; они не производят катехоламины. ФХ – частный случай параганглиом, может являться составляющей синдрома множественной эндокринной неоплазии
Клетки диффузной симпатической нервной системы, симпатических паравертебральных, паравазальных ганглиев и мозгового вещества надпочечников имеют единое происхождение – из нейроэктодермальных клеток, из которых возможно развитие ФХ. Кроме того, диффузные очаги хромаффинной ткани располагаются в оболочках различных органов (перикард, стенка мочевого пузыря, менингеальные оболочки), в околопрямокишечной клетчатке, простате, glomus carotis. Небольшие группы хромаффинных клеток могут располагаться практически в любой области туловища, головы и шеи человека (рис. 1). Результатом является то, что на дооперационном этапе и даже интраоперационно, иногда невозможно четко определить органную принадлежность хромаффинной опухоли. Например, опухоль, по результатам топических исследований казавшаяся исходящей из надпочечника, во время интраоперационной ревизии оказывается к нему тесно прилежащей, расположенной в области ворот почек.
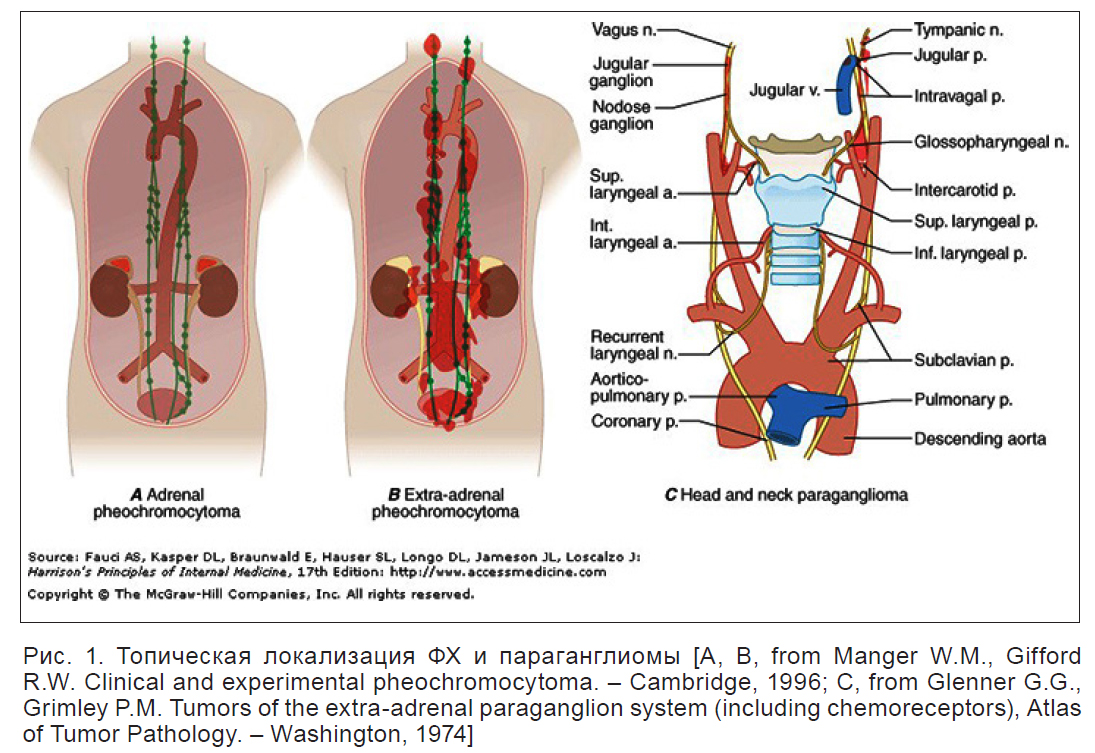
В настоящее время не представляется возможным говорить об абсолютной прижизненной диагностике хромаффинных опухолей надпочечников. Есть мнение, что приблизительно у 1/3 больных диагноз ФХ при жизни установить не представляется возможным. ФХ обнаруживают у 0,2–0,6% пациентов с постоянной формой артериальной гипертензии (АГ), особенно диастолическим артериальным давлением. В общей популяции ФХ встречается сравнительно редко – менее 1:200 тысяч в год, а заболеваемость составляет не более 1 человека на 2 млн населения. При оценке выявления ФХ по данным аутопсии ее распространенность составляет 0,05–0,1%. Опухоль может возникнуть в любом возрасте (чаще в 20–40 лет) с одинаковой частотой у мужчин и женщин. Множественные опухоли обнаруживаются в 8–10% случаев [3, 4].
В 80% случаев ФХ возникают спорадически, в 10–20% случаев носят семейный характер. По данным проспективных и ретроспективных генетических исследований на больших выборках пациентов с хромаффинными опухолями, выявлено, что до 25–30% больных имеют генетические дефекты, передающиеся по аутосомно-доминантному типу. Именно эти мутации ответственны за фенотипическую реализацию ФХ, поэтому единственным надежным методом диагностики наследственного характера заболевания является генетическое типирование, которое должно быть доступно, так как необходимо для определения лечебной тактики [1, 3–5, 8, 9]. Известно, что ФХ могут быть проявлением нескольких наследственных заболеваний, передающихся по аутосомно-доминантному типу, в том числе:
• МЭН 2А типа, или синдрома Сиппла (в сочетании с медуллярным раком щитовидной железы (ЩЖ) и, достаточно редко, с гиперплазией и/или аденомами околощитовидных желез, а также кожным амилоидозом);
• МЭН 2В типа, или синдрома Горлина (в сочетании с медуллярным раком ЩЖ, кожными невриномами, артериальной гипертензией, морфаноподобной внешностью (кифосколиозом или лордозом, гипермобильностью суставов), множественными ганглионевромами слизистой оболочки желудочно-кишечного тракта);
• синдрома фон Хиппеля – Линдау (в сочетании с гемангиоматозом сетчатки, спинномозговыми гемангиомами и гемангиобластомами, реже со светлоклеточным раком почки, множественными кистами почек, поджелудочной железы, опухолями среднего уха и др.);
• нейрофиброматоза 1 типа (в сочетании с множественным нейрофиброматозом, костными аномалиями, глиомами центральной нервной системы, макроцефалией, когнитивным дефицитом).
В клетках ФХ синтезируются КА, выброс которых может провоцироваться изменениями кровотока, некрозом в ткани опухоли и другими причинами, которые и определяют симптоматику заболевания. Кроме того, ФХ секретируют большое число пептидов, в том числе эндогенные опиоиды, адреномедуллин, эндотелин, эритропоэтин, нейропептид Y (мощный вазоконстриктор) и др. Разнообразие адренергического рецепторного аппарата, большое количество органов, в которых он представлен, возможность смешанной опухолевой секреции – факторы, объясняющие разнообразие клинических проявлений. Неслучайно ФХ образно называют и «великим имитатором», и «истинной фармакологической бомбой», и «импрессионистской опухолью».
ФХ обычно дебютирует признаками, связанными с избыточной продукцией КА и их системным действием на органы и системы с преобладанием, как правило, сердечно-сосудистых изменений. Однако далеко не всегда гемодинамические колебания при ФХ оказываются прямым следствием увеличенной выработки катехоламинов непосредственно опухолью. К факторам, влияющим на колебания артериального давления при ФХ, относится наличие значительного запаса КА в окончаниях симпатических нервов. Норадреналин (НА), выделяемый этими окончаниями, действует на рецепторы эфферентных клеток в синапсе, поэтому любая стимуляция симпатической нервной системы может вызвать криз, обусловленный нейрогенными эффектами НА, выброшенного из синаптических депо, а не из хромаффинной опухоли. В этом случае не наблюдается значительного повышения концентрации КА в крови, вектор и амплитуда изменения частоты сердечных сокращений вариабельны и индивидуальны, неоднозначна и реакция сосудов на гиперсекрецию КА.
Патофизиологические изменения при ФХ включают развитие централизации кровообращения и уменьшение объема циркулирующей жидкости в результате повышения периферического сосудистого сопротивления и эффекта шунтирования. Гиповолемия усугубляется выходом жидкости из сосудистого русла в так называемое «третье пространство» из-за изменения проницаемости сосудистой стенки вследствие формирования фибромускулярной дисплазии при длительном сосудистом спазме в результате стойкой вазоконстрикции. Развитие гиповолемии усугубляют потливость и хронические запоры. Гиповолемия при ФХ – один из ведущих синдромов, определяющих тяжесть состояния больного, кроме того, она маскирует результаты измерения периферического артериального давления, что приводит к диагностическим ошибкам. Синдром гиповолемии в значительной степени ответственен за нарушения микроциркуляции в жизненно важных органах.
Нарушение деятельности сердечно-сосудистой системы включает развитие морфологических изменений в миокарде на фоне избытка КА. Часто причиной поздней диагностики ФХ является гипердиагностика ишемии миокарда, не имеющей специфических электрокардиографических и лабораторных признаков разрушения миокардиоцитов. При невозможности дифференцировать изменения, обусловленные результатом прямого воздействия КА на миокард, возникновение аритмий, некрозов миокарда, лабораторного цитолитического синдрома электро- и эхокардиографических изменений при ФХ в подавляющем большинстве не связаны с изменениями коронарного кровообращения. Поэтому такие термины как «инфаркт», «стенокардия» не следует применять при ФХ, так как трофический (сосудистый) фактор в этой ситуации не является лидирующим в повреждении миокарда [3, 4, 8, 9].
Кардиотоксические изменения при избытке КА обусловлены метаболическими нарушениями и приводят к токсической катехоламиновой миокардиодистрофии. Высокая постнагрузка на фоне некоронарогенной миокардиодистрофии или некроза миокарда может привести к возникновению острой левожелудочковой недостаточности (сердечной астме, отеку легких). При длительном анамнезе ФХ и прогрессирующем кардиосклерозе на фоне гипертрофии миокарда возникает концентрическая, а затем дилатационная кардиомиопатия, приводящая к хронической сердечной недостаточности. Пароксизмы нарушения сердечного ритма становятся у этих больных фактором высокого риска внезапной сердечной смерти.
На фоне учащения эпизодов выброса КА в кровоток и увеличения интенсивности их секреции может возникнуть состояние «неуправляемой гемодинамики», при котором происходит частая и беспорядочная смена эпизодов повышенного и пониженного АД, которое практически не корректируется медикаментозно или отмечается парадоксальный ответ на введение препаратов. Главная угроза в этом состоянии кроется в возможности внезапного развития катехоламинового шока, который отличается от состояния «неуправляемой гемодинамики» тем, что при его развитии отмечается стойкая неуправляемая артериальная гипотензия на фоне нарушений сердечного ритма и неэффективного сердечного выброса. Это явление обусловлено изменением чувствительности адренорецепторов на фоне постоянной интенсивной стимуляции, истощением клеток проводящей системы сердца, а также изменением механизмов инактивации КА. К прогрессированию артериальной гипотензии приводит гиповолемия, которая прямо пропорциональна интенсивности и продолжительности КА интоксикации [6–8].
Причины синдрома «неуправляемой гемодинамики» включают:
• любые оперативные вмешательства, травмы, роды в случае недиагностированной ФХ или при известной ФХ без проведения адекватной предоперационной подготовки;
• неправильные диагностические или лечебные решения при лечении ФХ.
При ФХ может развиться «вторичный» сахарный диабет, что обусловлено ускорением гликогенолиза в печени и уменьшением выработки инсулина (в результате стимуляции ?-адренорецепторов поджелудочной железы), однако наиболее часто встречается предиабет или стрессовая (пароксизмальная) гипергликемия на фоне гипертензивного криза (10–40%).
О классическом течении ФХ говорят при наличии гипертонических кризов с внезапным повышением систолического АД, которое может достигать 300 мм рт. ст. Кризы могут провоцироваться незначительной физической нагрузкой, пальпацией живота, иногда приемом ?-адреноблокаторов, а при локализации ФХ в стенке мочевого пузыря – мочеиспусканием; сопровождаются учащенным сердцебиением (до 180 ударов/мин), аритмиями и/ или изменениями на электрокардиограмме по типу острой коронарной ишемии. Также во время приступа нередко отмечаются тремор, шум в ушах, беспокойство или страх, бледность кожных покровов, особенно кистей и стоп (возможен синдром Рейно), расширенные зрачки, потливость, боли в груди или животе, тошнота или рвота. Продолжительность приступа варьирует от нескольких минут до нескольких часов, заканчивается обычно внезапно.
К дополнительным симптомам относят ортостатическую гипотонию, потливость, постоянные головные боли, ощущение внутренней дрожи, беспокойство, общую слабость, снижение трудоспособности.
Осложнения ФХ включают сердечную недостаточность, аритмии, тахикардию, катехоламиновый шок, нарушение мозгового кровообращения, почечную недостаточность, гипертоническую энцефалопатию, ишемический колит, расслаивающую аневризму аорты, остановку кровообращения во время введения в общую анестезию, у беременных – лихорадку, эклампсию, шок, смерть матери или плода.
Многократные попытки создания моделей клинического течения ФХ в зависимости от преобладающего типа гормональной секреции не увенчались успехом. Это объясняется:
– вариабельностью развития рецепторного аппарата к КА в различных органах;
– избыточным депонированием КА благодаря механизму обратного нейронального захвата в пресинаптических окончаниях симпатической нервной системы;
– расстройством рецепторной чувствительности на фоне длительно существующей гиперкатехоламинемии;
– нарушением системного контроля за гемодинамикой в условиях относительной гиповолемии.
Макроскопически опухоль имеет вид узла шаровидной формы, на разрезе бурого или буровато-серого цвета различных размеров (>20 см в диаметре). ФХ небольших размеров (1–3 см в диаметре), иногда не имея четкой капсулы, переходят в окружающее мозговое вещество надпочечника. Примерно 10–15% ФХ являются злокачественными. Вероятность злокачественности повышается при увеличении экскреции дофамина с мочой, размерах опухоли более 6 см и признаках вненадпочечникового роста. Признаки малигнизации могут проявиться спустя несколько лет после хирургического вмешательства.
В международной гистологической классификации (ВОЗ, 2000) категория злокачественной ФХ отсутствует, так как морфологические критерии ее злокачественности до настоящего времени не определены. Ранее считали, что инвазия капсулы и сосудов, ядерный и клеточный полиморфизм, выраженная митотическая активность, наличие очагов некроза являются вполне достаточными признаками для верификации злокачественной ФХ. В настоящее время единственным абсолютным доказательством злокачественности ФХ является метастазирование в анатомические области, в которых отсутствуют параганглии (наиболее часто – лимфатические узлы, кости, легкие, печень) [1, 3–9].
Диагностика и рекомендуемые клинические исследования
Основанием для обязательного обследования с целью исключения или подтверждения диагноза ФХ являются следующие симптомы (как изолированные, так и выявленные в любой комбинации):
– гипертонические кризы с очень высоким артериальным давлением, обычно проходящие без лечения;
– артериальная гипертензия у детей;
– гипертонические кризы, провоцируемые приемом лекарств (табл. 1), наркозом, физической нагрузкой, мочеиспусканием, дефекацией или иными факторами;
– инциденталома надпочечников;
– множественные ганглионевромы слизистых оболочек ЖКТ, нейрофиброматоз кожи, гемангиоматоз сетчатки;
– ФХ в анамнезе или у родственников.
Таблица 1
Лекарства, прием которых может вызывать побочные реакции в виде ускорения развития криза у пациентов с феохромоцитомой (Diagnosis and Treatment of Pheochromocytoma and Paraganglioma, 2014)
|
Класс лекарственных средств
|
Примеры
|
|
Антагонисты допамина D2-рецепторов (в том числе некоторые противорвотные препараты и нейролептики)
|
Метоклопрамид, сульпирид, амисульприд, тиаприд, аминазин, прохлорперазин, дроперидол
|
|
ß-адреноблокаторы
|
Пропранолол, соталол, тимолол, надолол, лабетолол
|
|
Симпатомиметики
|
Эфедрин, псевдоэфедрин, фенфлурамин, метилфенидат, фентермин, дексамфетамин
|
|
Опиоидные анальгетики
|
Морфин, петидин, трамадол
|
|
Ингибиторы обратного захвата норадреналина
(в том числе трициклические антидепрессанты)
|
Амитриптилин, имипрамин
|
|
Ингибиторы обратного захвата серотонина
|
Пароксетин, флуоксетин
|
|
Ингибиторы моноаминоксидазы
|
Транилципромин, моклобемид, фенелзин
|
|
Глюкокортикоиды
|
Дексаметазон, преднизолон, гидрокортизон, бетаметазон
|
|
Пептиды
|
АКТГ, глюкагон
|
|
Миорелаксанты
|
Сукцинилхолин, тубокурарин, атракуриум
|
Диагностика ФХ основана на результатах лабораторных исследований и топической диагностики опухоли.
Лабораторная диагностика ФХ включает [10–12]:
• определение концентрации КА (адреналина, норадреналина) или их метаболитов (ванилилминдальной и гомованилиновой кислот) в моче, собранной за сутки или за 3 часа, прошедших после начала приступа (метод недостаточно специфичен, поэтому в настоящее время не рекомендован экспертами);
• определение свободных КА в плазме, перед забором крови пациент должен спокойно лежать на спине не менее 30 мин (метод недостаточно надежен из-за быстрого разрушения КА (в течение 10–15 с), а также из-за низкой специфичности);
• «золотой стандарт» в диагностике ФХ – определение концентрации метанефрина и норметанефрина в плазме или в суточной моче (чувствительность метода достигает 99%, а специфичность – 85–89%). Даже при невысокой концентрации КА в крови уровень метанефринов при ФХ всегда повышен. Метанефрины устойчивы в течение 24 часов, поэтому их определение не связано по времени с моментом выброса гормонов опухолью. Высокая диагностическая точность определения свободных метанефринов в плазме сейчас подтверждена независимыми исследованиями [12]. У пациентов с ФХ в подавляющем большинстве случаев повышен хотя бы один показатель (норметанефрин >400 нг/л [2,2 нмоль/л] или метанефрин >236 нг/л [1,2 нмоль/л]).
Ложноположительные результаты тестирования могут быть обусловлены использованием лекарственных препаратов (трициклические антидепрессанты, феноксибензамин, леводопа, мочегонные в высокой дозе), другими веществами (кофе, никотин, контрастные вещества, злаковые) или состояниями (застойная сердечная недостаточность, стресс, депрессия, панические расстройства), которые могут влиять на саму методику определения концентрации КА или на их метаболизм. Таким образом, отрицательный результат определения уровня КА на фоне приема вышеперечисленных препаратов, веществ и состояний можно считать в своем роде высокочувствительным тестом, особенно при проведении исследования методом жидкостной хроматографии с масс-спектрометрическим или электрохимическим методом [5].
Для подтверждения гормональной активности опухоли длительное время использовали провокационные пробы (гистамин, глюкагон, метоклопрамид, физическая нагрузка) и подавляющие (клонидин, фентоламин) тесты. Провокационные пробы сопряжены с большим количеством осложнений, поэтому практически не применяются.
Центральные агонисты ?-адренорецепторов понижают тонус сосудодвигательного центра продолговатого мозга и подавляют импульсацию в симпатическом звене периферической нервной системы на пресинаптическом уровне, однако не способны снизить секрецию КА опухолью. Согласно стандартной методике, первый забор крови проводят для определения базальной концентрации метанефринов, повторный – через 3 часа после приема клонидина в дозе 0,3 мг на 70 кг массы тела. Критерием исключения диагноза ФХ считают снижение концентрации норметанефрина в плазме крови до нормальных значений. Специфичность метода достигает 100%, чувствительность – до 98%. Таким образом, тест с клонидином в комбинации с определением концентрации норметанефрина в крови или в моче – эффективный и надежный метод исключения ложноположительных результатов [13].
В сомнительных случаях целесообразно определять концентрацию хромогранина А в крови. Она повышена у 86% пациентов с ФХ. Этот показатель часто используют при ведении пациентов со злокачественной ФХ как маркер наличия опухоли и прогрессирования болезни. Концентрация хромогранина А >225 нг/ мл соответствует положительному результату. Специфичность метода в отношении ФХ достигает 89%, чувствительность – 87% [14].
Иногда причиной диагностических ошибок при ФХ небольшого размера становится повышение концентрации альдостерона. Если при этом не исследована активность ренина плазмы, повышение которой указывает на вторичную природу гиперальдостеронизма, возможна постановка ошибочного диагноза (диагностируют альдостерому). К клинически значимым проявлениям вторичного гиперальдостеронизма при ФХ относится гипокалиемия, требующая предоперационной коррекции.
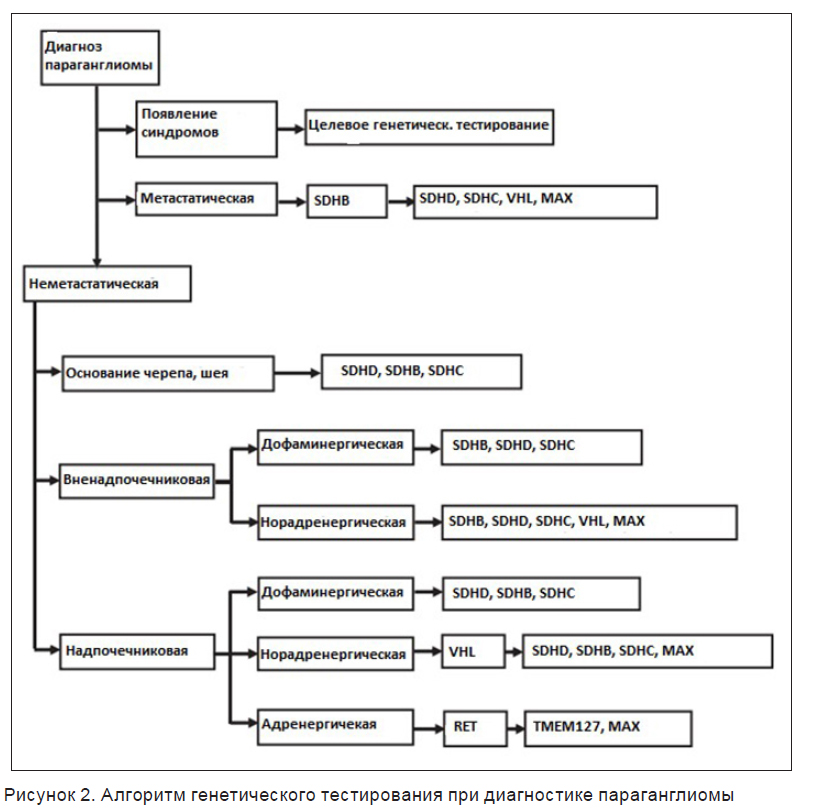
С учетом преобладающего типа секреции необходимо корректировать показания к генетической диагностике [15–19]. При изолированном повышении концентрации метанефрина и нормальном содержании норметанефрина практически отсутствует вероятность вненадпочечниковой локализации опухоли; актуально типирование гена RET, поиск мутации VHL (вызывает синдром фон Хиппеля – Линдау), а типирование гена SDH (сукцинатдегидрогеназы, чаще субъединицы D, хотя описаны и другие) нецелесообразно. Напротив, при изолированном повышении концентрации норметанефрина и нормальном содержании метанефрина практически отсутствует вероятность синдрома МЭН 2, не показано секвенирование RET, но необходимо исследование VHL и SDH. При смешанном типе секреции необходимо исследование всего спектра возможных мутаций, в том числе гена мик-ассоцированного фактора (MAX), гена трансмембранного протеина 127 (TMEM 127), гена фактора, индуцируемого гипоксией 2? (HIF2A), и др. [20].
Экспертами предложен алгоритм генетического тестирования, основанный на локализации патологического процесса и особенностях клинических проявлений (рис. 2) [9].
Топическая диагностика ФХ – сложный и необходимый процесс окончательной диагностики. При сонографическом исследовании в большинстве наблюдений ФХ надпочечниковой локализации при обнаружении выглядит как гетерогенная (по сравнению с нормальной тканью надпочечника) опухоль округлой или овальной формы, что обусловлено наличием опухолевых кровоизлияний, некрозов, очагов фиброза и кальцификацией.
Согласно международным рекомендациям как вариант визуализации первой линии с отличным пространственным разрешением для грудной клетки, живота и таза эксперты отдают предпочтение именно КТ, а не МРТ. КТ с контрастированием обладает высокой чувствительностью (88–100%). МРТ рекомендуется проводить лицам с метастатическими хромаффиномами для обнаружения образований у основания черепа и шеи, с хирургическими клипсами, когда видны артефакты, при невозможности выполнения КТ и пациентам, у которых уровень радиационной нагрузки должен быть ограничен (дети, беременные и лица, получавшие накануне большие дозы облучения) [21].
Несмотря на высокую чувствительность КТ и МРТ, в некоторых наблюдениях крайне важна идентификация хромаффинной природы опухоли. Для точности диагностики может использоваться в комбинации с однофотонно-эмиссионным КТ (single-photon emission CT или SPECT). Наибольшая специфичность функциональной топической диагностики отмечена при применении сцинтиграфии с мета-йод-бензилгуанидином, который концентрируется в клетках хромаффинной ткани и интегрируется в процесс синтеза КА. Через 1, 3 и 6 часов после внутривенного введения препарата при сканировании неизмененная надпочечниковая ткань редко поглощает изотоп, но его поглощают 90% ФХ. К отрицательным сторонам метода относится высокая лучевая нагрузка, длительность, сложность четкой дифференцировки опухоли из-за накопления препарата в кишечнике, печени, желчном пузыре. Накопление мета-йод-бензилгуанидина может быть уменьшено при приеме симпатомиметиков, трициклических антидепрессантов, блокаторов кальциевых каналов и некоторых комбинированных ?- и ?-адреноблокаторов (лабеталол), в связи с чем большинство этих препаратов должно быть отменено в течение 2 недель до проведения сцинтиграфии [22, 23].
В последние годы накапливается информация о применении позитронно-эмиссионной томографии (ПЭТ) при ФХ. Этот метод сочетает преимущества томографического исследования и сцинтиграфии. При проведении ПЭТ используют различные специфичные радиофармпрепараты. В настоящее время рекомендуется использование 18F?-фтордезоксиглюкозы (18F -ФДГ), так как рецепторы транспортера глюкозы экспрессированы на клетках хромаффином. Однако с учетом наличия и других экспрессированных рецепторов на клетках опухоли ведутся исследования по оценке возможности использования 18-фторДОФА (рецепторы ДОФА), 133InDTPA pentreotide и 68Ga-DOTA peptides (рецепторы соматостатина), 121/131 мета-йод-бензилгуанидина, 18-флюдгидроксидопаминa, 11С-гид-роксиметанефрина [24, 25].
Единственный радикальный метод лечения ФХ – хирургический. В связи с высоким риском развития осложнений удаление опухоли должно быть проведено в короткие сроки после диагностики, но операция может быть отложена в случаях острых состояний (нарушение коронарного или мозгового кровообращения, выраженная сердечно-сосудистая недостаточность) до улучшения состояния. Перед операцией необходимо стабилизировать артериальное давление и восполнить объем циркулирующей крови, что может быть достигнуто за несколько дней. Удаление опухоли рекомендуется осуществлять в клиниках, имеющих опыт ведения пациентов с ФХ, для обеспечения снижения послеоперационной летальности.
Для проведения стабилизирующей терапии у пациентов с ФХ необходимо оценить тяжесть состояния, определить приоритеты и критерии адекватности предстоящего лечения. Следует учитывать, что размер опухоли, стаж артериальной гипертензии, амплитуда и частота гипертензивных кризов не являются надежными критериями оценки тяжести состояния пациентов с ФХ. Тяжесть состояния оценивается по функциональному состоянию органов-мишеней КА – сердца, почек, головного мозга, так как это в большей степени влияет на интра- и послеоперационный прогноз. Основная стратегическая цель предоперационной подготовки – увеличение функциональных резервов органов-мишеней перед предстоящей операцией и неизбежными гемодинамическими кризами.
Состояние «неуправляемой гемодинамики» – относительное противопоказание для проведения экстренной операции. Смертность при экстренных вмешательствах достигает 30%. Современный подход позволяет избежать экстренного вмешательства при правильном применении предоперационной подготовки с использованием максимальных доз блокаторов ?-адренорецепторов длительного действия (10–16 мг доксазозина) перорально или через зонд, восполнением в кратчайшие сроки объема циркулирующей крови под контролем центрального венозного давления, ЭКГ, баланса жидкости. После купирования состояния «неуправляемой гемодинамики» продолжают плановую подготовку к операции.
Применение селективных ?-адреноблокаторов ассоциировано с более значимым снижением пред-операционного диастолического давления, интраоперационной тахикардии и артериальной гипотензии после «отключения» опухоли от центрального кровотока на этапе перевязки центральной вены надпочечника и лучшими постоперационными гемодинамическими эффектами, а также с более низкой частотой развития побочных эффектов (реактивная тахикардия и постоперационная гипотензия) по сравнению с неселективными адреноблокаторами [26, 27].
До недавних времен считали, что пролонгированные блокаторы ?-адренорецепторов и препараты, влияющие на синтез КА, должны быть отменены накануне плановой операции. Эта рекомендация была связана с риском развития коллапса после «отключения» опухоли от центрального кровотока на этапе перевязки центральной вены надпочечника. Дополнительным аргументом в пользу такой тактики было отсутствие возможности применить в момент коллапса миметики ?-адренорецепторов на фоне их блокады. В настоящее время критерием адекватности подготовки считают стабильное отсутствие гипертензивных кризов не менее 2 недель, нормализацию «фонового» артериального давления, отсутствие гиповолемии (клинически по результатам ортостатической пробы и объективно по результатам измерения центрального венозного давления).
При проведении адекватной подготовки применение блокаторов ?-адренорецепторов пролонгированного действия непосредственно перед операцией снижает число и амплитуду интраоперационных гипертензивных кризов, уменьшает риск и амплитуду артериальной гипотензии после «отключения» опухоли от центрального кровотока.
Необходимо акцентировать внимание на типичных ошибках при проведении предоперационной подготовки. Наиболее частая ошибка – отмена или снижение дозы ?-адреноблокаторов при постуральной артериальной гипотензии или тахикардии. Эти проявления связаны с патогенетически обусловленным дефицитом объема циркулирующей жидкости, а не с прямым действием препаратов. В начале лечения необходимо соблюдать строгий постельный режим в течение 2–3 дней, после чего происходит компенсация гиповолемии. Купировать артериальную гипотензию путем введения жидкости без применения блокаторов ?-адренорецепторов нецелесообразно, при этом дозу препарата необходимо ежедневно постепенно повышать до достижения целевых показателей.
Наличие исходной артериальной гипотензии ошибочно считают противопоказанием к применению ?-адреноблокаторов в связи с опасностью усугубления гипотензивного эффекта. Однако наиболее тяжелое состояние наблюдается у пациентов со стойкой артериальной гипотензией или тенденцией к ней в период между приступов. Средством выбора для этих пациентов считаются пероральные пролонгированные ?-адреноблокаторы, позволяющие избежать состояния «неуправляемой гемодинамики» и катехоламинового шока.
Критерии эффективности пред-операционной подготовки при ФХ:
• уменьшение (исчезновение) гипертензивных приступов;
• купирование гиповолемического синдрома (клинически и по результатам предоперационного измерения центрального венозного давления);
• нивелирование нарушений ритма;
• коррекция метаболических расстройств.
Анестезиологическое пособие при ФХ имеет значимые особенности. Наиболее часто подъемом артериального давления сопровож-даются: введение в наркоз, интубация трахеи, поворот больного на операционном столе и этап хирургического выделения опухоли. Принципиально отмечается необходимость прямого или опосредованного контроля за объемом сердечного выброса на операционном столе. При проведении анестезиологического пособия по поводу ФХ необходимо мониторировать оксигенацию крови, частоту сердечных сокращений, ЭКГ, проводить капнографию, инвазивно измерять артериальное давление и центральное венозное давление, осуществлять контроль диуреза.
При выборе препаратов для обез-боливания во время операции следует руководствоваться их влиянием на симпатоадреналовую систему. К сожалению, нет анестетиков, способных предупредить развитие тяжелой гиперкатехоламинемии или блокировать действие КА на адренорецепторы. Но если при нейролептаналгезии и наркозе галотаном наблюдается лишь незначительное повышение концентрации адреналина и НА, то кетамин оказывает выраженное симпатомиметическое действие. Описаны случаи развития симпатоадреналового криза после введения дроперидола, а галотан, в свою очередь, сенсибилизирует миокард к воздействию КА, что может спровоцировать желудочковую экстрасистолию и/или пароксизм желудочковой тахикардии. Препаратами выбора для обезболивания пациентов с ФХ считают: пропофол, гексобарбитал, тиопентал натрия, диазепам, фентанил. Применяют также современные ингаляционные анестетики: изофлуран, севофлуран. Обладая мощным анестезирующим действием, они практически лишены аритмогенного эффекта.
Важным вопросом анестезиологического пособия при ФХ остается выбор препарата эффективного контроля интраоперационной гемодинамики, который должен обеспечить быстрый гипотензивный эффект при ультракоротком времени действия. На современном этапе отдается предпочтение периферическим вазодилататорам (нитропруссид натрия) или блокаторов ?-адренорецепторов (фентоламин, троподифен). Использование нитропруссида обеспечило анестезиологов мощным, быстро титруемым препаратом для управления внезапными колебаниями артериального давления. Применяемые ?-адреноблокаторы не так легко и титруются как нитропруссид натрия. Период полураспада нитропруссида натрия – несколько секунд, фентоламина, троподифена – 19 минут. Очевидно, что следовой эффект после введения ?-адреноблокаторов может усугубить артериальную гипотензию, возникающую после «отключения» опухоли от центрального кровотока. Использование ганглиоблокаторов нецелесообразно, а при развитии криза их применение неэффективно [3, 4].
Интраоперационные нарушения кардиального ритма (тахикардия, наджелудочковые экстрасистолы) купируются ?-адреноблокаторами (оптимальное средство, сочетающее кардиоселективность и короткий период действия – эсмолол), а выявление желудочковой экстрасистолии является показанием для введения лидокаина.
Удаление ФХ, как никакая другая операция, требует четкого взаимодействия хирурга и анестезиолога, так как изменение артериального давления непосредственно зависит от действий оператора. Хирург должен сообщать анестезиологу о ходе операции, особенно о моменте пережатия центральной надпочечниковой вены: тогда концентрация КА быстро снижается и, несмотря на то что остается значительно выше нормальных значений, происходит дилатация артериол, что приводит к резкому увеличению объема сосудистого русла при прежнем объеме циркулирующей крови. Артериальное давление при этом может резко снижаться. В связи с временной рефрактерностью к КА любые попытки стабилизации гемодинамики применением вазопрессоров без коррекции объема циркулирующей жидкости бесперспективны. При этом в условиях адекватной пред-операционной подготовки риск развития критической артериальной гипотензии после отключения опухоли от центрального кровотока близок к нулю. После перевязки центральной надпочечниковой вены под контролем центрального венозного давления струйно вводят плазмозамещающие препараты, свежезамороженную плазму, растворы глюкозы и полиионные смеси. После нормализации артериального давления скорость введения уменьшают.
При длительной и травматичной операции по поводу множественных опухолей (двусторонних ФХ) или повторных операциях на контрлатеральном надпочечнике необходима заместительная гормональная терапия глюкокортикостероидами.
Хирургический доступ определяется локализацией опухоли. В связи с развитием эндоскопической хирургии в настоящее время у пациентов с ФХ до 10 см в диаметре операцией выбора считают лапароскопическую адреналэктомию, которая может осуществляться транс- или ретроперитонеально (в зависимости от предпочтений хирурга) [28]. При билатеральной ФХ пытаются провести не тотальное удаление надпочечников, а резекцию минимально пораженного.
При определении объема оперативного вмешательства руководствуются разделением ФХ на две группы.
В первую группу включены опухоли, имеющие высокую вероятность истинного рецидива:
– наличие регионарных или отдаленных метастазов;
– местное распространение опухоли на капсулу прилежащих органов или крупные сосуды;
– двустороннее поражение надпочечников или мультицентрические опухоли;
– генетически детерминированные ФХ.
Во вторую группу входят опухоли, имеющие только морфологические признаки опухолевого роста:
– ядерный и клеточный полиморфизм и атипия;
– наличие сосудистой и капсулярной инвазии.
Наибольшую опасность в отношении истинного рецидива опухоли при субтотальных резекциях надпочечника представляют опухоли первой группы. Сохранение ткани надпочечника позволяет избежать надпочечниковой недостаточности, но не снижает риск возникновения местного рецидива опухоли, а оперативное лечение в условиях рубцового процесса несет в себе большую вероятность осложнений, чем при первичных операциях.
Рецидив ФХ чаще всего обусловлен герминальными и соматогенными мутациями, для которых свойственна высокая фенотипическая пенетрантность тотального поражения мозгового слоя надпочечников. При мультицентрической ФХ надпочечника любого происхождения (генетически обусловленного или спорадического), даже если количество резидуального мозгового вещества надпочечников минимально, существует высокая вероятность рецидива. При органосохраняющих операциях невозможно не сохранить часть мозгового слоя надпочечников, что обусловлено конгруэнтностью расположения мозгового и коркового вещества надпочечников.
Приведенные факты определяют «золотой стандарт» объема оперативного вмешательства при ФХ – адреналэктомия с опухолью. Для отдельных пациентов возможно проведение парциальной адреналэктомии, например, при наследственной семейной форме ФХ, с небольшими опухолями, после адреналэктомии с противоположной стороны, чтобы по возможности сохранить кору надпочечников и предотвратить необратимый гипокортицизм, требующий ежедневной заместительной терапии.
Смертность в специализированных учреждениях составляет от 1 до 4%. Основные причины смерти на операционном столе – инфаркт мио-карда, инсульт, катехоламиновый шок, отек легких, отек мозга и др. В послеоперационном периоде наиболее часто причиной смерти становится нерадикальность операции (ненайденная опухоль, отдаленные метастазы и др.).
После хирургического лечения ФХ рекомендуется пожизненно ежегодно определять уровень метанефринов плазмы крови или мочи у прооперированных пациентов для оценки вероятности рецидива заболевания или метастазирования.
В течение 5 лет после операции по поводу ФХ выживают обычно более 95% пациентов, а частота развития рецидивов не достигает 10%. Серьезную проблему представляет ложный рецидив ФХ, связанный не с метастатическим процессом, а с ростом генетически детерминированных опухолей. С учетом того, что около 25–30% пациентов с ФХ имеют генетически обусловленную форму заболевания, ситуация представляется крайне непростой. Если при синдроме МЭН 2 локализация опухолевого процесса ограничивается, как правило, мозговым слоем надпочечников, то при таких мутациях, как SDHB, SDHD и VHL, локализация поражения может быть вненадпочечниковой и множественной. Зачастую такое распространенное поражение интерпретируют как метастатическое поражение, пациентов ошибочно считают инкурабельными [3].
Лучевую терапию опухолей из хромаффинных клеток до последнего времени считали неэффективной. Однако в настоящее время появляются сообщения об успешном лечении метастазов ФХ радиофармпрепаратом мета-йод-бензилгуанидином, в которых отмечается уменьшение размеров опухоли и увеличение продолжительности жизни у 2/3 пролеченных пациентов.
Злокачественные ФХ трудно поддаются лечению, однако на этом пути достигнуты определенные результаты. Стандартная химиотерапия неэффективна, а радиотерапия обоснована в лечении, прежде всего, костных метастазов. После выявления в хромаффинных опухолях экспрессии соматостатиновых рецепторов появилась уникальная возможность целевого назначения радионуклидов, связанных с аналогами соматостатина. Возможно, уникальные генетические характеристики ФХ будут использовать в лечении агрессивных форм этой болезни [3, 4].
При доброкачественных ФХ, отсутствии осложнений тяжелых гипертонических кризов (ишемическая болезнь сердца, сердечная недостаточность, нарушения мозгового кровообращения, отслойка сетчатки), отмечающихся в запущенных случаях заболевания, трудоспособность пациентов после хирургического лечения восстанавливается.
Очевидно, что успех в ведении категории пациентов с ФХ может быть обеспечен только совместными усилиями. Необходима активность терапевтов по выявлению пациентов высокого риска развития ФХ, адекватная диагностика заболевания эндокринологами с привлечением генетиков, проведение рациональной предоперационной подготовки, хирургического лечения хирургами, анестезиологами и адекватная терапия злокачественных форм ФХ онкологами.
Литература
1. Феохромоцитома: этиология, патогенез, диагностика, клинические особенности, лечение / Панькив В.И. // Международный эндокринологический журнал. – 2011. – №8 (40).
2. Коваленко А.Е. Феохромоцитома: современные подходы к диагностике и лечению // Здоровье Украины. – 2007. – №22/1.
3. Эндокринная хирургия. Практическое руководство под ред. Дедова И.И., Кузнецова Н.С., Мельниченко Г.А. – ГЭОТАР-Медиа, 2014. – 338 с.
4. Дедов И.И., Бельцевич Д.Г., Кузнецов Н.С., Мельниченко Г.Л. Феохромоцитома – М.: Практическая медицина, 2005. – 216 с.
5. Lenders J.W., Duh Q.-Y., Eisenhofer G. et al. // Pheochromocytoma and Paraganglioma: An Endocrine Society Clinical Practice Guideline. – J. of Clinical Endocrinology and Metabolism. – 2014. – Vol. 99(6). – P. 1915–1942.
6. Fonseca V., Bouloux P.M.-P. // Pheochromocytoma and paraganglioma. Baillieres Clin Endocrinol Metab. – 1993. – Vol. 7. – P. 509–544.
7. Manger W.M., Gifford Jr. // Pheochromocytoma. Current diagnosis and management. – Clin. J. Med. – 1993. – Vol. 60. – Р. 365–378.
8. Lenders J.W., Eisenhofer G., Mannelli M., Pacak K. // Phaeochromocytoma. – Lancet. – 2005. – Vol. 366. – Р. 665–675.
9. Martucci V.L., Pacak K. // Pheochromocytoma and paraganglioma: Diagnosis, genetics, management and treatment. – Curr. Probl. Cancer. – 2014. – Vol. 38. – Р.7–41.
10. Eisenhofer G., Keiser H., Friberg P. et al. // Plasma metanephrines are markers of pheochromocytoma produced by catechol-O-methyltransferase within tumors. – J. Clin. Endocrinol. Metab. – 1998. – Vol. 83. – Р. 2175–2185.
11. Unger N., Pitt C., Schmidt I.L. et al. // Diagnostic value of various biochemical parameters for the diagnosis of pheochromocytoma in patients with adrenal mass. – Eur. J. Endocrinol. – 2006. – Vol. 154. – Р. 409–417.
12. Hickman P.E., Leong M., Chang J., Wilson S.R., McWhinney B. // Plasma free metanephrines are superior to urine and plasma catecholamines and urine catecholamine metabolites for the investigation of pheochromocytoma. – Pathology. – 2009. – Vol. 41. – Р. 173–177.
13. Därr R., Lenders J.W., Stange K. et al. // Diagnosis of pheochromocytoma and paraganglioma: the clonidine suppression test in patients with borderline elevations of plasma free normetanephrine [in German]. – Dаtsch Med. Wochenschr. – 2013. – Vol. 138. – Р. 76–81.
14. Algeciras-Schimnich A., Preissner C.M., Young W.F. Jr, Singh R.J., Grebe S.K. // Plasma chromogranin A or urine fractionated metanephrines follow-up testing improves the diagnostic accuracy of plasma fractionated metanephrines for pheochromocytoma. – J. Clin Endocrinol. Metab. – 2008. – Vol. 93 . – Р. 91–95.
15. Lenders J.W., Eisenhofer G., Mannelli M. et al. // Guidelines on Pheochromocytoma and Paraganglioma. – J. Clin. Endocrinol. Metab. – 2014. – Vol. 99. – Р. 1915–1942.
16. Woodward E.R., Eng C., McMahon R. et al. // Genetic predisposition to pheochromocytoma: Analysis of candidate genes GDNF, RET and VHL. – Hum. Mol. Genet. – 1997. – Vol. 6. – Р. 1051–1056.
17. Gimenez-Roqueplo A.P., Dahia P.L., Robledo M. // An update on the genetics of paraganglioma, pheochromocytoma, and associated hereditary syndromes. – Horm. Metab. Res. – 2012. – Vol. 44. – Р. 328–333.
18. Bar М., Friedman E., Jakobovitz O. et al. // Sporadic pheochromocytomas are rarely associated with germline mutations in the von Hippel-Lindau and RET genes. – Clin. Endocrinol. – 1997. – Vol. 47. – Р. 707–712.
19. Amar L., Baudin E., Burnichon N., et al. // Succinate dehydrogenase B gene mutations predict survival in patients with malignant pheochromocytomas or paragangliomas. – J. Clin. Endocrinol. Metab. – 2007. – Vol. 92. – Р. 3822–3828.
20. Jafri M., Whitworth J., Rattenberry E. et al. // Evaluation of SDHB, SDHD and VHL gene susceptibility testing in the assessment of individuals with non-syndromic pheochromocytoma, paraganglioma and head and neck paraganglioma. – Clin. Endocrinol. (Oxf). – 2013. – Vol. 78. – Р. 898–906.
21. Qin Y., Yao L., King E.E. et al. // Germline mutations in TMEM127 confer susceptibility to pheochromocytoma. – Nat. Genet. – 2010. – Vol. 42. – Р. 229–233.
22. Lumachi F., Tregnaghi A., Zucchetta P. et al. // Sensitivity and positive predictive value of CT, MRI and 123I-MIBG scintigraphy in localizing pheochromocytomas: a prospective study. – Nucl. Med. Commun. – 2006. – Vol. 27. – Р. 583–587.
23. Maurea S., Cuocolo A., Reynolds J.C. et al. // Iodine-131-metaiodobenzylguanidine scintigraphy in preoperative and postoperative evaluation of paragangliomas: comparison with CT and MRI. – J. Nucl. Med. – 1993. – Vol. 34. – Р. 173–179.
24. Furuta N., Kiyota H., Yoshigoe F., Hasegawa N., Ohishi Y. // Diagnosis of pheochromocytoma using [123I]-compared with [131I]-metaiodobenzylguanidine scintigraphy. – Int. J. Urol. – 1999. – Vol. 6. – Р. 119–124.
25. van Berkel A., Pacak K., Lenders J.W. // Should every patient diagnosed with a phaeochromocytoma have a ¹²³ I-MIBG scintigraphy? – Clin. Endocrinol. (Oxf). – 2014. – Vol. 81. – Р. 329–333.
26. King K.S., Chen C.C., Alexopoulos D.K. et al. // Functional imaging of SDHx-related head and neck paragangliomas: comparison of 18Ffluorodihydroxyphenylalanine, 18F -fluorodopamine, 18F -fluoro-2-deoxy-D-glucose PET, 123I-metaiodobenzylguanidine scintigraphy, and 111In-pentetreotide scintigraphy. – J. Clin. Endocrinol. Metab. – 2011. – Vol. 96. – Р. 2779–2785.
27. Prys-Roberts C., Farndon J.R. // Efficacy and safety of doxazosin for perioperative management of patients with pheochromocytoma. – World J. Surg. – 2002. – Vol. 26. – Р. 1037–1042.
28. Hoffman B.B. // Catecholamines, sympathomimetic drugs, and adrenergic receptor antagonists. – Goodman and Gillman’s The Pharmacological Basis of Therapeutics. – Philadelphia; McGraw-Hill; 2001. – Р. 215–268.
29. Dickson P.V., Alex G.C., Grubbs E.G. et al. // Posterior retroperitoneoscopic adrenalectomy is a safe and effective alternative to transabdominal laparoscopic adrenalectomy for pheochromocytoma. – Surgery. – 2011. – Vol. 150. – Р. 452–458.
Международные обзоры: клиническая практика и здоровье. – 2016. – №1. – С. 4-23.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.