BelyakovskiyV.N.1, VoropaevE.V.1, VolchenkoA.N.2, StasenkovaS.V.3
1Gomel State Medical University, Belarus
2Republican Сentеr of Hygiene, Epidemiology and Public Health, Minsk, Belarus
3Gomel Regional Clinical Oncology Center, Belarus
Epidemiological aspects of genital human papillomavirus infection and cervical cancer in Republic of Belarus and Gomel region (1995–2014)
Резюме. Проанализированы результаты цитологического обследования и теста на вирус папилломы человека (ВПЧ) 1032 женщин, проживающих на территории г. Гомеля, и 5873 женщин, проживающих в г. Добруше и Добрушском районе Гомельской области. Отмечается неблагоприятная тенденция роста заболеваемости раком шейки матки (РШМ) у женщин репродуктивного возраста, а также среди женщин, проживающих в сельской зоне, при снижении заболеваемости и смертности в среднем и пожилом возрасте, укорочение периодов канцерогенеза РШМ. Инфицированность пациенток с цервикальной эктопией составила 80%. Изучена эффективность теста на ВПЧ в скрининге РШМ, предложен алгоритм медицинской профилактики РШМ. Тест на ВПЧ является этиопатогенетически обоснованным методом скрининга в условиях широкой эпидемии папилломавирусной инфекции и эффективно охватывающим группу риска по развитию РШМ у пациенток молодого возраста. Необходимо пересмотреть тактику ведения цервикальных эктопий в пользу их активного лечения.
Ключевые слова: ВПЧ-инфекция, цервикальная интраэпителиальная неоплазия, рак шейки матки, скрининг, тест на ВПЧ.
Медицинские новости. – 2016. – №7. – С. 61–66.
Summary. The results of cytology and HPV test from 1032women, residing in Gomel and 5873 women living in Dobrush and Dobrush district of Gomel region. There are unfavorable upward trend in the incidence of cervical cancer among reproductive aged women, and among rural women, while reducing morbidity and mortality in middle and old age women. It is observed shortening periods of carcinogenesis of cervical cancer. 80% patients with cervical ectopy were infected with HPV. Efficacy of HPV test in screening for cervical cancer is estimated, algorithm of medical prevention of cervical cancer is proposed. HPV test is a reasonable method of screening in a general PVI epidemic and effectively covering risk group of developing cervical cancer in young patients. It is necessary to reconsider tactics of observation cervical ectopy to an active treatment.
Keywords: HPV-infection, cervical intraepithelial neoplasia, cervical cancer screening, HPV-test.
Meditsinskie novosti. – 2016. – N7. – P. 61–66.
В течение последних 20 лет произошли значительные изменения как в понимании канцерогенеза рака шейки матки (РШМ), так и в профилактике данного заболевания. В результате проведенных эпидемиологических и молекулярно-биологических исследований было установлено, что вирусы папилломы человека высокого канцерогенного риска (ВПЧ ВКР) 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68, 73, 82 типов являются основным фактором риска развития РШМ [1]. Папилломавирусная инфекция высокого канцерогенного риска (ПВИ ВКР) является одной из самых распространенных инфекций, передающихся половым путем (ИППП), в мире [1, 2]. Эпидемиология ПВИ стала неотделимой от эпидемиологии цервикального рака. Различные уровни заболеваемости и смертности от РШМ обусловлены как разным уровнем распространения ВПЧ ВКР в популяциях, так и различающимися профилактическими и скрининговыми программами.
Согласно мета-анализу, проведенному L. Bruniи соавт. (2010), который включал 194 исследования, выполненные у более чем 1 млн женщин с нормальной цитологией с использованием технологии полимеразной цепной реакции (ПЦР) или Hybrid Capture 2 для выявления ДНК ВПЧ, мировая распространенность ВПЧ среди женщин составляет 11,7% (95% ДИ 11,6–11,7%), с наибольшей распространенностью в странах Африканского региона (к югу от Сахары) – 24,0%, Восточной Европы – 21,4% и Латинской Америки – 16,1% [3, 4]. Среди европейских стран в Румынии наблюдается самый высокий уровень инфицированности ВПЧ ВКР (60,7%), заболеваемости и смертности от РШМ (300/0000 и 210/0000 соответственно) [5]. В экономически развитых странах Европы (Швейцария, Финляндия, Франция, Нидерланды, Великобритания, Швеция) при инфицированности ВПЧ ВКР до 10% заболеваемость РШМ и смертность от него регистрируется в пределах 3,6–7,4 и 1,1–1,9 случая на 100 000 женского населения соответственно [6, 7].
В 9 странах Европы (Дания, Финляндия, Исландия, Норвегия, Словения, Швеция, Нидерланды, Великобритания и в крупные регионы Италии) внедрены программы организованного цервикального скрининга и образовательных мероприятий с целью повышения санитарной грамотности населения [6, 8, 9]. Эффективность в снижении заболеваемости РШМ при использовании направленного скрининга составляет 75%. В большинстве других стран обследование является добровольным и зависит от инициативы конкретной женщины или ее врача («оппортунистический или коньюнктурный скрининг»), эффективность его составляет около 43% [10]. В США цитологический скрининг дополнен тестом на ВПЧ после 30 лет [1]. Многоцентровыми долгосрочными исследованиями, проведенными в Европейском регионе, была доказана эффективность ПЦР-скрининга. Показано, что скрининг, основанный на определении ВПЧ ВКР (начало скрининга в 30 лет, интервал – 5 лет), обеспечивает на 60–70% большую защиту от инвазивного РШМ по сравнению с цитологическим скринингом [11]. В 2014 г. издано новое руководство ВОЗ по профилактике РШМ «Комплексная борьба с раком шейки матки: руководство по основам практики», в котором рекомендуется использовать тест на ВПЧ для скрининга у женщин в целях профилактики РШМ, как наиболее эффективный и экономически выгодный [12].
В Республике Беларусь в последние десятилетия отмечается рост заболеваемости РШМ у женщин молодого возраста [13]. Более 80% всех дисплазий ШМ диагностируется у женщин молодого и среднего возраста при чувствительности цитологического метода в диагностике тяжелой дисплазии и РШМ от 20 до 87% [13, 14]. Подобная ситуация свидетельствуют о необходимости усовершенствования методов профилактики развития инвазивного РШМ [15].
Цель исследования – изучить региональные эпидемиологические особенности генитальной ПВИ и РШМ и с их учетом разработать оптимальную стратегию и тактику профилактики инвазивного РШМ у молодых женщин в Гомельской области.
Материалы и методы
В работе использованы данные Белорусского канцер-регистра о заболеваемости РШМ и смертности от него в Республике Беларусь и Гомельской области с 1975 по 2014 г., на основании которых изучены особенности динамики заболеваемости и смертности в зависимости от возраста, места проживания.
Также в работе нами были проанализированы результаты обследования женщин, включенных в исследования в рамках выполнения 2-х региональных инновационных проектов, финансируемых Гомельским областным исполнительным комитетом, в 2008–2013 гг. В первом исследовании было обследовано 1023 женщины, проживающие на территории г. Гомеля и Гомельской области, считающие себя здоровыми, без дисплазии и РШМ в анамнезе. Во втором исследовании обследовано 5873 женщины, проживающие в г. Добруше и Добрушском районе Гомельской области, у которых материал для молекулярно-генетического исследования забирался при проведении ежегодного рутинного гинекологического осмотра.
Молекулярно-генетические исследования выполнялась в лаборатории ПЦР и диагностических препаратов Научно-исследовательской лаборатории Гомельского государственного медицинского университета. Генотипирование, количественное определение вирусной нагрузки проводилось методом ПЦР в реальном времени на амплификаторах RotorGene 3000 и RotorGeneQфирмы CorbettResearch (Австралия) и генетическом анализаторе ABIPRISM 310 AppliedBiosystems (США). Для выявления ВПЧ ВКР и определения филогенетической группы вирусов и вирусной нагрузки использовались тест-системы «Амплисенс ВПЧ ВКР Скрин-Титр FRT» фирмы «АмплиСенс» (Россия).
Цитологическое исследование мазков экто- и эндоцервикса выполнялось при первичном обследовании. Материал для цитологического исследования брался цитощеткой путем соскабливания поверхностных клеток с разных участков ШМ и из цервикального канала. Исследование мазков проводилось в цитологической лаборатории Гомельского областного клинического онкологического диспансера.
При углубленном исследовании женщин применяли простую и расширенную кольпоскопию ШМ с использованием пробы с 3%-ной уксусной кислотой.
Гистологическое исследование биопсированного материала проводилось на базе отделения патологической анатомии Гомельского областного клинического онкологического диспансера. Биопсия выполнялась электропетлей на границе поражений, после предварительной расширенной кольпоскопии, чтобы в образец попали и пораженные, и неизмененные ткани, для оценки взаимоотношения эпителия и соединительной ткани в целях диагностики инвазивного рака.
Конизационная биопсия проводилась при сочетании дисплазии влагалищной части ШМ и цервикального канала. Круговая биопсия выполнялась с диагностической и лечебной целью при наличии осложненной цервикальной эктопии, рубцовых деформаций, послеродовых разрывов и наботовых кист ШМ. Биопсийный материал исследовался в парафиновом блоке с серийно-ступенчатым приготовлением срезов для установления протяженности патологического процесса в цервикальном канале.
Статистическая обработка полученных результатов проведена с использованием методов параметрической и непараметрической статистики, с помощью компьютерной программы Statistica 6.0 компании StatSoft, MedCalс 11.3.0.0, пакета анализа из программы MicrosoftExcel 2003, программы анализа данных AtteStat, v. 10.5.1.
Результаты и обсуждение
Анализ показателей заболеваемости РШМ в Республике Беларусь в период с 1995 по 2014 г. подчеркивает устойчивую тенденцию роста как интенсивных показателей заболеваемости, так и стандартизованных. Заметное снижение заболеваемости за последние 3 года не отразилось на растущем тренде. Данная ситуация зависит от первичной и вторичной профилактики и визуализирует ее недостаточность. Снижение смертности является результатом реализации программы онкологии и стандартизации лечения онкологических заболеваний, т.е. улучшения третичной профилактики (рис. 1).
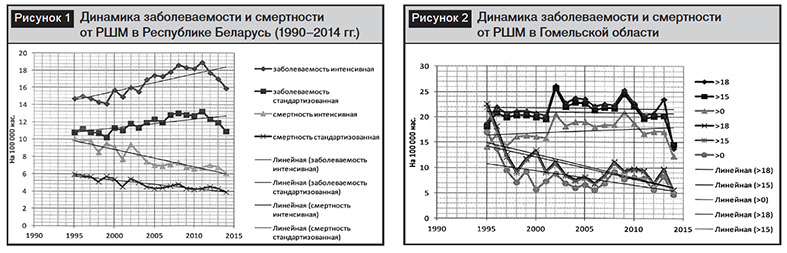
Для изучения эпидемиологических особенностей в Гомельской области был проведен анализ демографических показателей с 1995 по 2014 г. За данный период времени женское население уменьшилось на 81 995 человек (с 845 088 до 763 093). Из них 77 100 (94%) были дети от 0 до 17 лет. Наиболее стабильными оказались группы населения молодого, среднего и пожилого возрастов. Поэтому анализ интенсивных показателей заболеваемости и смертности был сделан с учетом этих особенностей (рис. 2).
Как следует из диаграммы, представленной на рис. 2, при исключении населения детского возраста отмечается снижение заболеваемости РШМ и независимо от учета возрастных групп снижение смертности в Гомельской области.
Анализ интенсивных показателей заболеваемости в зависимости от места проживания показал, что сохранение роста заболеваемости РШМ в области обеспечено сельской зоной, для которой характерен интенсивный тренд роста, при снижении заболеваемости у городского населения (рис. 3).
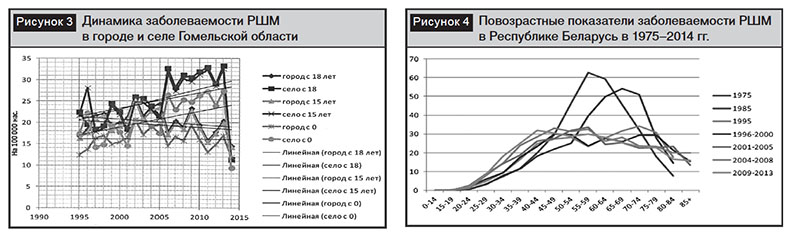
Анализ возрастных показателей заболеваемости РШМ в Республике Беларусь с 1975 по 2014 г. визуализировал тот факт, что система профилактических осмотров с использованием цитологического исследования цервикальных мазков, внедренная с 60-х годов ХХ столетия, позволила в течение 20 лет резко уменьшить заболеваемость (в 2 раза), но только в пожилом возрасте. В течение последующих 20 лет заболеваемость меньшими темпами продолжает снижаться в пожилом и среднем возрастах (рис. 4).
Позитивная тенденция снижения заболеваемости РШМ в пожилом и среднем возрасте в республике сопровождается крайне негативным и неуправляемым пока проявлением роста заболеваемости в молодом возрасте. За последние 20 лет пик заболеваемости РШМ сместился с возрастной группы 55–59 лет в 40–44 лет, т.е. почти на 20 лет.
Анализ возрастных показателей, проведенный в Гомельской области и республике за 2014 г., показал, что данная тенденция проявила себя еще более агрессивно (рис. 5).
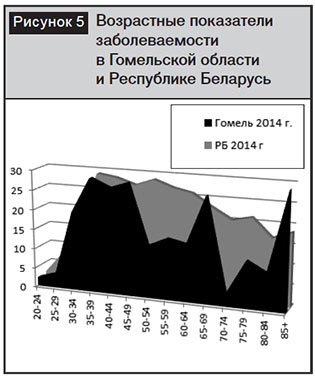
Как следует из диаграммы, представленной на рис. 5, пик заболеваемости РШМ в 2014 г. как в Беларуси, так и в Гомельской области сместился в возрастную группу женского населения 35–39 лет.
Сложившаяся ситуация явилась поводом для проведения эпидемиологического вирусологического исследования с целью изучения инфицированности ВПЧ в регионе и причин роста РШМ у женщин молодого возраста.
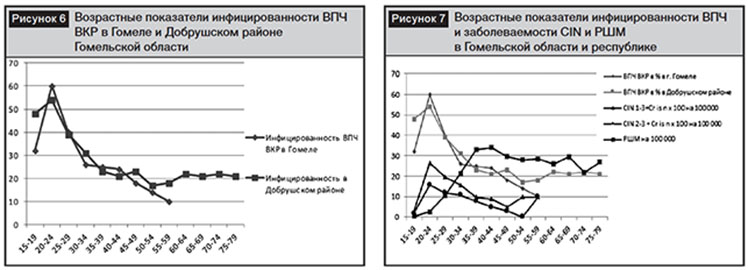
Инфицированность в г. Гомеле составила 35,6%, в Добрушском районе – 27%. Максимальные возрастные показатели инфицированности, представленные на рис. 6, регистрируются в группе до 24 лет в пределах 54–60%. Интересными оказались результаты инфицированности в Добрушском районе в возрасте старше 59 лет. Инфицированность ВПЧ не снижается, а возрастает и удерживается в пределах 20–22%. Данные особенности инфицированности объясняют динамику роста заболеваемости РШМ у женщин молодого возраста и в сельской зоне. Для сравнения в возрастной категории до 24 лет инфицированность ВПЧ ВКР в странах Северной, Центральной и Южной Америки, Африки и Европы не превышает 26–28%, в государствах Азии – менее 12%.
Продолжающийся рост заболеваемости РШМ у женщин в молодом возрасте и сельской зоне требует изучения данной ситуации и разработки нового подхода с учетом региональных особенностей основных этиопатогенетических факторов канцерогенеза. Нами была изучена возрастная заболеваемость цервикальной неоплазией (CINI–III степени) и данные результаты соотнесены с инфицированностью ВПЧ и заболеваемостью РШМ (рис. 7).
Как видно из данных, представленных на рис. 7, пик заболеваемости CINI–III степени наступает в возрасте до 24 лет и соответствует максимальной инфицированности ВПЧ, максимальная заболеваемость РШМ в регионе регистрируется в возрасте 35–39 лет, то есть на 15 лет позже. Мы сравнили аналогичные показатели в 1996 г., представленные на рис. 8 и 9.
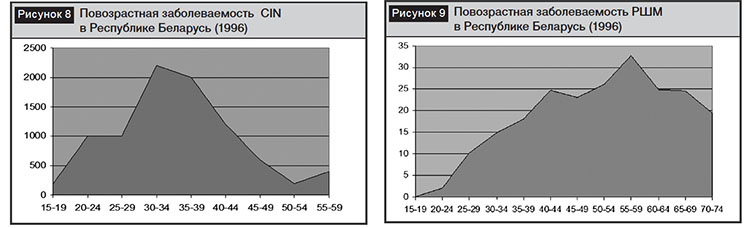
Как оказалось, пик заболеваемости CINI–III степени в 1996 г. развивался к 30–34 годам, а максимальная заболеваемость РШМ – в 55–59 лет. За последние 20 лет заболеваемость в среднем и пожилом возрасте резко уменьшилась, а в репродуктивном увеличилась со смещением пика в возрастную группу 35–39 лет, что связано с развитием дисплазий в условиях инфицирования ВПЧ в молодом возрасте до 24 лет (на 12–14 лет раньше, чем в 1996 г.). Это исследование показало, что ортодоксальность развития РШМ от инфицирования, развития CINI–III степени в настоящий период стало очень агрессивной с укорочением периодов канцерогенеза, что требует внедрения более действенных методов диагностики и профилактики РШМ в молодом возрасте с учетом основного фактора канцерогенеза – ВПЧ.
Нами был проведен сравнительный анализ эффективности скрининга РШМ с использованием теста на ВПЧ и цитологического метода. Углубленная диагностика проводилась с использованием кольпоскопии и петлевой электроэксцизии у пациенток с атипичными изменениями в мазках, а также инфицированных ВПЧ. Результаты представлены в табл. 1.
Таблица 1. Результаты скрининга РШМ с использованием теста на ВПЧ и цитологического метода (n=1023)
|
Характеристика технологии скрининга (критерий для углубленного
исследования)
|
Количество женщин, подлежащих
углубленному
исследованию
|
Морфологически
подтвержденный
диагноз дисплазии
и/или РШМ
|
|
Цитологический рутинный скрининг
(получено заключение «Дисплазия»)
|
11 (1,1%)
|
5 (0,5%)
|
|
Цитологический рутинный скрининг (получено заключение «Дисплазия и/или обнаружены цитологические маркеры вирусного поражения эпителия»)
|
51 (5,0%)
|
8 (0,8%)
|
|
ВПЧ-скрининг (обнаружена ДНК ВПЧ ВКР)
|
364 (35,6%)
|
83 (8,1%)
|
|
ВПЧ-скрининг и цитологический скрининг одновременно (обнаружена ДНК ВПЧ ВКР и/или получено цитологическое заключение «Дисплазия и/или обнаружены цитологические маркеры вирусного поражения эпителия»)
|
365 (35,7%)
|
84 (8,2%)
|
|
Кольпоскопический скрининг (наличие эктопии при отсутствии ДНК ВПЧ ВКР
и удовлетворительных результатах цитологического скрининга)
|
72 (7,0%)
|
7 (0,7%)
|
Как следует из результатов исследования, представленных в табл. 1, заметно, что диагностика с помощью цитологического метода как в рутинном исполнении, так и с исследованием вирусных маркеров (по системе Бетесда) позволила выявить лишь 0,5–0,8% дисплазий и РШМ от числа скринированных. Поиск дисплазий и РШМ в группе инфицированных ВПЧ женщин, считавших себя здоровыми и проходивших ежегодные рутинные обследования, позволил диагностировать 8,1% дисплазий и РШМ от числа скринированных (в 10–16 раз больше). Интересен тот факт, что если бы мы не использовали цитологический метод, то потеряли бы лишь 1 пациентку с дисплазией ШМ из 84, диагностированных с помощью 2 методов. Кроме этого, мы проанализировали эффективность диагностики круговой биопсии (петлевой электроэксцизии) у пациенток с цервикальной эктопией при отрицательных тестах на ВПЧ и цитологической норме. У этой категории было диагностировано 0,7% дисплазий I–III степени от скринированных, то есть столько же, как и при цитологическом обследовании, что является резервом диагностики дисплазий у молодых женщин.
Учитывая различные мнения о тактике ведения цервикальных эктопий, мы изучили инфицированность ВПЧ у пациенток с цервикальной эктопией (рис. 10).
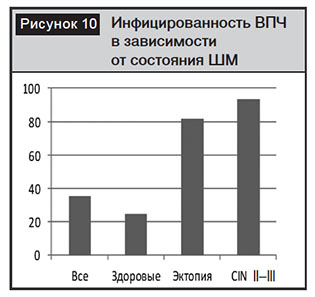
Инфицированность ВПЧ у пациенток с цервикальной эктопией статистически значимо отличается от здоровых женщин (р=0,001) и соответствует таковой у женщин с CINI–III степени. Полученные результаты позволяют сделать предположение, что эктопия цилиндрического эпителия на влагалищной части ШМ является «ловушкой» для ВПЧ и способствует персистенции вирусов и реализации канцерогенного эффекта ВПЧ. В более ранних исследованиях нами было отмечено, что у каждой второй здоровой пациентки в возрасте до 29 лет, инфицированной ВПЧ, вирусная нагрузка соответствует нагрузке при CINI–III степени [16].
Нами было проведен анализ лечения цервикальных эктопий у 1143 женщин в возрасте старше 18 лет при нормальной цитограмме и отрицательном тесте на ВПЧ с использованием радиоволнового аппарата «Сургитрон». Оказалось, что лишь у 40% пациенток лечение проведено в возрасте до 29 лет, при условии, что в республике средний возраст рождения 2-го ребенка в сельской зоне составляет 26,5 года, в городе – 27,5 года (коэффициент репродукции в Беларуси в репродуктивном возрасте 1,2–1,4). Остальные 60% женщин с цервикальной эктопией подвергаются лечению в возрасте 30–50 лет, что не противоречит литературным рекомендациям, но явно не соответствует региональной эпидемиологической ситуации. С учетом приведенных региональных особенностей 80–90% женщин с эктопией должны быть пролечены до 29–30 лет. При анализе гистологических заключений установлено, что CINI–III степени, РШМ и аденоматоз (железистый предрак) были диагностированы у 7,5% пациенток (1,5% от скринированных). Полученные нами данные показывают, что цервикальные эктопии являются скрытым резервом роста РШМ у женщин молодого возраста и у женщин сельской зоны.
В целях определения выбора скрининговых методов для профилактики РШМ была сделана оценка диагностических параметров цитологического и молекулярно-генетического методов (табл. 2).
Таблица 2. Сравнительная характеристика диагностических параметров цитологического и молекулярно-генетического методов, как методов скрининга в профилактике РШМ
|
Параметр оценки
|
Цитология
|
ПЦР + цитология
|
|
Чувствительность (Se), 95% ДИ
|
8,8 (3,9–16,6)
|
92,3 (84,8-96,8)
|
|
Специфичность (Sp), 95% ДИ
|
94,2 (92,5–95,6)
|
65,3 (62,2–68,4)
|
|
PV+, 95% ДИ
|
12,9 (5,8–23,9)
|
20,6 (16,8–24,9)
|
|
PV-, 95% ДИ
|
91,4 (89,4–93,1)
|
98,9 (97,7–99,5)
|
|
LR+, 95% ДИ
|
1,5 (0,8–2,9)
|
2,7 (2,5–2,9)
|
|
LR-, 95% ДИ
|
0,97 (0,7–1,3)
|
0,12 (0,06–0,2)
|
|
AUС
|
0,52 (0,48–0,55)
|
0,79 (0,76–0,81)
|
Примечание: PV+ – прогностическая ценность положительного результата; PV- – прогностическая ценность отрицательного результата; LR+ – отношение правдоподобия положительного результата; LR- – отношение правдоподобия отрицательного результата, AUС – площадь под кривой операционной характеристики теста.
По результатам ROC-анализа выявлено, что чувствительность комплекса методов оказалась значительно выше чувствительности одного цитологического исследования. Прогностическая ценность отрицательного результата примененных методов приближается к 100%, что позволяет рассматривать заключение комплекса молекулярно-генетического и цитологического исследований «отрицательный» как «отрицательный», т.е. при отсутствии ДНК ВПЧ ВКР и нормальной цитологии риск развития дисплазии, а впоследствии РШМ, минимален. Данные результаты указывают на целесообразность использования для скрининга комплекса теста на ВПЧ и цитологического метода, что позволяет подойти к скринингу дифференцированно и при наличии 2 отрицательных результатов выполнять его реже (1 раз в 3–5 лет), что позволит компенсировать затраты на внедрение теста на ВПЧ. Полученные нами результаты соответствуют рекомендациям экспертов ВОЗ в последнем руководстве по профилактике РШМ от 2014 г.
Результаты регионального эпидемиологического исследования позволило разработать алгоритм диагностики РШМ [17].
Тест на ВПЧ в дополнение цитологическому исследованию должен проводиться в первичном скрининге РШМ у женщин, подлежащих профилактическим осмотрам, после сексуального дебюта, при смене полового партнера независимо от возраста
Показания для углубленной диагностики. Расширенная кольпоскопия выполняется:
1) всем пациенткам с положительным тестом на ВПЧ;
2) всем пациенткам с цитологической картиной дисплазии ШМ.
Показания для выполнения биопсии. Прицельная биопсия выполняется при наличии кольпоскопически визуализируемой вирусассоциированной патологии ШМ как на фоне многослойного плоского эпителия, так и цилиндрического, в зоне трансформации. Биопсия выполняется конхотомом, скальпелем, петлей диатермокоагулятора или радиоволнового аппарата. Обязательным условием биопсии является наличие субэпителиального слоя.
Выскабливание слизистой цервикального канала выполняется в дополнение к прицельной биопсии. Выскабливание проводится ложечкой Фолькмана или кюреткой №1.
Круговая биопсия выполняется с диагностической и лечебной целью у инфицированных пациенток:
1)при наличииCINI степени;
2)при наличии зон трансформации, обусловленных:
– эктопией цилиндрического эпителия с кистами или без;
– эктропионом с кистами или без;
– множественными кистами ШМ;
3) конизация выполняется при наличии CINI–III степени в ШМ и цервикальном канале.
Круговая биопсия выполняется у нерожавших женщин на радиоволновых аппаратах, у рожавших с последующей репродуктивной функцией предпочтительно на радиволновых аппаратах или диатермокоагуляторах в пределах разрывов наружного зева ШМ. Соблюдение этих условий не травмирует мышечный слой ШМ, не вызывает рубцевания и не нарушает в последующем период раскрытия ШМ в родах.
Так как пик CINразвивается в возрасте до 24 лет в условиях максимальной инфицированности, целесообразно все диагностические и лечебные мероприятия проводить с использованием противовирусных и иммуномодулирующих препаратов как с целью профилактики рецидивов, так и достижения элиминации ВПЧ. В предыдущих исследованиях показана высокая эффективность применения препаратов интерферона для элиминации ВПЧ ВКР [18].
Элиминационное лечение генитальной ПВИ можно использовать как дополнительное, так и самостоятельное.
Какдополнительноепосле выполнения аблации, круговой биопсии и конизации ШМ в период эпителизации (начиная с 1–2-х суток после выполнеия данных процедур) назначаются интерфероновые свечи «Генферон» эндовагинально в дозировке 1 000 000 ЕД №10 ежедневно или через один день на ночь. Через 2 месяца выполняется тест на ВПЧ. Элиминация ВПЧ наступает у 95,7% пациенток в течение 1 года [18]. Как самостоятельное лечение интерфероновые свечи назначаются стабильным сексуальным парампри отсутствии патологии ШМ и желании пациентки провести элиминационное лечение. Интерфероновые свечи в дозировке 1 000 000 ЕД вводятся эндовагинально в межменструальном периоде во вторую фазу цикла ежедневно на ночь. В день сексуального контакта свечи вводятся за 15–20 минут до полового акта. Применение свечей продолжается без перерыва до наступления элиминации ВПЧ. Тест на ВПЧ для контроля элиминации выполняется 1 раз в 3 месяца [17].
Целесообразно использование препарата «Гроприносин» (инозин пранобекс), обладающего как прямым противовирусным, так и иммуномодулирующим эффектом, назначаемым внутрь. Эффективность применения при ПВИ доказана в больших многоцентровых рандомизированных исследованиях как в комбинации с хирургическим лечением, так и для достижения элиминации ВПЧ [19, 20]. Гроприносин рекомендован к использованию приказом МЗ РБ №1182 от 09.10.2012. Назначается по 2 таблетки (1000 мг) 3 раза в день в течение 5 дней 3–4 курса с интервалом 1 месяц, или в течение 14–28 дней, или по 1000 мг в течение 6 месяцев. Препарат можно назначать как в виде монотерапии, так и в сочетании с интерфероновыми препаратами. Целесообразно назначение Гроприносина в течение 5 дней за неделю до радиоволновой аблации IV. После выполнения аблации, или круговой биопсии, или конизации ШМ удобно назначение интерфероновых вагинальных свечей на протяжении периода эпителизации, как правило, в течение 3–4 недель. В последующие 3 месяца проводятся еще 2–3 5-дневных курса Гроприносина с интервалом, придерживающимся менструального цикла женщины, при его отсутствии – 1 раз в месяц. После проведения деструктивных мероприятий на ШМ или вульве при лечении кондилом для достижения максимального противовирусного эффекта назначается Гроприносин по 2 таблетки 3 раза в день в течение 14–28 дней. При лечении множественных кондилом вульвы, влагалища, кожи промежности после достижения достаточного иммунного ответа, подтверждающегося прекращением роста новых кондилом, Гроприносин целесообразно назначать в непрерывном режиме по 2 таблетки ежедневно на период последовательных деструкций кондилом (2–3 месяца или по необходимости).
Заключение
В течение последних лет с 1995 по 2014 г. в Республике Беларусь и Гомельской области сложилась неблагоприятная тенденция роста заболеваемости РШМ у женщин репродуктивного возраста и сельской зоны при снижении заболеваемости и смертности в среднем и пожилом возрасте.
Отмечается укорочение периодов канцерогенеза от инфицированности, развития CINI–III степени и до инвазивного РШМ: пик заболеваемости сместился в возрастную группу 40–44 года в республике и 35–39 лет – в Гомельской области, пик заболеваемости CINI–III степени регистрируется в возрасте до 24 лет в период максимальной инфицированности ВПЧ.
Использование теста на ВПЧ в качестве скринингового метода позволяет улучшить диагностику CINI–III степени и РШМ в 16 раз по сравнению с цитологическим методом. Тест на ВПЧ является этиопатогенетически обоснованным методом скрининга в условиях широкой эпидемии ПВИ и максимально очерчивающим группу риска по развитию РШМ у пациенток молодого возраста.
Инфицированность пациенток с цервикальной эктопией составила 80%, что указывает на ее ведущую роль в реализации канцерогенного эффекта ВПЧ за счет создания персистенции ВПЧ и поддержания высокой концентрации ВПЧ в зоне трансформации. Необходимо пересмотреть тактику ведения цервикальных эктопий в пользу их активного лечения в ближайший период после завершения репродуктивной деятельности с использованием радиоволновых аппаратов в объеме круговых биопсий, петлевой электроэксцизии и аблации зоны трансформации.
Диагностические и лечебные методы должны сопровождаться назначением противовирусных и иммуномодулирующих препаратов (гроприносин, генферон, руферон) с целью достижения элиминации ВПЧ.
Л И Т Е Р А Т У Р А
1. Muñoz N.,etal. // N. Engl. J. Med. – 2003. – Vol.348, N6. – Р.518–527.
2. Revzina N.V., Diclemente R.J. // Int. J. STD AIDS. – 2005. – Vol.16, N18. – P.528–537.
3. Bruni L., et al. // J. Infect. Dis. – 2010. – Vol.202, iss.12. – Р.1789–1799.
4. Clifford G.M., et al. // Lancet. – 2005. – Vol.366, N9490. – P.991–998.
5. Anton G., et al. // APMIS. – 2011. – Vol.119, N1. – Р.1–9.
6. Arbyn M. // Европейский журнал по сексуальному и репродуктивному здоровью. – 2007. – №64. – С.10–12.
7. Leinonen M., et al. // Int. J. Cancer. – 2008. – Vol.123, N6. – Р.1344–1349.
8. Anttila A., Nieminen P. // Eur. J. Cancer. – 2000. – Vol.36, N17. – P.2209–2214.
9. Antilla A., et al. // BMJ. – 2010. – Mode of access: http://www.bmj.com/content/340/bmj.c1804/. – Date of access: 21.02.2012.
10. Arbyn M., et al. European guidelines for quality assurance in cervical cancer screening. – Luxembourg, 2007. – 291 p.
11. Ronco G., et al. // Lancet. – 2014. – Vol.383, N9916. – Р.524–532.
12. Новое руководство ВОЗ по профилактике рака шейки матки и борьбе с ним / ВОЗ // Электронный ресурс. Режим доступа: www.who.int/mediacentre/news/releases/2014/preventing-cervical-cancer/ru. – Дата доступа: 21.08.2015.
13. Беляковский В.Н. Дисплазия и рак шейки матки. – Гомель, 2003. – 148 с.
14. Русакевич П.С. и др. Роль цитологического метода в исследовании шейки матки (Часть 1): Учеб.-метод. пособие. – Минск, 2013. – 111 с.
15. Беляковский В.Н. и др. Эпидемиологические аспекты папилломавирусной инфекции и рака шейки матки: методическое пособие. – Гомель, 2012. – 34 с.
16. Воропаев Е.В. Определение вирусной нагрузки вируса папилломы человека в различных возрастных группах и клинических состояниях шейки матки / Е.В. Воропаев, А.Н. Волченко, В.Н. Беляковский // Актуальные проблемы современной медицины: материалы Респ. науч.-практ. и 19-й науч. сессии Гомел. гос. мед. ун-та, Гомель, 23–24 фев. 2010 г.: в 4 т. – Гомель, 2010. – Т.4. – С.106–108.
17. Алгоритм диагностики и элиминации генитальной папилломавирусной инфекции высокого канцерогенного риска: Инструкция по применению №238-1210: утв. МЗ РБ 16.03.2011 / В.Н. Беляковский, Е.В. Воропаев, С.В. Стасенкова, Т.И. Пригожая, А.Н. Волченко. – Гомель, 2011. – 19 с.
18. Беляковский В.Н., Аль-Яхири О.В., Аль-Яхири А.К. // Проблемы здоровья и экологии. – 2010. – №1(23). – С.63-67.
19. Кедрова А.Г. и др. // Гинекология. – 2005. – Т.7, №3. – С.73–78.
20. Соколов В.Н., Костава М.Н., Прилепская В.Н. // Русский мед. журнал. – 2009. – Т.17, №1. – С.52–57.
Медицинские новости. – 2016. – №7. – С. 61-66.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.