Всемирная организация здравоохранения объявила 2000–2010 годы Декадой костно-суставных болей (The Bone and Joint Decade). Одним из пяти основных направлений в рамках Декады выделены боли в спине (БС), в частности боли в нижней части спины (БНС; low back pain). Конечным результатом Декады должно стать снижение на 25% прямых и непрямых расходов на медицинскую помощь больным с БС.
В силу высокой распространенности боли в спине занимают ведущее место по количеству дней нетрудоспособности среди работающего населения. До 80% людей в течение жизни испытывают боли в пояснично-крестцовой области.
Боли в нижней части спины делятся по времени их возникновения на острые, длительностью до 12 недель, и хронические — свыше 12 недель. В 13,8% случаев [1] длительность болей составляет более 12 недель, 17% пациентов страдают хроническими болями, а 11% испытывают социальную дезадаптацию из-за болевого синдрома.
Выявляемые дегенеративно-дистрофические изменения позвоночника не коррелируют с клинической картиной, поэтому их наличие не должно определять ни лечебную, ни экспертную тактику.
Все случаи болей в спине делятся на первичные и вторичные [3].
Первичный синдром БС — это болевой синдром в спине, обусловленный дистрофическими и функциональными изменениями в тканях позвоночно-двигательных сегментов (дугоотростчатых суставах позвонков, межпозвонковом диске — МПД, фасциях, мышцах, сухожилиях, связках) с возможным вовлечением смежных структур.
Вторичный синдром БС может быть связан с врожденными аномалиями, травмами позвоночника, опухолевыми и инфекционными процессами, остеопорозом, заболеваниями внутренних органов.
Основой первичного синдрома БС является дорсопатия в сочетании с мышечно-связочными нарушениями. Под термином «дорсопатия» понимают болевые синдромы в области туловища и конечностей невисцеральной этиологии и связанные с дегенеративными заболеваниями позвоночника.
По МКБ–10 дорсопатии делятся на три основные группы: деформирующие дорсопатии, спондилопатии, дорсалгии. В разделе «Спондилопатии» наиболее распространенным дегенеративным изменением является спондилез, в том числе артроз и дегенерация фасеточных (дугоотростчатых) суставов (спондилоартроз).
Спондилоартроз представляет собой дегенеративный процесс, локализующийся в межпозвонковых суставах, являющихся обычными синовиальными суставами с двумя покрытыми гиалиновым хрящом суставными поверхностями. Гиалиновый (суставной) и волокнистый хрящи состоят из клеток-хондроцитов, синтезирующих протеогликаны из межклеточного вещества (хрящевой матрикс). В настоящее время установлено, что МПД — разновидность хрящевой ткани, богатой протеогликанами, представленными сульфатированными глюкозаминогликанами и коллагеном I и II типов. Протеогликаны диска (пульпозного ядра и фиброзного кольца) представлены хондроитинсульфатами, которые гомологичны протеогликанам суставных хрящей периферических суставов. Показано, что процессы дегенерации в межпозвонковых и периферических суставах принципиально не различаются.
Спондилоартроз — самая частая причина болей в пояснице у лиц пожилого возраста. При артрозе фасеточных суставов боль обычно двусторонняя, локализуется паравертебрально, а не по средней линии, усиливается при длительном стоянии и разгибании и уменьшается при ходьбе и сидении.
Ноцицептивная афферентация при болях, обусловленных поражением суставов позвоночника, осуществляется в результате выброса алгогенных соединений (ионы водорода и калия, серотонин, гистамин, простагландины, брадикинин, субстанция Р) в межклеточную жидкость, окружающую ноцицепторы. Эти вещества играют ключевую роль в формировании боли, обусловленной повреждением, ишемией и воспалением. Кроме прямого возбуждающего действия на мембраны ноцицепторов имеется непрямой механизм, связанный с нарушением локальной микроциркуляции. Повышенная проницаемость капилляров способствует экстравазации таких активных веществ, как кинины плазмы и серотонин, что в свою очередь нарушает физиологическую и химическую среду вокруг ноцицепторов и усиливает их возбуждение. Продолжающийся выброс медиаторов воспаления может вызывать длительную импульсацию с развитием сенситизации ноцицептивных нейронов и формированием «вторичной гипералгезии» поврежденной ткани, способствующей хронизации патологического процесса.
Повышение чувствительности первичного ноцицептора в пораженной периферической ткани приводит к повышению активности нейронов, посылающих импульсацию в спинной мозг и ЦНС, однако в очаге воспаления может генерироваться спонтанная электрическая активность, обусловливающая стойкий болевой синдром. Таким мощным индуктором болевой чувствительности являются провоспалительные компоненты — брадикинины, гистамин, нейрокинины, оксид азота, обычно обнаруживаемые в очаге воспаления. Простагландины (ПГ) сами по себе не являются модераторами боли, они лишь повышают чувствительность ноцицепторов к различным стимулам, а их накопление коррелирует с интенсивностью воспаления и гипералгезией. Простагландины как бы опосредуют вовлечение «спящих» ноцицепторов в процесс формирования вторичной воспалительной гипералгезии и периферической сенситизации. После того как было установлено значение циклооксигеназы (ЦОГ-2) в каскаде превращения арахидоновой кислоты в провоспалительные ПГ, интерес к ее роли в развитии болевого стимула и снижении боли при подавлении ЦОГ-2 существенно возрос. Исследования показали, что активность ЦОГ-2 в развитии гипералгезии имеет большое значение. ЦОГ-2 может индуцироваться в спинном мозге после развития периферического воспаления, а ее селективные ингибиторы, непосредственно воздействующие на поясничный отдел спинного мозга, прекращают воспалительную гипералгезию [2, 4].
Совокупность этих процессов с клинической точки зрения можно представить как синдромы компрессионного поражения пояснично-крестцовых корешков и рефлекторные: миофасциальные, мышечно-тонические, поражение связочного и суставного аппарата позвоночника.
Наиболее часто в клинической практике встречаются рефлекторные болевые синдромы. Особенностью болевых синдромов поясничного отдела позвоночника является сочетание рефлекторных мышечно-тонических и миофасциальных синдромов с изменениями в эмоциональной сфере, которые способствуют хронизации состояния.
Клиническая диагностика болей в спине
Клиническая диагностика БС основывается на установлении характера болей, их связи с физическими (статическими или динамическими) нагрузками, выявлении триггерных точек, наличия симптомов «натяжения нервных стволов».
Источники болевой импульсации при остром вертеброгенном болевом синдроме:
• измененные межпозвонковые диски,
• связки позвоночника,
• надкостничная ткань суставов,
• периартикулярные ткани,
• спазмированные мышцы, окружающие пораженный позвоночно-двигательный сегмент.
Клинические признаки, заставляющие усомниться в первичном вертеброгенном характере процесса и требующие детального обследования больного:
• дебют болевого синдрома в возрасте менее 20 или более 55 лет,
• нарастающий болевой синдром,
• онкологические заболевания в анамнезе,
• стойкая лихорадка,
• снижение массы тела,
• общая слабость,
• возникновение болей в связи с травмой.
Особого внимания требуют пациенты с клиническими признаками компрессии спинного мозга или конского хвоста — элементами спастического пареза, проводниковыми расстройствами чувствительности, расстройствами тазовых функций. Как правило, именно они нуждаются в консультации нейрохирурга с обсуждением вопроса о целесообразности оперативного лечения.
Дополнительное обследование
Цель инструментальных и лабораторных диагностических процедур — исключение заболеваний, имеющих сходную клиническую картину (новообразования и воспалительные поражения спинного мозга, корешков, костей позвоночника, спинальная травма, заболевания внутренних органов и пр.), и выявление признаков компрессионного (радикулярного, миелопатического) синдрома.
Методы визуализации:
• компьютерная и магнитно-резонансная томография,
• рентгенография (обладает меньшей диагностической ценностью, но в ряде случаев способствует правильной постановке диагноза).
Лабораторные исследования: общий и биохимический анализ крови, клинический анализ мочи.
Консультации: хирурга (в том числе проктолога), гинеколога.
Подходы к лечению люмбоишиалгического синдрома включают препараты (простые или комбинированные аналгетики) и оперативное вмешательство.
Основные задачи ведения больного с острыми болями в спине: максимально полное купирование болей, обеспечение условий для проведения полноценного курса реабилитационных мероприятий, профилактика рецидива обострений.
Повседневная физическая активность
Больным с острым болевым синдромом следует избегать ситуаций, способных спровоцировать обострение болей, однако нежелательно и чрезмерно длительное ограничение физических нагрузок. Соблюдение постельного режима целесообразно на протяжении 1—3 дней, особенно при наличии корешкового синдрома. В острой фазе заболевания желательно избегать непривычных для больного чрезмерно высоких нагрузок.
Иммобилизация позвоночника
При невозможности ограничения физических нагрузок необходимо обеспечить временную иммобилизацию соответствующего отдела позвоночника при помощи ортезов, фиксирующих поясов (корсетов), снабженных вертикальными ребрами жесткости.
Фармакотерапия
Нестероидные противовоспалительные препараты
Одним из основных направлений лечения пациентов с болями в спине является применение нестероидных противовоспалительных препаратов (НПВП). Желательно максимально раннее их назначение.
НПВП представляют собой гетерогенную группу, в которую входит не менее 100 веществ, относящихся к нескольким химическим группам (производные салициловой, индоловой, пропионовой, гетероарилуксусной, эноликовой кислот). К сожалению, «химическая» классификация мало полезна для прогнозирования как клинической эффективности, так и выраженности различных побочных явлений, обусловленных приемом препаратов. Исследования в области синтеза новых НПВП связаны именно с неудовлетворенностью критерием отношения «риск/польза» при их использовании. В целом доля пациентов, у которых отмечаются побочные эффекты, достигает 25%, однако у 5% больных могут развиться опасные для жизни осложнения. Закономерность их появления обусловлена механизмом действия НПВП. Механизм действия НПВП состоит в ингибировании ЦОГ — ключевого фермента в каскаде метаболизма арахидоновой кислоты, которая является предшественником ПГ, простациклинов и тромбоксанов. В настоящее время выделены два изофермента ЦОГ. ЦОГ-1 является структурным ферментом, постоянно присутствующим в большинстве тканей и участвующим в регуляции многих физиологических процессов. ЦОГ-2 в норме в большинстве тканей не присутствует, ее экспрессия увеличивается на фоне воспаления и приводит к повышению уровня провоспалительных субстанций (ПГ групп F и I). Именно ингибирование ЦОГ-2 рассматривается как один из важнейших механизмов противовоспалительной, аналгетической активности, а ингибирование ЦОГ-1 — как механизм развития большинства побочных эффектов. Кроме того, имеются экспериментальные данные, свидетельствующие о том, что ЦОГ-2-ингибиторы обладают центральным действием, проявляющимся подавлением развития центральной сенситизации.
Препаратом выбора является диклофенак натрия, отличающийся мощной обезболивающей и противовоспалительной активностью, сочетающейся с хорошей переносимостью. Используется пролонгированная форма диклофенака натрия (содержит 75—150 мг активного вещества).
Аналгезирующий эффект диклофенака калия проявляется уже через 20—30 минут после приема препарата, а концентрация в крови достигает максимума через 40—50 минут. Препарат показан для быстрого купирования болевого синдрома в остром периоде вертеброгенных болей в спине. Диклофенак калия назначают в суточной дозе 75—150 мг, разделенной на два-три приема.
Хорошо зарекомендовал себя селективный ЦОГ-2-ингибитор мелоксикам (мелоксам). Результаты его клинического применения свидетельствуют о невысокой частоте развития побочных гастроэнтерологических осложнений и достаточной эффективности при лечении люмбоишиалгического синдрома.
При ревматоидном артрите и анкилозирующем спондилите мелоксам (мелоксикам) назначают внутрь по 15 мг/сут, при достижении положительного терапевтического эффекта доза может быть снижена до 7,5 мг/сут.
При остеоартрозе доза составляет 7,5—15 мг/сут. Максимальная суточная доза — 15 мг.
У лиц с повышенным риском возникновения побочных эффектов лечение следует начинать с дозы 7,5 мг/сут.
Широко применяются трансдермальные формы НПВП (мазь, крем, гель), однако их биодоступность при локальном введении на порядок ниже, чем при пероральном или парентеральном использовании. В связи с этим целесообразно многократное (не менее 4—6 раз в сутки) применение трансдермальных форм, в основном при умеренно выраженных болевых синдромах.
Аналгетики
При острой БС назначают парацетамол (ацетаминофен). Выраженность обезболивающего эффекта повышается при использовании комбинированных препаратов (парацетамол + кодеин).
Наркотические препараты редко применяют у пациентов с болью в спине. Исключение составляют острые травматические повреждения и новообразования (чаще метастазы в кости позвоночника).
Миорелаксанты
Эффективность аналгетиков и НПВП может быть повышена за счет сочетания лекарственных препаратов, воздействующих на различные звенья патогенеза болевого синдрома. С этой целью широко используются миорелаксанты — производные бензодиазепинов (диазепам, тетразепам), толперизон, тизанидин. Назначение бензодиазепинов для миорелаксации зачастую не оправдано, так как они имеют целый ряд неблагоприятных эффектов, в первую очередь седативный. Дело в том, что наибольший удельный вес лиц с болями в нижней части спины составляют водители, люди, занятые тяжелым физическим трудом на производстве, и седативный эффект бензодиазепинов фактически снижает их профессиональные возможности. Во многих европейских странах эти препараты утратили свое значение при лечении данной категории больных, что видно на примере Германии, где популярность миорелаксантов снижается (рисунок).
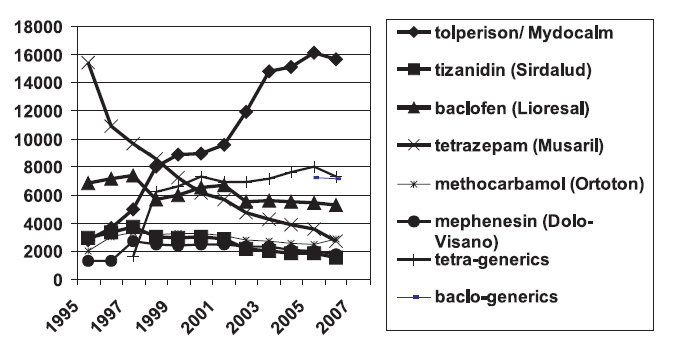
Толперизон (мидокалм) не вызывает седативный эффект. Мидокалм (производство ОАО «Химический завод «Гедеон Рихтер») выпускается как в инъекционной, так и в таблетированной форме. Наличие инъекционной формы позволяет применять его для купирования острых мышечных болей, назначая по 100 мг 2 раза в день в/м, затем переходят на таблетированную форму в дозировке 50 или 150 мг 3 раза в сутки. Хороший эффект толперизона установлен у пациентов с БС как в качестве монотерапии, так и в комбинации с НПВП (мелоксам + мидокалм). Сочетанная терапия более эффективна (сокращение сроков лечения) и сопровождается меньшей частотой побочных реакций.
Кортикостероиды
У больных с тяжелым компрессионным корешковым синдромом возможно применение кортикостероидов. Обычно назначают преднизолон (40–60 мг, до 100 мг в сутки) или дексаметазон (4–8 мг в сутки) на протяжении 3–5 дней с последующей быстрой отменой. Естественно, при их использовании повышается риск осложнений со стороны ЖКТ, особенно при одновременном применении НПВП.
Локальная аналгезия
Купирование болевого синдрома может быть достигнуто блокированием болезненных мышечных групп или триггерных точек. Вероятность травматизации нервных стволов требует аккуратности при проведении блокады. При условии соблюдения правил выполнения эти манипуляции обладают достаточной эффективностью и не вызывают осложнений. Смесь препаратов для введения включает анестетик (лидокаин, бупивакаин) и небольшую дозу кортикостероида (дипроспан, суспензия гидрокортизона). Не следует применять препараты, не обладающие местным действием, а также способностью к депонированию в тканях. Эффект, вызываемый блокадами, нестоек, в связи с чем возникает необходимость в повторных введениях и одновременном применении других способов лечения. У некоторых пациентов с остро развившимся болевым синдромом может быть использовано эпидуральное введение кортикостероидов. Препарат вводится через крестцово-копчиковое сочленение или первое крестцовое отверстие. Показаниями для эпидурального введения лекарственных препаратов являются стойкий болевой синдром (длительностью не менее 4—6 нед.) и корешковые нарушения.
Другие лекарственные средства
Широко используются препараты, улучшающие микроциркуляцию, способствующие нормализации метаболизма нервной ткани, в частности витамины группы В. Целесообразность их применения, сформулированная эмпирически и не подтвержденная результатами рандомизированных клинических исследований, должна рассматриваться в каждом случае индивидуально. Необходимо учитывать возможный психотерапевтический эффект от проводимого интенсивного (по мнению пациента) лечения, а также роль эффекта плацебо.
Длительность медикаментозного лечения пациентов с острой болью в спине определяется ее интенсивностью. Желательно систематическое, через равные промежутки времени, введение препаратов. Прием НПВП, миорелаксантов и прочих лекарственных средств прекращается по достижении эффекта. Нецелесообразно профилактическое назначение НПВП в отсутствие болевого синдрома — убедительных подтверждений превентивного эффекта не получено, тогда как риск осложнений значительно возрастает.
Характеристика основных препаратов, используемых при острых болях в спине, представлена в таблице.
Характеристика препаратов, применяемых при острых болях в спине
|
|
|
|
|
|
|
Ацеклофенак, диклофенак калия, диклофенак натрия, ибупрофен, кетопрофен, лорноксикам, нимесулид, мелоксикам (мелоксам)
|
|
Тизанидин, толперизон (мидокалм)
|
|
|
Подавление синтеза простагландинов
|
Агонисты опиоидных рецепторов
|
Торможение рефлекторных связей на уровне спинного мозга и ретикулярной формации
|
|
|
Аналгетический, противовоспалительный, жаропонижающий
|
|
|
Немедикаментозные методы лечения
Физиотерапия. Установлена противоболевая активность ультразвуковых колебаний, в ряде случаев — чрескожной электронейростимуляции.
К настоящему времени не получено убедительных данных о положительной роли вытяжения (как сухого, так и подводного) у рассматриваемого контингента больных.
Массаж. В результате метаанализа исследований, посвященных изучению результатов применения классического массажа при боли в спине, установлена его более высокая эффективность по сравнению с контролем. Целесообразно использовать массаж по прошествии стадии острого болевого синдрома, при этом положительный эффект сохраняется на протяжении порядка 12 месяцев.
Мануальная терапия, в частности методики мобилизации, тракции, противопоказана при остро выраженном болевом синдроме, наличии признаков компрессии корешков или конского хвоста. При умеренном болевом синдроме к комплексной терапии постепенно подключаются методики мануальной терапии, в частности постизометрической релаксации. Эффективность их значительно возрастает при начале лечения не позже 3 месяцев от дебюта заболевания, а также в комбинации с элементами лечебной гимнастики.
Традиционная акупунктура. Результаты систематизированного анализа позволяют констатировать умеренную эффективность метода, лишь незначительно превышающую таковую в группе плацебо (ложная акупунктура) и не отличающуюся от чрескожной электронейростимуляции или местного введения анестетиков.
1. Алексеев В.В., Алексеев А.В. // Справочник практического врача. — 2007. — № 2.
2. Клинические рекомендации. Ревматология / под ред. Е.Л. Насонова.— М.: ГЭОТАР-Медиа, 2005.
3. Шостак Н.А. // Справочник практического врача. — 2006. — № 9.
4. EULAR standardized operating procedures for the elaboration evaluation, and implementation of recommendations endorsed by the EULAR standing committees // Amer. Rheum. Dis. — 2004. — N 63. — P. 1172–1176.
Медицинские новости. – 2008. – 1. – С. 36-40.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.