Внимание! Статья адресована врачам-специалистам.
BulgakA.G., BelskayaM.I., KoushA.V., ShibekoN.A., ZhiznevskayaE.E.,
KlyshevichN.A., KrushevskayaT.V., ZatolokaN.V.
Republican Scientific and Practical Centre of Cardiology, Minsk, Belarus
Evaluation of efficacy and safety of the drug «Egilok SR» in comparison with the drug «Betaloc ZOK» in patients with arterial hypertension
Резюме. У 30 пациентов с артериальной гипертензией I–II степени изучены эффективность и безопасность применения кардиоселективного бета-блокатора Эгилока СР (Эгис, Венгрия) в дозах 50 и 100 мг/сутки в течение 3 месяцев терапии. Антигипертезивное действие Эгилока СР наиболее значимо проявилось через месяц терапии, максимальный эффект был получен через 2 месяца от начала лечения. Отмечены отсутствие влияния Эгилока СР на метаболические показатели и отсутствие побочных эффектов при его длительном применении.
Ключевые слова: артериальная гипертензия, эффективность и безопасность антигипертензивной терапии, препарат Эгилок СР.
Медицинские новости. – 2016. – №9. – С. 40–43.
Summary. The efficacy and safety of cardio selective beta-blocker Egilok SR (Egis, Hungary) at doses of 50 and 100 mg per day for 3 months of therapy studied in 30 patients with arterial hypertension I-II degree. Hypotensive action of Egilok SR was significantly manifested in a month of therapy. The maximum effect was obtained within two months after starting treatment. Side effects and influence of Egilok SR on metabolic parameters in long-term use were not revealed.
Keywords: arterial hypertension, the efficacy and safety of antihypertensive therapy, the drug Egilok SR.
Meditsinskie novosti. – 2016. – N9. – P. 40–43.
Артериальная гипертензия (АГ) является широко распространенным хроническим заболеванием и занимает ведущее место в структуре причин нетрудоспособности, инвалидизации и cердечно-сосудистой смертности во многих странах мира [1, 7]. В развитых и развивающихся странах АГ обнаруживается у 25–35% взрослого населения, а у лиц старше 60 лет – в 60–70% случаев [1, 7, 13, 15]. При наличии АГ повышается риск развития ишемической болезни сердца, в том числе инфаркта миокарда и внезапной коронарной смерти, острых расстройств мозгового кровообращения, хронической сердечной, а также почечной недостаточности, периферических сосудистых расстройств. Число людей с неконтролируемой гипертензией увеличилось с 600 млн в 1980 г. до 1 млрд в 2008 г., по прогнозу на 2025 г. их количество возрастет до 1,56 млрд. Важное медико-социальное значение этого заболевания обусловлено не только высокой распространенностью в общей популяции, но и большим количеством сердечно-сосудистых осложнений, в том числе со смертельным исходом: ежегодно в мире причиной смерти 9,4 млн человек является повышенное артериальное давление (АД) [1, 7, 9, 13].
На начальных стадиях артериальной гипертензии пациентам может быть предложено терапия одним из гипотензивных препаратов, к которым относятся и бета-блокаторы. На нашем рынке присутствует значительный арсенал бета-блокаторов как оригинальных, так и дженериков.
Целью нашего исследования явилась оценка клинической эффективности и безопасности генерического лекарственного средства Эгилок СР у пациентов с АГ в сравнении с оригинальным лекарственным средством Беталок ЗОК.
Материалы и методы
Исследование выполнено по протоколу пострегистрационного ограниченного простого открытого сравнительного рандомизированного клинического испытания в параллельных группах пациентов с активным контролем (прием лекарственного средства сравнения). Пациенты основной группы получали препарат Эгилок СР, в контрольной группе проводилась терапия препаратом Беталок ЗОК в амбулаторных условиях. исследования проведены на 60 добровольцах – взрослых пациентах кардиологического профиля обоего пола с нелеченой клинически верифицированной или плохо контролируемой до включения в исследование клинически верифицированной АГ I–II cтепени с уровнем АД от 140/90 до 180/110 мм рт. ст. Продолжительность исследования составила 90 дней.
Критерии включения:
1. Возраст 35–70 лет.
2. Способность пациента выполнять предписания врача-исследователя и соблюдать необходимые по протоколу испытания процедуры.
3. Клинически верифицировать диагноз АГ I–II степени, риск 1–2. Н0-1.
4. Признаки гипертрофии левого желудочка по электрокардиографии (ЭКГ) (критерий Соколова – Лайона более 38 мм, Корнельский критерий 2440 мс) или эхокардиографии (ЭхоКГ) (индекс массы миокарда левого желудочка более 125 г/м2 у мужчин и 110 г/м2 у женщин).
5. Информированное согласие.
Критерии не включения:
1. Повышенная чувствительность к компонентам референтного или тестируемого лекарственного средства или другим бета-блокаторам.
2. Атриовентрикулярная блокада II–III степени, подозрение на острый инфаркт миокарда, нестабильное течение стенокардии, манифестная и клинически значимая синусовая брадикардия (частота сердечных сокращений <50/мин), кардиогенный шок.
3. Артериальная гипертония с показателями САД ≤90 мм рт. ст.
4. Застойная сердечная недостаточность (II, III или IV функционального класса по классификации HYHA) и/или продолжительное или периодическое лечение препаратами, повышающими сократимость сердечной мышцы (стимулирование бета-рецепторов).
5. Острое нарушение мозгового кровообращения, инфаркт миокарда, коронарная ангиопластика или шунтирование в течение последних 6 месяцев до включения в исследование.
6. Тяжелое поражение периферических артерий.
7. Поражение клапанов, оказывающее влияние на гемодинамику.
8. Во время или после хирургических операций на сердце в течение последних 4 месяцев, предшествующих лечению метопрололом.
9. Метаболический ацидоз, бронхиальная астма или хроническая обструктивная болезнь легких, сахарный диабет, псориаз, феохромоцитома, обструктивная гипертрофическая кардиомиопатия.
10. Одновременное внутривенное введение блокаторов кальциевых каналов типа верапамил и дилтиазем, а также применение других антиаритмиков, блокаторов симпатических ганглиев, ингибиторов МАО, норадреналина, адреналина и других симпатомиметиков, альфа-метилдопы и сердечных гликозидов.
11. Указания на наличие психического заболевания, алкогольной, наркотической зависимости.
12. Хроническая печеночная недостаточность.
13. Хроническая почечная недостаточность.
14. Онкологическое заболевание.
15. Беременность и период лактации.
16. Участие в иных клинических испытаниях менее за 30 дней до включения в настоящее исследование.
Основная группа (ОГ), получавшая Эгилок СР, состояла из 30 пациентов, средний возраст – 49,00±8,10 года, из них 11 мужчин (36,7%) и 19 женщин (63,3%).
Сравнительная характеристика пациентов представлена в таблице.
Таблица. Характеристика пациентов основной и контрольной групп
|
Характеристика пациентов
|
Основная группа
|
Контрольная группа
|
|
Количество пациентов
|
30
|
30
|
|
Количество женщин
|
19 (63,3%)
|
17 (56,7%)
|
|
Количество мужчин
|
11 (36,7%)
|
13 (43,3%)
|
|
Средний возраст, лет
|
49,00±8,10
|
50,00±7,93
|
|
АГ I ст., риск 1
|
5 (16,7%)
|
4 (13,3%)
|
|
АГ I ст., риск 2
|
16 (53,3%)
|
19 (63,3%)
|
|
АГ I ст., риск 2, желудочковая экстрасистолия
|
1 (3,3%)
|
0
|
|
АГ II ст., риск 2
|
7 (23,3%)
|
7 (23,4%)
|
|
АГ II ст., риск 2
|
1 (3,4%)
|
0
|
|
Ожирение I ст.
|
1 (3,3%)
|
1 (3,3%)
|
|
Нарушение гликемии натощак
|
0
|
1 (3,3%)
|
|
Дислипидемия
|
0
|
2 (6,7%)
|
В контрольную группу (КГ), получавшую Беталок ЗОК, было включено 30 лиц, средний возраст – 50,00±7,93 года, из них 13 мужчин (43,3%) и 17 женщин (56,7%).
После подписания формы информированного согласия на участие в исследовании, проведение скрининга для подтверждения соответствия критериям отбора проводилось лечение АГ I–II степени лекарственными средствами Эгилок СР/Беталок ЗОК в течение 90 дней.
Первоначальная доза Эгилок СР/Беталок ЗОК – 50 мг 1 раз в день утром. При необходимости (отсутствие снижения показателей АД на 10% в течение 4 недель терапии, при частоте сердечных сокращений (ЧСС) более 60 уд./мин) доза повышалась до 100 мг 1 раз в день. За критерий хорошей гипотензивной переносимости препарата было принято достижение целевого АД (<140/90 мм рт. ст.).
Требования по предшествующей и сопутствующей терапии соблюдались. Не допускалось применение других гипотензивных средств, одновременное внутривенное введение блокаторов кальциевых каналов типа верапамил и дилтиазем, применение других антиаритмических препаратов, блокаторов симпатических ганглиев, ингибиторов МАО, норадреналина, адреналина и других симпатомиметиков, альфа-метилдопы и сердечных гликозидов.
Всем пациентам проводились общеклинические и биохимические исследования, ЭКГ, ЭхоКГ, суточное мониторирование артериального давления (СМАД). Данные исследования проводились при каждом из 4 визитов пациентов.
Кроме того, проводилась оценка качества жизни пациентов по анкете ВКНЦ в модификации ИГМА (2000) и сравнительной безопасности препаратов по шкале UKU [2, 4, 6–8, 10, 11, 14].
ЭхоКГ выполнялась на ультразвуковом аппарате Vivid 7 (США), СМАД проводилось на оборудовании Zymed (США) с расчетом всех стандартных показателей.
Эффективность препаратов определялась по конечным точкам.
Первичная конечная точка:
– доля пациентов в каждой группе лечения, достигших целевого АД (<140/90 мм рт. ст.) на каждой из доз 50 мг, 100 мг;
– частота гипертонических кризов в течение месяца (на каждой из доз 50 мг, 100 мг);
– оценка данных СМАД.
Вторичные конечные точки:
– оценка качества жизни пациентов по анкете ВКНЦ в модификации ИГМА (2000);
– частота развития и степень тяжести побочных реакций в каждой группе, зарегистрированных в ходе исследования в обеих группах лечения с оценкой степени их выраженности;
– оценка сравнительной безопасности препаратов по шкале UKU.
Статистическая обработка данных проводилась при помощи пакета программ STATISTICA 6.0 c оценкой методами параметрической и непараметрической статистики. В окончательный статистический анализ включались данные пациентов, полностью выполнивших программу испытаний [3, 5, 12]. Различия считались достоверными при вероятности p<0,05 и мощности метода 80%.
Результаты и обсуждение
Исходные цифры АД перед приемом препаратов достоверно не различались в ОГ и КГ, т.е. группы сопоставимы по исходному уровню АД до начала лечения.
В ОГ у 24 (80%) пациентов были достигнуты целевые уровни АД при приеме 50 мг Эгилок СР в течение первого месяца приема препарата. У 6 (20,0%) лиц целевой уровень АД на 50 мг в течение первого месяца достигнут не был, в связи с чем доза была увеличена до 100 мг в сутки. Достоверных различий между группами не получено, что свидетельствует о высокой терапевтической эффективности обоих препаратов (рисунок).
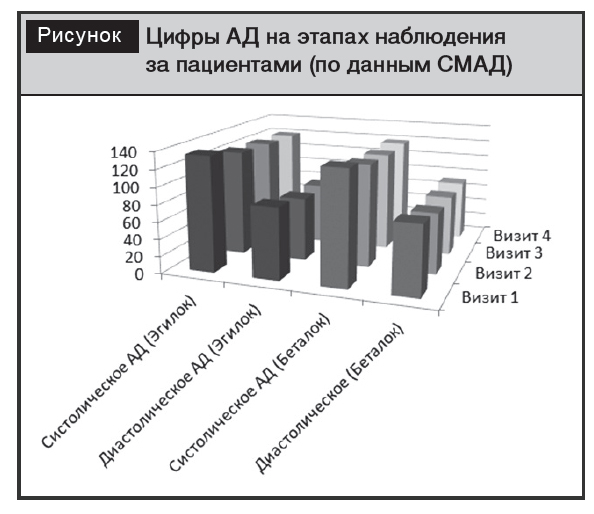
По данным СМАД, можно говорить и о сходном влиянии исследуемых препаратов на уровень АД в разное время суток.
По результатам исследования отмечена однотипная реакция ЧСС при приеме Эгилока СР и Беталока ЗОК. Дозу препарата из-за снижения ЧСС корригировать не приходилось.
При анализе показателей общеклинических показателей, биохимического анализа крови достоверных изменений как в ОГ, так и КГ не отмечено.
Выраженность побочных эффектов лечения в обеих группах оценивалась с помощью шкалы оценки побочного действия лекарств UKU у мужчин и женщин отдельно.
Шкала UKU включает 48 наиболее часто возникающих вследствие фармакотерапии симптомов, распределенных по группам: психические, неврологические, вегетативные и другие побочные эффекты. Различия в группах мужчин и женщин ОГ и КГ по отдельным пунктам и общая балльная оценка побочных действий определялась по баллам с поправкой на исходное состояние на всех этапах наблюдения.
Нежелательные явления, регистрируемые по шкале UKU, не были выявлены ни по одному симптому как в ОГ, так и в КГ среди мужчин и женщин. Таким образом, достоверного различия между исследуемыми группами по тяжести развития побочных эффектов нет.
Одной из задач настоящего исследования явилось изучение качества жизни пациентов с АГ по анкете ВКНЦ в модификации ИГМА. Само понятие «качество жизни» означает оценку человеком своего физического, психического и социального благополучия. Степень снижения качества жизни определяется числом факторов, вызывающих у пациента отрицательное персональное отношение, а также его индивидуальностью.
При анализе показателей качества жизни в ОГ и КГ не найдено достоверных различий показателей, характеризующих качество жизни пациентов. У пациентов, принимающих Эгилок СР, отмечено статистически значимое уменьшение головной боли через 2 и 3 месяца лечения, у лиц, принимающих Беталок ЗОК, уменьшение головной боли и головокружения через 2 и 3 месяца терапии.
Таким образом, препараты показали сходную терапевтическую эффективность на уровень АД у пациентов и можно говорить о сопоставимой клинической эффективности лекарственного средства «Эгилок СР» по сравнению с «Беталок ЗОК» у лиц с АГ I–II степени в качестве монотерапии.
Л И Т Е Р А Т У Р А
1. Архипов М.В., Липченко А.А., Суворова Т.Е., Фокина Е.Г., Малахов В.И. // Росс. кардиолог. журн. – 2000. – №5. – С.15–20.
2. Ахапкин Р.В. / / Психиатрия и психофармакотерапия. – 2003. – Т.5, №3. – С.1–6.
3. Боровиков В. STATISTIKA: искусство анализа данных на компьютере. – СПб., 2003. – 160 с.
4. Бурсиков А.В., Ушакова С.Е., Мишка И.Е. и др. // Клинич. медицина. – 2004. – №7. – С.20–22.
5. Гланц С. Медико-биологическая статистика: Пер. с англ. / С. Гланц. – М., 1999. – 459 с.
6. Зайцев В.П. // Кардиология. – 1986. – №3. – С.42.
7. Кисляк О.А. // Справочник поликлинического врача. – 2006. – Т.4, №5. – С.28–33.
8. Куимов А.Д., Петрова М.М., Маренич А.В. // Росс. кардиолог. журн. – 2000. – №1. – С.24–27.
9. Ливенцева М.М., Павлова О.С., Черник С.В. и др. // Мед. новости. – 2016. – №4. – С.43–46.
10. Люсов В.А., Евсиков Е.М., Машукова Ю.М., Шарипов Р.А. // Росс. кардиолог. журн. – 2008. – №1. – С.1–19.
11. Медведев И.Н., Даниленко О.А. // Успехи современного естествознания. – 2011. – №2 – С.26–29.
12. Сергиенко В.И., Бондаренко И.Б. Математическая статистика в клинических исследованиях. – М., 2000.
13. Guideline on clinical investigation of medicinal products in the treatment of hypertension (Draft) / EMA/CHMP/29947/2013/Rev. 4 // 27 June 2013.
14. Lingjaerde O., Ahlfors U.G., Bech P., Dencker S.J., Elgen K. // Acta Psychiatrica Scandinavica. – 1987. – Vol.76. – P.1–100: doi: 10.1111/j.1600-0447.1987.tb10566.x 12.
15. Neutel J. et al. // J. RAAS. – 2005. – N6. – Р.84–89.
Медицинские новости. – 2016. – №9. – С. 40-43.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.