Внимание! Статьяадресованаврачам-специалистам
Romaschenko T.I., Belyayeva Ya.V.
Karaganda State Medical University, Kazakhstan
Ultrasonic diagnosis of brain structures in children
with hypotrophic type of intrauterine growth retardation
Резюме. Комплексное ультразвуковое исследование было проведено 20 пациентам с гипотрофическим вариантом задержки внутриутробного развитияв возрасте 2 месяцев жизни на аппарате Sonoscap S-20 в режиме реального времени, используя высокочастотный датчик 5,0 Мгц. При нейросонографии оценивали состояние паренхимы головного мозга, желудочковой системы и цистерн, выраженность извилин. Патологические изменения были выявлены у подавляющего большинства 18 (90%) детей. Полученные данные позволяют считать, что у детей с задержкой внутриутробного развития по гипотрофическому типу первой степени в двухмесячном возрасте наиболее часто наблюдаются перивентрикулярные кровоизлияния первой степени – 10 (50%); на втором месте по частоте встречаемости стоят перивентрикулярные кровоизлияния второй степени – 8 (40%); признаки незрелости мозга встречаются у четверти больных и занимают третье место – 5 (25%); перивентрикулярная лейкомаляция стоит на четвертом месте – 4 (20%). У 4 (20%) детей при отсутствии клинической симптоматики ультразвуковыми методами исследования были выявлены признаки перивентрикулярной лейкомаляции и диастолический вариант нарушения церебрального кровообращения. Данный факт подтверждает наличие латентной фазы перивентрикулярной лейкомаляции и высокие компенсаторные возможности сосудов головного мозга.
Ключевые слова: ультразвуковая диагностика, задержка внутриутробного развития, структуры головного мозга.
Медицинские новости. – 2017. – №1. – С. 69–72.
Summary. Twenty 2 month-old children with hypotrophy- type IUGR were subjected to a real-time complex ultrasound examination with Sonoscap S-20, using a high-frequency 50 MHz probe. The neurosonography was performed to evaluate the state of brain parenchima, that of cerebral ventricular system and brain cisterns as well as the development of gyri and sulci. The vast majority of patients revealed pathologies,18 children ( 90%). The data allows to conclude that 1-st Degree intraventricular hemorrhage is the most frequent case in two-month babies with 1-st Degree hypotrophy- type IUGR, 10 patients (50%). This is followed by 2-Degree periventricular hemorrhage – 8 cases (40%). The symptoms of cerebral immaturity were found in a quarter of the subjects (5 patients) and periventricular leukomalacia was the problem in 4 children (20%). According to neurosonography, four babies (20%) who had not shown any clinical signs were diagnosed with periventricular leukomalacia and diastolic type disorders of cerebral blood flow, which fact proves the latent phase of leukomalacia and high compensatory ability of cerebral blood vessels.
Keywords: neurosonography, IUGR (Intrauterine Growth Restriction), brain structures.
Meditsinskie novosti. – 2017. – N1. – P. 69–72.
Среди проблем, имеющих государственное медико-социальное значение, особо может быть выделена проблема охраны материнства и детства. Многогранность этой проблемы состоит в том, что она включает в себя комплекс задач, определяющих качество здоровья населения. К ним относятся снижение показателей перинатальной и ранней неонатальной смертности, забота о здоровье детей на разных этапах их жизни, предупреждение врожденных и наследственных заболеваний, врожденных инфекций и др.
Практическую ценность для своевременной коррекции выявленных нарушений и дальнейшего прогноза имеет ранняя диагностика неврологической патологии у новорожденных. Наибольшее значение среди диагностических методов у детей раннего возраста в настоящее время стало приобретать ультразвуковое исследование головного мозга (нейросонография). Преимуществами метода являются: информативность, безболезненность, отсутствие необходимости специальной подготовки пациента, возможность обследования у постели больного, отсутствие лучевой нагрузки.
Нейросонография позволяет объективизировать морфологические изменения головного мозга у новорожденных, у которых рутинных анамнестического и клинико-неврологического методов может быть недостаточно для постановки диагноза.
Задержка внутриутробного развития (ЗВУР) представляет собой следствие воздействия многих неблагоприятных факторов в период беременности, способствующих поражению плаценты и приводящих к снижению трофики плода.
Частота рождения детей с ЗВУР широко варьирует и во многом зависит от критериев, положенных в основу диагноза, от генетического груза популяции, социально-экономических условий, а также географических факторов. В экономически развитых странах частота рождения детей с ЗВУР составляет 30–40%, в развивающихся странах она достигает 70% на фоне более высокой частоты рождения детей с низкой массой тела.
Высокая перинатальная заболеваемость и смертность новорожденных и детей раннего возраста при ЗВУР, а также отставание в физическом и интеллектуальном развитии в постнатальном онтогенезе определяют актуальность проблемы ЗВУР.
Сказанное свидетельствует о необходимости дальнейшего изучения проблемы ЗВУР с акцентом на раннее выявление нарушений адаптации, разработку лечебно-профилактических мероприятий, что будет способствовать снижению заболеваемости и повышению уровня здоровья как в детском возрасте, так и в последующие периоды жизни.
Таким образом, изучение данных ультразвуковых методов исследования структур головного мозга новорожденных при ЗВУР является актуальным и представляет практический интерес для специалистов лучевой диагностики и лучевой терапии, неонатологов, невропатологов и педиатров.
Материалы и методы
Комплексное ультразвуковое исследование было проведено 20 пациентам с гипотрофическим вариантом ЗВУРв возрасте 2 месяцев жизни на аппарате Sonoscap S-20 в режиме реального времени, используя высокочастотный датчик 5,0 Мгц. При нейросонографии оценивали состояние паренхимы головного мозга, желудочковой системы и цистерн, выраженность извилин. Патологические изменения были выявлены у подавляющего большинства –18 (90%) – детей.
Результаты и обсуждения
Патологические изменения были выявлены у подавляющего большинства (18 (90%)) детей.
При коронарном сканировании через структуры передней черепной ямки, а также в парасагиттальных сечениях через боковые желудочки мозга у 9 (45%) детей визуализировали зоны повышенной эхогенности в области наружных перивентрикулярных областей боковых желудочков мозга, у 3 (15%) из них эти изменения локализовались в области латеральных отделов передних рогов боковых желудочков (рис. 1). Аналогичные изменения описаны К.В. Ватолиным и расценивались как ультразвуковые признаки перивентрикулярной лейкомаляции.
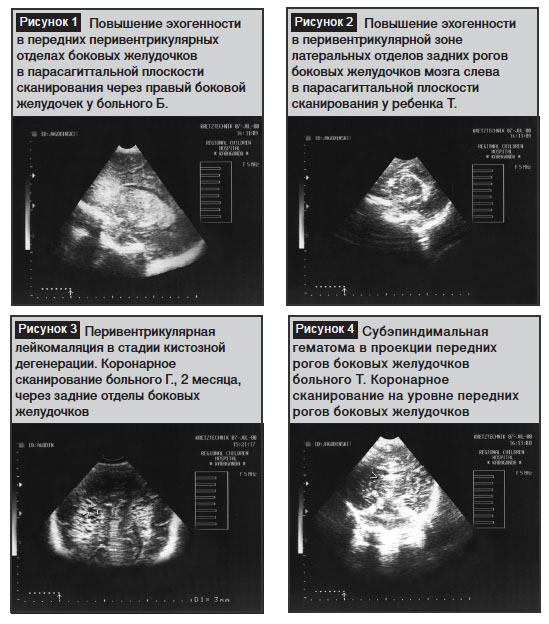
Зоны повышенной эхогенности в области латеральных отделов задних рогов боковых желудочков мозга были зарегистрированы у 6 (30%) больных (рис. 2).
Зоны повышенной эхогенности имели характерную треугольную форму с основанием, обращенным к корковым структурам, и носили двухсторонний характер. Повышение эхогенности перивентрикулярной паренхимы мозга достигала степени эхогенности сосудистых сплетений боковых желудочков и костных структур.
Между передними рогами боковых желудочков мозга у 5 (25%) наблюдаемых выявляли полость прозрачной перегородки. Размеры полости прозрачной перегородки, по нашим данным, варьировали от 4,5 до 5,7 мм. К.В. Ватолин считает, что такие размеры полости прозрачной перегородки соответствуют увеличению размеров данной анатомической структуры. У 5 (25%) детей при нейросонографии не было выявлено расширение боковых желудочков, но хорошо визуализировалось увеличение полости прозрачной перегородки, что являлось проявлением ультразвукового признака незрелости головного мозга.
Полость Верги визуализировалась у 3 (15%) детей. Ширина полости Верги соответствовала нормативным показателям, характерным для детей данного возраста.
Визуализация полости Верги и прозрачной перегородки, повышение эхогенности перивентрикулярных зон с последующим уменьшением эхогенности при динамическом исследовании, отсутствие расширения размеров боковых желудочков мозга указывало на наличие у детей признаков незрелости структур головного мозга, чему способствовала внутриутробная гипоксия плода.
Полученные нами данные ультразвукового исследования дают основание разделить точку зрения А.В. Свирского, что незрелость структур головного мозга, которая проявляется только повышением эхогенности в перивентрикулярной области, не требует медикаментозной коррекции.
У 4 (20%) детей с ультразвуковыми признаками перивентрикулярного отека боковых желудочков мозга в динамике мы отмечали появление на месте отека множественных, мелких анэхогенных образований (кист), отграниченных от паренхимы мозга четким гиперэхогенным ободком размером 2–3 мм, которые «веером» отходили от боковых желудочков мозга к периферии мозга (рис. 3).
Данная ультразвуковая картина соответствовала перивентрикулярной лейкомаляции.
Субэпиндимальные гематомы менее 10 мм в наибольшем размере диагностированы у 18 (90%) пациентов в возрасте двух месяцев жизни, что соответствовало перивентрикулярному кровоизлиянию первой степени. Эхографическим критерием перивентрикулярного кровоизлияния первой степени явились гомогенные зоны повышенной эхоплотности в области субэпиндимальных отделов передних рогов боковых желудочков мозга, головок хвостатых ядер (рис. 4).
При локализации кровоизлияний в область субэпиндимальных отделов передних рогов боковых желудочков мозга у 11 (55%) пациентов выявили гиперэхогенную структуру гематомы с небольшим расширением контралатерального желудочка. В вариантах развития геморрагии в области головки хвостатого ядра у 7 (35%) детей повышенную эхогенность выявляли в нижне-медиальных отделах передних рогов боковых желудочков мозга (рис. 5).
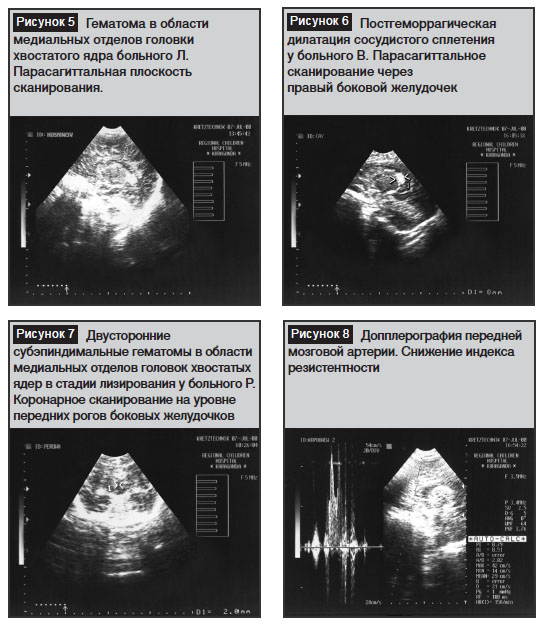
У 5 (25%) детей изменения носили двухсторонний характер. Изолированные субэпиндимальные кровоизлияния наблюдали у 10 (50%) пациентов. Полученные данные, согласно классификации M.J. Levenе, соответствовали перивентрикулярному кровоизлиянию первой степени.
Учитывая то, что кровоизлияния в область сосудистых сплетений всегда сочетались с субэпиндимальным кровоизлиянием, можно думать, что у 8 (40%) больных имело место перивентрикулярное кровоизлияние второй степени.
При коронарном сканировании через область желудочковых треугольников у 8 (40%) детей диагностировали кровоизлияния в область сосудистых сплетений боковых желудочков мозга. В 6 (30%) наблюдениях изменения носили левосторонний характер. Сосудистые сплетения были увеличены до 7–9 мм, при этом отсутствовала дилатация желудочков мозга на стороне поражения. Эхоструктура сосудистых сплетений была неоднородна за счет единичных узелковых зон повышенной эхоплотности. Размер тромбов достигал 1–4 мм в диаметре (рис. 6).
Процесс рассасывания субэпиндимальных гематом (рис. 7) и кровоизлия-ний в область сосудистых сплетений был ярко выражен в виде анэхогенных образований в центре тромботических масс в диаметре 1–2 мм и носил множественный характер, что можно было рассматривать как один из вариантов возрастной нормы ребенка.
Последующее наблюдение за детьми показало, что типичные субэпиндимальные кровоизлияния и кровоизлияния в область сосудистых сплетений у детей данной группы наблюдения исчезали к 12–14 месяцам жизни, что было несколько позже обычных сроков рассасывания кровоизлияний данной локализации (в норме – к 8–10 месяцам), по данным К.В. Ватолина.
Как видно из табл. 1, размеры внутренних полостных структур головного мозга у детей с ЗВУР первой степени соответствовали показателям нормы.
Таблица 1. Параметры структур головного мозга, по данным нейросонографии (n=20)
|
Название анатомических образований
|
Размер, M±m
|
|
Межполушарная щель, мм
|
2,3±0,3
|
|
Передние рога боковых желудочков, мм
|
1,7±0,09
|
|
Ширина третьего желудочка, мм
|
2,7±0,2
|
|
Глубина тела бокового желудочка в коронарном сечении, мм
|
2,9±0,3
|
|
Желудочковый индекс = а/в?100%, %
|
33±2,3
|
|
Ширина полости Верги, мм
|
2,6±0,3
|
|
Ширина полости прозрачной перегородки в коронарной плоскости сканирования, мм
|
4,5±0,2
|
|
Мозжечково-мозговая цистерна, мм
|
4,0±0,5
|
|
Большая цистерна мозга, мм
|
5,8±0,1
|
|
Расстояние от мозгового вещества до лобной кости, мм
|
29,5±0,4
|
|
Расстояние мозгового вещества до затылочной кости, мм
|
22,8±0,2
|
Как видно из табл. 2, в бассейне передней мозговой артерии имело место стабильное повышение максимальной, средней и минимальной скоростей кровотока, что приводило к снижению индекса резистентности, повышению пульсационного индекса (рис. 8).
Таблица 2. Показатели церебрального кровотока передней мозговой артерии у детей с ЗВУР первой степени (n=20)
|
Показатели мозгового кровотока
|
Размер, M±m
|
|
Vmax, м/с ( максимальная систолическая скорость)
|
0,42±0,09
|
|
Vmin, м/с (минимальная диастолическая скорость)
|
0,14±0,03
|
|
Vmean, м/с (средняя скорость кровотока)
|
0,29±0,011
|
|
Ri (индекс резистентности) (Vc-Vd)/Vc
|
0,65±0,005
|
|
Ip (индекс пульсационный) (Vc-Vd)/Vm
|
0,93±0,12
|
|
ISD (систоло-диастолическое отношение) ISD=Vs/Vd
|
2,85±0,07
|
Вероятно, такое усиление крово-снабжения в зоне «интереса», бассейне передней мозговой артерии, являлось компенсаторным после перенесенной гипоксии и объяснялось большей потребностью пораженной области в кислороде и питательных веществах для восстановительных процессов. Умеренное снижение индекса резистентности указывало на наличие морфофункциональной незрелости мозга.
Таким образом, усиление регионального кровотока в раннем восстановительном периоде носило компенсаторно-адаптационный характер и служило благоприятным прогностическим признаком.
Для оценки размеров желудочковой системы головного мозга и состояния ликворопроводящих путей использовали эхоэнцефалографию.
Как видно из табл. 3, показатели расстояния до полости прозрачной перегородки, третьего желудочка, вентрикулярного эха, а также окружности головы и ширины третьего желудочка в динамике имели тенденцию к увеличению, что было связано с ростом мозга детей. Показатели индекса третьего желудочка, среднеселлярного индекса, индекса мозгового плаща в динамике оставались стабильными и находились в пределах возрастной нормы, характерной для детей данной возрастной группы. На эхограммах детей, перенесших перивентрикулярное кровоизлияние второй степени, отмечали оживление общего фона пульсаций, незначительное увеличение их амплитуды, но коэффициенты нарастания при этом практически не менялись.
Таблица 3. Основные эхографические показатели у детей (n=20)
|
Основные эхографические показатели
|
Размер, М±m
|
|
Расстояние до полости прозрачной перегородки, см
|
4,85±0,5
|
|
Расстояние до третьего желудочка, см
|
5,3±0,7
|
|
Расстояние до вентрикулярного эха, см
|
7,6±0,3
|
|
Межтеменной диаметр черепа, см
|
10,2±0,2
|
|
Ширина третьего желудочка (V3), мм
|
3,8±0,5
|
|
Окружность головы, см
|
38,5±0,3
|
|
Индекс третьего желудочка Dvi=2*Tr/V3 (при N=1,89±0,2, не более 15)
|
2,7±0,3
|
|
Среднеселлярный индекс Ci=2*Dt/(DV2 – DV1) (при N=3,8±0,2)
|
4,0±0,4
|
|
Индекс мозгового плаща ИМП=B/a (N=2,3±01)
|
1,86±0,2
|
Заключение
Полученные данные позволяют считать, что у детей с ЗВУР по гипотрофическому типу первой степени в двухмесячном возрасте наиболее часто наблюдаются перивентрикулярные кровоизлияния первой степени – 10 (50%); на втором месте по частоте встречаемости стоят перивентрикулярные кровоизлияния второй степени – 8 (40%); признаки незрелости мозга встречаются у четверти больных и занимают третье место – 5 (25%); перивентрикулярная лейкомаляция стоит на четвертом месте – 4 (20%). У 4 (20%) детей при отсутствии клинической симптоматики ультразвуковыми методами исследования были выявлены признаки перивентрикулярной лейкомаляции и диастолический вариант нарушения церебрального кровообращения. Данный факт подтверждает наличие латентной фазы перивентрикулярной лейкомаляции и высокие компенсаторные возможности сосудов головного мозга.
W. Allan и J.J. Volpe считают, что нарастание перивентрикулярных кровоизлияний продолжается до 21 дня жизни; процесс рассасывания тромбов, по данным R. Altman, происходит постепенно в течение 5–6 недель.
Наши данные дают основание считать, что у детей с ЗВУР по гипотрофическому типу первой степени процессы тромбообразования и тромболизиса продлеваются во времени, перивентрикулярные кровоизлияния разрешаются к четырем месяцам жизни ребенка, что свидетельствует об обратимости патологических изменений головного мозга.
В группе детей с ЗВУР по гипотрофическому типу первой степени, наиболее информативными методами ультразвуковой диагностики оказались нейросонография и допплерография сосудов головного мозга. Данные методы исследования позволили оценить не только количественные, но и качественные показатели структур головного мозга, понять патоморфологию мозга.
Наши данные не подтверждают мнение М.Н. Мухарлямова, который предлагает использовать эхоэнцефалографию как скрининговый тест для диагностики заболеваний головного мозга у детей в возрасте с 2 месяцев жизни, поскольку у большинства детей, перенесших внутриутробную гипоксию, при проведении нейросонографии определяются признаки поражения структур головного мозга, тогда как эхогафические показатели остаются нормальными.
Л И Т Е Р А Т У Р А
1. Пыков М.И., Ватолин К.В. Клиническое руководство по ультразвуковой диагностике в педиатрии. – М., 2008. – 218 с.
2. Нейросонография в диагностике внутричерепных кровоизлияний у новорожденных: Метод. рекомендации / В.В. Гаврюшов [и др.]. – М., 2007. – 20 с.
3. Никулин Л.А., Бурундукова А.Е., Литвинова Г.В., Кононова В.Е. // Вопр. охраны мат. дет. –2009. – №1 – С.11–14.
4. Каре Н.С. Диагностические возможности одномерной эхоэнцефалографии при поражениях центральной нервной системы у новорожденных и детей грудного возраста: Дис. ... канд. мед. наук. – М., 2004. – 173 с.
5. Хрусталева О.П. Перивентрикулярные кровоизлияния у недоношенных детей: Автореф. дис. ... канд. мед. наук. – М., 2008. – 30 с.
6. Евсюкова И.И., Фоменко Б.А., Андреева A.A. и др. // Журнал акушерства и женских болезней. – 2003. – Т.52, №4. – С.23–27.
7. Шишмакова М.Ю., Захарова С.Ю. // Вопросы соврем. педиатрии. – 2006. – Т.5, прил.1. – С.800.
8. Жумашева А.В. Клинические и патоморфологические изменения при внутричерепных кровоизлияниях у новорожденных детей: Автореф. дис. … канд. мед. наук. – Казахстан, 2003. – 18 с.
9. Допплерография перинатальных поражений головного мозга / Е.А. Зубарева, И.В. Дворяковский, А.Р. Зубарев, А.Б. Сугак. – М., 2006. – 92 с.
10. Van Bel F. Cerebral blood flow velocity waveform characteristics (Doppler ultrasound) // An atlas of neonatal Brain sonography / P. Govaert, L.L. De Vries. – MacKeith Press, 2007. – P.341–363.
11. Schellinger D., Grant E.G., Richardson J.D. // AJNR. – 2004. – Vol.5. – P.439–445.
Медицинские новости. – 2017. – №1. – С. 69-72.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.