Внимание! Статья адресована врачам-специалистам
DavydovA.V.1,2, TitovL.P.2, KlyuikoN.L.3, LevshinaN.N.4, KharkhalA.N.2, MadjarovaO.A.3, BelanovskayaL.I.5
1Belarusian State Medical University, Minsk
2The Republican Research and Practical Center for Epidemiology and Microbiology, Minsk, Belarus
3City Children’s Infectious Diseases Clinical Hospital, Minsk, Belarus
4City Center for Hygiene and Epidemiology, Minsk, Belarus
5City Infectious Diseases Clinical Hospital, Minsk, Belarus
Antimicrobial susceptibility of Streptococcus pneumoniae strains isolated from patients with pneumonia in Belarus
Резюме. Фенотипическая резистентность к антибиотикам 26 штаммов пневмококка исследована с использованием микроразведений в бульоне и критериев CLSI 2017, EUCAST 2017. Отмечены высокие уровни клинически нечувствительных штаммов к феноксиметилпенициллину (62%), ампициллину и меропенему (58%), цефалоспоринам II–III поколения (46–58%), 14- и 15-членным макролидам (50%), ингибиторам синтеза фолиевой кислоты (54%), повышенные – к бензилпенициллину (23%), цефалоспоринам IV поколения (15%), линкозамидам и 16-членным макролидам (39%), тетрациклинам (31%), амфениколам (12%), низкие – к пероральному амоксициллину (8%), фторхинолонам (4%), эртапенему (4%) и полная чувствительность к ансамицинам, гликопептидам и оксазолидинонам. Штаммы с природной чувствительностью встречались редко (35%), мульти- и чрезвычайно резистентные – с частотой 50% и 27%, причем все они относились к «педиатрическим» и вакцинальным серотипам (6B, 14, 19F, 23F и 19A). Полученные результаты рекомендуем использовать врачам-специалистам при проведении эмпирической антибиотикотерапии и подготовке протоколов лечения пациентов с пневмококковой инфекцией.
Ключевые слова: пневмококк, пневмококковая пневмония, Streptococcus pneumoniae, минимальная подавляющая концентрация, резистентность к антибиотикам.
Медицинские новости. – 2017. – №12. – С. 74–82.
Summary. Phenotypic resistance to antibiotics of 26 pneumococcal strains was examined using broth microdilution method and CLSI 2017, EUCAST 2017 criteria. We registered high levels of clinically not susceptible strains to Phenoxymethylpenicillin (62%), Ampicillin and Meropenem (58%), II–III gen. Cephalosporins (46–58%), 14- and 15-member Macrolides (50%), Folate pathway inhibitors (54%), evaluated levels – to Benzylpenicillin (23%), IV gen. Cephalosporins (15%), Lincosamides and 16-member Macrolides (39%), Tetracyclines (31%), Phenicols (12%), low levels – to oral Amoxicillin (8%), Fluoroquinolones (4%), Ertapenem (4%), and absolute susceptibility to Ansamycins, Glycopeptides and Oxazolidinones. Strains with natural antibiotic susceptibility were rare (35%), but XDR and MDR strains ranged from 27% to 50% and belonged to “pediatric” and vaccine serotypes (6B, 14, 19F, 23F and 19A). We recommend to use obtained results by clinicians for empiric antibacterial treatment and correction of national guidelines for treatment of pneumococcal infection.
Keywords: pneumococcus, pneumococcal pneumonia, Streptococcus pneumoniae, minimum inhibitory concentration, resistance to antibiotics.
Meditsinskie novosti. – 2017. – N12. – P. 74–82.
Внебольничная пневмония сегодня остается одной из основных причин заболеваемости, обращений за медицинской помощью, госпитализаций и смертности как среди детей, так и взрослых [1–4]. Несмотря на достигнутый успех в разработке рекомендаций по ведению пациентов с внебольничной пневмонией, возможность применения своевременной и подходящей антибактериальной терапии и внедрение эффективных программ иммунопрофилактики, ассоциированные с данным заболеванием экономические затраты и летальность остаются высокими [5]. Независимо от возраста пациентов Streptococcus pneumoniae (пневмококк) во всем мире является основным этиологическим агентом внебольничной пневмонии, обусловливая, по разным оценкам, от 12 до 68% случаев [1, 3].
Резистентность клинических штаммов пневмококка к используемым в терапии антибиотикам впервые была выявлена еще в 1917 году, в течение 70–80-х годов XX века резистентные к пенициллину, макролидам, тетрациклинам, ко-тримоксазолу и хлорамфениколу пневмококки широко распространялись во всем мире, что обусловило рост инфекционной заболеваемости и смертности людей [6, 7]. Резистентность пневмококка к фторхинолонам была описана значительно позже, однако наряду с устойчивостью к пенициллинам и макролидам в настоящее время она представляет серьезную проблему здравоохранения [8]. Несмотря на то, что описано множество механизмов резистентности пневмококка и опции терапии существуют даже для самых устойчивых штаммов, высокая летальность и скорость прогрессирования наиболее тяжелых форм пневмококковой инфекции (ПИ) наряду с высокой распространенностью менее тяжелых форм создают серьезные проблемы выбора антибиотиков для эмпирической и этиотропной терапии. В связи с этим локальные данные об антибиотикорезистентности циркулирующих среди населения региона и выделяемых от пациентов пневмококков имеют не только эпидемиологическую значимость с точки зрения отслеживания появления и распространения резистентных форм, но и клиническую, так как могут напрямую использоваться для составления и коррекции протоколов терапии инфекций, ассоциированных с пневмококком [9].
Цель исследования – изучить in vitro активность антибиотиков в отношении штаммов пневмококка, выделенных от пациентов с инфекциями нижних дыхательных путей, а также оценка уровней и профилей резистентности, анализ возможностей применения разных классов антибиотиков для терапии ПИ.
Материалы и методы
Материалом являлись 26 штаммов пневмококка, выделенных микробиологическими лабораториями лечебно-профилактических учреждений страны с мая 2013 по декабрь 2016 год и переданные в Республиканскую референс-лабораторию по диагностике инвазивных бактериальных заболеваний (Лаборатория клинической и экспериментальной микробиологии Республиканского научно-практического центра эпидемиологии и микробиологии). Штаммы были выделены из крови (46,2%), мокроты (26,9%), плевральной жидкости (19,2%) и тканей легкого (7,7%) госпитализированных пациентов (50% мужчин, 50% женщин) с внебольничной пневмонией (24 (92,3%) человека), плевритом (1 (26, 3,8%) пациент), бронхитом (1 (3,8%) человек) в возрасте 11 месяцев – 70 лет (средний возраст пациентов – 24,3 года, межквартильный размах – 4–43 года).
Реидентификацию изолятов проводили в соответствии с лабораторным руководством Всемирной организации здравоохранения и CDC (Центры по контролю и профилактике заболеваний, США) [10]на основании: микроскопии с окрашиванием по Граму, оценки морфологии колоний и гемолитической активности, отрицательной пробы на каталазу, чувствительности к оптохину, растворимости солями желчных кислот, а также молекулярно-генетического обнаружения гена аутолизина (lytA), гена регуляции синтеза капсулы (cpsA), а также специфичных отдельным серотипам фрагментов генов капсульного локуса с целью серогенотипирования по описанной ранее методике [11, 12].
Определение фенотипической чувствительности к антибиотикам выполнялось методом микроразведений в бульоне в соответствии со стандартом CLSI (Институт клинических и лабораторных стандартов, США) M07-A10:2015 и международным стандартом ISO 20776-1:2006, рекомендованным EUCAST (Европейский комитет по определению чувствительности к противомикробным препаратам) [13]. В качестве питательной среды использовали сбалансированный по катионному составу Мюллер – Хинтон бульон (Fluka, США) с добавлением 5% лизированной лошадиной крови. В качестве контрольных образцов использовали штаммы S. pneumoniae как из международной коллекции (ATCC 49619), так и полученные в рамках программы контроля качества проекта CAESAR (Сеть по эпиднадзору за устойчивостью к противомикробным препаратам в странах Центральной Азии и Восточной Европы).
Микробиологическая чувствительность/резистентность штаммов определялась путем сравнения фактических значений МПК антибиотиков с эпидемиологическими точками отсечения (Epidemiological Cut-Off Value, ECOFFV) базы данных EUCAST, которые разделяют популяцию на штаммы «дикого» типа (микробиологически чувствительные) и штаммы с наличием механизмов приобретенной, в том числе мутационной, резистентности (микробиологически устойчивые) [14–16].
Для определения клинической чувствительности/резистентности штаммов полученные значения МПК интерпретировали с использованием критериев и пороговых значений CLSI 2017, а также EUCAST 2017 (для ампициллина) (табл. 1) [15]. Полученный результат МПК интерпретировали в соответствии со следующими категориями: чувствительность (Susceptible – S), резистентность/устойчивость (Resistant – R) и промежуточная категория (умеренная чувствительность/резистентность, Intermediate – I). Категория чувствительности обозначает, что изоляты ингибируются обычно достигаемыми концентрациями антибиотика при использовании рекомендованных дозировок для терапии инфекции соответствующей локализации, что приводит к высоковероятной клинической эффективности. Промежуточная категория включает в себя изоляты с такими МПК антибиотиков, которые численно приближаются к обычно достигаемым в крови и тканях концентрациям; для этих изолятов вероятность положительного клинического ответа может быть ниже, чем для чувствительных изолятов, однако предполагается клиническая эффективность в локализациях (тканях и органах), где антибиотик физиологически концентрируется (например, фторхинолоны и ?-лактамы в моче) либо при возможности использования дозировки, превышающей стандартную (например, ?-лактамы). Категория резистентности обозначает, что изоляты не ингибируются достигаемыми обычно концентрациями антибиотика при использовании стандартных режимов дозирования и/или изоляты имеют МПК, попадающие в границы с высоковероятным присутствуем специ-фических механизмов резистентности бактерий (например, ?-лактамазы), в то время как клиническая эффективность препарата против таковых изолятов не была достоверно продемонстрирована в терапевтических исследованиях [15, 16].
Таблица1. Критерии интерпретации результатов МПК и способы введения (режимы дозирования) антибиотиков, для которых разработаны критерии
|
Антибиотик
|
Код
|
S, мг/л
|
R, мг/л
|
Способ введения, доза
|
|
Бензилпенициллин
(не менингит)
|
PEN
|
≤2
|
≥8
|
внутривенно ≥12 МЕД/сутки (если МПК ≤2 мг/л)
внутривенно 18–24 МЕД/сутки (если МПК =4 мг/л)
|
|
Феноксиметилпенициллин (per os)
|
PNV
|
≤0,06
|
≥2
|
перорально
|
|
Ампициллин
|
AMP
|
≤0,5
|
≥4
|
внутривенно 0,5–1 г
3–4 раза в сутки
|
|
Амоксициллин (per os)
|
AMX
|
≤2
|
≥8
|
перорально
|
|
Цефуроксим
|
CXM
|
≤0,5
|
≥2
|
внутримышечно, внутривенно
|
|
Цефуроксим (per os)
|
CXA
|
≤1
|
≥4
|
перорально
|
|
Цефтриаксон
(не менингит)
|
CRO
|
≤1
|
≥4
|
внутривенно, внутримышечно
|
|
Цефотаксим (не менингит)
|
CTX
|
≤1
|
≥4
|
внутривенно, внутримышечно
|
|
Цефепим (не менингит)
|
FEP
|
≤1
|
≥4
|
внутривенно, внутримышечно
|
|
Меропенем
|
MEM
|
≤0,25
|
≥1
|
внутривенно
|
|
Эртапенем (не менингит)
|
ETP
|
≤1
|
≥4
|
внутривенно, внутримышечно
|
|
Офлоксацин
|
OFX
|
≤2
|
≥8
|
внутривенно,
внутримышечно, перорально
|
|
Левофлоксацин
|
LVX
|
≤2
|
≥8
|
внутривенно, перорально
|
|
Моксифлоксацин
|
MFX
|
≤1
|
≥4
|
внутривенно, перорально
|
|
Спарфлоксацин (per os)
|
SPX
|
≤0,5
|
≥2
|
перорально
|
|
Эритромицин
|
ERY
|
≤0,25
|
≥1
|
внутривенно, перорально
|
|
Клиндамицин
|
CLI
|
≤0,25
|
≥1
|
внутривенно,
внутримышечно, перорально
|
|
Тетрациклин
|
TET
|
≤1
|
≥4
|
внутривенно, перорально
|
|
Доксициклин
|
DOX
|
≤0,25
|
≥1
|
внутривенно, перорально
|
|
Хлорамфеникол
|
CHL
|
≤4
|
≥8
|
внутривенно, перорально
|
|
Ко-тримоксазол
|
SXT
|
≤0,5
|
≥4
|
внутривенно, перорально
|
|
Рифампицин
|
RIF
|
≤1
|
≥4
|
внутривенно, перорально
|
|
Ванкомицин
|
VAN
|
≤1
|
–
|
внутривенно, перорально
|
|
Линезолид
|
LNZ
|
≤2
|
–
|
внутривенно, перорально
|
Статистическая обработка данных проводилась с использованием программы STATISTICA 10.0 (StatSoft Inc., США). Показатели МПК50 и МПК90 рассчитывали c использованием метода простого упорядоченного массива данных [17]. При составлении профилей резистентности и определении множественной устойчивости учитывались все клинически нечувствительные штаммы, к которым относили как устойчивые, так и умеренно устойчивые.
Результаты и обсуждение
В таблице 2 представлена характеристика in vitroактивности 22 антибиотиков по отношению к 26 исследуемым штаммам пневмококка (распределение МПК, показатели МПК50 и МПК90).
Таблица 2. Фенотипическая характеристика исследованных штаммов пневмококка
|
Антибиотик
|
МПК (мг/л) и количество штаммов
|
|
≤0.004
|
0.008
|
0.016
|
0.03
|
0.06
|
0.125
|
0.25
|
0.5
|
1
|
2
|
4
|
8
|
16
|
32
|
64
|
128
|
256
|
≥512
|
МПК50
|
МПК90
|
|
Пенициллин
|
3
|
4
|
2
|
1
|
1
|
|
|
1
|
8
|
6
|
|
|
|
|
|
|
|
2
|
4
|
|
Ампициллин
|
|
|
1
|
5
|
4
|
|
1
|
|
|
2
|
7
|
5
|
1
|
|
|
|
|
|
2
|
8
|
|
Амоксициллин
|
|
1
|
6
|
3
|
|
1
|
|
1
|
4
|
8
|
1
|
1
|
|
|
|
|
|
|
1
|
2
|
|
Цефуроксим
|
|
|
1
|
7
|
1
|
1
|
1
|
|
|
2
|
1
|
10
|
1
|
1
|
|
|
|
|
2
|
8
|
|
Цефтриаксон
|
|
|
1
|
8
|
|
2
|
2
|
1
|
10
|
1
|
1
|
|
|
|
|
|
|
0,5
|
2
|
|
Цефотаксим
|
|
|
1
|
8
|
1
|
1
|
|
2
|
|
12
|
|
1
|
|
|
|
|
|
|
0,5
|
2
|
|
Цефепим
|
|
|
1
|
7
|
2
|
1
|
|
2
|
9
|
4
|
|
|
|
|
|
|
|
|
0,5
|
2
|
|
Меропенем
|
|
1
|
9
|
|
|
1
|
|
7
|
8
|
|
|
|
|
|
|
|
|
|
0,5
|
1
|
|
Эртапенем
|
|
|
|
7
|
3
|
|
1
|
|
14
|
1
|
|
|
|
|
|
|
|
|
1
|
1
|
|
Офлоксацин
|
|
|
|
|
|
|
|
|
9
|
16
|
|
|
|
1
|
|
|
|
|
2
|
2
|
|
Левофлоксацин
|
|
|
|
|
|
|
|
6
|
19
|
|
|
|
1
|
|
|
|
|
|
1
|
1
|
|
Моксифлоксацин
|
|
|
|
|
3
|
22
|
|
|
|
1
|
|
|
|
|
|
|
|
|
0,125
|
0,125
|
|
Спарфлоксацин
|
|
|
|
|
|
3
|
22
|
|
|
|
|
1
|
|
|
|
|
|
|
0,25
|
0,25
|
|
Эритромицин
|
|
|
4
|
8
|
1
|
|
|
|
|
1
|
1
|
2
|
|
|
|
|
|
9
|
0,064
|
≥512
|
|
Клиндамицин
|
|
|
3
|
10
|
3
|
|
|
|
|
|
|
|
1
|
|
|
7
|
2
|
|
0,032
|
128
|
|
Тетрациклин
|
|
|
|
|
|
7
|
10
|
|
1
|
|
|
|
1
|
3
|
4
|
|
|
|
0,25
|
64
|
|
Доксициклин
|
|
|
|
|
6
|
11
|
1
|
|
|
|
5
|
3
|
|
|
|
|
|
|
0,125
|
8
|
|
Хлорамфеникол
|
|
|
|
|
|
|
|
|
1
|
9
|
13
|
|
3
|
|
|
|
|
|
4
|
16
|
|
Ко-тримоксазол
|
|
|
|
|
|
|
4
|
8
|
|
2
|
|
8
|
3
|
1
|
|
|
|
|
2
|
16
|
|
Рифампицин
|
|
|
|
|
23
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
0,064
|
0,125
|
|
Ванкомицин
|
|
|
|
|
|
|
|
20
|
6
|
|
|
|
|
|
|
|
|
|
0,5
|
1
|
|
Линезолид
|
|
|
|
|
|
|
|
4
|
21
|
1
|
|
|
|
|
|
|
|
|
1
|
1
|
Примечание: эпидемиологические точки отсечения отмечены утолщенной границей [14].
Для множества антибиотиков бета-лактамы, эритромицин, клиндамицин и тетрациклины) отмечается вариация МПК в весьма широком диапазоне (0,016–8 мг/л и более). МПК других препаратов варьирует в узких диапазонах – ванкомицина (0,5–1 мг/л), рифампицина (0,064–0,125 мг/л) и линезолида (0,5–2 мг/л), а также всех фторхинолонов, МПК которых для абсолютного большинства штаммов составляет 0,064–0,125 мг/л (мокси-флоксацин), 0,125–0,25 мг/л (спар-флоксацин), 0,5–1 мг/л (левофлоксацин) и 1–2 мг/л (офлоксацин). Для некоторых антибиотиков часто отмечается формирование резистентности высокого уровня (значения МПК 32–≥512 мг/л) – так, показатель МПК90 для эритромицина составил ≥512 мг/л, для клиндамицина – 128 мг/л, для тетрациклина – 64 мг/л.
Среди исследованных штаммов распределение МПК некоторых антибиотиков не отличается от распределения МПК штаммов «дикого» типа (то есть у данных штаммов фенотипически не отмечается наличие механизмов резистентности к данным антибиотикам). Так, показатели МПК линезолида распределены в промежутке 0,5–2 мг/л и не превышают эпидемиологическую точку отсечения ECOFFV 2 мг/л. Подобное наблюдается для ванкомицина (МПК – 0,5–1 мг/л, ECOFFV – 1 мг/л), рифампицина (МПК – 0,064–0,125 мг/л, ECOFFV – 0,125 мг/л) и всех фторхинолоновых антибиотиков (за исключением одного штамма с наличием механизмов приобретенной резистентности ко всем фторхинолонам) – офлоксацина (МПК – 1–2 мг/л, ECOFFV – 4 мг/л), левофлоксацина (МПК – 0,5–1 мг/л, ECOFFV – 2 мг/л), моксифлоксацина (МПК – 0,064–0,125 мг/л, ECOFFV – 0,5 мг/л) и спарфлоксацина (МПК – 0,125–0,25 мг/л, ECOFFV – не опубликовано, но, вероятно, близко к 1 мг/л). Среди остальных антибиотиков полученное распределение МПК свидетельствует о наличии в исследованной популяции пневмококка микробиологически устойчивых штаммов. Причем, доля таких штаммов весьма высока для некоторых антибиотиков – 61,5–73,1% среди бета-лактамов (16–19 штаммов из 26), 53,8% – для ко-тримоксазола, 50,0% – для эритромицина, 38,5% – для клиндамицина, 30,8% – для тетрациклина и доксициклина.
Учитывая тот факт, что наличие микробиологической резистентности отнюдь не всегда ассоциировано с клинической устойчивостью (наличием риска неблагоприятного исхода терапии), результаты сравнения фактических значений МПК штаммов с ECOFFV не характеризуются какой-либо доказательной клинической значимостью, а используются для эпидемиологических целей (сообщают о появлении, увеличении/снижении распространенности в популяции штаммов с механизмами приобретенной резистентности или их эволюции) [14, 15]. Клинически значимая оценка результатов антибиотикочувствительности штаммов осуществляется исключительно на основе клинических критериев интерпретации и пороговых значений (clinical breakpoints), которые являются надежными предикторами исходов терапии. В свою очередь, они разрабатываются и устанавливаются соответствующими комитетами с учетом активности антибиотиков in vitro (распределения МПК изолятов), параметров фармакокинетики/фармакодинамики и данных клинических исходов терапии совместно с индивидуальными показателями МПК штаммов [15, 16].
На рисунке 1 представлены уровни клинической резистентности к антибиотикам 26 штаммов пневмококка, выделенных от госпитализированных пациентов с инфекциями нижних дыхательных путей. Штаммов с резистентностью высокого уровня к бензилпенициллину (МПК ≥8 мг/л) обнаружено не было, а доля умеренно резистентных штаммов (МПК 4 мг/л) составила 23,1% (6/26). При применении пенициллина per os (феноксиметилпенициллин – Penicillin V) доля чувствительных штаммов (МПК ≤0,06 мг/л) составляет всего 38,5% (10/26 штаммов). Следует отметить, что такое же пороговое значение (МПК ≤0,06 мг/л) применяется для разделения менингеальных штаммов пневмококка на чувствительные и резистентные к парентеральному пенициллину. В данном случае при применении пороговых значений для менингита (что вполне корректно и даже обязательно, так как всегда учитывается возможность осложнения любой формы ПИ) доля резистентных к бензилпенициллину штаммов, вызвавших пневмонию, составила бы 61,5% (16/26 штаммов), что совпадает со значением, полученным ранее для менингеальных штаммов 63,2%.
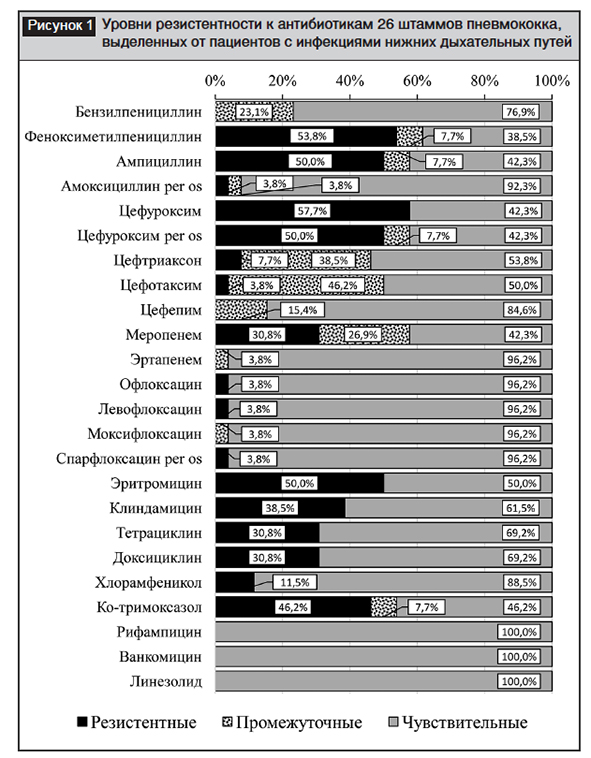
Для остальных бета-лактамных антибиотиков наблюдаются весьма высокие уровни нечувствительных штаммов (57,7% – к ампициллину, парентеральному и пероральному цефуроксиму и меропенему, 50% – к цефотаксиму, 46,2% – к цефтриаксону), за исключением цефепима (15,4%), перорального амоксициллина (7,6%) и эртапенема (3,8%). Причем, резистентных штаммов не обнаружено только по отношению к цефепиму и эртапенему, а их доля по отношению к цефотаксиму, пероральному амоксициллину (по 3,8%) и цефтриаксону (7,7%) является довольно низкой, чего нельзя отметить в отношении цефуроксима, ампициллина и меропенема (30,8–57,5%). Весьма примечательны отличия результатов, полученные для разных аминопенициллинов (92,3% чувствительных к амоксициллину per osпротив 42,3% к парентеральному ампициллину). Причиной этого является установление соответствующими комитетами и применение в данном исследовании различных критериев интерпретации (более высоких пороговых значений CLSIдля амоксициллина per os≤2/≥8 мг/л и более низких EUCASTдля парентерального ампициллина ≤0,5/≥4 мг/л), а также немного более высокая активность in vitroамоксициллина по отношению к ампициллину (полученные показатели МПК примерно на одно двукратное разведение ниже, что также наблюдалось в других исследованиях [14, 18]). Более того, в соответствии с правилами интерпретативного чтения EUCASTампициллин используется для оценки чувствительности и к другим пенициллинам (ампициллин-сульбактам, амоксициллин, амоксициллин-клавуланат, пиперациллин, пиперациллин-тазобактам), определяя в данном случае для них весьма низкий уровень чувствительных штаммов 42,3%. Еще более парадоксальные результаты наблюдаются при сравнении уровней чувствительности к бензилпенициллину и пероральному амоксициллину (76,9–92,3%) с парентеральными цефалоспоринами широкого спектра действия III–IV поколения и меропенемом (42,3–84,6%), которые теоретически должны обладать более высокой активностью и биодоступностью [19, 20].
Действительно, с одной стороны, антипневмококковая активность бета-лактамов in vitro (оцененная на основании показателей МПК90, МПК50 и распределения МПК всех штаммов) в нашем исследовании и в других [21–23]увеличивается в ряду цефуроксим → ампициллин → пенициллин → амоксициллин → цефепим → цефтриаксон → цефотаксим → эртапенем→ меропенем. Однако, установленные CLSIпороговые значения чувствительности бензилпенициллина (неменингеальные формы ПИ) и амоксициллина per os (≤2 мг/л) значительно выше, чем остальных бета-лактамов (≤0,25–1 мг/л). Одобрение для некоторых антибиотиков столь высоких пороговых значений МПК, значительно превышающих ECOFFV, возможно только ввиду наличия данных о том, что имеющие приобретенные механизмы резистентности штаммы с такими МПК хоть и ассоциированы со сниженной противомикробной активностью in vitro (демонстрируют микробиологическую резистентность), но в терапевтических исследованиях была достоверно продемонстрирована клиническая эффективность препарата против них при использовании стандартных режимов дозирования [15, 24]. Касательно других препаратов данная терапевтическая эффективность не наблюдалась: либо отсутствуют достоверные исследования, либо они имеют худшие параметры фармакокинетики/фармакодинамики. Кроме того, подход CLSIпри установлении пороговых значений для амоксициллина всегда основывался только на нетяжелых и неменингеальных формах инфекции, терапия которых выполняется перорально (хотя в некоторых странах существуют и инъекционные формы амоксициллина). Для парентеральных цефалоспоринов вплоть до 2000 года существовали пороговые значения, рассчитанные преимущественно на менингит (с учетом достижения сниженных концентраций в СМЖ по сравнению с плазмой крови и межтканевой жидкостью легких), а после введения в 2000 году неменингеальных пороговых значений, они были рассчитаны, в первую очередь, на более тяжелые формы ПИ, чем те, которые лечат пероральным амоксициллином [19, 25]. Для меропенема до настоящего времени существуют только пороговые значения, рассчитанные преимущественно на менингит.
В связи с этим следует понимать, что результаты, полученные для амоксициллина и, соответственно, пероральной терапии нетяжелых форм инфекций, не следует экстраполировать на инъекционный амоксициллин и другие аминопенициллины, применяемые при терапии более тяжелых форм ПИ. Для бензилпенициллина в 2008 году были установлены отдельные (повышенные) пороговые значения для неменингеальных форм ПИ, что опять же стало возможным благодаря проведению достаточных и достоверных терапевтических исследований. За счет соответствующего увеличения количества чувствительных к пенициллину штаммов ожидалось сокращение применения препаратов широкого спектра (цефалоспоринов III–IV поколения) благодаря большему использованию узконаправленного бензилпенициллина, что, в свою очередь, сдерживало бы общий рост резистентности пневмококка и других бактерий [24]. Таким образом, несколько искусственный характер наблюдаемых различий в результатах чувствительности пневмококка к ?-лактамам ни в коем случае не должен служить основой для необоснованных выводов о потенциальной большей клинической эффективности более активных и усовершенствованных современных препаратов по сравнению с базовыми.
Среди исследованных штаммов 50% (13/26) оказались устойчивы к эритромицину, значит, и ко всем 14- и 15-членным макролидам (кларитромицину, рокситромицину, диритромицину и азитромицину), в то время как резистентность к клиндамицину (значит, и к 16-членным макролидам) составила 38,5%. Таким образом, MLSB-фенотип, характеризующийся перекрестной резистентностью ко всем макролидам (14-, 15- и 16-членным), а также к линкозамидам и стрептограмину B, наблюдался у 38,5% исследованных штаммов (10/26), в то время как М-фенотип (резистентность к 14- и 15-членным макролидам с сохранением чувствительности к 16-членным макролидам, линкозамидам и стрептограмину B) встречался с частотой 11,5% (3/26 штаммов) [6]. Соотношение данных фенотипов среди резистентных к эритромицину штаммов составило 77% для MLSBк 23% для М-фенотипа.
Уровень чувствительности к фторхинолонам составил 96,2% (25/26) за счет выявления одного штамма (3,8%) с наличием механизмов приобретенной резистентности к препаратам данного класса, что выразилось клинической устойчивостью к офлоксацину, левофлоксацину, спарфлоксацину и промежуточной устойчивости к моксифлоксацину. Следует отметить, что данный штамм BRL/Sput/395_2/2015, выделенный в реанимационном отделении в Гродно в 2015 году из мокроты 58-летнего пациента мужского пола с пневмонией, является единственным описанным на данный момент белорусским штаммом с присутствием механизмов приобретенной резистентности к фторхинолонам.
По отношению к ванкомицину, рифампицину и линезолиду все штаммы были полностью чувствительны, а уровни резистентности к остальным антибиотикам составили 30,8% для тетрациклина и доксициклина, 46,2% – для ко-тримоксазола и 11,5% – для хлорамфеникола.
По данным литературы (охарактеризовано 96 штаммов до 2005 года, 9 штаммов за 2008–2009 годы), ранее в Беларуси не встречались респираторные штаммы пневмококка с МПК бензилпенициллина более 2 мг/л, а также нечувствительные к амоксициллину, парентеральным цефалоспоринам III поколения и фторхинолонам. Уровень нечувствительных штаммов к эритромицину составлял 7–12%, клиндамицину – 0–7%, тетрациклину – 31–49%, хлорамфениколу – 8%, ко-тримоксазолу – 39–68% [26–30]. Таким образом, среди циркулирующих в Беларуси респираторных штаммов пневмококка за последнее время произошло формирование и распространение новых фенотипов резистентности (резистентные к аминопенициллинам, парентеральным цефалоспоринам III поколения, меропенему, фторхинолонам), а также существенный рост уровней резистентности к ?-лактамам, макролидам и линкозамидам с сохранением прежних уровней резистентности к тетрациклинам, амфениколам и ингибиторам синтеза фолиевой кислоты.
Таблица 3. Профили резистентности к антибиотикам 26 штаммов пневмококка, выделенных от пациентов с инфекциями нижних дыхательных путей
|
Профиль резистентности и их характеристика
|
Штамм
|
|
n
|
%
|
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
–
|
9
|
34,6
|
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
SXT
|
---
|
---
|
---
|
–
|
1
|
3,8
|
|
---
|
PNV
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
ERY
|
CLI
|
TET
|
DOX
|
---
|
SXT
|
---
|
---
|
---
|
MDR
+XDR
|
1
|
3,8
|
|
---
|
PNV
|
AMP
|
---
|
CXM
|
---
|
---
|
---
|
MEM
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
SXT
|
---
|
---
|
---
|
–
|
1
|
3,8
|
|
---
|
PNV
|
AMP
|
---
|
CXM
|
---
|
---
|
---
|
MEM
|
---
|
---
|
---
|
---
|
---
|
ERY
|
---
|
---
|
---
|
---
|
SXT
|
---
|
---
|
---
|
MDR
|
1
|
3,8
|
|
---
|
PNV
|
AMP
|
---
|
CXM
|
---
|
CTX
|
---
|
MEM
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
SXT
|
---
|
---
|
---
|
–
|
1
|
3,8
|
|
---
|
PNV
|
AMP
|
---
|
CXM
|
CRO
|
CTX
|
---
|
MEM
|
---
|
---
|
---
|
---
|
---
|
ERY
|
CLI
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
MDR
|
3
|
11,5
|
|
---
|
PNV
|
AMP
|
---
|
CXM
|
CRO
|
CTX
|
---
|
MEM
|
---
|
---
|
---
|
---
|
---
|
ERY
|
CLI
|
TET
|
DOX
|
---
|
SXT
|
---
|
---
|
---
|
MDR+
XDR
|
2
|
7,7
|
|
---
|
PNV
|
AMP
|
---
|
CXM
|
CRO
|
CTX
|
---
|
MEM
|
---
|
---
|
---
|
---
|
---
|
ERY
|
CLI
|
TET
|
DOX
|
CHL
|
SXT
|
---
|
---
|
---
|
MDR+
XDR
|
1
|
3,8
|
|
PEN
|
PNV
|
AMP
|
---
|
CXM
|
CRO
|
CTX
|
---
|
MEM
|
---
|
---
|
---
|
---
|
---
|
ERY
|
---
|
TET
|
DOX
|
CHL
|
SXT
|
---
|
---
|
---
|
MDR
|
1
|
3,8
|
|
PEN
|
PNV
|
AMP
|
---
|
CXM
|
CRO
|
CTX
|
---
|
MEM
|
---
|
---
|
---
|
---
|
---
|
ERY
|
CLI
|
TET
|
DOX
|
---
|
SXT
|
---
|
---
|
---
|
MDR+
XDR
|
1
|
3,8
|
|
PEN
|
PNV
|
AMP
|
---
|
CXM
|
CRO
|
CTX
|
FEP
|
MEM
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
---
|
SXT
|
---
|
---
|
---
|
–
|
1
|
3,8
|
|
PEN
|
PNV
|
AMP
|
---
|
CXM
|
CRO
|
CTX
|
FEP
|
MEM
|
---
|
---
|
---
|
---
|
---
|
ERY
|
CLI
|
TET
|
DOX
|
---
|
SXT
|
---
|
---
|
---
|
MDR+
XDR
|
1
|
3,8
|
|
PEN
|
PNV
|
AMP
|
AMX
|
CXM
|
CRO
|
CTX
|
FEP
|
MEM
|
---
|
OFX
|
LVX
|
MFX
|
SPX
|
ERY
|
---
|
---
|
---
|
CHL
|
SXT
|
---
|
---
|
---
|
MDR
|
1
|
3,8
|
|
PEN
|
PNV
|
AMP
|
AMX
|
CXM
|
CRO
|
CTX
|
FEP
|
MEM
|
ETP
|
---
|
---
|
---
|
---
|
ERY
|
CLI
|
TET
|
DOX
|
---
|
SXT
|
---
|
---
|
---
|
MDR+ XDR
|
1
|
3,8
|
|
PEN
|
PNV
|
AMP
|
AMX
|
CXM
|
CRO
|
CTX
|
FEP
|
MEM
|
ETP
|
OFX
|
LVX
|
MFX
|
SPX
|
ERY
|
CLI
|
TET
|
DOX
|
CHL
|
SXT
|
RIF
|
VAN
|
LNZ
|
MDR+
XDR
|
0
|
0,0
|
Примечание: прочерк обозначает клиническую чувствительность к данному антибиотику; указание кода антибиотика – нечувствительность.
Оценивая профили резистентности респираторных штаммов пневмококка к антибиотикам (табл. 3), видно, что штаммы «дикого» типа с природной чувствительностью ко всем исследованным антибиотикам встречались с низкой частотой 34,6% (9/26), а доля чувствительных к пенициллину и макролидам штаммов составляет 46,2% (12/26). Большинство штаммов со сниженной чувствительностью к бета-лактамам (МПК пенициллина ≥0,125 мг/л) демонстрируют клиническую нечувствительность и к другим классам антибиотиков: 81,2% (13/16) – к макролидам и ко-тримоксазолу, 62,5% (10/16) – к линкозамидам, 50,0% (8/16) – к тетрациклинам. Крайне часто они обладают резистентностью сразу к нескольким классам антибиотиков: в 18,8% случаев (3/16) – к двум классам, 25% – к трем классам, 50% – к пяти классам и 6,2% – к шести классам антибиотиков. Нечувствительные к парентеральным аминопенициллинам штаммы всегда демонстрируют резистентность к цефалоспоринам II поколения (цефуроксим) и снижение чувствительности к меропенему, очень часто (86,7%, 13/15) – к цефалоспоринам III поколения, но значительно реже – к бензилпенициллину (40%, 6/15), цефалоспоринам IV поколения (26,7%, 4/15), пероральному амоксициллину (13,3%, 2/15) и эртапенему (6,7%, 1/15). Среди штаммов с природной чувствительностью к ?-лактамам весьма редко (10,0%, 1/10) встречается устойчивость к другим классам антибиотиков и только к ингибиторам синтеза фолиевой кислоты. Обнаруженный резистентный к фторхинолонам штамм являлся также нечувствительным ко всем ?-лактамам (кроме эртапенема), макролидам, но чувствительным к линкозамидам и тетрациклинам.
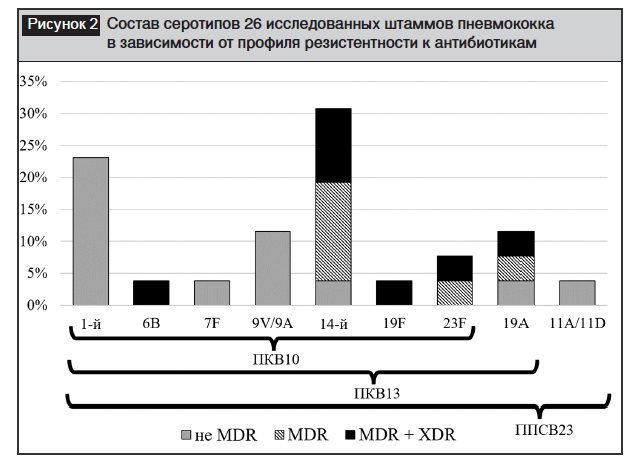
Штаммы с множественной лекарственной устойчивостью (Multidrug-resistant – MDR), определяемые как нечувствительные к любым 3 и более классам антибиотиков [31–33], встречались с частотой 50,0% (13/26), а чрезвычайно резистентные штаммы (Extensivelydrug-resistant – XDR), определяемые как нечувствительные к 5 и более классам антибиотиков в ряду ?-лактамов, макролидов, линкозамидов, тетрациклинов, фторхинолонов, ингибиторов синтеза фолиевой кислоты [33, 34], составили 26,9% (7/26 штаммов).
Оценивая пейзаж серотипов исследованных штаммов пневмококка и его соответствие составу современных пневмококковых вакцин (рис. 2), видно, что наиболее распространенными являются серотипы 14 (30,8%), 1 (23,1%), 9V/9A (11,5%) и 19A (11,5%), реже встречаются серотипы 23F (7,7%) и 6B, 7F, 19F, 11A/11D (по 3,8%). Все мультирезистентные и чрезвычайно резистентные штаммы относятся к «педиатрическим» серотипам, определяемым как серотипы 6A, 6B, 9V, 14, 19A, 19F, 23F и имеющим общие эпидемиологические характеристики (преимущественное распространение среди детей или при носительстве, наличие антибиотикорезистентности) [9, 35]. Более того, все эти серотипы включены в состав 13-валентной пневмококковой конъюгированной вакцины (ПКВ) и 23-валентной пневмококковой полисахаридной вакцины (ППСВ23), а уровень соответствия составу ПКВ10 достиг 85% для MDR штаммов и 86% – для XDR штаммов (из-за наличия штаммов серотипа 19A). Таким образом, все описанные случаи пневмококковой пневмонии, вызванные чрезвычайно и мультирезистентными штаммами (терапия которых ассоциирована с наибольшими трудностями), теоретически (но с разной долей вероятности для инвазивных и неинвазивных форм) могли быть предупреждены в случае предшествующей вакцинации данных пациентов.
Заключение
Проведенное изучение in vitro активности 22 антибиотиков по отношению к 26 исследуемым штаммам и полученные данные распределений МПК свидетельствуют о том, что циркулирующая в Беларуси среди госпитализированных пациентов с внебольничными инфекциями нижних дыхательных путей популяция пневмококка характеризуется разновероятным распространением штаммов с наличием механизмов приобретенной резистентности по отношению к антибиотикам разных классов. Отмечено широкое распространение микробиологически резистентных штаммов к бета-лактамам (62–73%), ингибиторам синтеза фолиевой кислоты (54%), макролидам (50%), линкозамидам (39%) и тетрациклинам (31%), низкое – к амфениколам (12%), фторхинолонам (4%) и полное их отсутствие по отношению к ансамицинам, гликопептидам и оксазолидинонам.
Применение современных критериев интерпретации результатов антибиотикочувствительности CLSI и EUCAST позволило установить уровни клинически резистентных, умеренно резистентных и чувствительных штаммов и оценить возможности использования разных классов антибиотиков при терапии внебольничных инфекций нижних дыхательных путей в Беларуси. Циркулирующие среди госпитализированных пациентов с внебольничной пневмонией пневмококки характеризуются высоким уровнем клинически нечувствительных штаммов к феноксиметилпенициллину (61,5%), ампициллину и меропенему (57,7%), цефалоспоринам II–III поколения (46,2–57,7%), 14- и 15-членным макролидам (50,0%), ингибиторам синтеза фолиевой кислоты (53,8%), повышенным уровнем клинически нечувствительных штаммов к бензилпенициллину (23,1%), цефалоспоринам IV поколения (15,4%), линкозамидам и 16-членным макролидам (38,5%), тетрациклинам (30,8%), амфениколам (11,5%), низким уровнем – к пероральному амоксициллину (7,6%), фторхинолонам (3,8%), эртапенему (3,8%) и полной клинической чувствительностью к ансамицинам, гликопептидам и оксазолидинонам. Среди клинически нечувствительных штаммов в отношении бензилпенициллина, цефалоспоринов IV поколения, эртапенема и моксифлоксацина все относились к категории умеренно резистентных, а в отношении цефалоспоринов III поколения – подавляющее большинство (39–46% от общего числа). Встречаемость MLSB-фенотипа среди всех штаммов составила 38,5%, а М-фенотипа – 11,5%, в то время как среди резистентных к эритромицину штаммов 77% экспрессировало MLSB-фенотип, а М-фенотип наблюдался у 23%. Штаммы с природной чувствительностью к антибиотикам встречались с частотой 34,6%, мультирезистентные – 50,0%, а чрезвычайно резистентные – 26,9%. Все мультирезистентные и чрезвычайно резистентные пневмококки относились к «педиатрическим» и вакцинальным серотипам (6B, 14, 19F, 23F и 19A).
Некоторые профили резистентности респираторных штаммов пневмококка не встречались в Беларуси ранее и описаны впервые (резистентность к аминопенициллинам, парентеральным цефалоспоринам III поколения, карбапенемам, фторхинолонам). За последние 10 лет в стране отмечается существенный рост уровня резистентности респираторных штаммов к ?-лактамам, макролидам и линкозамидам с сохранением прежних уровней резистентности к тетрацик-линам, амфениколам и ингибиторам синтеза фолиевой кислоты.
В соответствии с современными подходами к проведению эмпирической терапии пациентов с инфекциями нижних дыхательных путей при выборе антибиотика и его дозы должны учитываться локальные сведения об антибиотикорезистентности возбудителей [36–38]. С учетом полученных данных в Беларуси при амбулаторном лечении бактериальной пневмонии, вызванной пневмококком, амоксициллин (или его комбинация с ингибитором ?-лактамаз) может эффективно применяться как средство первоочередного выбора, а респираторные фторхинолоны (лево-флоксацин, спарфлоксацин, мокси-флоксацин) могут быть рекомендованы как альтернативные препараты. Ввиду вероятной селекции штаммов в данном исследовании на этапе госпитализации пациентов, окончательный вывод о прогнозируемой клинической неэффективности 14-, 15- и 16-членных макролидов (эритромицин, кларитромицин, рокситромицин, азитромицин, мидекамицин, спирамицин, джозамицин), линкозамидов (клиндамицин), тетрациклинов, пероральных цефалоспоринов II поколения, феноксиметилпенициллина и возможности применения в амбулаторной практике данных препаратов может быть сделан после исследования штаммов, выделенных исключительно от амбулаторных пациентов.
При лечении госпитализированных пациентов схемы терапии, включающие аминопенициллины (ампициллин, амоксициллин, амоксиклав), 14-, 15- и 16-членные макролиды, линкозамиды, цефалоспорины II поколения, могут оказаться неэффективными в отличие от применения бензилпенициллина или цефалоспоринов III–IV поколения (цефтриаксон, цефотаксим, цефепим) в повышенных дозах. Применение респираторных фторхинолонов (левофлоксацин, моксифлоксацин), эртапенема, а также, где необходимо, гликопептидов (ванкомицин и тейкопланин) или оксазолидинонов (линезолид) может быть рекомендовано для терапии с минимальным риском клинической неэффективности.
Полученные результаты рекомендуем использовать врачам-пульмонологам, терапевтам, инфекционистам и педиатрам при проведении эмпирической антибиотикотерапии и подготовке протоколов лечения пациентов с пневмококковой инфекцией.
ЛИТЕРАТУ РА
1. Prina E., Ranzani O.T., Torres A. // Lancet. – 2015. – Vol.386, N9998. – P.1097–1108.
2. Jain S. [et al.] // N. Engl. J. Med. – 2015. – Vol.373, N5. – P.415–427.
3. Welte T., Torres A., Nathwani D. // Thorax. – 2012. – Vol.67, N1. – P.71–79.
4. Walker C.L.F. [et al.] // Lancet Lond. Engl. – 2013. – Vol.381, N9875. – P.1405–1416.
5. Prina E., Ceccato A., Torres A. // Crit. Care Lond. Engl. – 2016. – Vol.20, N1. – P.267.
6. Cornick J.E., Bentley S.D. // Microbes Infect. – 2012. – Vol.14, N7. – P.573–583.
7. Hackel M. [et al.] // Vaccine. – 2013. – Vol.31, N42. – P.4881–4887.
8. Jones R.N. [et al.] // Diagn. Microbiol. Infect. Dis. – 2013. – Vol.75, N1. – P.107–109.
9. Kim L. [et al.] // Clin. Microbiol. Rev. – 2016. – Vol.29, N3. – P.525–552.
10. Laboratory methods for the diagnosis of meningitis caused by Neisseria meningitidis, Streptococcus pneumoniae, and Haemophilus influenzae?: WHO manual / World Health Organization, Centers for Disease Control and Prevention. – Pub. 2. – WHO/IVB.11.09, 2011. – 311 p.
11. Давыдов А.В. [и др.] // Здравоохранение. – 2016. – №3. – С.12–20.
12. Давыдов А.В., Титов Л.П., Хархаль А.Н. // Молекулярная диагностика: Сб. трудов IX Всероссийской научно-практической конференции с международным участием. – Тамбов, 2017. – Т.2. – С.336–338.
13. Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically: approved standard / Clinical and Laboratory Standards Institute. – Wayne, 2012. – 68 p.
14. The European Committee on Antimicrobial Susceptibility Testing. Antimicrobial wild type distributions of microorganisms [Electronic resource]: EUCAST / The European Committee on Antimicrobial Susceptibility Testing.
15. CLSI. Performance Standards for Antimicrobial Susceptibility Testing. CLSI supplement M100 / CLSI. – Pub. 27th. – Wayne, 2017. – 224 p.
16. Silley P. // Rev. Sci. Tech. Int. Off. Epizoot. – 2012. – Vol.31, N1. – P.33–41.
17. Hamilton-Miller J.M. // J. Antimicrob. Chemother. – 1991. – Vol.27, N6. – P.863–864.
18. Funatsu T. [et al.] // Jpn. J. Antibiot. – 2015. – Vol.68, N4. – P.225–242.
19. Jones R.N., Mutnick A.H., Varnam D.J. // J. Clin. Microbiol. – 2002. – Vol.40, N11. – P.4332–4333.
20. Sahm D.F. [et al.] // J. Clin. Microbiol. – 2002. – Vol.40, N2. – P.669–674.
21. Oteo J., Alуs J.I., Gуmez–Garcйs J.L. // J. Antimicrob. Chemother. – 2001. – Vol.47, N2. – P.215–218.
22. Zhang Y. [et al.] // J. Glob. Antimicrob. Resist. – 2016. – Vol.5. – P.36–41.
23. Koeth L.M. [et al.] // Int. J. Infect. Dis. IJID Off. Publ. Int. Soc. Infect. Dis. – 2004. – Vol.8, N6. – P.362–373.
24. Centers for Disease Control and Prevention (CDC) // Morb. Mortal. Wkly. Rep. – 2008. – Vol.57, N50. – P.1353–1355.
25. Centers for Disease Control and Prevention (CDC) // Morb. Mortal. Wkly. Rep. – 2004. – Vol.53, N7. – P.152–154.
26. Муравьев А.А. [и др.] // Клиническая микробиология и антимикробная химиотерапия. – 2013. – Т.15, №2. – С.147–158.
27. Качанко Е.Ф. [и др.] // ARSMedica. – 2011. – Т.48, №12. – С.37–44.
28. Скворцова В.В. [и др.] // Вестник Витебского государственного медицинского университета. – 2005. – Т.4, №1. – С.98–102.
29. Дмитраченко Т.И. [и др.] // Иммунопатология. Аллергология. Инфектология. – 2005. – №1. – С.68–75.
30. Семенов В.М. [и др.] // Клиническая инфектология и паразитология. – 2013. – №4 (07). – С.13–21.
31. Whitney C.G. [et al.] // N. Engl. J. Med. – 2000. – Vol.343, N26. – P.1917–1924.
32. Jacobs M.R. [et al.] // N. Engl. J. Med. – 1978. – Vol.299, N14. – P.735–740.
33. Magiorakos A.-P. [et al.] // Clin. Microbiol. Infect. – 2012. – Vol.18, N3. – P.268–281.
34. Golden A.R. [et al.] // J. Antimicrob. Chemother. – 2015. – Vol.70, N8. – P.2199–2202.
35. Feikin D.R. [et al.] // Clin. Infect. Dis. Off. Publ. Infect. Dis. Soc. Am. – 2005. – Vol.41, N4. – Е481–Е487.
36. Bradley J.S. [et al.] // Clin. Infect. Dis. Off. Publ. Infect. Dis. Soc. Am. – 2011. – Vol.53, N7. – Е25–Е76.
37. Woodhead M. [et al.] // Clin. Microbiol. Infect. Off. Publ. Eur. Soc. Clin. Microbiol. Infect. Dis. – 2011. – Vol.17, Suppl 6. – E1–E59.
38. Tramper-Stranders G.A. // Paediatr. Respir. Rev. – 2017 [Epub ahead of print].
Медицинские новости. – 2017. – №12. – С. 74-82.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.