Внимание! Статья адресована врачам-специалистам
Trisvetova E.L.
Belarusian State Medical University, Minsk
Efficacy of the blocker of AT1- angiotensin II receptors of valsartan in arterial hypertension
Реферат. Доказательства эффективности блокаторов рецепторов ангиотензина II, полученные за истекшее десятилетие во многих клинических исследованиях, позволили значительно расширить показания к их применению. Сохранение влияния АТII на рецепторы 2-го типа, оказывающие вазодилатирующее, антипролиферативное действие, замедление прогрессирования гипертрофии кардиомиоцитов, отсутствие нежелательных эффектов, обусловленных повышением активности брадикининовой системы у Сартвала (валсартана) позволяет снизить риск развития сердечно-сосудистых осложнений, улучшить прогноз и качество жизни пациентов с артериальной гипертензией.
Ключевые слова: артериальная гипертензия, контроль артериального давления, органы-мишени, риск развития сердечно-сосудистых осложнений.
Медицинские новости. – 2018. – №2. – С. 36–42.
Summary. Evidence of the effectiveness of angiotensin II receptor blockers, obtained over the past decade in many clinical studies, has significantly expanded the indications for their use. The preservation of the effect of ATII on type 2 receptors, which exert a vasodilating, antiproliferative effect, slowing the progression of cardiomyocyte hypertrophy, and the absence of undesirable effects due to an increase in the activity of the bradykinin system in Sartwal (valsartan) can reduce the risk of cardiovascular complications, improve the prognosis and quality of life of patients with arterial hypertension.
Keywords:arterial hypertension, control of blood pressure, target organs, risk of cardiovascular complications.
Meditsinskie novosti. – 2018. – N2. – P. 36–42.
Эффективный контроль за уровнем артериального давления (АД) является обязательным условием для снижения риска развития сердечно-сосудистых осложнений и смертности у пациентов с артериальной гипертензией (АГ) [1]. Сложные механизмы АГ вызывают трудности в выборе терапии, достижении целевого уровня и контроля АД. Российские исследователи показали, что в 73% случаев пациенты осведомлены о наличии заболевания, в 50% – принимают антигипертензивные препараты и лишь в 23% – достигают целевого уровня АД (систолическое <140 мм рт.ст. и диастолическое <90 мм рт.ст.) [2]. В развитии АГ и сердечно-сосудистых осложнений известна патофизиологическая роль гиперактивации ренин-ангиотензин-альдостероновой системы (РААС), в связи с этим препараты, блокирующие активность РААС (ингибиторы АПФ и блокаторы АТ1-рецепторов ангиотензина II), рассматривают как лекарственные средства выбора в лечении заболевания [3].
Применение блокаторов АТ1-рецепторов ангиотензина II (БРА) на протяжении многих лет показало перспективность препаратов для снижения и контроля АД, а также для предотвращения сердечно-сосудистых осложнений, сердечной недостаточности и болезней почек. При появлении БРА в 90-х годах XX столетия в клинической практике их расценивали как препараты, альтернативные ингибиторам АПФ в случае непереносимости (появление кашля) последних [4]. Результаты исследований, выполненных в последующие годы, показали важные фармакодинамические эффекты БРА, что позволило рассматривать их как один из пяти основных классов антигипертензивных препаратов и расширить показания к применению при многих сердечно-сосудистых осложнениях (рис. 1) [5, 6].
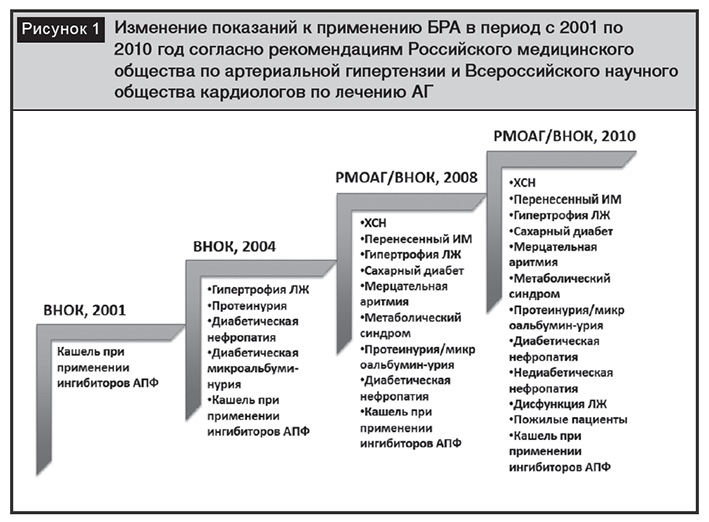
Основным эффектором РААС является ангиотензин II (АТII), действие которого реализуется через специфические ангиотензиновые рецепторы. Наибольшее значение имеет I подтип рецепторов (АТ1), определяющий большинство физиологических и патофизиологических эффектов. АТ1-рецепторы расположены в кровеносных сосудах, сердце, почках, надпочечниках, печени, головном мозге, легких [4].
Одним из механизмов БРА является блокада АТ1-рецепторов, препятствующая проявлениям большинства нежелательных эффектов АТII. Известно, что в организме человека при повышении активности АТII эффекты, реализующиеся преимущественно через стимуляцию рецепторов АТ1, обусловливают констрикцию артерий, повышение гидравлического давления в почечных клубочках, сокращение мезангиальных клеток и снижение почечного кровотока, усиление реабсорбции натрия в проксимальных почечных канальцах, секрецию альдостерона корой надпочечников, вазопрессина, эндотелина-1, высвобождение ренина, повышение активности симпатоадреналовой системы [7]. Повышение активности АТII вызывает стимуляцию пролиферации и миграции гладких мышечных клеток сосудов, гиперплазии интимы, гипертрофии кардиомиоцитов и фиброза миокарда, приводя к ремоделированию сосудов и миокарда [8].
Препараты класса БРА не только блокируют эффекты АТII, взаимодействуя с АТ1-рецепторами сосудов и надпочечников, а также препятствуют высвобождению норадреналина в синаптическую щель, связываясь с пресинаптическими рецепторами норадренергических нейронов.
Действие БРА приводит к системной вазодилатации, снижению общего периферического сосудистого сопротивления, натрийуретическому и диуретическому влиянию. Сохранение влияния АТII на рецепторы 2-го типа, оказывающие вазодилатирующее, антипролиферативное действие, замедление прогрессирования гипертрофии кардиомиоцитов, отсутствие нежелательных эффектов, обусловленных повышением активности брадикининовой системы, свойственно БРА в отличие от ингибиторов АПФ [7, 8].
Исследования функции эндотелия при АГ показали, что влияние БРА связано также с увеличением эндотелийзависимого синтеза и высвобождения оксида азота, способствующего вазодилатации, уменьшению агрегации тромбоцитов и снижению пролиферации клеток [9, 10]. Благоприятное действие БРА отмечено на концентрацию мочевой кислоты [8].
Препараты класса БРА различают по химической структуре, наличию или отсутствию активных метаболитов, типу действия на АТ1-рецепторы (конкурентная или неконкурентная блокада), продолжительности действия.
По химическому строению выделяют бифениловые производные тетразола (лозартан, ирбесартан, кандесартан), небифениловые нететразоловые производные (эпросартан), небифениловые производные тетразола (телмисартан) и негетероциклические соединения (валсартан) [7]. Фармакологические свойства препаратов класса БРА по аффинности, силе связывания и характеру взаимодействия с АТ1-рецепторами влияют на клиническую эффективность (табл. 1).
Таблица 1. Сравнительная характеристика фармакологических и фармакокинетических свойств препаратов класса БРА [4]
|
Препарат
|
Связь с рецепторами
|
Селективность к АТ1-рецепторам против АТ2-рецепторов
|
|
Степень ингибирования прессорного эффекта АТII
|
Биодоступность
|
|
Лозартан
|
Конкурентная
|
1000
|
|
25–40%
|
33%
|
|
Валсартан
|
Неконкурентная
|
20 000
|
|
30%
|
35%
|
|
Ирбесартан
|
Неконкурентная
|
8 500
|
|
40%
|
60–80%
|
|
Кандесартан
|
Неконкурентная
|
10 000
|
|
–
|
15%
|
|
Телмисартан
|
Неконкурентная
|
3 000
|
|
40%
|
42–58%
|
|
Эпросартан
|
Конкурентная
|
1 000
|
|
30%
|
13%
|
|
Олмесартан
|
Неконкурентная
|
12 500
|
|
61%
|
26%
|
Валсартан относится к неконкурентным антагонистам АТ1-рецепторов с высокой аффинностью, определяющей действие вне зависимости от концентрации агониста, и медленной скоростью диссоциации из связи с рецептором в отличие от препаратов с конкурентным действием [3]. Среди БРА валсартан отличает самая высокая селективность к АТ1-рецепторам, превышающая в 20 тысяч раз сродство к АТ2-рецепторам [4]. Молекулярное взаимодействие некоторых БРА с АТ1-рецепторами обеспечивает инактивацию рецепторов и подавление их способности активироваться (обратный агонизм). В исследованиях установлено, что наибольшим свойством обратного агонизма к АТ1-рецепторам среди БРА обладает валсартан, по силе эффекта сопоставимый с олмесартаном из-за сходства их химического строения [8]. Наличие обратного агонизма обусловливает плейотропные свойства препаратов, клинически проявляющиеся способностью предотвращать сердечно-сосудистые осложнения (например, при сердечной недостаточности), не связанные с индуцированной АТII активностью рецепторов.
Валсартан представляет собой активное лекарство, не требующее предварительного пресистемного метаболизма, быстро всасывающееся из желудочно-кишечного тракта. Концентрация валсартана в организме человека достигает максимального значения через 2 часа после приема. Период полувыведения валсартана в плазме крови составляет в среднем 6–10 часов, эффект препарата поддерживается в течение 24 часов после однократного приема. Основным путем элиминации валсартана из организма является выведение с желчью (80%) в неизмененном виде [11]. С мочой выводится 20% препарата, что свидетельствует о безопасности применения валсартана при хронической почечной недостаточности (табл. 2). При тяжелой печеночной недостаточности наблюдают увеличение биодоступности, снижение клиренса и билиарной экскреции препаратов класса БРА, поэтому они противопоказаны пациентам с билиарной обструкцией или тяжелой печеночной недостаточностью, при легкой или среднетяжелой печеночной недостаточности могут применяться с осторожностью.
Таблица 2. Метаболизм, пути элиминации препаратов класса БРА, коррекция дозы при заболеваниях печени
|
Препарат
|
Мета-
болизм (ферменты)
|
Степень мета-
болизма, %
|
Элиминация печень/
почки, %
|
Коррекция дозы при заболеваниях печени
|
Лекарственное взаимодействие
|
|
Лозартан
|
CYP2C9, CYP3A4
|
14
|
65/35
|
Да
|
Рифампицин, флуканазол
|
|
Валсартан
|
CYP2C9, CYP2C8, P450,
нецитохром
|
20
|
80/20
|
Да
|
Нет
|
|
Ирбесартан
|
CYP2C9, глюкуронизация
|
9
|
80/20
|
Нет
|
Нет
|
|
Кандесартан
|
CYP2C9, глюкуронизация
|
min
|
67/33
|
Да
|
Нет
|
|
Телмисартан
|
Глюкуронизация
|
15
|
98/2
|
Да
|
Дигоксин
|
|
Эпросартан
|
Нет
|
min
|
90/10
|
Нет
|
Нет
|
|
Олмесартан
|
Нет
|
–
|
65/35
|
Нет
|
Нет
|
В печени метаболизируется незначительная часть валсартана (8–10%), при этом без участия системы цитохрома Р450, что обусловливает отсутствие нежелательных лекарственных взаимодействий [4].
В пожилом возрасте отмечают увеличение биодоступности препарата, вследствие удвоения максимальной плазменной концентрации и замедления скорости всасывания, приводящее к увеличению времени полувыведения. Вместе с тем не возникает необходимости, в снижении дозы валсартана у пожилых людей [7].
Валсартан, применяемый в дозе 80–320 мг/сутки, проявляет дозозависимое антигипертензивное действие, характерное для препаратов класса БРА. Антигипертензивное действие валсартана проявляется через 1–2 недели, а максимальный эффект – через 4–6 недель от начала лечения.
Валсартан не влияет на частоту и ритм сердечных сокращений, ортостатическую адаптацию после изменения положения тела, гемодинамические реакции вследствие симпатической стимуляции после нагрузки [4]. Препарат эффективен при кратковременном и длительном применении, в виде монотерапии и в составе комбинаций у лиц любого возраста, мужчин и женщин.
Обширная доказательная база эффективности и безопасности валсартана при АГ и сердечно-сосудистых осложнениях превосходит доказательную базу кандесартана, ирбесартана, телмисартана, олмесартана и включает клинические исследования с участием около 100 000 пациентов (табл. 3).
Таблица 3. Распределение препаратов по количеству исследований, в которых оценивалась их эффективность в мета-анализе (Nixon R.M., et al., 2009)
|
Препарат
|
Количество
исследований
|
|
Лозартан
|
13
|
|
Валсартан
|
12
|
|
Кандесартан
|
6
|
|
Ирбесартан
|
6
|
|
Телмисартан
|
5
|
|
Олмесартан
|
2
|
Согласно Рекомендациям по диагностике и лечению АГ, все основные классы антигипертензивных препаратов одинаково снижают АД и применяются для начальной и поддерживающей терапии [6].
Доказательства сопоставимости валсартана и ингибитора АПФ получены N.J. Holwerda и соавт. В 1996 году исследователи выполнили двойное слепое параллельное исследование с участием пациентов с легкой и умеренной АГ. Одна группа получала валсартан 80 мг в день, вторая группа – ингибитор АПФ эналаприл 20 мг в день в течение 8 недель. В обеих группах отметили статистически значимое сопоставимое снижение систолического и диастолического АД [12]. Результаты исследования показали безопасность и одинаковую эффективность монотерапии 80 мг валсартана или 20 мг эналаприла при приеме один раз в день при лечении легкой и умеренной АГ.
В исследовании VAST (Valsartan/HCTZ versus Amlodipine in Stage II hypertensive with additional cardiovascular risk factors) сравнивали действие комбинированной терапии валсартаном и гидрохлортиазидом с лечением амлодипином. Оценивали влияние препаратов на уровень АД, анализировали эндотелиальную функцию, маркеры воспаления у 1088 пациентов с АГ 2-й степени и одним фактором риска и более (избыточная масса тела, высокий уровень холестерина, сахарный диабет 2-го типа, перенесенный инфаркт миокарда или инсульт, реваскуляризация в анамнезе). Пациентов рандомизировали в группу валсартана (160 мг/сутки) или амлодипина (5 мг/сутки). В случае недостаточной эффективности начальной терапии к валсартану добавляли гидрохлортиазид 12,5 или 25 мг/сутки, дозу амлодипина увеличивали до 10 мг/сутки [13].
Выраженное снижение систолического АД регистрировали у пациентов, получавших валсартан и 25 мг гидрохлортиазида (на 29,7 мм рт.ст.), меньшие значения показателя наблюдали у получавших валсартан и 12,5 мг гидрохлортиазида или амлодипин (27,1 и 27,6 мм рт.ст. соответственно). Различий в снижении диастолического АД в группах исследованных не отметили.
В группе валсартана наблюдали значимое по сравнению с группой пациентов, получавших амлодипин, снижение уровня тканевого активатора плазминогена и уровня маркеров воспаления (С-реактивный протеин и интерлейкин-6) [14].
Лучшая приверженность к терапии отмечена в группе валсартана – меньшее количество пациентов отказалось продолжать лечение из-за появления нежелательных реакций.
Субисследование в рамках VAST с применением суточного мониторирования АД в конце наблюдения подтвердило большую эффективность комбинации валсартана в дозе 160 мг/сутки и гидрохлортиазида 25 мг/сутки. Контроля уровня АД в этой группе достигли 60,8% против 48,4% пациентов, получавших валсартан и гидрохлортиа-зид 12,5 мг, а также 50,9% пациентов в группе амлодипина [15].
Таким образом, получены доказательства эффективности и безопасности валсартана в лечении АГ в виде моно- и комбинированной терапии. При рациональной комбинации валсартана с тиазидным диуретиком синергизм действия препаратов разных классов способствует более выраженному снижению АД и частоты нежелательных реакций. Назначение тиазидного диуретика сопровождается повышением активности РААС, в то же время БРА блокируют этот нежелательный эффект и потенцируют действие диуретика, увеличивая экскрецию натрия почками. Комбинация БРА и диуретика предупреждает нежелательное влияние последнего на метаболические процессы, приводящие к гипокалиемии, гиперурикемии и нарушению углеводного обмена (рис. 2) [11].
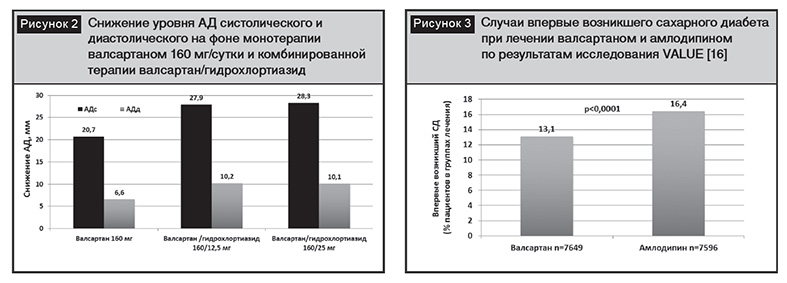
Результаты одного из самых известных исследований с применением валсартана VALUE (The Valsartan Antihypertensive Long-term Use Evaluation) опубликованы в 2004 году. Целью исследования явилось изучение влияния на заболеваемость и смертность двух антигипертензивных препаратов валсартана и амлодипина у пациентов с АГ и факторами риска развития сердечно-сосудистых осложнений и/или ассоциированными состояниями. В рандомизированном двойном слепом исследовании участвовали более 15 000 пациентов из 31 страны в возрасте старше 50 лет, средний срок наблюдения составил 4,2 года. Лечение начинали с дозы валсартана 80 мг или амлодипина 5 мг в день, целевым уровнем АД считали 140/90 мм рт.ст. В зависимости от уровня АД дозы препаратов увеличивали вдвое через месяц или в последующем добавляли гидрохлортиазид (12,5–25 мг в день) и/или другие антигипертензивные препараты [16].
Результаты исследования показали, что частота совокупной точки сердечной смертности и заболеваемости между группами существенно не различалась. Анализ результатов вторичной конечной точки свидетельствовал о снижении риска развития нефатального инфаркта миокарда в группе пациентов, получавших амлодипин (р=0,02), по сравнению с показателем в группе валсартана, и сопоставимом снижении в обеих группах частоты госпитализаций по поводу сердечной недостаточности. Смертность от инфаркта миокарда достоверно не различалась в обеих группах. Исследователи отметили развитие новых случаев сахарного диабета реже в случае лечения валсартаном по сравнению с показателями группы амлодипина (p<0,0001) (рис. 3).
Валсартан проявляет благоприятные эффекты в отношении сердечно-сосудистых осложнений, обусловленные не только снижением уровня АД, а также плеойтропными свойствами препарата. В Рекомендациях по диагностике и лечению АГ Европейского кардиологического общества эффективное применение БРА доказано в качестве препаратов первого выбора у пациентов с гипертрофиеи? левого желудочка, перенесенным инфарктом миокарда, хронической сердечной недостаточностью, микроальбуминурией/протеинурией и нарушением фильтрационнои? функции почек, а также при сахарном диабете и метаболическом синдроме [17].
При длительном применении валсартана доказана способность препарата уменьшать выраженность гипертрофии левого желудочка. Сравнительное исследование влияния валсартана или атенолола на гипертрофию левого желудочка у пациентов с мягкой и умеренной АГ проводили в течение 8 месяцев. Результаты исследования свидетельствовали о более выраженном уменьшении массы миокарда левого желудочка и толщины межжелудочковой перегородки у пациентов, получавших 80–160 мг/сутки валсартана по сравнению с пациентами, получавшими 50–100 мг/сутки атенолола. Поскольку уровень снижения АД не различался в обеих группах, регресс гипертрофии левого желудочка рассматривали как результат прямого кардиопротективного влияния валсартана, реализуемого через клеточные структуры кардиомиоцитов [18, 19].
Кардиопротективное действие валсартана проявляется в предупреждении пароксизмов фибрилляции предсердий у пациентов с АГ и хронической сердечной недостаточностью (рис. 4) [20].
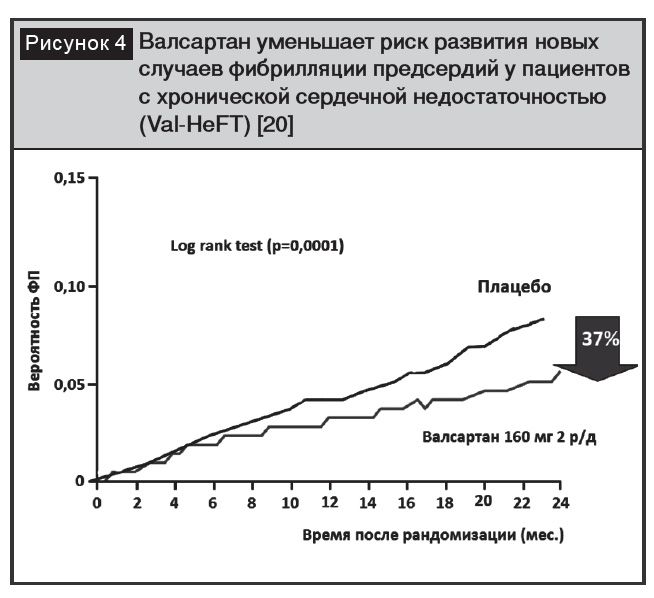
Результаты мета-анализа 11 клинических исследований, включавших более 56 000 пациентов, продемонстрировали способность валсартана снижать риск развития фибрилляции предсердий [20]. В основе предупреждения возникновения фибрилляции предсердий лежит непосредственное влияние препарата на структуру и электрическую стабильность миокарда через блокаду АТ1-рецепторов, а также модификацию гуморальных, механических и других патологических стимулов [21].
Нефропротективный эффект валсартана обусловлен снижением АД и прямым действием препарата на нефрон. В исследованиях DROP, MARVAL, SMART и VIVALDI антипротеинурический эффект валсартана доказан у пациентов с сахарным диабетом и микроальбуминурией. Лечение валсартаном в дозе 80–320 мг/сутки вызвало регресс микроальбуминурии и протеинурии у пациентов с сахарным диабетом и микроальбуминурией независимо от уровня снижения АД [22]. К тому же в отдаленный период наблюдения отмечены снижение частоты удвоения креатинина сыворотки, случаев терминальной хронической почечной недостаточности, общей смертности (4,2%) [23].
Ученые, наблюдавшие пациентов в исследовании VIVALDI (inVestIgate the efficacy of telmIsartan versus VALsartan in hypertensive type 2 DIabetic patients with overt nephropathy), показали, что к механизмам нефропротективного действия валсартана относится противовоспалительный эффект, доказанный достоверным снижением маркеров воспаления (высокочувствительный С-реактивный протеин, мочевая фракция PGF2?), а также антипролиферативное влияние на почечный фильтр, способствующее уменьшению его проницаемости для белков, и снижение резистивности почечных артерий [24].
В клиническом исследовании MARVAL (MicroAlbuminuria Reduction with VALsartan) валсартан уменьшал выраженность микроальбуминурии у пациентов с/без АГ и сахарным диабетом [25]. В исследовании участвовали 332 пациента с сахарным диабетом 2-го типа, получавших валсартан в дозе 80 мг/сутки или амлодипин в дозе 5 мг/сутки. После 24 недель лечения в группе валсартана отметили снижение микроальбуминурии на 44%, в группе амлодипина – на 8% (p<0,001). Нормальную концентрацию альбумина в моче определяли у пациентов независимо от уровня снижения АД в 29,9% случаев в группе валсартана и 14,5% в группе амлодипина [26]. Результаты исследования доказали обоснованное применение валсартана для снижения микроальбуминурии при АГ или при нормальном уровне АД.
Эффективность применения валсартана при ишемической болезни сердца изучали в исследовании VALIANT (VALsartan In Acute myocardial iNfarction Trial) с участием более 14 000 пациентов (средний возраст – 65,8 года), с острым инфарктом миокарда (давностью 12 часов – 10 суток от момента рандомизации) с симптомами сердечной недостаточности или систолической дисфункции левого желудочка. Первая группа пациентов получала валсартан (дозу титровали до 160 мг 2 раза в сутки), вторая – каптоприл (дозу титровали до 50 мг 3 раза в сутки), третья группа – комбинированную терапию валсартаном 80 мг 2 раза в сутки и каптоприлом 50 мг 3 раза в сутки. Продолжительность наблюдения составила 2 года. Исследователи не отметили различий в группах в показателях общей смертности (первичная конечная точка) и в частоте развития событий – повторный инфаркт миокарда, госпитализация по поводу хронической сердечной недостаточности, остановка сердца с успешной реанимацией, инсульт (вторичная конечная точка) [27].
Таким образом, эффективность лечения инфаркта миокарда валсартаном или комбинацией валсартан и каптоприл не различалась с результатами применения ингибитора АПФ каптоприла. Отмечена лучшая переносимость валсартана по сравнению с каптоприлом, обусловленная редкими нежелательными реакциями – отсутствием кашля, характерного для ингибитора АПФ. Результаты исследования послужили обоснованием для внесения валсартана – единственного представителя класса БРА, в международные и российские рекомендации по лечению острого и перенесенного инфаркта миокарда с подъемом сегмента ST на ЭКГ [28, 29].
Применение валсартана у пациентов, перенесших стентирование по поводу острого коронарного синдрома, приводит к снижению частоты рестенозов стента по сравнению с показателем при приеме плацебо (9,2 и 38,6% соответственно, p<0,005). В исследовании ValPREST (Valsartan for Prevention of Restenosis after Stenting of Type B2/C lesions trial) отмечено, что в группе, получавшей валсартан, реже появлялись показания для повторного стентирования (12,1 и 28,7% соответственно, p<0,005) [30].
В исследовании VALVACE (VALsartan Versus ACE inhibition after bare metal stent implantation) доказана большая эффективность валсартана по сравнению с таковой при применении ингибитора АПФ в предотвращении рестеноза стента [31]. Наблюдение пациентов в течение 6 месяцев показало развитие рестеноза в 34% случаев (р<0,005) у пациентов, принимавших ингибитор АПФ, и лишь в 19,5% – у получавших валсартан. S. Peters и соавт., выполнив небольшое исследование у пациентов после стентирования, показали, что обработка стента валсартаном одновременно с пероральным приемом препарата снижают риск развития рестеноза коронарных артерий [32].
Применение валсартана при хронической сердечной недостаточности изучали в многоцентровом двойном слепом исследовании Val-HеFT (Valsartan Heart Failure Trial). Критериями включения в исследование считали наличие хронической сердечной недостаточности II–IV функционального класса (ФК) по NYHA и фракции выброса <40%. Пациенты (n=5010) в течение 2 лет получали стандартную терапию, к которой добавляли валсартан (титровали дозу от 40 до 160 мг 2 раза в сутки) или плацебо. Первичная конечная точка включала общую смертность, госпитализацию по поводу хронической сердечной недостаточности, остановку сердца с успешными реанимационными мероприятиями, необходимость внутривенного введения диуретиков или дигоксина. В группе валсартана риск развития событий первичной конечной точки снизился на 13,3% (р=0,009), наиболее существенно уменьшилась частота госпитализаций по поводу хронической сердечной недостаточности (27,5%, p<0,001) по сравнению с показателями в группе плацебо [20]. При лечении валсартаном отметили снижение нейрогормональной активности, повышение толерантности к физической нагрузки с улучшением ФК сердечной недостаточности, структурных и функциональных показателей левого желудочка и улучшением качества жизни.
В субисследовании 366 пациентов (не леченых ингибитором АПФ) рандомизировали на две группы: в одной получали валсартан, во второй – плацебо. В группе валсартана общая смертность снизилась на 33,1% (р=0,017), частота комбинированной конечной точки – на 44,5% (р<0,001) [20]. Результаты исследования доказали возможность применения при хронической сердечной недостаточности валсартана в случае непереносимости ингибитора АПФ, что нашло отражение в Европейских и Российских рекомендациях по диагностике и лечению хронической сердечной недостаточности.
Анализ результатов эхокардиографического исследования пациентов, участвовавших в Val-HеFT, показал достоверное уменьшение конечного диастолического размера левого желудочка и увеличение фракции выброса при лечении валсартаном. Изменения регистрировали через 4 месяца от начала применения препарата и в последующем до окончания наблюдения [33].
Анализ уровня гормонов показал достоверное снижение активности мозгового натрийуретического пептида и меньшее возрастание уровня нор-адреналина у пациентов, получавших валсартан.
Таким образом, положительное влияние валсартана при хронической сердечной недостаточности проявляется улучшением структуры и функции миокарда левого желудочка, обусловленное в том числе снижением активности нейрогормональных воздействий, вызывающее повышение качества жизни, снижение частоты госпитализаций по поводу хронической сердечной недостаточности, смертности и заболеваемости.
Лечение валсартаном сопровож-дается снижением центрального АД и скорости распространения пульсовой волны – показателей, отражающих жесткость сосудистой стенки, являющихся факторами риска развития сердечно-сосудистых осложнений [34]. В перспективном рандомизированном контролируемом 10-недельном исследовании с участием 134 пациентов с недавно диагностированной АГ изучали показатели жесткости сосудистой стенки на фоне монотерапии валсартаном (160 мг/сутки) или амлодипином (10 мг/сутки), либо комбинации валсартан (80 мг/сутки) и амлодипин (5 мг/сутки). Результаты исследования показали снижение систолического и диастолического АД во всех группах наблюдения (р<0,05), по результатам суточного мониторирования АД, – наибольшее снижение отметили в группе амлодипина и комбинации препаратов (3,55±2,57, 4,11±2,20 против 2,23±2,54 мм рт.ст. соответственно, р<0,05). Скорость пульсовои? волны у пациентов на фоне лечения валсартаном в дозе 160 мг/сутки снизилась на 228,87±60,41 против 99,35±35,57 см/с в группе лечения амлодипином 10 мг/сутки и 152,49±49,25 см/с в группе комбинированной терапии этими же препаратами в меньших дозах – валсартаном 80 мг/сутки и амлодипином 5 мг/сутки (р<0,01) [34].
Следует отметить метаболические эффекты валсартана, при применении которого улучшается чувствительность периферических тканей к глюкозе и снижается риск развития новых случаев сахарного диабета [4, 26]. Применение валсартана в виде монотерапии или в комбинации с диуретиками способствует снижению уровня мочевой кислоты в крови [23, 35].
Известно, что эректильная дисфункция у мужчин в 80% случаев возникает как осложнение соматических заболеваний, в том числе сердечно-сосудистых (АГ, атеросклероз и ИБС), сахарного диабета. К тому же многие лекарственные средства (антидепрессанты, ?-, ?-адреноблокаторы и т.п.) оказывают отрицательное влияние на различные звенья полового акта. Приверженность к лечению среди пациентов с АГ после подбора антигипертензивной терапии снижается в связи с появлением сексуальных нарушений. На фоне лечения валсартаном повышается сексуальная активность мужчин в возрасте 40–49 лет и женщин в постменопаузальном периоде значимо по сравнению с таковой при приеме атенолола [36].
В рандомизированном двойном слепом клиническом исследовании с участием мужчин 40–49 лет с впервые выявленной АГ при лечении валсартаном (80 мг/сутки) показатель сексуальной активности через 16 недель наблюдения повысился по сравнению с результатами пациентов, получавших ?-адреноблокатор карведилол (50 мг/сутки) [37].
Механизмы влияния валсартана на сексуальную функцию у мужчин с АГ остаются спорными. Известно, что препарат положительно влияет на сосуды: улучшает состояние сосудистой стенки микроциркуляторного русла, ангиогенез, эндотелиальную функцию. Экспериментальные данные указывают на влияние валсартана на обратное развитие ремоделирования сосудов и замедление развития соединительной ткани в кавернозных телах [38]. Исследователи показали, что на фоне приема валсартана улучшается сексуальное желание, обусловленное повышением уровня тестостерона, в то же время при лечении ?-адреноблокаторами отмечали снижение уровня тестостерона.
Оценка уровня сексуальной функции по Международному индексу эректильной функции (IIEF) из 15 пунктов у мужчин с АГ (n=5743) показала снижение показателя у большинства пациентов (75,4 – леченых ранее антигипертензивными препаратами, 65% – не леченых). При применении валсартана в дозе 80–160 мг (средняя суточная доза составила 117 мг) в течение 6 месяцев АД снизилось с уровня 158/94 мм рт.ст. в среднем до 136/82 мм рт.ст. (р<0,001). Проявления эректильной дисфункции уменьшились в группах до 53% и 45% соответственно (p<0,0001). Результаты исследования показали на фоне применения валсартана улучшение сексуальной функции у мужчин с АГ, что, несомненно, способствует повышению приверженности к лечению [39].
Убедительные доказательства эффективности применения валсартана, оказывающего влияние на улучшение прогноза пациентов с АГ и поражение органов-мишеней, ассоциированными состояниями, получены во многих многоцентровых рандомизированных исследованиях. Антигипертензивное действие валсартана в виде монотерапии или в комбинации с тиазидным диуретиком либо блокатором кальциевых каналов получено у пациентов с легкой и умеренной АГ, изолированной систолической гипертензией в разных возрастных группах. Замедление прогрессирования гипертрофии миокарда, уменьшение жесткости сосудистой стенки, нефропротективный эффект при АГ и сахарном диабете, снижение смертности и заболеваемости при хронической сердечной недостаточности определяют место как препарата первого выбора среди антигипертензивных средств.
В Республике Беларусь зарегистрирован Сартвал (фармацевтическая фирма Sandoz) – валсартан в дозе 80 и 160 мг и Сартвал Плюс – комбинация валсартана и гидрохлортиазида в разных дозах. Хорошая переносимость и безопасность препарата, применяемого в виде монотерапии и в комбинации с тиазидным диуретиком, определяет обоснованность его широкого применения для снижения и контроля АД у пациентов с АГ и гипертрофией левого желудочка, для предупреждения фибрилляции предсердий, при метаболических нарушениях (сахарный диабет, гиперурикемия), после перенесенного инфаркта миокарда, при диабетической и недиабетической нефропатии. В отличие от ингибиторов АПФ Сартвал сохраняет свою эффективность при длительном применении (отсутствует эффект «ускользания»), не вызывает сухого кашля и ангионевротического отека, безопасность и хорошая переносимость повышают приверженность к лечению. Применение препарата позволяет снизить риск развития сердечно-сосудистых осложнений, улучшить прогноз и качество жизни пациентов с АГ.
Л И Т Е Р А Т У Р А
1. Sever P.S., Messerli F.H. // Eur. Heart J. – 2011. – Vol.32, N20. – P.2499–2506.
2. Муромцева Г.А., Концевая А.В., Константинов В.В. и др. // Кардиoваск. тер. и профилакт. – 2014. – №13(6). – С.4–11.
3. Zaman M.A., Oparil S., Calhoun D.A. // Nat. Rev. Drug. Discov. – 2002. – Vol.1. – P.621–636.
4. Conlin P.R. // J. Clin. Hypertens. – 2000. – Vol.2. – P.253–257.
5. Диагностика и лечение артериальной гипертензии (Рекомендации Российского медицинского общества по артериальной гипертонии и Всероссийского научного общества кардиологов) // Системные гипертензии. – 2010. – №3. – С.5–26.
6. Mancia G., Fagard R., Narkiewicz K., et al. // Eur. Heart J. – 2013. – Vol.34. – P.2159–2219.
7. Van Liefde I., Vauquelin G. // Molecular and Cellular Endocrinology. – 2009. – Vol.302, N2. – P.237–257.
8. Miura S., Karnik S.S., Saku K. // J. Renin-Angiotensin-Aldosterone System . – 2011. – Vol.12, N1. – P.1–7.
9. Suzuki H., Sano T., Umeda Y., et al. // Neurol. Res. – 2015. – Vol.37, N1. – 35e–42е.
10. Allagnat F., Haefliger J.-A., Lambelet M. // Eur. J. Vasc. Endovasc. Surg. – 2016. – Vol.51. – 733e–742e.
11. Шилов А.М. // Фарматека. – 2014. – №9. – С.39–44.
12. Holwerda N.J., Fogari R., Angeli P., et al. // J. Hypertens. – 1996. – Vol.14, N9. – P.1147–1151.
13. Palatini P., Malacco E., Fogari R., et al. // J. Hypertens. – 2001. – Vol.19. – P.1691–1696.
14. Ruilope L.M., Malacco E., Khder Y., et al. // Clin. Ther. – 2005. – Vol.27, N5. – P.578–587.
15. Ruilope L.M., Heintz D., Brandao A.A., et al. // Blood Press Monit. – 2005. – Vol.10, N2. – P.85–91.
16. Julius S., Kjeldsen S.E., Weber M. // Lancet. – 2004. – Vol.363. – P.2022–2031.
17. Mancia G., Fagard R., Narkiewicz K., et al. // Blood Press. – 2014. – Vol.23, N1. – P.3–16.
18. Kucukler N., Kurt I.H., Topaloglu C., et al. // J. Cardiovasc. Med. (Hagerstown). – 2012. – Vol.13, N3. – P.181–186.
19. Zhang X., Li Z.L., Crane J.A., et al. // Hypertension. – 2014. – Vol.64, N1. – P.87–93.
20. Maggoni A.P., Latini R., Carson P.E., et al. // Am. Heart J. – 2005. – P.149, N3. – Vol.548–557.
21. Healey J.S., Baranchuk A., Crystal E., et al. // JACC. – 2005. – Vol.45, N11. – P.1832–1839.
22. Blood Pressure Lowering Treatment Trialists’ Collaboration // J. Hypertens. – 2007. – Vol.25. – P.95–98.
23. González-Ortiz M., Mora-Martínez J.M., Martínez-Abundis E., et al. // J. Nephrol. – 2000. – Vol.13, N2. – P.126–128.
24. Galle J., Schwedhelm E., Pinnetti S., et al. // Nephrol. Dial Transplant. – 2008. – Vol.23, N10. – P.3174–3183.
25. Suzuki K., Souda S., Ikarashi T., et al. // Diabet Res. Clin. Pract. – 2002. – Vol.57, N3. – P.179–183.
26. Viberti G., Wheeldon N. // Circulation. – 2002. – Vol.106. – P.672–678.
27. McMurray J., Solomon S., Pieper K., et al. // J. Am. Coll. Cardiol. – 2006. – Vol.47, N4. – P.726–733.
28. 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction // JACC. – 2013. – Vol.61, N4. – e78–e140.
29. Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации // Кардиологический вестник. – 2014. – Vol.4. – P.3–59.
30. Peters S., Götting B., Trümmel M., et al. // J. Invasive Cardiol. – 2001. – Vol.13. – P.93–97.
31. Peters S., Trümmel M., Meyners W., Koehler B., Westermann K.U. // Int. J. Cardiol. – 2005. – Vol.98. – P.331–335.
32. Peters S., Bechnisch B., Heilmann T., et al. // J. Renin-Angiotensin-Aldosterone System. – 2009. – Vol.10, N2. – P.91–95.
33. Latini R., Masson S., Staszewsky L., et al. // Expert Opinion on Pharmacotherapy. – 2005. – Vol.5, N1. – P.181–193.
34. Shi R., Liu K., Shi D., Liu Q., Chen X. // Am. J. Med. Sci. – 2017. – Vol.353, N1. – P.6–11.
35. Zappe D.H., Sowers J.R., Hsueh W.A., et al. // J. Clin. Hypertens (Greenwich). – 2008. – Vol.10(12). – P.894–903.
36. Подзолков В.И., Булатов В.А., Вигдорчик А.В. и др. // Рациональная фармакотерапия в кардиологии. – 2010. – №6(2). – С.166–172.
Медицинские новости. – 2018. – №2. – С. 36-42.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Статья подготовлена при поддержке компании Sandoz