Внимание! Статья адресована врачам-специалистам
Huseynov V.T., Nasrullayeva G.
Azerbaijan Medical University, Baku
Clinical features and distribution
of multiple myeloma immunochemical variants in Azerbaijan
Резюме. Исследуется эпидемиология множественных миелом, обнаруженных у жителей Азербайджана, в зависимости от типа иммуноглобулина с целью выявить их влияние на клиническое течение и лечение заболевания. Анализ полученных результатов показывает, что наиболее часто встречаются IgA- и IgG-миелома. Не выявлена зависимость протекания заболевания и продолжительности жизни больных от конкретного иммунохимического варианта.
Ключевые слова: множественная миелома, моноклональные иммуноглобулины, белки Бенс-Джонса, трансплантация стволовых клеток.
Медицинские новости. – 2018. – №2. – С. 74–77.
Summary. The article examines the epidemiology of multiple myelomas, found in Azerbaijan, depending on the type of immunoglobulin in order to identify the effect of immunoglobulin types on the clinical course and treatment of the disease. The analysis of the obtained results shows that in Azerbaijan of all types of myelomas IgA and IgG myeloma are the most common types. The result of the study was the lack of regularity in the dependence of the course of the disease and the life expectancy of patients from a specific immunochemical variant.
Keywords: multiple myeloma, monoclonal immunoglobulins, Bens-Jones proteins, stem cell transplantation.
Meditsinskie novosti. – 2018. – N2. – P. 74–77.
Множественная миелома (ММ) – это злокачественное заболевание плазматических клеток, характеризующееся образованием моноклональных тяжелых иммуноглобулинов (IgA, IgG, IgD, IgЕ) и легких (?,??) цепей протеинов в костном мозге. ММ составляет 1% от всех онкологических заболеваний, свыше 10% от всех опухолевых заболеваний кроветворной системы [1, 2]. При этом заболевании в лимфоциты, образованные из стволовых клеток трансформируются в плазматические клетки, которые синтезируют моноклональные иммуноглобулины или же легкие цепи протеинов (парапротеин, М-протеин). В результате этого у больных нарушается синтез нормальных элементов крови, особенно иммуноглобулинов, что приводит к следующим клиническим проявлениям: деструктивные поражения костей, нарушение реологических свойств крови, иммунная недостаточность, тяжелые поражения почек.
Как известно, каждый иммуноглобулин состоит из двух длинных (тяжелых) и двух коротких (легких) цепей. Исходя из строения тяжелых цепей, различают 5 классов иммуноглобулинов. Каждая тяжелая цепь имеет своеобразное строе-ние и обозначается греческими буквами: гамма (IgG), альфа (IgA), мю (IgM), епсилон (IgE) и дельта (IgD). Легкие же цепи иммуноглобулинов обозначаются греческими буквами каппа (k) и лямбда (?) (рисунок). Отличие специфических иммуноглобулинов – в строении тяжелых цепей: каждая из них имеет два участка (константный и вариабельный).
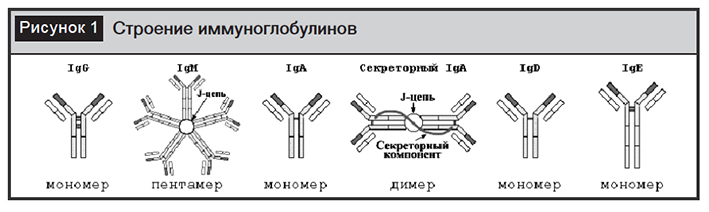
В то время как константные участки определяют тип каждого класса иммуноглобулинов, вариабельные – обусловливают специфичность антитела. Патологический процесс в организме вызывает поликлональное увеличение количества иммуноглобулинов в сыворотке крови, что является адекватной реакцией на патогенные факторы. При нормальном физиологическом состоянии, исходя из функций, выполняемых в организме, типы иммуноглобулинов мало отличаются друг от друга.
При миеломе иммуноглобулины синтезированы плазматическими клетками. Такие протеины синтезируются по причине мутации генов плазматических клеток, участвующих в синтезе иммуноглобулинов. В отличие от нормальных иммуноглобулинов, аминокислотная последовательность парапротеинов, синтезированных в мутированных плазматических клетках, нарушается, в результате чего они теряют функцию иммуноглобулинов. М-белки аномальной формы и функции приводят к ниже перечисленным нарушениям.
В отличие от иммуноглобулинов моноклональные парапротеины, присоединяясь в крови друг к другу, к стенкам кровеносных сосудов, форменным элементам, а также другим компонентам крови, увеличивают ее вязкость и замедляют ее циркуляцию. Кроме того, моноклональные парапротеины, присоединяясь к кровяным тельцам, что повышают свертываемость крови, что приводит к увеличению кровопотери при кровотечении и к развитию флебита.
Присоединение моноклональных белков к гормонам, иммуноглобулинам и другим химическим элементам приводит к нарушению функции эндокринной системы, обмена веществ и иммунной реакции.
Кроме того, симметричное присоединение белков Бенс-Джонса друг к другу и их осаждение в различных тканях, особенно почек, нервной системы и сердца, приводит к амилоидозу. Легкие цепи таких белков, беспорядочно соединяясь, откладываются в стенках мелких кровеносных сосудов глаз и почек.
В результате бесконтрольного повышения количества в костном мозге М-белки попадают в кровь, скапливаются и при достижении определенной концентрации не могут полностью реабсорбироваться в почечных канальцах, поэтому выводятся с мочой.
Вырабатывается примерно на 30% больше легких цепей, которые соединяются с тяжелыми цепями и идут на построение молекулы иммуноглобулина. Эти белки имеют молекулярный вес 22 Да и с легкостью попадают в мочу.
При миеломе тип заболевания определяют на основании концентрации моноклональных иммуноглобулинов, синтезированных плазматическими клетками. Согласно литературным данным, выяснение типа ММ позволяет врачам, определив тяжесть и клиническое течение заболевания, проводить адекватное и эффективное лечение.
Опубликованные результаты исследований показали, что по сравнению с другими вариантами множественных миелом IgA-миелома – более агрессивна и первично резистентная к химической терапии. Другие исследователи придерживаются того мнения, что по течению заболевания и ответной реакции на лечение IgA-миелома – не такой уж и тяжелый вариант. Исследуя литературные данные, приходишь к выводу, что мнения по поводу клинического течения и темпов развития IgA-миеломы – неоднозначны. Одни исследователи считают, что IgA-миелома медленно прогрессирует, другие уверяют, что IgA-миелома – фульминантно прогрессирующая.
Цель исследования – определить эпидемиологию множественных миелом, обнаруженных у жителей Азербайджана, в зависимости от типа иммуноглобулина, а также выявить влияние типов иммуноглобулинов на клиническое течение и лечение заболевания.
Материалы и методы
Клиническое исследование и лечение прошли 53 мужчины и 38 женщин, средний возраст которых составил 56,8 года. В таблице 1 показано распределение больных по типу иммуноглобулина и легких цепей.
Как видно из данных таблицы, у 62 (68%) больных выявлен иммуноглобулин типа G, у 15 (17%) – типа А, у 11 (12%) – болезнь легких цепей и у 3 (3%) – несекретирующая миелома.
Таблица 1. Распределение больных по типу иммуноглобулина
|
Тип множественной
миеломы
|
Количество пациентов
|
|
Иммуноглобулин A
|
15 (17%)
|
12 (80%) мужчин
|
|
3 (20%) женщин
|
|
Иммуноглобулин G
|
62 (68%)
|
36 (58%) мужчин
|
|
26 (42%) женщин
|
|
Болезнь легких цепей
|
11 (12%)
|
4 (58%) мужчин
|
|
7 (42%) женщин
|
|
Несекретирующая
|
3 (3%)
|
1 (36%) мужчин
|
|
2 (74%) женщин
|
Из 62 пациентов с миеломой типа IgG 36 (58%) человек – мужчины, 26 (42%) – женщины. Среди 15 (17%) больных с миеломой типа IgA 12 (80%) мужчин и 3 (20%) женщины, а соотношение мужчин и женщин, страдающих болезнью легких цепей, составило 1:2. Из 3 (3%) обследованных с несекретирующей миеломой 1 – мужчина и 2 – женщины.
Анализ полученных результатов показывает, что в Азербайджане IgG-миелома – наиболее часто встречающийся тип (мужчины болеют сравнительно больше, чем женщины). Миеломой типа IgA мужчины болеют в 4 раза больше, чем женщины, болезнь легких цепей, наоборот, среди мужчин встречается в 2 раза реже, чем у женщин. Высказать мнение по поводу распространения несекретирующей миеломы тяжело, поскольку обследовали малое число пациентов, страдающих этим заболеванием.
В ходе исследования IgD и IgE типы ММ не встречались. Если сравнивать полученные результаты с литературными данными, становится ясным, что IgD и IgE типы ММ – это самые редкие заболевания (встречаемость составляет 2% и 0,1% соответственно), то есть эпидемиология ММ в Азербайджане не отличается от таковой в других странах.
Если обратить внимание на то, что в последнее время генетические факторы заболеваемости ММ превосходят пищевые, экологические и социальные, то можно прийти к выводу, что небольшие различия в эпидемиологии заболевания связаны с наследственностью каждой этнической группы.
Для диагностики миеломы и начала лечения были использованы «Диагностические критерии активной миеломы», разработанные Международной рабочей группой по миеломе (IMWG).
В соответствии с этими критериями важно, чтобы наряду с белком М в сыворотке крови или моче, клональными плазматическими клетками в костном мозге или подтвержденным плазмоцитозом было наличие одного из ниже перечисленных [12].
– C – гиперкальциемия (>11,5 mg/dl, >2,65 mmol/l);
– R – почечная недостаточность (креатинин >2 mg/dl, >177 mmol/l);
– A – анемия (Hb <10 g/dl или меньше нормы на 2 g/dl);
– B – изменения в костях (литические очаги или остеопения).
С целью контроля диагностики и лечения заболеваний использовали рентген, компьютерную томографию, а также метод инновационной технологии РЕТ-СТ (Positron Emission Tomography-Computed Tomography).
После назначения лечения на основании протокола была начата первичная химиотерапия. С целью изучения влияния типа иммуноглобулина на течение заболевания реакция больных IgA и IgG типов на первичную химиотерапию была оценена на основании Критериев ответа на лечение и рецидивов Международной рабочей группы по миеломе (табл. 2) [3].
Таблица 2. Ответ на лечение множественной миеломы IgA и IgG
|
Ответ на лечение
|
Иммуноглобулин A
|
Иммуноглобулин G
|
|
Совершенный полный ответ
|
2 (13,3%)
|
12 (19,3%)
|
|
Полный ответ
|
3 (20%)
|
10 (16,2%)
|
|
Очень хороший частичный ответ
|
7 (46,7%)
|
29 (46,7%)
|
|
Стабилизация заболевания
|
1 (6,7%)
|
5 (8,1%)
|
|
Прогрессирование заболевания
|
2 (13,3%)
|
6 (9,7%)
|
Как видно из данных таблицы, более 80% больных имели положительный ответ на лечение как в случае с миеломой типа А, так и типа G. У остальных 20% пациентов с миеломой IgA и 17,8% с миеломой IgG никаких изменений не наблюдалось или же отмечена резистентность к химиотерапии.
Полученные данные свидетельствуют о том, что при сравнении клинического течения миеломы IgA и IgG были получены аналогичные результаты независимо от типа иммуноглобулинов.
Таким образом, у 77 из обследованных 91 пациента были созданы условия для проведения трансплантации аутологичных периферических стволовых клеток (АПСК). У остальных 14 пациентов из-за осложнений после первичной химиотерапии оказалось невозможным проведение химиотерапии высоких доз и трансплантации АПСК.
У 77 пациентов с положительными результатами были идентифицированы показания на сбор и пересадку стволовых клеток для очередного этапа трансплантации. У всех пациентов с миеломой IgA и IgG удалось собрать, по меньшей мере, 2,7´106 CD34+клеток/кг стволовых клеток. Учитывая, что оптимальное количество стволовых клеток для трансплантации составляет 5´106 CD34+клеток/кг, у 8 больных дополнительно собрали нужное количество. У 6 пациентов количество собранных клеток было достаточно для проведения двух пересадок.
В ходе исследования мы пришли к выводу, что положительный ответ к первичной химиотерапии, прогрессирование или резистентность IgА- и IgG-миеломы не сильно отличаются друг от друга. Кроме того, у всех пациентов с положительным ответом на первичную химиотерапию был успешно проведен сбор АПСК.
Эти результаты совпадают с мнением ученых, которые долгое время наблюдали большое количество пациентов. Таким образом, в ходе выполнения многочисленных работ, посвященных исследованию прогностических факторов ММ, так и не выявлена закономерность и зависимость протекания заболевания и продолжительности жизни больных от конкретного иммунохимического варианта.
Во всех случаях высокие факторы риска агрессивного течения заболевания при IgА-миеломе такие же, как и при IgG-миеломе. Учитывая лабильность таких прогностических факторов ММ, как р2-микроглобулин и С-реактивный белок при почечной недостаточности и многих инфекционных заболеваниях, необходимо проводить их тщательный анализ. В ближайшем будущем благодаря широкому использованию цитогенетического метода и метода множественных хромосомных аномалий можно будет получить гораздо больше информации.
Многие авторы утверждают, что при ММ можно более точно спрогнозировать заболевание, основываясь не на типе иммуноглобулина, а на соотношении тяжелых и легких цепей. При наблюдении 120 пациентов с ММ ретроспективный анализ влияния соотношения тяжелых и легких цепей на клинический статус больного и его прогноз выявил корреляционную зависимость между этими параметрами.
После лечения средняя продолжительность жизни больных с аномальным соотношением тяжелых и легких цепей составила 30,1 месяца, а у пациентов с соотношением тяжелых и легких цепей, близким к норме, – 55,5 месяца. Авторы пришли к выводу, что соотношение тяжелых и легких цепей является прогностическим показателем для пациентов с IgA-миеломой [4].
Исходя из литературных данных, IgD-миелома, являясь наиболее редким субтипом, характеризуется агрессивностью, устойчивостью к химиотерапии и плохим прогнозом. Исследования последних лет показали положительные результаты и после проведения трансплантации АПСК у таких больных. Так, 15 пациентов с IgD-миеломой после трансплантации прожили 45 месяцев [4].
Таким образом, ответ на лечение IgA и IgG типов ММ не зависит от типа секретируемых иммуноглобулинов. Типы иммуноглобулинов не оказывают существенного влияния на клиническое течение заболевания и сбор аутологичных периферических стволовых клеток.
Л И Т Е Р А Т У Р А
1. Blade J., Cibeira M.T., Fernandez de Larrea C., Rosinol L. // Ann. Oncol. – 2010. – Vol.21, N7. – P.313–316.
2. Tricot G., Barlogie B., Van Rhee F. // Br. J. Haematol. – 2004. – Vol.125, N1. – P.24–26.
3. Pимашевская Е.В., Aндреева Н.Е. // Гематология и трансфузиология. – 2005. – Т.50, №4. – C.21–26.
4. Spalding D.M., Griffin J.A. // Cell. – 1986. – Vol.44, N3. – P.507–515.
5. Kutteh W.H., Moldoveanu Z., Prince S.J., et al. // Mol. Immunology. – 1983. – Vol.20, N9. – P.967–976.
6. Durie B.G., Harousseau J.L., Miguel J.S., et al. // Leukemia. – 2006.
7. Mayer L., Posnett D.H., Kunkel H.G. // J. Exp. Med. – 1985. – Vol.161, N1. – P.134–144.
8. Sharma M., Qureshi S.R., Champlin R.E., et al. // Am. J. Hematol. – 2010. – Vol.85, Is.7. – P.146–148.
Медицинские новости. – 2018. – №2. – С. 74-77.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.