Внимание! Статья адресована врачам-специалистам
Sitnik A., Volotovsky P.
Republican Scientific and Practical Center of Traumatology and Orthopedics, Minsk, Belarus
Treatment of infection after osteosynthesis
Резюме. Частота инфекционных осложнений остеосинтеза составляет от 1–2% до 30–52% в зависимости от тяжести первичной травмы. Развитие инфекционного процесса после остеосинтеза перелома имеет свои особенности, связанные с первичными повреждениями кости и мягких тканей, наличием имплантата (инородного тела) и возможной нестабильности фиксации. Тремя наиболее важными факторами при определении стратегии лечения являются: время проявления инфекции после остеосинтеза (ранняя, промежуточная или поздняя инфекция), стабильность фиксации и наличие сращения. При отсутствии глубоких скоплений жидкостей и уверенности в том, что инфекция острая и поверхностная, может быть достаточно эмпирической антибиотикотерапии без удаления имплантата. При поздних инфекциях необходима радикальная хирургическая обработка, замена или удаление фиксатора с обеспечением стабильности костных фрагментов; дефекты костной ткани восстанавливаются после устранения инфекции. Системная и локальная антибиотикотерапия являются важными элементами лечения.
Ключевые слова: остеосинтез, инфекция, диагностика, лечение.
Медицинские новости. – 2018. – №7. – С. 18–24.
Summary. Osteosynthesis-associated infections occur in 1–2% to 30–52% of fractures, depending of the severity of initial injury. The development of infection after fracture fixation has special features due to bone and soft-tissue injuries, presence of fixation device (foreign body) and possible instability of fixation. The three most important factor in the planning of treatment strategy are: time interval after fracture fixation (early, intermediate or late infection), stability of fixation and the degree of fracture union. In acute infection implant retention is possible and empirical antibiotic therapy may be sufficient for the treatment of infection. In late cases radical surgical debridement is necessary; implant must be removed or exchanged, the stability of bone fragments shall be provided; bone defects are addressed after eradication of infection as the second stage surgery. Systemic and local antibiotic therapy is important part of treatment.
Keywords: osteosynthesis, infection, diagnostics, treatment.
Meditsinskienovosti. – 2018. – N7. – P. 18–24.
Инфекционные осложнения остео-синтеза представляют собой особую ситуацию ввиду развития инфекции на фоне имеющегося травматического повреждения мягких тканей, возможной нестабильности костных фрагментов и наличия имплантата. Такие осложнения могут драматически нарушать восстановление пациента после перелома и сопровождаться долгосрочными нарушениями функции конечности и общей жизнедеятельности.
Эпидемиология и факторы риска
Частота инфекционных осложнений остеосинтеза зависит от тяжести первичного повреждения мягких тканей и составляет для низкоэнергетичных закрытых переломов около 1–2%, увеличиваясь до 30–52% при тяжелых открытых переломах Gustilo III. Переломы нижней конечности, особенно околосуставные переломы голени, являются зонами особого риска. Другими способствующими факторами являются тяжелые повреждения мягких тканей, политравма, минно-взрывные и боевые ранения, а также развитие компартмент-синдрома [16, 51].
Доказано, что риск развития инфекционных осложнений выше у курящих, пациентов с сахарным диабетом, сердечно-сосудистой недостаточностью и множественными перенесенными операциями. Прекращение курения позволяет снизить риск развития инфекционных осложнений [19, 31].
Роль антибиотикопрофилактики в снижении риска инфекционных осложнений при лечении открытых и закрытых переломов неоспорима. Применение антибиотиков позднее 6 часов с момента травмы сопровождается значимым увеличением риска нагноений [36, 51]. При этом опасность отсрочки выполнения ПХО при открытых переломах на срок более 6 часов остается недоказанной, но ее выполнение врачами без должного опыта сопровож-дается повышением уровня раневых осложнений [13]. Имеются слабые свидетельства того, что длительное применение временной внешней фиксации (более 4 недель) сопровождается повышением опасности инфекционных осложнений [51].
Патогенез
Развитие инфекционного процесса после остеосинтеза перелома имеет свои особенности, связанные с повреждениями кости и мягких тканей вследствие травмы, наличием имплантата (инородного тела) и возможной нестабильности фиксации.
Наличие инородных тел нарушает защитные механизмы хозяина. Макрофаги вблизи имплантата функционально дефективны, так как не могут поглотить тело большого размера. Таким же образом гиперактивируются гранулоциты, однако направленная на бактерии дегрануляция, переваривание и продукция супероксида нарушены [2, 54].
Свободные микроорганизмы весьма чувствительны к факторам окружающей среды. Формирование биопленок является важным фактором для выживания бактерий. Биопленка – это скопление клеток в виде колоний, окруженных экзополисахаридами, смешанными с внеклеточными продуктами, и прочно фиксированных на поверхности имплантата. Микроорганизмы в биопленках устойчивы к фагоцитозу. Макрофаги, пытающиеся атаковать биопленки, могут вызывать значимые повреждения окружающих тканей. Внеклеточный матрикс препятствует проникновению антибиотиков и антител. Микроорганизмы в биопленках находятся в дремлющем состоянии, что еще более повышает их устойчивость к антибиотикам. Например, минимальная подавляющая концентрация (МПК) антибиотика для синегнойной палочки, находящейся в состоянии биопленки, повышается в 1000 раз по сравнению с планктонической формой[5].
Имплантаты с внутренними полыми пространствами, такие как канюлированные стержни, более предрасположены к развитию инфекции по сравнению с цельными. Частота инфекционных осложнений при малоинвазивном остеосинтезе пластиной по сравнению с открытым остеосинтезом снижается за счет минимизации контакта пластины с костью (пластины с ограниченным контактом или блокированием винтов), уменьшения повреждений надкостницы и нарушений кровоснабжения кости [11, 29].
Стабильность фиксации играет важную роль в заживлении послеоперационной раны. Хотя риск инфекции возрастает при наличии инородного тела, стабильная внутренняя фиксация перелома приводит к снижению вероятности ее развития. В эксперименте на кроликах было показано, что остеотомии, инфицированные S. aureus, гораздо реже сопровождались развитием инфекции при стабильной внутренней фиксации по сравнению с нестабильной. При том, что механизм до сих пор не ясен, считается, что этот эффект связан с раздражением мягких тканей, сложностями реваскуляризации, формированием гематом и мертвых пространств вследствие нестабильной фиксации отломков [41].
Если инфекция персистирует более 2 недель, достигнутая первичная стабильность фиксации может нарушаться. Требуемый для естественного восстановления костной ткани баланс активности остеобластов и остеокластов нарушается в сторону резорбции костной ткани в зоне инфекции около имплантата и перелома, что ведет к механической нестабильности и несращению.
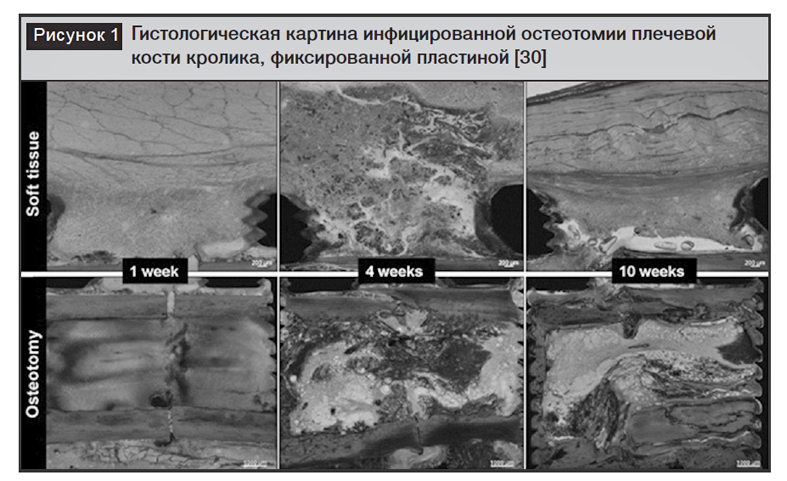
На рисунке 1 представлена гистологическая картина инфицированной остеотомии плечевой кости кролика, фиксированной пластиной. Изменения со стороны мягких тканей в срок 1 недели заключаются в умеренных ранних признаках воспаления над пластиной, к 4 неделе имеется значительный некроз тканей, а к 10 неделе – формирование капсулы, отграничивающей некротизированные мягкие ткани в области пластины. Изменения в кости происходят с некоторой задержкой по отношению к мягким тканям: в срок 1 недели изменений в кости еще нет, к 4 неделе кость демонстрирует остеолиз, который усиливается к 10 неделе, когда имеется несращение с секвестрацией некротизированных фрагментов [30].
Диагноз
Клиника. Диагноз обычно устанавливается клинически. Картина может зависеть от вирулентности организма, глубины расположения фиксатора и степени консолидации перелома. Обычно наблюдаются увеличение локальной болезненности, гиперемия, отеч-ность, расхождение краев раны, гнойное отделяемое, формирование свища, а также общие симптомы – лихорадка. Симптомы острой инфекции могут скрадываться при беспорядочном назначении антибиотиков, глубоком расположении имплантата, использовании гипсовых повязок, а также при низкой вирулентности флоры.
Визуализация. Изменения на рентгенограммах происходят довольно поздно, поэтому рентген бесполезен в выявлении острой инфекции. При подострой инфекции могут наблюдаться периостальные наслоения, расшатывание имплантата и несращение. При хронической инфекции в вовлеченных областях кости могут наблюдаться секвестрация, нарушения кортикального слоя, резорбция кости и формирование реактивной костной мозоли. Хотя рентгенологическое исследование не обладает высокой чувствительностью и специфичностью, серия рентгенограмм, выполненных в течение длительного периода времени, обеспечивает весьма важную информацию о ходе сращения перелома и стабильности имплантата [37, 47].
Компьютерная томография (КТ) обеспечивает более детальную информацию относительно формирования костной мозоли, наличия секвестров, а также абсцессов в мягких тканях. Применение контрастирующих средств улучшает визуализацию воспаленных тканей и пограничных зон вокруг абсцессов [43, 47].
Магнитно-резонансная терапия (МРТ) является методом выбора для оценки степени вовлечения мягких тканей и предоставляет дополнительную информацию относительно интрамедуллярной инфекции. При этом присутствие имплантата вызывает достаточно сильные артефакты, способные имитировать изменения, характерные для инфекции [21].
Ультразвуковое исследование (УЗИ) применяется для выявления скоплений жидкости. Кость и имплантат обладают высокой эхогенностью, сигналы от жидкости определяются хорошо, а артефакты минимальны по сравнению с КТ или МРТ. При глубоком ограниченном скоплении жидкости возможно выполнение пункции под УЗИ-контролем [7].
Cцинтиграфия (99 mTc) позволяет выявить локальную гиперемию или гиперперфузию костной ткани. Так как эти изменения характерны и для сращения перелома, сцинтиграфия не позволяет различить инфекционный процесс и нормальные посттравматические изменения [24].
Позиционно-эмиссионная томография (ПЭТ)получает все более широкое распространение при диагностике инфекционных осложнений остеосинтеза. Чувствительность теста при острых и скрытых мышечно-костных инфекциях составляет практически 100%, а специфичность – более 90%. ПЭТ значительно быстрее сцинтиграфии (около 2–3 часов) и, что особенно важно, дает трехмерную информацию, позволяя четко определить пространственное расположение очага инфекции с минимальными артефактами. В настоящее время применение ПЭТ при костных инфекциях интенсивно изучается [24].
Лабораторные исследования. Рутинное определение количества лейкоцитов, СОЭ и уровня С-РБ является важным при диагностике инфекции. В ранние сроки после остеосинтеза уровень С-РБ обычно достигает максимума на второй день после операции, после чего возвращается к нормальным показателям в течение 2–3 недель. Сохранение высокого уровня С-РБ более 4–7 дней после операции должно вызывать подозрения в отношении инфекции. СОЭ характеризуется высокой чувствительностью, но для ее снижения вдвое требуется около 6 недель.
При несращении перелома и повышении уровня всех трех параметров выше нормы инфекция выявляется в 100% случаев, при повышении двух параметров – в 56%, одного – в 18%. Если все три показателя находятся в пределах нормы – в 81,6% случаев диагноз инфицированного несращения не подтверждается [44]. Повторные измерения С-РБ и СОЭ в динамике важны для контроля прогресса лечения у пациентов с установленным диагнозом инфекции после остеосинтеза [32].
Микробиологическое исследование
Поверхностные мазки менее информативны, чем образцы кости, мягких тканей или жидкости. При хронических ранах и наличии свищей поверхностные мазки не являются ни чувствительными, ни специфичными из-за вторичной контаминации и колонизации [1, 25].
Аспирация скоплений жидкости около имплантата для посева и определения чувствительности флоры относительно проста. Манипуляция выполняется до операции в стерильных условиях под контролем УЗИ или ЭОПа.
При нечетких местных и системных клинических признаках, неясности лабораторной и рентгенологической картины диагноз помогает установить хирургическая ревизия. Во время операции получают набор образцов тканей, включающий периимплантные мягкие ткани, участки костной мозоли и кости [10]. Некротизированные и инфицированные материалы обладают большей информативностью. Секвестры могут содержать медленнорастущие организмы. Необходимо взятие минимум трех образцов тканей. Если микроорганизм выявлен в двух отдельных образцах (микробиологических), диагноз считается надежным. При высоковирулентной флоре (S. aureusили E. coli) для установки диагноза достаточно одной положительной пробы [34]. Жидкости (суставная жидкость, гной, инфицированная гематома) лучше инъецировать в пробирки для посева крови для улучшения выявления медленнорастущих организмов. Выполнение тестов на чувствительность к антибиотикам является обязательным [18].
Гистологическое исследование дополняет микробиологические тесты, так как инфекция вызывает специфичные типы воспалительного ответа, миграцию лейкоцитов, абсцедирование и некроз тканей. Атипичные низко-активные патогены, такие как грибки или микобактерии, иногда выявляются только с помощью гистологического исследования [13].
Ложноотрицательные результаты. Нередко у пациентов с подозрением на имплантат-ассоциированную инфекцию микробиологическое исследование является неинформативным. Наиболее частой причиной является предшествующее использование антибиотиков. Прием антибиотиков необходимо прекратить не менее чем за 2 недели до взятия материала (за исключением случаев острой инфекции или сепсиса). Другие факторы включают недостатки работы лаборатории или недостаточное качество образцов. Кроме того, роста могут не давать некоторые чувствительные к условиям внешней среды организмы.
Для высвобождения микроорганизмов из биопленок наиболее эффективным средством считается сонификация удаляемых имплантатов: для отделения формирующих пленку организмов от поверхности имплантата применяется низкочастотный ультразвук. Чувствительность метода достигает 90%, а частота выявления организмов повышается на 18–30% по сравнению с обычным забором тканей в области имплантата [17, 18].
Важную роль при неинформативности микробиологического исследования играет ПЦР, которая позволяет выявить возбудителя в 85% случаев имплантат-ассоциированных инфекций. ПЦР позволяет с бóльшей эффективностью идентифицировать медленнорастущие организмы, такие как Propionibacterium acnes. Из-за высокой стоимости, невозможности оценки чувствительности микроорганизмов к антибиотикам и опасности ложноположительных результатов ПЦР должна применяться только при неэффективности стандартных микробиологических исследований [23].
Принципы лечения
Тремя наиболее важными факторами при классификации и определении стратегии лечения являются: время после выполнения остеосинтеза, стабильность фиксации и наличие сращения [49]. Также важны: тип имплантата, наличие абсцессов, секвестров, дефектов кости и/или мягких тканей, вовлечение суставов, общее состояние пациента и реакция на лечение.
Основные задачи при лечении инфекции после остеосинтеза включают:
1) достижение консолидации перелома;
2) устранение инфекции или в некоторых случаях ее подавление до сращения перелома;
3) заживление мягких тканей;
4) предотвращение хронизации процесса;
5) восстановление функции конечности.
В отличие от перипротезной инфекции, фиксаторы могут быть удалены уже после консолидации перелома, что значительно повышает шансы на излечение. Поэтому первостепенной задачей является сращение перелома, а не полное устранение инфекции. В определенных случаях супрессивная антибиотикотерапия до сращения перелома может быть разумной альтернативой [3, 47, 54].
Стратегии лечения в зависимости от давности остеосинтеза
Ранняя или острая инфекция (в течение 2 недель после остеосинтеза) является наиболее частой и вызывается высоковирулентными организмами, такими как S. аureus. [46]. В эти сроки уже возможно формирование биопленок, но они являются относительно незрелыми, а бактерии соответственно чувствительны к антибиотикам. Вовлечение кости в ранние сроки минимально, как показано в эксперименте W. Metsemakers и соавт., в течение недели после инокуляции остео-миелита или остеолиза не отмечалось, несмотря на наличие бактерий (рис. 1). Стабильность костных фрагментов на этой стадии определяется достигнутой стабильностью остеосинтеза [30].
Диагноз чаще всего устанавливается на основании клинических признаков: гиперемии краев раны, расхождения ее краев и наличия отделяемого из раны. Часто такие процессы расцениваются как поверхностные. Важным на этой стадии является выявление глубоких скоплений жидкости, которые часто незаметны клинически, но могут быть обнаружены с помощью УЗИ или КТ.
При отсутствии глубоких скоплений жидкостей и уверенности в том, что инфекция острая и поверхностная, может быть достаточно эмпирической антибиотикотерапии [14]. При обнаружении таких скоплений жидкости необходима тщательная хирургическая обработка раны, дренирование гематом и их микробиологическое исследование. Удаление имплантата в ранние сроки, как правило, не показано [25].
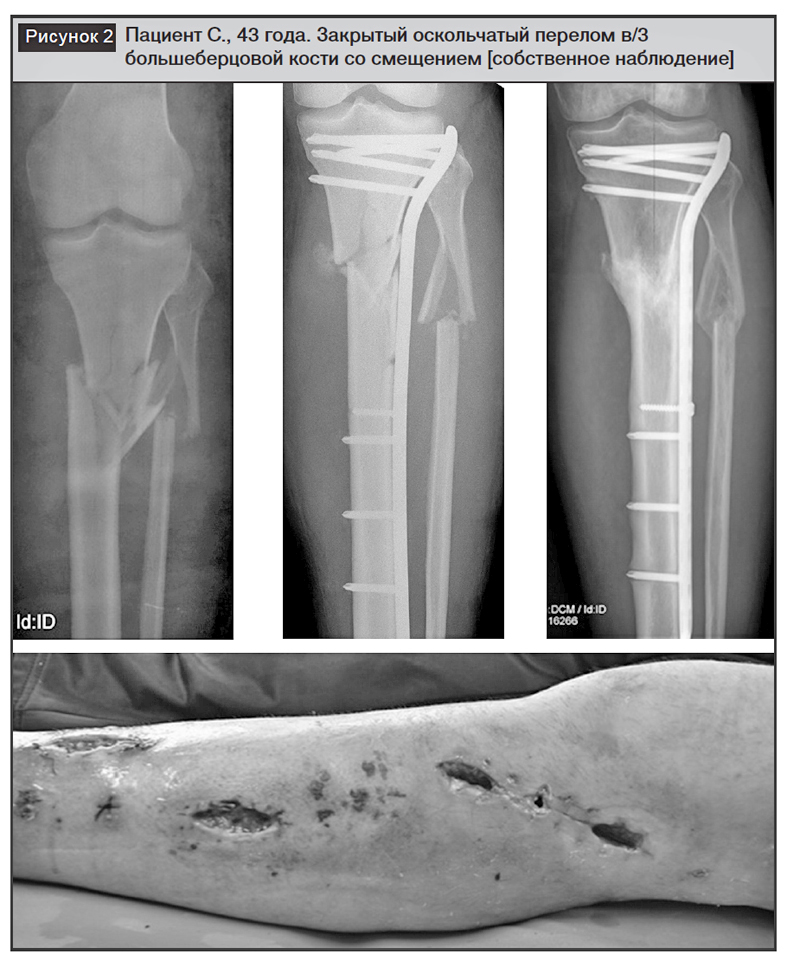
На рисунке 2 представлен клинический пример ранней инфекции у пациета с закрытым оскольчатым переломом верхней трети (в/3) большеберцовой кости со смещением. Признаки острой инфекции появились спустя 10 дней после выполнения малоинвазивного остеосинтеза пластиной. Проведена ревизия ран, хирургическая обработка, удаление гематомы, назначена эмпирическая антибиотикотерапия. Воспалительный процесс купирован с сохранением стабильного имплантата. Сращение перелома. Удаление фиксатора через 10 месяцев после травмы.
Отсроченная инфекция (3–10 недель после остеосинтеза) обычно возникает при меньшей вирулентности микроорганизма (S. epidermidis) [47]. Отсроченные инфекции представляют собой так называемую серую зону, так как обладают свойствами как ранних, так и поздних инфекций. Например, гематомы, более характерные для ранней инфекции, могут наблюдаться и спустя 3–4 недели после операции. С другой стороны, свищи могут появляться уже на 8–9 неделе, хотя обычно характерны для поздней инфекции.
При отсроченных инфекциях сращение перелома часто является незавершенным. Важным отличием от ранней инфекции является дальнейшее созревание и бóльшая устойчивость биопленки к антибиотикотерапии и защитным реакциям организма. В эти сроки инфекционный процесс вовлекает уже и костную ткань (развитие остеомиелита). Поэтому для лечения отсроченной инфекции необходим иной подход по сравнению с ранней инфекцией и минимальным вовлечением кости.
Рутинного удаления имплантатов все еще желательно избегать, так как это приведет к выраженной нестабильности фрагментов и усугублению инфекции. Поэтому решение о выборе стратегии лечения перелома (оставление имплантата, его замена или удалениe) должно проводиться индивидуально, с учетом вида имплантата, возбудителя и общего состояния пациента. Две крупные ретроспективные серии М. Berkesи соавт. и Е. Rightmireи соавт. продемонстрировали успех тактики, заключающейся в хирургической обработке, системной антибиотикотерапии и оставлении имплантата, в 68–71% случаев [3]. В то же время имеются случаи, когда оставление имплантата нежелательно и требуется его замена или переход к внешней фиксации. К таким случаям относятся инфекции при интрамедуллярном остеосинтезе, нестабильность фиксации или плохая репозиция перелома, дефекты мягких тканей, плохое общее состояние пациента и устойчивые к антибиотикам микроорганизмы [30, 40].
Поздняя инфекция (более 10 недель после остеосинтеза) обычно связана с поздней диагностикой. Типичными микроорганизмами являются S. аureus, S. epidermidisи Ps. aeruginosa [46]. Поздние инфекции более сложны для эрадикации из-за наличия биопленок, секвестрации кости и устойчивости микроорганизмов к антибиотикам. Часто наблюдается реактивация инфекции после проведенного лечения.
Симптомы поздней инфекции обычно скудные, без системных проявлений. Часто отмечаются нарушения функции, боль при нагрузке, локализованная отечность и гиперемия либо свищ.
Консолидация перелома нарушается при поздних инфекциях практически всегда. Воспаление и остеолиз с остео-миелитом приводят к нестабильности остеосинтеза. Имплантат не обеспечивает стабильную фиксацию, поэтому должен быть удален или заменен. Показания к переходу на внешнюю фиксацию устанавливаются довольно агрессивно. В тех случаях, где это затруднительно, следует обсуждать замену внутренней фиксации на погружные мостовидные конструкции.
Периостальные наслоения по периферии очага инфекции формируют дополнительный барьер для отграничения инфекции. Эти изменения часто требуют выполнения широких и повторных хирургических обработок и приводят к возникновению дефектов кости. Прежде чем приступать к реконструкции костных дефектов, следует добиться контроля над инфекцией, для чего необходима радикальная хирургическая обработка.
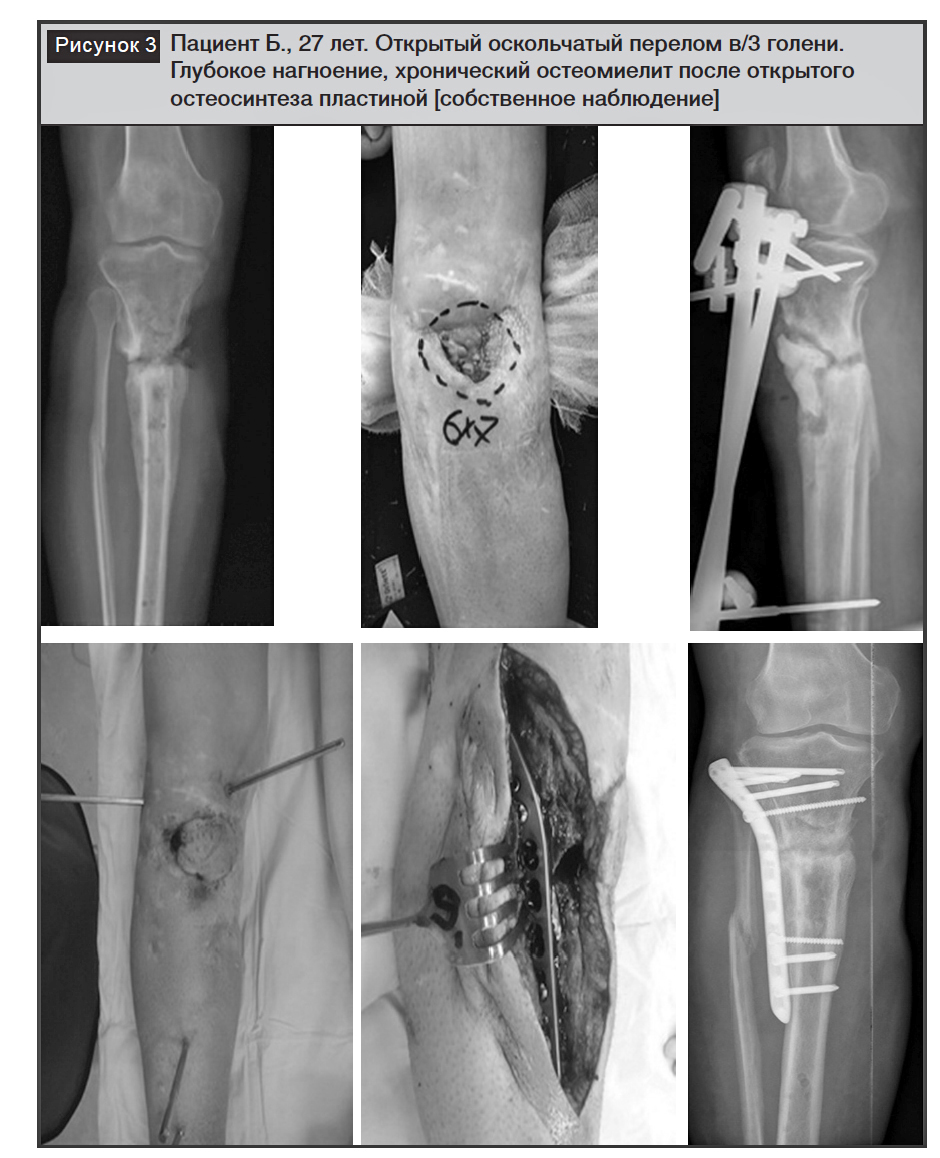
На рисунке 3 представлен пример поздней инфекции у пациентки. Открытый оскольчатый перелом в/3 голени. Глубокое нагноение, хронический остео-миелит после открытого остеосинтеза пластиной. На момент обращения фиксатор удален, по передне-медиальной поверхности в/3 голени находится участок измененных мягких тканей с небольшим количеством зловонного отделяемого. Инфицированное несращение с дефектом мягких тканей. Назначено этапное лечение. Первый этап: ХО, иссечение измененных мягких тканей, резекция измененных костных тканей в области несращения, взятие образцов тканей для микробиологического исследования, цементный спейсер с антибиотиком (ванкомицин 2,0), внешняя фиксация стержневым аппаратом, закрытие дефекта мягких тканей суральным лоскутом на проксимальном основании (хирург А.А. Сухарев). Системная антибактериальная терапия с учетом данных бактериологического исследования. Гладкое течение послеоперационного периода. Через 8 недель – второй этап: демонтаж стержневого аппарата, удаление спейсера, контроль чистоты раны, остеосинтез в/3 голени пластиной, костная пластика дефекта спонгиозным аутотрансплантатом из крыла подвздошной кости. Гладкое течение послеоперационного периода. Сращение перелома через 5 месяцев после операции.
Инфекция после сращения перелома
Лечение инфекции после сращения перелома обычно простое и заключается в хирургической обработке и удалении имплантата. У пациентов с ранее перенесенной инфекцией имплантаты также должны удаляться, так как из-за дремлющей в биопленках инфекции сохраняется высокий риск рецидива.
Общие хирургические принципы
Хирургическая обработка
Удаление гематомы, гноя и некротизированных тканей должно выполняться агрессивно, при этом к кожным краям раны следует относиться бережно. Выполняется оценка стабильности имплантата и перелома. Замена имплантата позволяет снизить риск рецидива инфекции за счет удаления фиксированных на нем биопленок и возможности ревизии зоны под пластиной. При тяжелых и персистирующих инфекциях нежизнеспособная кость должна быть удалена, несмотря на сохранение связи с окружающими тканями. Выполняется промывание раны большими объемами физиологического раствора. Применение антисептиков и устройств пульсирующего промывания ран не имеет значимого научного обоснования. Значимые дефекты костной ткани могут заполняться спейсерами с антибиотиками. Дефекты мягких тканей требуют аккуратного закрытия, возможно с применением вакуумирования или лоскутов. Первичное укрытие раны особенно важно при обнажении кости [13, 30].
В большинстве случаев потребуется две или более хирургические обработки (ХО), что необходимо обсуждать с пациентом еще до начала лечения. При сомнениях в жизнеспособности тканей показаны повторные обработки каждые 2–3 дня до получения чистого раневого ложа со здоровой кровоточащей костью и мягкими тканями [14, 40, 47].
Применение внешней фиксации
При невозможности достижения контроля над инфекцией после нескольких ХО или при выраженных неблагоприятных локальных или системных факторах показано полное удаление имплантатов и переход к внешней фиксации [4]. Фиксаторы Илизарова обеспечивают лучшую фиксацию в спонгиозной кости и особенно эффективны в периартикулярных зонах, при вовлечении которых важно сохранение подвижности сустава. Основными недостатками является громоздкость конструкции, неудобство для пациента и высокая частота спицевой инфекции. У пациентов с хорошим общим состоянием и невыраженными местными факторами риска после достижения контроля над инфекцией возможен обратный переход к внутренней фиксации [12].
Локальная антибиотикотерапия
Эффективность локальной антибиотикотерапии при инфекциях после остеосинтеза не имеет серьезного научного подтверждения, однако она широко применяется на практике на основании опыта лечения перипротезной инфекции [33]. Варианты применения включают применение костного цемента с добавлением антибиотиков в виде шариков (бус), цельных спейсеров или цементного покрытия стержней [22, 50]. Даже простое местное применение ванкомицина снижает риск инфекции [52].
При значительных (сегментарных) дефектах может применяться метод индуцирования костной мембраны за счет цементного спейсера и последующей костной пластики, описанный А. Masquelet и Т. Begue [27]. Этот метод показал свою эффективность и сопровождался низким уровнем осложнений при травматических и постинфекционных дефектах [15, 28].
Во время хирургической обработки значимые дефекты временно заполняются цементом с антибиотиком, который обеспечивает структурную поддержку и также препятствует врастанию рубцовой ткани. Так как затвердение костного цемента сопровождается выделением тепла, предпочтительны термостабильные водорастворимые антибиотики, такие как аминогликозиды, ванкомицин и имипенем. Применение двух или более антибиотиков в одном спейсере обеспечивает синергичный эффект их действия, однако ослабляет механические свойства. Количество антибиотика может составлять до 10% массы цемента. Например, с одной упаковкой цемента может смешиваться 0,5–1,0 г гентамицина и 2–4 г ванкомицина.
Скорость выделения антибиотика варьируется в зависимости от вещества и геометрической формы спейсера, однако в любом случае высокие дозы выделяются в течение короткого периода времени (часы после установки), а локальная концентрация быстро снижается в течение нескольких дней. Так как подавляющая рост концентрация антибиотика не всегда поддерживается в течение 2 недель, обязательно необходима дополнительная системная АБ-терапия.
Второй этап – спонгиозная костная пластика – выполняется через 6–8 недель при условии купирования инфекции. Обычно в этот срок вокруг спейсера формируется псевдомембрана, которая богата факторами роста и хорошо васкуляризована [47]. Спонгиозный трансплантат укладывается в образованную чистую полость. Отличным источником большого количества спонгиозной кости является рассверливание костно-мозгового канала здорового бедра с аспирацией и фильтрацией промывных вод (RIA) [8, 42]. Такая техника позволяет получить до 50–70 мл аутотрансплантата с минимальной морбидностью для пациента.
Инфекция после интрамедуллярного остеосинтеза
Инфекции после интрамедуллярного остеосинтеза представляют уникальные сложности при лечении. Костномозговой канал труднодоступен для хирургической обработки, а диагноз зачастую устанавливается поздно. Лечение основывается на принципах хирургической обработки, стабилизации, укрытия мягкими тканями, системной антибиотикотерапии и этапного замещения костных дефектов [26].
При интрамедуллярных инфекциях все чаще применяются стержни с антибактериальным цементным покрытием. В ряде статей с небольшим количеством случаев сообщается об успешном применении таких стержней в качестве временного средства стабилизации и локальной антибиотикотерапии с последующей окончательной фиксацией стандартными стержнями примерно через 2 месяца. При необходимости поддержания осевой и ротационной стабильности могут применяться блокируемые стержни с антибактериальным цементным покрытием [35, 38, 48]. Рассверливание позволяет эффективно удалить инфицированные ткани в пределах костномозгового канала. При использовании техники рассверливания с одновременным промыванием и аспирацией содержимого канала (RIA) сообщаемая частота успеха достигает 96–100% случаев [6, 20, 53].
Системное лечение
Системная антибиотикотерапия при инфекции после остеосинтеза является обязательной. Ее можно разделить на три вида: эмпирическую терапию, специфичную целенаправленную и супрессивную. При выборе антибиотика следует учитывать чувствительность бактерий, возможности проникновения в костную ткань и выраженность побочных эффектов.
Эмпирическая антибиотикотерапия
Эмпирическая внутривенная антибиотикотерапия может быть эффективной при лечении ранней и поверхностной инфекции при отсутствии формирования биопленок. Антибиотики не проникают в гематомы, серомы, абсцессы или девитализированную кость, поэтому их применение не может заменить полноценную ХО. Внутривенное назначение антибиотиков в высоких дозах может обеспечить достаточную концентрацию в слабокровоснабжаемых зонах кости и периимплантных тканях.
Наиболее частой причиной ранних инфекций после остеосинтеза является Staphylococcus aureus, особенно метициллин-чувствительный. Поэтому средствами первой линии при эмпирическом лечении являются антистафилококковые антибиотики, такие как пеницилоназо-резистентный пенициллин (клоксациллин) или цефалоспорины первого поколения (цефазолин). У пациентов с перенесенными ранее инфекциями с участием метициллин-резистентного стафилококка либо при длительном нахождении в стационаре следует применять гликопептиды (ванкомицин или тейкопланин). Цефалоспорины третьего поколения (цефтриаксон или цефотаксим) показаны при инфекциях в области промежности, у пожилых пациентов, диабетиков или при иммунодефиците, так как здесь высок риск участия грамотрицательной флоры [46].
При отсроченных или поздних инфекциях спустя 3 недели и более после остеосинтеза частой их причиной является менее вирулентная флора. Эмпирическая терапия не должна препятствовать быстрой микробиологической диагностике. Поэтому (если речь не идет о сепсисе) эмпирическая терапия приостанавливается до получения образцов глубоких тканей или скоплений жидкостей.
Целенаправленная антибиотикотерапия
Целенаправленная антибиотикотерапия должна начинаться сразу после получения данных микробиологического исследования. После выделения специ-фического микроорганизма антибиотики широкого спектра действия (эмпирическая терапия) следует заменять на узконаправленные для минимизации подавления флоры хозяина и профилактики возникновения резистентности. После открытых переломов и при нарушениях иммунитета возможен полимикробный рост. Обычно требуется комбинация антибиотиков. При стафилококковых инфекциях сочетание хинолонов или β-лактамных антибиотиков с рифампицином показало бóльшую эффективность по сравнению с монотерапией. Несколько проспективных исследований продемонстрировали частоту излечения в 69–100% при использовании комбинации рифампицина с хинолонами, особенно при ранних инфекциях [9, 55].
Продолжительность антибиотикотерапии
Во всех случаях стандартным началом антибиотикотерапии должно быть внутривенное назначение в высоких дозах на первые три недели. При отсроченных или поздних инфекциях с наличием имплантатов необходима более продолжительная терапия. При хорошей реакции на лечение внутривенное введение можно заменить на пероральный прием антибиотиков с хорошей биодоступностью в костной ткани [45]. Необходимо регулярно контролировать параметры воспаления, локальную картину и рентгенологические признаки сращения перелома или наоборот, расшатывания имплантата. Прием антибиотиков прекращается только при наличии клинических признаков разрешения инфекции, нормализации биохимических параметров и рентгенологических признаках стабильности перелома, его прогрессирующего сращения и отсутствия расшатывания имплантата.
Минимальная продолжительность антибиотикотерапии при отсроченной инфекции и сохранении имплантата должна составлять 6 недель при хорошем ответе на лечение (клинически и биохимически). Она увеличивается до 3 месяцев или более, если реакция на лечение получается не сразу или у пациента имеются неблагоприятные локальные или системные факторы. Продолжительность лечения может быть сокращена до 3 недель при удалении всех имплантатов с хорошей местной реакцией и сращением перелома.
Заключение
· Развитие инфекционного процесса после выполненного остеосинтеза является серьезным осложнением, затрудняющим восстановление пациента.
· Основой лечения является хирургическое удаление всех инфицированных и нежизнеспособных тканей.
· Оценка стабильности фиксации важна для решения вопроса об оставлении, замене имплантата или переходе на внешнюю фиксацию.
· Длительная системная антибиотикотерапия является обязательной: при острых инфекциях возможно применение эмпирической антибиотикотерапии, которая должна заменяться на целенаправленную при получении данных микробиологического исследования.
· Локальная антибиотикотерапия с применением цементных спейсеров или покрытий имплантатов и вторичное восполнение дефектов кости играют важную роль при лечении поздней инфекции.
ЛИТЕРАТУ РА
1. Aggarwal V., Higuera C., Parvizi J., Austin M. // Clin. Orthop. Relat. Res. – 2013. – Vol.471. – P.3196–203.
2. Anderson J., Rodriguez A., Chang D. // Semin. Immunopathol. – 2008. – Vol.20, N2. – P.86–100.
3. Berkes M., Obremskey W., Bosse M. // J. Bone Joint Surg. Am. – 2010. – Vol.92. – P.823–828.
4. Chen C., Ko J., Wang J. // J. Trauma. – 2003. – Vol.55, N2. – P.338–344.
5. Costerton J., Lewandowski Z., Caldwell D. // Ann. Rev. Microbiol. – 1995. – Vol.49, N1. – P.711–745.
6. Cox G., Jones E., McGonagle D. // Int. Orthop. – 2011. – Vol.35, N7. – P.951–956.
7. Cyteval C., Bourdon A. // Diagn. Interv. Imaging. – 2012. – Vol.93, N6. – P.547–557.
8. Donegan D., Scolaro J., Matuszewski P. // Orthopedics 2011. – Vol.34, N11. – e730–e735.
9. Drancourt M., Stein A., Argenson J. // Antimicrob. Agents Chemother. – 1993. – Vol.37, N6. – P.1214–1218.
10. Egol K., Karunakar M., Marroum M. // J. Trauma. – 2002. – Vol.52, N6. – P.1198–1201.
11. Eijer H., Hauke C., Arens S. // Injury. – 2001. – Vol.32, Suppl.2. – B38–43.
12. Emara K., Allam M. // J. Trauma. – 2008. – Vol.65, N3. – P.685–691.
13. Fang C., Wong T.-M., To K., Wong S., Leung F. // J. Orthop. Surgery. – 2017. – Vol.25, N1. – P.1–13.
14. Fang C., Wong T.-M., To K., Wong S., Leung F. // J. Orthop. Surgery. – 2017. – Vol.25, N2. – P.1–11.
15. Giannoudis P., Faour O., Goff T. // Injury. – 2011. – Vol.42, N6. – P.591–598.
16. Gustilo R., Anderson J. // J. Bone Joint Surg. Am. – 1976. – Vol.58, N4. – P.453–458.
17. Holinka J., Bauer L., Hirschl A. // Journal of Orthopaedic Research. – 2011. – Vol.29, N4. – P.617–622.
18. Jenkins S., Schuetz A. // Mayo Clin. Proc. – 2012. – Vol.87, N3. – P.290–308.
19. Kadar A., Sherman H., Glazer Y. // J. Orthop. Sci. – 2015. – Vol.20, N1. – P.168–173.
20. Kanakaris N., Gudipati S., Tosounidis T. // Bone Joint J. – 2014. – Vol.96, N6. – P.783–188.
21. Ledermann H., Kaim A., Bongartz G., Steinbrich W. // Eur Radiol. – 2000. – Vol.10. – P.1815–1823.
22. Lehner B., Fleischmann W., Becker R. // Int. Orthop. – 2011. – Vol.35, N9. – P.1415–1420.
23. Levy P., Fournier P., Fenollar F. // Am. J. Med. – 2013. – Vol.126, N12. – e1125.
24. Love C., Palestro C. // Clin. Radiol. – 2016. – Vol.71, N7. – P.632–646.
25. Mackowiak P., Jones S., Smith J. // JAMA. – 1978. – Vol.239, N26. – P.2772–2775.
26. Makridis K., Tosounidis T., Giannoudis P. // Open Orthop. J. – 2013. – Vol.7. – P.219–226.
27. Masquelet A., Begue T. // Orthop. Clin. North Am. – 2010. – Vol.1, N1. – P.27–37.
28. McKee M., Li-Bland E., Wild L. // J. Orthop. Trauma. – 2010. – Vol.24, N8. – P.483–490.
29. Melcher G., Claudi B., Schlegel U. // J. Bone Joint Surg. Br. – 1994. – Vol.76, N6. – P.955–959.
30. Metsemakers W., Kuehl R., Moriarty T., Verhofstad M., Borens O., Kates S., Morgenstern M. // Injury. – 2016. – http://dx.doi.org/10.1016/j.injury.2016.09.019
31. Nasell H., Ottosson C., Törnqvist H. // J. Orthop. Trauma. – 2011. – Vol.25, N12. – P.748–755.
32. Neumaier M., Scherer M. // Acta Orthop. – 2008. – Vol.79, N3. – P.428–432.
33. Obremskey W., Molina C., Collinge C. // J. Orthop. Trauma. – 2014. – Vol.28, N8. – e198–202.
34. Osmon D., Berbari E., Berendt A., Lew D., Zimmerli W., Steckelberg J. // Clin. Infect. Dis. – 2013. – Vol.56. – e1–e25.
35. Paley D., Herzenberg J. // J. Orthop. Trauma. – 2002. – Vol.16, N10. – P.723–729.
36. Patzakis M., Wilkins J. // Clin. Orthop. Relat. Res. – 1989. – Vol.243. – P.36–40.
37. Patzakis M., Zalavras C. // J. Am. Acad. Orthop. Surg. – 2005. – Vol.13. – P.417–427.
38. Qiang Z., Jun P., Jie X. // Arch. Orthop. Trauma Surg. – 2007. – Vol.127, N10. – P.945–951.
39. Rochford E., Richards R., Moriarty T. // Clin. Microbiol. Infect. – 2012. – Vol.18, N12. – P.1162–1167.
40. Rightmire E., Zurakowski D., Vrahas M. // Clin. Orthop. Relat. Res. – 2008. – Vol.466, N2. – P.466–472.
41. Schmidt A., Swiontkowski M. // J. Am. Acad. Orthop. Surg. – 2000. – Vol.8, N5. – P.285–291.
42. Stafford P., NorrisB. // Injury. – 2010. – Vol.41, Suppl.2. – S72–77.
43. Steinhausen E., Glombitza M., Bohm H.J., Hax P.M., Rixen D. // Unfallchirurg. – 2013. – Vol.116. – P.633–647.
44. Stucken C., Olszewski D., Creevy W. // J. Bone Joint. Surg. Am. – 2013. – Vol.95, N15. – P.1409–1412.
45. Swiontkowski M., Hanel D., Vedder N. // J. Bone Joint. Surg. Br. – 1999. – Vol.81, N6. – P.1046–1050.
46. Torbert J., Joshi M., Moraff A. // J. Orthop. Trauma. – 2015. – Vol.29, N1. – P.7–17.
47. Trampuz A., Zimmerli W. // Injury. – 2006. – Vol.37, Suppl.2. – S59–66.
48. Wasko M., Borens O. // Injury. – 2013. – Vol.44, N8. – P.1057–1060.
49. Willenegger H., Roth B. // Unfallchirurgie. – 1986. – Vol.12. – P.241–246.
50. Wong T., Lau T., Li X. // Scientific World J. – 2014. – Vol.14. – P.702–710.
51. Young S., Lie S., Hallan G. // World J. Surg. – 2013. – Vol.37, N2. – P.349–355.
52. Yan H., He J., Chen S. // J. Shoulder Elbow Surg. – 2014. – Vol.23, N5. – P.686–692.
53. Zalavras C., Sirkin M. // Injury. – 2010. – Vol.41, Suppl.2. – S43–47.
54. Zimmerli W. // J. Intern. Med. – 2014. – Vol.276. – P.111–119.
55. Zimmerli W., Widmer A., Blatter M. // JAMA. – 1998. – Vol.279, N19. – P.1537–1541.
Медицинские новости. – 2018. – 7. – С. 18-24.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.