Внимание! Статья адресована врачам-специалистам
Azizov Y.H., Okhunov A.O.
Tashkent Medical Academy, Uzbekistan
Morphofunctional peculiarities of the lungs
in the dynamics of development of surgical sepsis in experiment
Резюме. При хирургическом сепсисе на 14-е сутки наблюдали прогрессирование гнойно-некротического процесса в мягких тканях, который сопровождался появлением богатой белком и нитями фибрина жидкости в просвете альвеол, а также слущиванием альвеолоцитов. Стенки альвеол приобретали необратимый морфоструктурный характер изменений и сопровождались образованием гиалиновых мембран, способные, как известно, нарушать диффузию кислорода. Разрушались межальвеолярные перегородки, местами развивался фиброз и облитерация альвеол, появлялись очаги абсцедирования. Эти изменения носили необратимый характер.
Ключевые слова: хирургический сепсис, генерализация инфекции, ателектаз легких, повреждения эндотелия.
Медицинские новости. – 2018. – №11. – С. 74–76.
Summary. During surgical sepsis on the 14th day, the progression of the purulent-necrotic process in the soft tissues was observed, which was accompanied by the appearance of fluid rich in protein and fibrin threads in the lumen of the alveoli, as well as by sloughing of the alveolocytes. The walls of the alveoli acquired an irreversible morphostructural character of the changes and were accompanied by the formation of hyaline membranes capable, as is well known, of disrupting the diffusion of oxygen. The interalveolar partitions were destroyed, in some places fibrosis and obliteration of the alveoli developed, and foci of abscess appeared. These changes were not reversible.
Keywords: surgical sepsis, generalization of infection, lung atelectasis, endothelium damage.
Meditsinskie novosti. – 2018. – N11. – P. 74–76.
Хирургический сепсис – один из самых значительных этиологических факторов развития синдрома острого повреждения легких, который при образовании гиалиновых мембран в альвеолярных выстилках трансформируется в экстрапульмональный вид острого респираторного дистресс-синдрома [1, 2].
Безусловно, важную роль в патогенезе острого респираторного дистресс-синдрома при сепсисе играет инфекция. По мнению D.G. Ashbaugh[5], при бактериемии гематогенное инфицирование легких с развитием дыхательной недостаточности почти неизбежно. Однако немаловажное значение в прогрессировании сепсиса имеет разновидность патологического источника и его характера (гнойного, некротического, гнилостного и т.д.).
Цель исследования – изучение морфологии легкого при моделировании сепсиса на фоне тяжелой формы гнойно-воспалительного заболевания мягких тканей.
Материалы и методы
В эксперименте использовали 36 беспородных кроликов массой 1500–2500 г, находившихся на обычном лабораторном рационе. Все животные были разделены на 2 группы: в контрольную включили 12 интактных кроликов (без моделирования патологического процесса); в основную – 24 кролика с экспериментальной моделью сепсиса на фоне тяжелой формы гнойно-воспалительного заболевания мягких тканей (некротический фасциит I типа).
Экспериментальную модель сепсиса воспроизводили на фоне некротического фасциита I типа по разработанной нами оригинальной методике. Моделирование осуществляли следующим образом: кроликам натощак под эфирным наркозом в течение 2 дней внутрибрюшинно вводили антилимфолин-Кр в дозе 0,03 мг на 100 г массы животного. На 3-и сутки подкожно в 5 точек спины животного инъецировали по 3–4 мл 30% взвеси аутокала животного, разбавленного 10-процентным раствором хлористого кальция.
Забой животных осуществляли с учетом рекомендаций Европейского комитета по гуманному обращению с лабораторными животными на 1-е, 3-и, 7-е и 14-е сутки после введения взвеси аутокала в мягкие ткани поясничной области животного.
Кусочки органа были фиксированы в формалине и глутаральдегиде по традиционной методике. Срезы тканей окрашивали гематоксилином эозином и фуксином – метиленовой синью.
Результаты и обсуждение
При моделировании хирургического сепсиса на фоне некротического фасциита во всех сроках наблюдения макроскопически обнаружена неравномерность кровенаполнения легочной паренхимы, а в более поздние сроки – синюшные ацинарные и субсегментарные западающие участки, мелкие субплевральные кровоизлияния.
При светооптическом исследовании установлено прогрессирование гистологических изменений в ткани и преимущественными изменениями в сосудах микроциркуляторного русла легких.
Через 24 часа после моделирования некротического фасциита у кроликов в легочной ткани наблюдались в основном изменения сосудистого характера. При этом местами изменения сосудов в виде сужения их просвета посредством спазма венул сочетались с вазодилятацией и увеличением концентрации в них форменных элементов, преимущественно лейкоцитов.
Как известно, такое антагонистическое соотношение сосудистой реакции бывает при прогрессирующем возрастании объема притока крови [1, 3]. Капилляры и мелкие венулы находились в спавшемся состоянии, эндотелиоциты выбухали в просвет микрососудов, где отмечалось увеличение числа нейтрофильных гранулоцитов и моноцитов. Соседние участки легочной ткани характеризовались мозаичным сочетанием воздушности альвеол. В просвете альвеол со сниженной воздушностью выявлялось большое количество форменных элементов, преимущественно эритроцитов, тогда как в зоне раскрытых альвеол имело место скопления в их капиллярах микроагрегатов.
На 3-и сутки развития хирургического сепсиса на фоне некротического фасциита макроскопически отмечалось усиление гиперемирования легочной ткани. Микроскопически в капиллярах легких, преимущественно в венулах, имело место развития стаза и агрегации эритроцитов. Отмечалось увеличение полнокровия капилляров и участков с внутриальвеолярным отеком. Агрегация эритроцитов в микрососудистом русле приобретала характер массивности. В физиологических местах, подверженных наибольшей возможности стаза крови, появляются «кровяные лакуны», которые блокировали нижележащие участки аэрогематического барьера.
Отличительной особенностью является сладжирование крови в суббазальных участках микрососудистых шунтов, о чем свидетельствует одинаковая картина в расправленных и спавшихся альвеолах. Для этих участков микрососудов легких характерным было появление тромбов и скопление в них лейкоцитов.
Нарастает отек интерстициальной ткани что, по-видимому, было обусловлено образованием эритроцитарных агрегатов в венах, венулах и капиллярах легких. Это приводило к выраженным изменениям клеточных и внеклеточных элементов альвеол.
Увеличение размеров и изменение формы альвеоцитов свидетельствовало об их отечности, причем как I, так и II типа. Множественные разрывы мембран и резко деформированные поры Кона сочетались с появлением участков с необтурационными микроателектазами.
Седьмые сутки экспериментальной модели хирургического сепсиса на фоне некротического фасциита характеризовались нарастанием проявлений гиперемии и стаза морфологической структуры легочной ткани, что проявлялось массивным скоплением форменных элементов крови в капиллярах и венулах. Это в свою очередь способствовало увеличению массивности тромбообразования с распространением данных проявлений на все большие участки легкого. Межэндотелиальные капиллярные промежутки расширились.
В паренхиме легкого обнаруживались необтурационные микроателектазы диссеминированного характера, в которых альвеоциты II типа имели участки просветления, в цитоплазме эндотелиоцитов наблюдались крупных размеров вакуоли. Вокруг микроателектазов отмечались отек интерстиция, кровоизлияния и очаги воспаления. В просвете многих альвеол появилась жидкость, богатая белком, нити фибрина, слущенные альвеолоциты.
Нарастание закупорки легочных капилляров и набухание клеток эндотелия сопровождалось усилением образования микроателектазов, причем количество экстрацеллюлярной жидкости в легких было увеличено незначительно.
Усиливались проявления нарастания сосудистой проницаемости, изменения происходили уже не только в клетках эндотелия, но и альвеолярного эпителия, нарастал отек, особенно в области более крупных сосудов.
Наблюдались выраженные изменения деформации альвеолярных стенок, наличие ателектазированных участков легочной ткани и очаги воспаления. Наблюдалась выраженная деструкция и местами разрывы клеточных мембран, отек и разрыхление базальной мембраны, также встречались участки расслоения альвеолокапиллярной мембраны.
Местами клетки отслаивались от базальной мембраны с проникновением и скоплением в них большого количества эритроцитов. Отмечался резко выраженный отек как эндотелиоцитов сосудистой стенки с выбуханием их в просвет, так и значительный отек альвеолоцитов I и II типа с нарушением их формы. Выявлен отек и клеточная инфильтрация межальвеолярных перегородок и интерстициального пространства, окружающего воздухоносные пути, стаз эритроцитов, тромбоцитарные и гранулоцитарные агрегаты в очагах альвеолярных и интерстициальных геморрагий.
Нередко встречались гиперплазия и дисплазия гранулярных альвеоцитов. В стенках альвеол образовывались гиалиновые мембраны, которые сопровождались разрушением меж-альвеолярных перегородок. В просвете альвеол выявлялся фибрин. Образование гиалиновых мембран сочеталось с другими пролиферативными изменениями в виде фиброза легочной ткани.
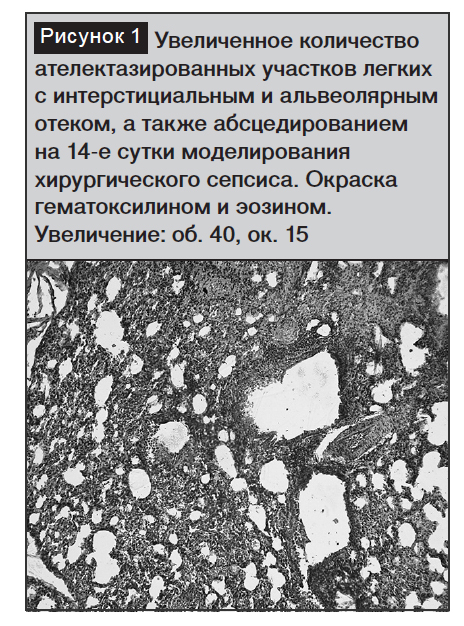
На 14-е сутки моделирования хирургического сепсиса на фоне некротического фасциита интенсивность развития патологических изменений снизилась вопреки нарастанию патологических изменений в легочной ткани кроликов. Увеличилось число необтурационных микроателектазов диссеминированного характера. Образование микроателектазов было отмечено в зонах легочной ткани, в которых преобладал распад альвеоцитов.
Увеличивалось число гиалиновых мембран, развивался фиброз и облитерация альвеол. Наряду с усилением описанных на 7-е сутки патологических изменений наблюдалась отслойка альвеоцитов I типа от базальной мембраны, а в периферических отделах легких альвеоциты II типа сохраняли очаги просветления с увеличением количества и размеров вакуолей. Дистрофические изменения альвеоцитов нарастали вплоть до единичных участков распада этих клеток. Наряду с дистрофией альвео-цитов наблюдались слущенные клетки в просвете альвеол.
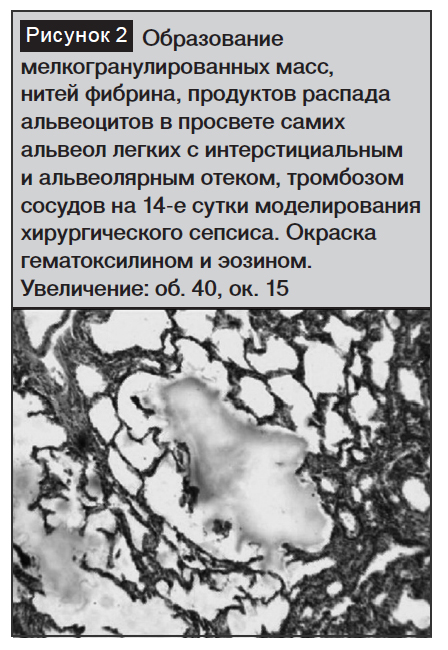
В просвете капилляров встречались сформировавшиеся тромбозы и агрегаты, имелись признаки внутриальвеолярного отека. В просвете сосудистого русла легочного бассейна, помимо агрегатов из эритроцитов или стазов, было увеличено количество лейкоцитов, особенно моноцитов.
В просвете альвеол, помимо эритроцитов, появлялись и мелкогранулярные массы, что характеризовало ухудшение количественных и качественных морфологических признаков состояния легочной ткани.
Цитоплазма эндотелиоцитов содержала большое количество вакуолей, а сами клетки эндотелия в большинстве случаев имели неправильную форму.
Увеличивалось количество и размеры участков ателектазов, а также количество капилляров со стазами микротромбами, еще больше нарастал интерстициальный и внутриальвеолярный отек (рис. 1–2).
Таким образом, в ранние сроки моделирования хирургического сепсиса в капиллярах легких отмечается образование агрегатов из эритроцитов. Этот процесс более выражен в венулах, где скорость кровотока значительно снижается в результате прогрессивно развивающейся дилятации, обусловленной, по-видимому, продуктами местного метаболизма. Затем агрегация распространяется и на другие сосуды. Возникающее при этом снижение скорости кровотока, отделение плазмы от эритроцитов, множественное микротромбообразование, явления стаза в венулах, капиллярах и синусоидах приводят к развитию тканевой гипоксии во многих органах. При моделировании хирургического сепсиса в ранние сроки наблюдается большое число капилляров, заполненных одной плазмой, причем в одних капиллярах движение плазмы прекращено, в то время как в других перфузия плазмы через капилляры продолжается.
В динамике развития патологического процесса микроциркуляторные нарушения еще более нарастают, что проявляется в распространенной агрегации эритроцитов, эмболо- и тромбообразовании. Результаты других исследований объясняют это явление сепарацией плазмы и в раскрытии артериоло-венулярных анастомозов, особенно в легочной ткани. Согласно литературным данным, шунтирующий кровоток, усиливающийся в условиях патологии, когда заблокированы капилляры, свидетельствует о больших приспособительных возможностях организма в целом и сердечно-сосудистой системы в частности [3–5]. Однако полной компенсации не наступает, и развиваются такие нарушения, как стазы, тромбофлебиты, тканевый ацидоз [2].
Выявленные изменения в морфологической структуре тканей легких позволили определить ряд изменений, характерных для генерализованных гнойно-септических процессов. Это в свою очередь подтверждает, что данные изменения в легочной ткани являются последствием развития некротического фасциита с его септическим осложнением.
Заключение
Ранние сроки развития сепсиса (1-е–3-и сутки) характеризовались проявлениями изменений в легочной ткани в виде сосудистой реакции, в большинстве случаев носящие функциональный и компенсаторный характер. Во втором периоде экспериментального моделирования хирургического сепсиса на фоне некротического фасциита (7-е сутки) изменения в структуре легочной ткани выходили за рамки сосудистой реакции и характеризовались появлением, а в последующем и нарастанием числа необтурационных микроателектазов, которые приобретали диссеминированный характер.
Третий период (14-е сутки) характеризовался прогрессированием гнойно-некротического процесса в мягких тканях, развитием хирургического сепсиса и острого респираторного дистресс-синдрома, который сопровождался появлением богатой белком и нитями фибрина жидкости в просвете альвеол, а также слущиванием альвео-цитов. Стенки альвеол приобретали необратимый морфоструктурный характер изменений и сопровождались образованием гиалиновых мембран, способные, как известно, нарушать диффузию кислорода. Разрушались межальвеолярные перегородки, местами развивался фиброз и облитерация альвеол, появлялись очаги абсцедирования. Эти изменения носили необратимый характер.
Л И Т Е Р А Т У Р А
1. Адроге Г.Дж., Тобин М.Дж. Дыхательная недостаточность. Пер. с англ. – М., 2008.– 511 с.
2. Багдатьев В.Е., Гологорский В.А., Гельфанд Б.Р. // Вестн. интенс. терапии. – 2006. – №4.– С.9–14.
3. Кассиль В.Л., Золотокрылина Е.С. Острый респираторный дистресс-синдром. – М., 2008. – 224 с.
4. Раппопорт Я.Л., Горчакова А.И., Рабинович В.Е. // Эксперим. хирургия и анестезиология. – 1990. – №5. – С.87–90.
5. Ashbaugh D.G., Bigelow D.B., Petty T.L., Levine B.E. // Lancet. – 1967.– Vol.2.– P.319–323.
Медицинские новости. – 2018. – №11. – С. 74-76.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.