Внимание! Статья адресована врачам-специалистам
GuliyevaN.T., AbdulkerimovaF.D., PoluhovaSh.M., MagerramovaS.G., AkhundovR.A.
Azerbaijan Medical University, Baku
Morphofunctional features of the liver in the background
of reproduced toxic hepatitis. Сorrection of pathology by a new phytohepatoprotector
Резюме. В экспериментальных условиях воспроизведена модифицированная модель токсического гепатита тетрахлорметаном. Модель характеризовалась следующими изменениями: цитолизом значительной части гепатоцитов, повреждением клеток Купфера, разрушением их наружной мембраны, уплотнением ядра клеток, приводящим к дистрофии печени. На фоне поражения гепатобилиарной системы произведена коррекция новым фитогепатопротектором, который приводит к уменьшению проявлений токсических, цитолитических и холестатических эффектов тетрахлорметана. Наблюдается улучшение морфофункциональных свойств гепатобилиарной системы, пораженной цитолитическим ядом.
Ключевые слова: токсический гепатит, биохимические и морфофункциональные изменения, новый фитогепатопротектор.
Медицинские новости. – 2019. – №3. – С. 64–67.
Summary. Under experimental conditions, a modified model of acute and chronic hepatitis carbon tetrachloride was reproduced. The model was characterized by the following changes: cytolysis of a significant part of hepatocytes, damage to Kupffer cells, destruction of their outer membrane, compaction of the nucleus of cells, leading to liver degeneration. Against the background of the lesions of the hepatobiliary system, correction made by new phytohepatoprotector, which led to a decrease in the manifestations of toxic, cytolytic and cholestatic effects of carbon tetrachloride. Marked indicates an improvement in the morphofunctional properties of the hepatobiliary system, affected by cytolytic poison.
Keywords: toxic hepatitis, biochemical and morphofunctional changes, new phytohepatoprotector.
Meditsinskie novosti. – 2019. – N3. – P. 64–67.
Патология печени занимает ведущее место среди болезней органов пищеварения. Одной из наиболее распространенных причин данных заболеваний являются воздействия гепатотоксических агентов [7, 10]. К ним относятся многие лекарственные препараты, токсины, алкоголь, вещества, загрязняющие окружающую среду, и другие. В этом контексте основными функциями печени являются: детоксикация, образование желчи, участие в углеводном, липидном и белковом обмене, выработка протромбина, участие в процессе свертывания крови, синтез гормонов, ферментов, депонирование витаминов и другие [4].
Цель исследования – создать модифицированную модель поражения печени тетрахлорметаном, подтверждение патологии органа посредством биохимических и гистоморфологических исследований, коррекция нарушенной функции печени на фоне воспроизведенной модели гепатита оригинальным фитогепатопротектором «Азгепафлор» [3, 5].
Материалы и методы
Эксперименты проведены посерийно на 50 белых крысах обоего пола массой 180–220 г. После суточной пищевой депривации крысам с помощью специального зонда в пищевод вводили тетрахлорметан (СС14) в вазелиновом масле в соотношении 1:1 (доза – 0,064 мл на 100 г веса животного). Для острых опытов разовую дозу тетрахлорметана вводили дробно в течение двух дней (2-дневная модель), для хронических – вещество также вводили дробно в течение 5 и 15 дней.
Фитокомплекс «Азгепафлор», состоящий из нескольких растений, произрастающих в Азербайджане, использовали в виде густого экстракта, который разводили в концентрации 1 мл экстракта на 25 мл дистиллированной воды, затем вводили крысам (190– 210 г) перорально через зонд по 1 мл ежедневно в одно и то же время суток по утрам [1].
Все эксперименты проведены в сопоставлении с известным гепатопротектором растительного происхождения со схожим составом, а именно с «Гепа-силимартом» (Hepa silimart) в соответствующей дозе.
Были изучены следующие биохимические показатели крови: количество общего билирубина, аланинаминотрансаминазы (ALТ), аспартатаминотрансаминазы (AST), ?-глутаминотрансферазы (?-ГТ), активность щелочной фосфатазы (ЩФ), а также продукты перекисного окисления липидов (ПОЛ) (количество диеновых конъюгатов (ДК) и малонового диальдегида (МДА)). Ферменты анализировали методом ИФА на приборе Bioscreen MS-2000 (USA). МДА и ДК определяли методом Гаврилова В.П. и др., каталазу – методом Королюк М.А. [6].
Для подтверждения модели патологии печени биоптат органа подвергали гистоморфологическому анализу. Методика заключается в следующем. Срезы ткани печени крыс размером 5–7 см фиксировали в 10% растворе формалина не менее чем 5–6 суток. Затем исходный материал помещали в 20% раствор формалина на 1 сутки, промывали проточной водой еще 1 сутки. По истечении фиксации материалов на микротоме производили срезы препаратов печени, которые были изучены под микроскопом марки MAKRO (Italia). Фиксированный материал для обезвоживания и подготовки к заливке чистым парафином помещали в спиртовой раствор в возрастающей крепости: 70% – 86% – 96% – 100% по 6–12 часов в каждой концентрации. Затем материал переносили в смесь хлороформа и 100% раствора спирта на 10 часов, отдельно в хлороформе выдерживали еще 10 часов. Смесь хлороформа и парафина при +37 °С помещали в термостат на 12 часов. Для изготовления блоков заливку чистым парафином производили в бумажные коробки, из которых в дальнейшем изготавливали парафиновые блоки. Нарезку производили на микротоме МС-2.
Для окраски срезов использовали гемотоксилин, препараты держали в красителе в течение 4–6 мин, пока не получали устойчивую окраску, затем промывали дистиллированной водой. Полученные препараты фотографировали. Анализ полученных результатов оценивали микроскопированием материала [9].
Все исследования проведены в соответствии с этическими требованиями к работе с экспериментальными животными (Закон о защите животных от жесткого обращения).
Результаты и обсуждение
На фоне гистологически подтвержденной патологии под действием тетра-хлорметана уже через 2 суток наблюдался цитолиз значительной части гепатоцитов, повреждались клетки Купфера, ядра клеток уплотнялись, начался воспалительный процесс и дистрофия клеток печени (рис. 1).
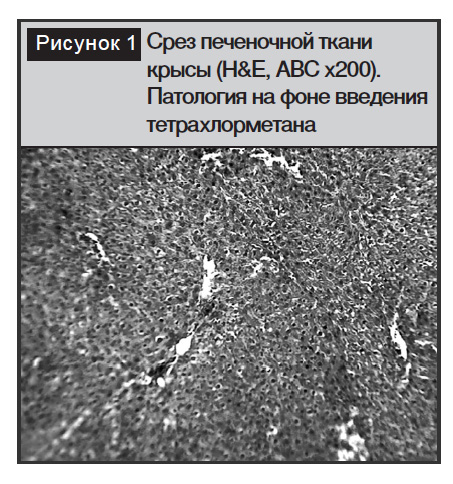
Биохимические изменения в этих же условиях выражались в увеличении активности АЛТ и АСТ в 1,6 и 2,9 раза соответственно. Повышение активности ?-ГТ в 5,8 раза, являющимся главным маркером гепатита, и ЩФ на 3,6% может свидетельствовать о массивном некрозе гепатоцитов, возникающих под действием тетрахлорметана. На 5-е сутки эксперимента активность ферментов АЛТ, АСТ, ЩФ и ?-ГТ продолжало нарастать. Через 15 дней эксперимента уровни АЛТ, АСТ, ЩФ и ?-ГТ достоверно возрастали по сравнению с интактной группой. Концентрация МДА и ДК у животных 2-й группы повысилась в 1,3 раза, а содержание ДК увеличилось на 2,9%. Таким образом, по мере продолжительности гепатита наблюдается накопление токсических продуктов ПОЛ (табл. 1).
Таблица 1. Определение биохимических показателей и продуктов ПОЛ в крови опытных крыс на фоне создания хронической тетрахлорметановой модели гепатита (15 дней) M±m, n=6
|
Номер животного
|
Общий билирубин, мкмоль/л
|
АСТ,
U/l
|
АЛТ,
U/l
|
?-ГТ, U/l
|
ЩФ, U/l
|
МДА, mkmol/l
|
ДК, D232/ml
|
Каталаза, mkat/l
|
|
1
|
23,4
|
264,7
|
149,8
|
21,2
|
640,2
|
5,61
|
1,92
|
7,2
|
|
2
|
21,6
|
275,6
|
203,9
|
28,3
|
666,7
|
5,80
|
1,88
|
6,9
|
|
3
|
20,5
|
360,7
|
205,6
|
18,0
|
641,0
|
5,72
|
1,90
|
7,0
|
|
4
|
25,3
|
361,5
|
201,5
|
26,4
|
653,2
|
4,99
|
1,87
|
7,4
|
|
5
|
22,1
|
270,9
|
132,3
|
19,4
|
639,4
|
5,69
|
1,85
|
6,8
|
|
6
|
21,9
|
363,1
|
136,6
|
17,4
|
655,3
|
5,42
|
1,91
|
7,1
|
|
∑
|
22,5**
|
316,1**
|
171,7**
|
21,8**
|
649,3**
|
5,53**
|
1,9**
|
7,1
|
Примечание: * – достоверность различий показателей p<0,01, ** – p<0,001.
В условиях воспроизведенного гепатита применение препарата «Азгепа-флор» (на 30-й день коррекции) выявило значимую защиту гепатобилиарной системы, которая выражалась существенным улучшением биохимических показателей: количество ALT, AST и щелочной фосфатазы уменьшились и составило соответственно 14 u/l (24 u/l при интоксикации), 30 u/l против 41 u/l и 88 u/l и против 91 u/l (р<0,01). Активность щелочной фосфатазы также имела тенденцию к уменьшению на 49,3% (р<0,01) относительно группы крыс с патологией печени. Количество ДК и МДА соответственно уменьшились на 82% и 75% (р<0,01), а активность каталазы, наоборот, увеличилась на 5% (табл. 2).
Таблица 2. Изменения биохимических показателей и продуктов ПОЛ в крови
у опытных животных на фоне 30-дневного лечения гепатита препаратом «Азгепафлор» M±m, n=5
|
Номер животного
|
Общий билирубин, мкмоль/л
|
АСТ, U/l
|
АЛТ, U/l
|
?-ГТ, U/l
|
ЩФ, U/l
|
МДА, mkmol/l
|
ДК, D232/ml
|
Каталаза, mkat/l
|
|
1
|
5,8
|
121,2
|
237,7
|
5,2
|
396,4
|
2,69
|
0,74
|
11,3
|
|
2
|
5,6
|
122,3
|
270,4
|
5,25
|
398,4
|
2,65
|
0,65
|
11,4
|
|
3
|
5,5
|
123,5
|
270,8
|
5,18
|
391,2
|
2,60
|
0,63
|
10,3
|
|
4
|
5,1
|
101,6
|
242,4
|
5,26
|
407,6
|
2,51
|
0,61
|
12,5
|
|
5
|
5,2
|
112,4
|
271,5
|
5,87
|
410,5
|
2,58
|
0,63
|
11,2
|
|
∑
|
5,44**
|
116,2**
|
271,8**
|
5,35*
|
400,8**
|
2,61 н/д
|
0,65 н/д
|
11,31*
|
Примечание: * – достоверность различий показателей p<0,05, ** – p<0,01, *** – p<0,001.
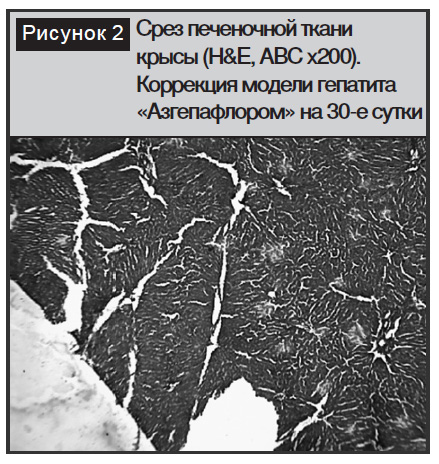
Одновременно с улучшением биохимических показателей применение «Азгепафлора» способствовало восстановлению нормальной морфологической структуры печени. В частности, улучшалась микроциркуляция паренхимы, отмечалось отсутствие псевдо-келоидных образований, структура долек была в значительной мере восстановлена и хорошо выражена, печеночные балки имели характерное радиальное расположение. Отмеченные изменения указывали на наличие у испытуемого средства гепатопротективных свойств (рис. 2).
В условиях экспериментального моделирования токсического гепатита тетрахлорметаном получена устойчивая форма поражения гепатобилиарной системы крыс, которая характеризовалась гибелью части гепатоцитов. Картина поражения выражалась разрушением наружной мембраны гепатоцитов, в результате которого ядро клеток уплотнялось, начинался воспалительный процесс и дистрофия клеток печени. Некроз и гибель клеток преимущественно происходили в центральной зоне печеночной доли [8]. В результате разрушения стенок кровеносных сосудов кровь смешивалась с желчью, у подопытных животных возникал острый токсический гепатит. В целом введение тетрахлорметана вызывало выраженные временные и дозозависимые нарушения структурно-функцио-нального состояния печени, триггерным механизмом которых является усиление процессов липопероксидации [9].
В этих же условиях биохимический анализ активности изученных ферментов, таких как АЛТ, AST, ?-ГТ и щелочная фосфатаза у крыс, при моделировании гепатита в разные сроки наблюдения позволил наблюдать увеличение активности трансаминаз в сыворотке крови [6]. Данное положение свидетельствует о повреждении мембран гепатоцитов, повышении их проницаемости, а также гибели клеток печени, вызванных введением тетрахлорметана, которое сопровождается выходом внутриклеточных субстанций в кровь и лимфу [8]. О преимущественном повреждении внешних мембран клеток печени тетрахлорметаном свидетельствует, в частности, увеличение активности цитоплазматического энзима – АЛТ. Увеличение активности ?-ГТ и ЩФ также может свидетельствовать о массивном некрозе гепатоцитов, возникающих под воздействием тетрахлорметана. На фоне высокой активности ?-ГТ происходит повышение концентрации общего билирубина, что дает основание утверждать, что у подопытных крыс имеет место не только формирование цитолиза, но и развитие синдрома внутриклеточного холестаза [3, 11].
Известно, что важным фактором в патогенезе поражений органов наравне с изменениями, возникающими в структуре и функции органов, является усиление интенсивности ПОЛ с образованием токсических метаболитов, которое приводит к повреждению биологических мембран. Известно также, что диеновые конъюгаты и маловый диальдегид являются метаболитами, обладающими цитотоксичностью [4]. В наших экспериментах тетрахлорметан, активно блокируя сульфгидрильные группы микросомальных ферментов и ферментов окислительного фосфорилирования в митохондриях, также способствует усилению ПОЛ, нарушению энергетического обмена в клетках, повреждению биомембран и цитолизу клеток. Одновременно с усилением ПОЛ происходит снижение активности фермента АОС-каталазы [2].
На фоне моделированного гепатита тетрахлометаном применение «Азгепафлора» вызывало положительную динамику изменений в активности изученных ферментов. Так, несмотря на уменьшение гиперферментемии, обнаруженной в группах животных, получавших «Гепа-силимарт» (аналог «Азгепафлора»), активность АЛТ, АСТ и ?-ГТ наиболее достоверно уменьшалась при введении подопытным крысам нового фитокомплекса. Испытуемый «Азгепа-флор» более существенно нормализовал биохимические показатели крови животных, при этом в организме наблюдалась стабилизация аминотрансфераз, значительное снижение уровня билирубина по сравнению с действием аналога. Схожее гепатозащитное действие при экспериментальном токсическом гепатите оказывал экстракт лабазника вязолистного [6].
Наряду с позитивными биохимическими изменениями в крови применение «Азгепафлора» нормализовало картину белковой и жировой дистрофии гепатоцитов крыс. Так, гистологические исследования у грызунов выявили, что введение «Азгепафлора» в течение 30 дней вызывает репарацию ткани печени. В центральной зоне печеночных долей патология частично остается, однако в значительной части гепатоцитов целостность мембраны постепенно восстанавливается. По истечении 40 дней коррекции «Азгепафлором» в печени крыс нарастает число нормальных гепатоцитов, усиливается репаративный процесс, наблюдаются крупноядерные гепатоциты, что свидетельствует об активации репаративного процесса. Одновременно нормализируется дилятация центральных вен, отечность постепенно исчезает, что отражается в более равномерном просвете сосудов, восстанавливается целостность почечных балок [9]. Увеличение числа нормальных гепатоцитов в препортальной зоне указывает на повышение числа двуядерных гепатоцитов. Вместе с тем, в некоторых зонах отмечается некроз некоторых гепатоцитов, но при наличии регенерирующих гепатоцитов он менее выражен из-за уменьшения воспалительно-клеточной инфильтрации портальных трактов [12].
При сопоставлении эффектов «Азгепафлора» и его аналога «Гепа-силимарта» выявлено, что новая фитокомпозиция обладает более существенным гепатопротекторным свойством, способствуя уменьшению проявлений токсических, цитолитических и холестатических эффектов тетрахлорметана у экспериментальных крыс.
Исходя из полученных результатов по применению «Азгепафлора», его действие направлено на восстановление гомеостаза в печени, поврежденного тетрахлорметаном, повышению ее устойчивости к действию токсического фактора, нормализацию функциональной активности и стимуляцию в печени процессов регенерации.
Перечисленные эффекты под действием «Азгепафлора» указывают на значимую защиту гепатобилиарной системы крыс на фоне токсического гепатита, вызванного тетрахлометаном [2].
Итак, комплексное средство «Азгепафлор», содержащее большое количество флавоноидов, обладает существенным гепатотропным и детоксикационным действием, сопоставимым с эффектом классического гепатотропного препарата «Гепа-силимарт». Учитывая значимое повреждение печеночной ткани тетрахлорметаном, даже незначительная защита гепатоцитов «Азгепафлором» может считаться патогенетически приемлемой из-за частичного восстановления количества и функции гепатоцитов. Это подтверждается тем, что препараты растительного происхождения, обладающие мембраностабилизирующим действием, защищают клетки от проникновения в них токсинов. Средства этой группы стимулируют также систему антиоксидантной защиты, способствуя повышению содержания восстановленного глутатиона в печени, а также синтез белка, что ускоряет регенерацию поврежденных гепатоцитов [6].
Подводя итоги по данным исследования фитокомплекса на основе флоры Азербайджана, следует указать на уникальные фитофармакологические свойства, присущие именно растениям данного региона, так как в них содержится наибольшее количество полезных веществ, в частности флавоноидов [5].
Таким образом,комплексное средство «Азгепафлор», содержащее большое количество флавоноидов, обладает существенным гепатотропным и детоксикационным действием, сопоставимо с эффектом классического гепатотропного препарата «Гепа-силимарт». Отмеченное указывает на улучшение функции пораженной тетрахлорметаном гепатобилиарной системы, на нивелирование эффекта при поражении тетрахлорметаном функции печени и частичное восстановление пораженной гепатобилиарной системы.
Заключение
В условиях воссозданного токсического гепатита тетрахлорметаном получена устойчивая форма поражения гепатобилиарной системы крыс, которая характеризовалась гибелью части гепатоцитов и некрозом. Применение фитогепатопротектора «Азгепафлор», содержащего большое количество флавоноидов, способствовало существенному детоксикационному действию, уменьшению проявлений токсических, цитолитических и холестатических эффектов тетрахлорметана. Учитывая значимое повреждение печеночной ткани тетрахлорметаном, даже незначительное восстановление гепатоцитов «Азгепа-флором» может считаться патогенетически приемлемым эффектом.
Л И Т Е Р А Т У Р А
1. Ахундов Р.А., Ханум Айдын г., Саилова Д.Д., Абдулкеримова Ф.Д., Гулиева С.Т. Азгепафлор – новая фтокомпозиция с гепатопротекторным эффектом: М-лы Межд. научной конф. «Здоровье нации – XXI век». – Черногория, 2018. – С.22–26.
2. Ахундов Р.А., Джафарова Р.Э., Эйвазов Т.А., Раджабова Ф.О. Фитопрепараты в лечении патологии печени // Журнал Сагламлыг. – 2016. – №2. – С.7–12.
3. Ахундов Р.А., Абдулкеримова Ф.Д., Ханум Айдын г., Гулиева С.Т. Коррекция воспроизведенного острого гепатита оригинальным фитокомплексом на основе флоры Азербайджана: М-лы V съезда Фармакологов России «Научные основы поиска и создания новых лекарств». – Москва–Ярославль, 2018. – С.19–20.
4. Бугаева А. // Здоровье Украины. – 2008. – №19/1. – С.26–30.
5. Гараев Э.А., Мовсумов И.С. // Химия растительного сырья (Барнаул). – 2010. – №3. – С.5–8.
6. Есауленко Е.Е. Гепатопротекторные свойства и метаболические эффекты липофильных продуктов растительного происхождения в эксперименте: Автореф. дис. … д-ра биол. наук. – Краснодар, 2014. – 45 с.
7. Косарев В.В., Бабанов С.А. // Consilium medicum, Гастроэнтерология. – 2009. – №2. – С.29–30.
8. Медведева С.Ю., Сенцов В.Г., Гетте И.Ф., Данилова И.Г. // Клиническая токсикология. – 2014. – Т.15, №3. – С.366–380.
9. Халилов В.Г., Гулиева С.В., Эйвазов Т.А., Джафарова Г.К., Бабаева М.Х. Цитогенетическая токсичность и антиоксидантное свойство различных растительных экстрактов: Сбор. матер. научной конф., посв. 70-летнему юбилею проф. Г.Ш. Гарае-ва. – Баку, 2017. – С.229–236.
10. Arrak J.K. // Kufa. Journal for Veterinary Medical Sciences. – 2013. – Vol.4, N1. – P.57–68.
11. Eidi A. [et al.] // EXCLI Journal. – 2012. – Vol.1. – P.748–759.
12. Wanga Y. // Food Chemistry. – 2011. – Vol.125. – Р.673–678.
Медицинские новости. – 2019. – №3. – С. 64-67.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.