Внимание! Статья адресована врачам-специалистам
Zhyltsov I.V.1, Kundzer A.V.2
1Vitebsk State Medical University, Belarus
2Belarusian Medical Academy of Post-Graduate Education, Minsk
Personalized treatment of ankylosing spondylitis
Резюме. Анкилозирующий спондилит (АС) – заболевание из группы спондилоартритов, характеризующееся воспалительным поражением позвоночника и крестцово-подвздошных суставов, ассоциированное с носительством HLA-B27 антигена. Приоритетной задачей терапии анкилозирующего спондилита, как хронического иммуновоспалительного заболевания, является достижение ремиссии. Основные цели терапии – уменьшение степени выраженности основных симптомов болезни (боль и скованность), улучшение функционального состояния пациентов, предотвращение прогрессирования заболевания, купирование системных проявлений. В статье изложены современные рекомендации по лечению анкилозирующего спондилита с учетом персонализированного подхода к пациентам.
Ключевые слова: анкилозирующий спондилит, лечение.
Медицинские новости. – 2019. – №5. – С. 59–63.
Summary. Ankylosing spondylitis is a disease of spondylarthritis, characterized by inflammation of the spine and the sacroiliac joints, associated with the HLA-B27 antigen. The priority task of treating ankylosing spondylitis, as a chronic immune-inflammatory disease, is to achieve remission. The main objectives of therapy are: reducing the severity of the main symptoms of the disease (pain and stiffness); improving the functional status of patients; preventing disease progression; relief of systemic manifestations. The article presents modern recommendations for the treatment of ankylosing spondylitis, taking into account a personalized approach to patients.
Keywords: ankylosing spondylitis, treatment.
Meditsinskie novosti. – 2019. – N5. – P. 59–63.
Анкилозирующий спондилит (АС)и ранний дорентгенологический спондилоартрит относятся к аксиальным спондилоартритам (аксСпА) и являются по сути последствиями одного и того же патологического процесса в аксиальном (осевом) скелете.
Лечение АС в настоящее время осуществляется в соответствии с международными рекомендациями ASAS и EULAR 2016 года для лечения аксСпА [28], основанными на принципах доказательной медицины, а также действующими протоколами оказания медицинской помощи пациентам с ревматическими заболеваниями в Республике Беларусь.
Важнейшими принципами терапии АС являются:
1) понимание того, что АС представляет собой серьезное заболевание с гетерогенными клиническими проявлениями, требующее мультидисциплинарного подхода, координируемого ревматологом;
2) первичная цель терапии пациента АС – максимально улучшить качество жизни посредством контроля симптомов заболевания и воспаления, профилактики прогрессирования структурныхизменений, нормализации функции пациентов и их социальной активности;
3) максимально эффективной в лечении АС является комбинация нефармакологического и фармакологического типов лечения;
4) лечение АС нацелено на максимальную заботу о пациенте и должно обсуждаться с пациентом;
5) АС имеет высокую индивидуальную медицинскую и социальную стоимость, каждая из которых должна учитываться ревматологом при курировании пациентов.
РекомендацииASAS и EULAR 2016 года для лечения аксСпА [28]
1. Лечение пациента с аксСпА должно быть индивидуализировано в соответствии с текущими симптомами заболевания (аксиальные, периферические, экстраартикулярные) и характеристиками пациента, включая коморбидность и психосоциальные факторы.
2. Мониторинг состояния пациента должен включать сообщаемые пациентом сведения, клинические данные, лабораторные результаты и визуализацию. Частота мониторинга определяется индивидуально и зависит от симптомов, тяжести заболевания и назначенного лечения.
3. Лечение должно быть ориентировано на достижение цели. Конечной целью является неактивное состояние заболевания, то есть ремиссия.
4. Пациент должен быть образован, привержен регулярным физическим упражнениям, прекратить курить.
5. Пациент, страдающий от боли и скованности, должен применять нестероидные противовоспалительные препараты (НПВС) в качестве терапии первой линии в максимальных дозах, принимая во внимание их пользу и риск. Регулярное лечение достоверно лучше лечения по требованию.
6. Анальгетики (парацетамол и опиоиды) могут использоваться для полного купирования боли при неэффективности предшествующей терапии, ее плохой переносимости и наличия противопоказаний.
7. Могут использоваться инъекции глюкокортикоидов (ГК) в места воспаления. Пациенты с изолированным аксиальным процессом не должны получать системную терапию ГК.
8. Пациенты с изолированным аксиальным процессом не должны получать терапию синтетическими базисными противовоспалительными средствами (БПВС). При периферическом артрите показан сульфасалазин.
9. Биологические БПВП должны получать пациенты с персистирующей высокой активностью заболевания, несмотря на стандартную терапию, текущая практика предусматривает старт с блокаторов ФНО-?.
10. Если терапия блокаторами ФНО-? оказалась неэффективной, показано переключение на другой блокатор ФНО-? или на ингибиторы ИЛ-17.
11. У достигших ремиссии пациентов можно обсуждать деэскалацию терапии ГИБС.
12. Тотальная артропластика тазобедренных суставов необходима пациентам с рефрактерным болевым синдромом или невозможностью передвижения (инвалидностью) и рентгенологическими признаками структурных повреждений независимо от возраста; корректирующие остеотомии позвоночника требуются пациентам с тяжелыми инвалидизирующими деформациями.
13. Если в течение болезни происходят значимые изменения, вызванные другими причинами, кроме воспаления, такие как переломы позвоночника, они должны приниматься во внимание и оцениваться с применением визуализации.
Обсудим некоторые частные вопросы лечения пациентов с АС. Препаратами первой линии для лечения заболевания являются НПВС. Все эксперты единодушны во мнении, что использование НПВС должно осуществляться в полной противовоспалительной дозе. Однако нельзя забывать и о побочных эффектах НПВС, особенно в случае хронического использования. Данные клинических исследований свидетельствует о том, что продолжительное использование НПВС у пациентов с высокими уровнями С-реактивного белка приводит к снижению прогрессии структурных повреждений в позвоночнике по сравнению с пациентами, принимающими НПВС по требованию [11]. Аналогичные результаты были получены в когортном исследовании, сравнивающем использование высоких и низких доз НПВС [21]. В ходе дискуссии экспертам удалось прийти к мнению, что протективный эффект НПВС может быть специфичным для определенных препаратов [25]. Было принято решение основать выбор тактики непрерывного использования НПВС при симптомах, имеющихся у пациента, а не на возможном защитном эффекте в отношении структурной прогрессии. Если симптомы повторяются после прекращения приема или снижения дозы препарата, следует рекомендовать непрерывное использование.
Важной задачей ревматолога является сделать правильный выбор препарата из данной группы с учетом оценки его эффективности и безопасности в каждом отдельном случае. У пациентов с АС оправдано чередование нескольких НПВС с целью выбора наиболее эффективного лекарственного средства для конкретного больного. Распределение приема НПВС в течение суток должно осуществляться с учетом индивидуального ритма болей у каждого пациента. Особое место в ряду НПВС, применяемых для лечения пациентов с АС, занимает ацеклофенак. По химической структуре данный препарат, так же, как и диклофенак, является производным фенилуксусной кислоты. Отличия ацеклофенака и диклофенака заключается в наличии у первого 2,6-дихлорфениламиновой группы, что значительно изменяет фармакологические свойства препарата [24]. Ацеклофенак ингибирует экспрессию как ЦОГ-1, так и ЦОГ-2, преимущественный эффект показан в отношении ЦОГ-2, что позволяет препарату приблизиться к селективным ингибиторам ЦОГ-2 [24]. Фармакокинетическими особенностями ацеклофенака являются высокая биодоступность (после перорального приема всасывается практически полностью), короткий латентный период (15–30 минут), быстрое достижение максимальной концентрации (через 1–3 часа после приема), высокое содержание в синовиальной жидкости (более 50% от плазменной концентрации), быстрая элиминация из организма (период полувыведения – 3–6 часов). Основной метаболизм ацеклофенака происходит в печени, главный метаболит – 4-гидроксиацеклофенак – обладает выраженной анальгетической и противовоспалительной активностью. Фармакокинетика препарата у пожилых пациентов существенно не отличается от таковой у пациентов более молодых возрастных категорий даже при многократном дозировании.
Эффективность ацеклофенака убедительно доказана в клинических исследованиях [4, 7, 12]. Об относительной безопасности ацеклофенака для органов желудочно-кишечного тракта свидетельствуют результаты многочисленных исследований [10, 15, 16, 18, 20]. При оценке кардиоваскулярной безопасности ацеклофенака не выявлено различий между данным препаратом и другими НПВС по частоте развития или дестабилизации артериальной гипертензии, сердечной недостаточности, а также кардиоваскулярных катастроф [8, 18]. Суммируя сказанное, можно заключить, что ацеклофенак (лекарственное средство «Аэртал») оказывает анальгетическое и противовоспалительное действие. Препарат отличается хорошим профилем безопасности (как желудочно-кишечной, так и кардиоваскулярной), а также хорошо переносится, достоверно реже (на 20–50%) вызывая диспепсию.
Лечение ГК проводится локально при энтезитах и артритах. Несколько изменились рекомендации относительно системного применения ГК. Появились новые сведения о том, что краткосрочная терапия высокими дозами ГК (50 мг в день) может иметь среднюю эффективность при аксСпА [6]. Однако эксперты единодушно решили, что пациентов с АС не следует длительно лечить системными ГК независимо от дозы.
БПВП назначаются только пациентам с периферическим суставным синдромом. Препаратом выбора является сульфасалазин в стандартной дозе 2 грамма в сутки, при неэффективности можно увеличить дозу до 3 граммов в сутки.
Предыдущая редакция рекомендаций из биологических БПВП включала лишь блокаторы ФНО-?, поскольку другие классы не были доступны. Биологические агенты (чаще всего подразумеваются блокаторы ФНО-?) должны быть назначены пациентам с персистирующей высокой активностью, несмотря на традиционную терапию. Традиционная терапия должна включать нефармакологическое лечение и НПВС. Также у пациентов с периферическим суставным синдромом традиционная терапия может включать синтетические базисные средства (сульфасалазин) и локальные ГК. Эта рекомендация подчеркивает, что терапию следует назначить, но окончательное решение принимается путем взвешивания возможных рисков и предполагаемых эффектов.
На рисунке 1 суммированы требования, которые должны выполняться при назначении биологических БПВП.
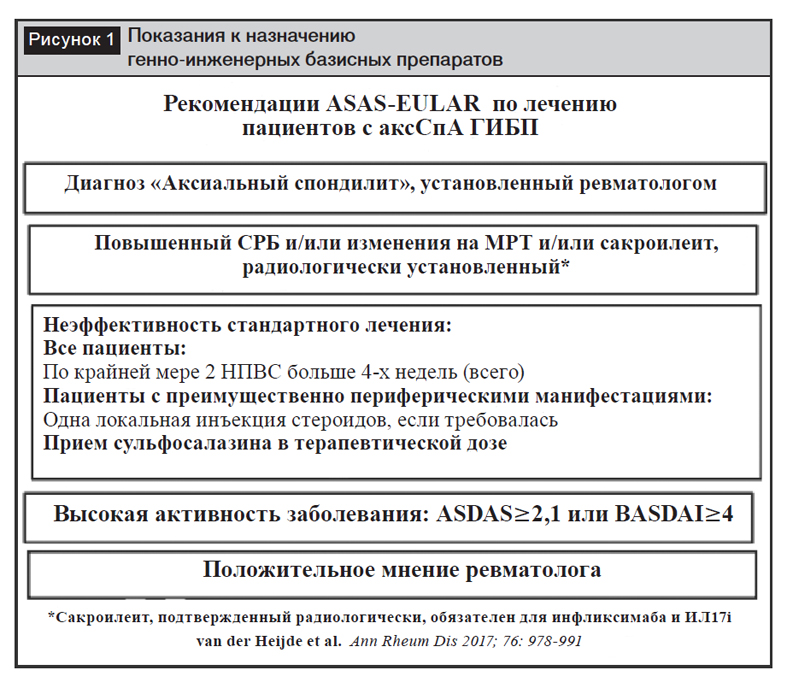
Первое требование – это диагноз, подтвержденный ревматологом. Только формального выполнения классификационных критериев недостаточно. Квалифицированные ревматологи верифицируют диагноз на основании оценки всех клинических, лабораторных и визуализационных признаков и после исключения других потенциально похожих заболеваний.
Следующее требование – выяснить, имеют ли пациенты такие критерии, как повышенный С-реактивный белок, наличие сакроилеита на МРТ или рентгенограмме. Разъяснения требований выглядят следующим образом. Терапия блокаторами ФНО-? во многих странах одобрена для пациентов с АС без дальнейших ограничений и у пациентов с дорентгенологическим аксСпА только если у них повышен С-реактивный белок и/или есть признаки воспаления на МРТ. Это значит, что, если пациент с аксСпА имеет рентгенологический сакроилеит или этот пациент имеет либо повышенный С-реактивный белок, либо воспаление на МРТ, он формально подходит под требования для назначения блокаторов ФНО-?? указанные в инструкции соответствующего препарата. Эксперты считают, что пациенты с АС, у которых повышен уровень С-реактивного белка, имели наибольшую вероятность успешного лечения [1].
Рентгенологический сакроилеит не является предиктором ответа: исследование [13] показывает, что пациенты с рентгенологическим сакроилеитом и без него имели одинаковую частоту ответа. Но есть одна оговорка – в данный момент использование ингибиторов ИЛ-17 и инфликсимаба у пациентов с дорентгенологическим аксСпА не одобрено, следовательно, для назначения данных препаратов обязательно наличие рентгенологического сакроилеита.
Следующий шаг относится к неудачам стандартного лечения, описанного выше. Рекомендуется эскалация дозы сульфасалазина через 3 месяца от начала терапии до 3 граммов в сутки при хорошей переносимости. Так как нет данных, доказывающих эффективность метотрексата, но есть доказательства эффективности сульфасалазина, изменения были сделаны в пользу последнего [2].
Далее требуется определить активность заболевания. Исторически сложилось, что активным заболевание считалось при уровне BASDAI 4 и более. Но ASDAS оценивает активность более достоверно, чем BASDAI, и активным следует считать АС при ASDAS 2,1 и более [19].
BASDAI полностью зависит от мнения пациента, ASDAS же учитывает мнение пациента и уровень С-реактивного белка. BASDAI с оценкой активности врачом коррелирует слабо, в то время как ASDASкоррелирует намного сильнее как с оценкой активности пациентом, так и врачом [29]. Другой аргумент состоит в том, что повышенный ASDAS может приводить к образованию синдесмофитов, однако это не доказано в отношении одного BASDAI, он работает только вместе с С-реактивным белком [22]. Более того, высокий BASDAI, вероятно, является предиктором прекращения терапии блокаторами ФНО-?, а высокий ASDAS – предиктором ее продолжения.
Часто имеется ассоциация между BASDAI≥4 и ASDAS≥2,1, но в несогласующихся случаях высокий ASDAS обладает большей предсказуемостью хорошего ответа, чем повышенный BASDAI [30].
В дополнение к уровню высокой активности заболевания ревматологи должны быть убеждены, что у определенных пациентов существует благоприятный профиль – польза/риск перед началом терапии блокаторами ФНО-?. Чтобы оценить этот профиль интуитивно, ревматолог должен принимать во внимание позитивные факторы, такие как воспаление на МРТ, но также следует взвешивать потенциальные противопоказания, такие как риск возникновения нежелательных явлений или осложнений. В конечном счете должно быть принято совместно решение врача и пациента относительно старта терапии ГИБС.
Вторая часть рекомендаций касается текущей практики, в которой принято стартовать с блокаторов ФНО-?. В алфавитном (англоязычном) порядке зарегистрированы по показанию аксСпА: адалимумаб, цертолизумаба пегол, этанерцепт, голимумаб, инфликсимаб. Блокаторы ФНО-? уже давно на рынке, имеется огромный опыт их применения, они используются в клинической практике у большого числа пациентов, результаты подтверждают хороший долговременный профиль безопасности.
Новшества рекомендаций касаются новых биологических БПВП с иным механизмом действия – блокаторов ИЛ-17. В настоящее время рекомендуется только один препарат из этой группы – секукинумаб. В настоящее время доступны результаты клинического исследования по блокаторам ИЛ-17 при рентгенологически доказанном аксСпА.
Таким образом, опыт применения блокаторов ФНО-?, включая эффективность, безопасность и разнообразие показаний, значительно больше, чем в отношении ингибиторов ИЛ-17. Поэтому эксперты решили рекомендовать блокаторы ФНО-??в качестве первой линии терапии. Использование блокаторов ИЛ-17 должно быть ограничено у пациентов с активным воспалительным заболеванием кишечника (ВЗК), так как секукинумаб по сравнению с плацебо не показал эффективности при болезни Крона и имел больше нежелательных явлений, чем положительных [9]. Секукинумаб обладает доказанной эффективностью при псориазе [14]. Кроме блокаторов ИЛ-17 на рынке нет других биологических БПВП, не относящихся к блокаторам ФНО-?. Блокаторы ИЛ-6 не показали эффективности в клинических исследованиях при аксСпА.
Для лечения АС одобрены несколько блокаторов ФНО-?. Их эффективность в отношении купирования симптомов со стороны опорно-двигательного аппарата представляется сопоставимой, хотя прямых исследований «голова к голове» (headtohead) не выполнялось. Но существуют некоторые различия по эффективности в отношении купирования экстраартикулярных проявлений заболевания.
Моноклональные антитела (инфликсимаб, адалимумаб, цертолизумаб, голимумаб) эффективны для лечения ВЗК и для профилактики обострений увеита (нет данных по голимумабу), в то время как этанерцепт показал противоречивые результаты в отношении увеита и отсутствие эффективности при ВЗК [23, 27]. Этанерцепт, вероятно, менее эффективен для кожного псориаза, чем другие блокаторы ФНО-?, но исследований «голова к голове» не проведено [5]. При выборе лечения должна учитываться стоимость биологических БПВП. Выбор сильно зависит от локальной ситуации, общие рекомендации дать сложно, но аналогична ожидаемая безопасность и эффективность в отношении облегчения симптомов поражения со стороны опорно-двигательной системы. Во многих случаях именно стоимость терапии определяет выбор препарата.
На рисунке 2 представлена информация о том, когда и как следует оценивать эффективность биологических БПВП, в каких обстоятельствах рекомендуется продолжение терапии. Ответ оценивается с помощью ASDAS и BASDAI. Для ASDAS клиническая значимость улучшения ≥1,1, для BASDAI – ≥2. Эта оценка должна подкрепляться положительным мнением ревматолога, который принимает во внимание все потенциальные риски и пользу перед тем, как вместе с пациентом решить, будет ли продолжена терапия биологическими БПВП.
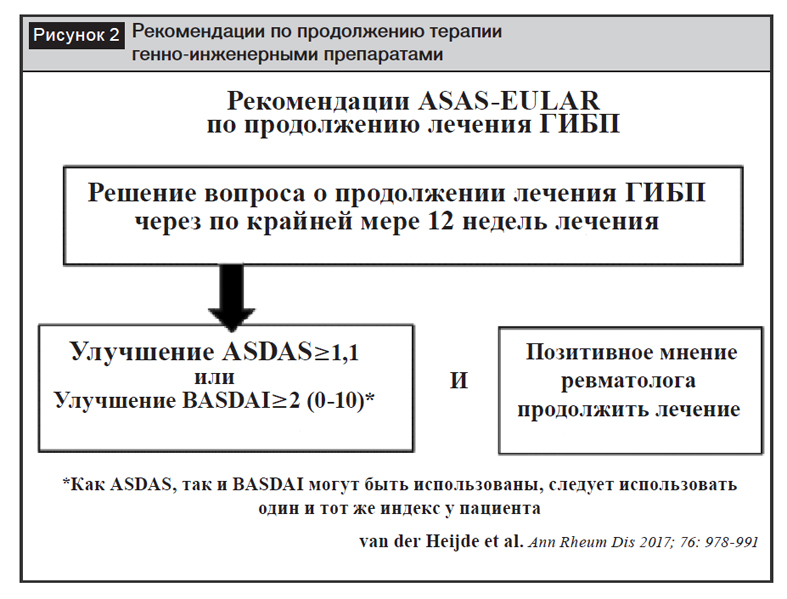
После открытия второго класса биологических БПВП появился потенциальный выбор терапии при неэффективности блокаторов ФНО-?. Результаты исследований свидетельствуют о том, что второй блокатор ФНО-? после неуспешного лечения первым может быть эффективным, хотя уровень эффективности может быть ниже, чем для первого препарата [17]. Доказана эффективность блокаторов ИЛ-17 у пациентов с неудачными результатами лечения блокаторами ФНО-?, но эффективность блокаторов ИЛ-17 в данном случае ниже, чем у наивных пациентов [26]. У первичных неответчиков на блокаторы ФНО-? более рационально переключение на класс биологических БПВП с другим механизмом действия, а именно на блокаторы ИЛ-17. Однако перед тем, как это сделать, важно повторно оценить, были ли показания для старта терапии блокаторами ФНО-?. Скорее отсутствие эффекта от терапии может быть связано с неправильным диагнозом, в этом случае клиническая эффективность не может быть ожидаемой. Эксперты выразили мнение, что истинная первичная неэффективность встречается довольно редко при правильном диагнозе и активном аксСпА. Токсичность блокаторов ФНО-? также может быть причиной прямого переключения на блокаторы ИЛ-17. Данные, подтверждающие эффективность блокаторов ФНО-? при неэффективности блокаторов ИЛ-17, отсутствуют. Следовательно, отсутствует доказательная база, но эксперты предполагают, что назначение блокаторов ФНО-? в такой ситуации имеет смысл. Важно формально исследовать эффективность блокаторов ФНО-? после неудачной терапии блокаторами ИЛ-17.
С 2009 года стали появляться данные, доказывающие успешную деэскалацию (сужение) терапии и возможную эффективность после рестарта [3]. Однако полная отмена терапии биологическими БПВП приводит к частым рецидивам [3]. Учитывая высокую стоимость длительной терапии биологическими БПВП, рационально снижение терапии при достижении ремиссии. Хотя ремиссия еще не определена, следует достигать неактивного заболевания по ASDAS. Пока непонятно, что такое продолжительная ремиссия, но эксперты предлагают определить ее как минимум в течение 6 месяцев, возможно дольше.
В настоящее время проводится сбор данных о предикторах обострения при сужении терапии. Например, важно знать, может ли остаточное воспаление на МРТ быть предиктором обострения после деэскалации терапии и есть ли связь между продолжительностью ремиссии и вероятностью обострения.
В принципе деэскалация может быть достигнута редукцией дозы или увеличением интервалов между введениями. Пока непонятно, какой способ лучше. Предполагается, что увеличение промежутков между введениями имеет более правильный клинический подход. Хотя снижение дозы может теоретически дойти до 0 (прекращение терапии), рекомендуется это делать очень медленно и быть уверенным в достаточном промежутке времени после предшествующего шага снижения. Обсуждение решения является основным моментом в деэскалации. Пациент должен быть согласен на снижение дозы для экономии финансов, но принцип наилучшей помощи должен быть приоритетным. Излишне говорить о том, что для качества жизни пациента принцип наилучшей помощи и обсужденного решения должен перевешивать стоимость терапии, хотя последнее, несомненно, является важным.
ЛИТЕРАТУ РА
1. Arends S. [et al] // Arthritis Res. Ther. – 2011. – Vol.13. – P.94.
2. Braun J. [et al.] // Ann. Rheum. Dis. – 2006. – Vol.65. – P.316–320.
3. Cantini F. [et al.] // Biologics. – 2013. – Vol.7. – P.1–6.
4. Dooley M., Spencer C., Dunn C. // Drugs. – 2001. – Vol.61 (9). – P.1351–1378.
5. Gosses L. [et al.] // Ann. Rheum. Dis. – 2016. – Vol.75. – P.499–510.
6. Haibel H. [et al.] // Ann. Rheum. Dis. – 2014. – Vol.73. – P.243–246.
7. Haskinsson E.C., Irani M., Murray F.F. // Eur. J. Rheumatol. Inflam. – 2000. – Vol.17. – P.1–7.
8. Helin-Salmivaara A. [et al.] // Eur. Heart J. – 2006. – Vol.14. – P.1657–1663.
9. Hueber W. [et al.] // Gut. – 2012. – Vol.61. – P.1693–1700.
10. Kornasoff D. [et al.] // Rheumatol. Int. – 1996. – Vol.15. – P.225–230.
11. Kroon F. [et al.] // Ann. Rheum. Dis. – 2012. – Vol.71. – P.1623–1629.
12. Lanas A. [et al.] // Gut. – 2006. – Vol.55, N2. – P.1731–1738.
13. Landewe R. [et al.] // Ann. Rhum. Dis. – 2014. – Vol.73. – P.39–47.
14. Langley R.G. [et al.] // N. Engl. J. Med. – 2014. – Vol.371. – P.326–338.
15. Laporte J. [et al.] // Drug. Saf. – 2004. – Vol.27. – P.411–420.
16. Lemmel E.M. [et al.] // Curr. Med. Res. Opin. – 2002. – Vol.18 (3). – P.146–153.
17. Lie E. [et al.] // Ann. Rheum. Dis. – 2011. – Vol.70. – P.157–163.
18. Liorente M. [et al.] // Rev. Esp. Enferm. Dig. – 2002. – Vol.94 (10). – P.13–18.
19. Machado P. [et al.] // Ann. Rheum. Dis. – 2011. – Vol.70. – P.47–53.
20. Perez Busquier M. [et al.] // Clin. Rheumatol. – 1997. – Vol.16. – P.154–159.
21. Poddubnyy D. [et al.] // Ann. Rheum. Dis. – 2012. – Vol.71. – P.1616–1622.
22. Ramiro S. [et al.] // Ann. Rheum. Dis. – 2014. – Vol.73. – P.1455–1461.
23. Sanborn W.J. [et al.] // Gut. – 2007. – Vol.56. – P.1232–1239.
24. Saraf S. // In latest Reviews. – 2006. – Vol.4. – P.119–124.
25. Sieper J. [et al.] // Ann. Rheum. Dis. – 2016. – Vol.75. – P.1438–1443.
26. Sieper J. [et al.] // Ann. Rheum. Dis. – 2016. – Vol.23. – P.124–131.
27. van Denderen J.C. [et al.] // J. Rheumatol. – 2014. – Vol.41. – P.1843–1848.
28. van der Heijde D. [et al.] // Ann. Rheum. Dis. – 2017. – Vol.76. – P.978–991.
29. van der Heijde D. [et al.] // Ann. Rheum. Dis. – 2009. – Vol.68. – P.1811–1818.
30. Vastesaeger N. [et al.] // Rheumatol. Clin. – 2014. – Vol.10. – P.204–209.
Медицинские новости. – 2019. – №5. – С. 59-63.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.