Внимание! Статья адресована врачам-специалистам
Israilov R.I., Urinov F.A., Urinova G.G.
Tashkent Medical Academy, Uzbekistan
Angioarchitectonic of the spleen of newborns with congenital sepsis
Резюме. Патоморфологические изменения развивались в мелких артериях и артериолах, локализованных в различных морфофункциональных зонах белой пульпы селезенки. В зависимости от формы врожденного сепсиса в центральных артериолах отмечались патоморфологические изменения по-разному. При раннем врожденном сепсисе структурные элементы стенки артериол были недоразвиты и находились в состоянии незрелости и морфофункциональной недостаточности. При позднем врожденном сепсисе в стенке центральных артериол и вокруг них патоморфологические изменения, характеризующие пролиферативный процесс, возникали на фоне состоятельного развития всех структурных элементов.
Ключевые слова: селезенка, ангиоархитектоника, новорожденный, врожденный сепсис, септическая селезенка.
Медицинские новости. – 2019. – №6. – С. 74–77.
Summary. Pathological changes developed in small arteries and arterioles, localized in different morphofunctional areas of the white pulp of the spleen. Depending on the form of congenital sepsis in the central arterioles, pathomorphological changes noted in different ways. In early congenital sepsis, the structural elements of the arteriole wall were underdeveloped and were in a state of immaturity and morphofunctional insufficiency. In late congenital sepsis in the wall of central arterioles and around them, the pathomorphological changes that characterize the proliferative process developed against the background of the sustainable development of all structural elements.
Keywords: spleen, angioarchitecture, newborn, congenital sepsis, septic spleen.
Meditsinskie novosti. – 2019. – N6. – P. 74–77.
У новорожденных встречается врожденный сепсис («врожденная септицемия» по МКБ-10), отличительной чертой которого является отсутствие у ребенка первичного септического очага, в связи с тем, что очаг находится в плаценте или в организме матери [3, 8]. При врожденном сепсисе у новорожденного нет обязательных критериев диагноза – сочетания первичного инфекционного очага и симптомов синдрома системной воспалительной реакции (ССВР). В настоящее время принято выделять ранний и поздний врожденный сепсис. Под ранним врожденным принято понимать сепсис, клинически манифестировавший в первые 72 ч жизни ребенка, а поздним врожденным сепсисом – в 4–5-е сутки жизни новорожденного.
Морфологические проявления сепсиса у новорожденных имеют комплексный характер и включают в себя ряд патологических процессов: пролиферацию тканевых мононуклеарных фагоцитов; гиперплазию синусовых макрофагов селезенки и лимфатических узлов; гиперплазию кроветворной ткани печени и селезенки; акцидентальную инволюцию тимуса. В доступной нам литературе не обнаружены данные о патоморфологических изменениях селезенки, в частности ее ангиоархитектоники при врожденном сепсисе новорожденных.
Цель исследования – изучить особенности морфологических изменений в сосудистой системе селезенки умерших новорожденных от врожденного сепсиса.
Материалы и методы
Были проанализированы клинические и патоморфологические данные 36 новорожденных, умерших от раннего (17 случаев) и позднего (19 случаев) врожденного сепсиса.
В качестве материала исследования использовали селезенку 36 умерших новорожденных от врожденного сепсиса, изъятую во время аутопсийного исследования в детском отделении Андижанского патологоанатомического бюро и Республиканского патологоанатомического центра.
Во время вскрытия была выделена селезенка, после чего взвешена и определен весовой коэффициент селезенки (ВКС). Для гистологического исследования кусочки селезенки фиксировали в 4% растворе формалина на фосфатном буфере и после обезвоживания в спиртах заливали в парафин. Срезы толщиной 5–8 мкм окрашивали гематоксилином и эозином.
Результаты и обсуждение
Результаты микроскопического исследования показали, что при врожденном сепсисе соединительнотканная капсула разрыхлена за счет отека межклеточного вещества. В первичных крупных трабекулах, начинающихся на медиальной поверхности селезенки в воротах, отмечается нарушение локализации и ориентации друг с другом артерий, вен и лимфатических сосудов. В норме в середине сосудистого пучка расположена артерия, вокруг нее идут крупные вены и лимфатические сосуды и на периферии нервы, а при сепсисе отмечалась дислокализация их. Стенка артерии утолщена за счет гофрированности эндотелия, разрыхления базальной мембраны и гладкомышечного слоя. Причем, как эндотелиальные, так и гладкомышечные клетки в состоянии гипертрофии и гиперхромазии. Тонкостенные венозные и лимфатические сосуды, находящиеся вокруг артерии, расширены и полнокровны. Тонкая стенка вен, состоящая из эндотелия и базальной мембраны, – в состоянии мукоидного и фибриноидного набухания, местами инфильтрированая лимфоидными и макрофагальными клетками (рис. 1). Лимфатические сосуды в просвете содержат вакуолизированную лимфатическую жидкость. Адвентиция данного сосудистого пучка подвергнута сильному отеку, разрыхлению волокнистых структур и деструкции соединительнотканных клеток.
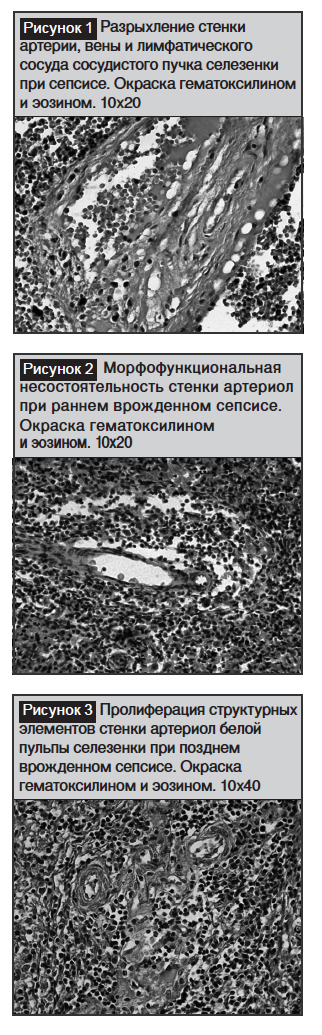
Со стороны трабекулярных артерий особых патологические изменения не обнаружены; как только они выходят из трабекул, в паренхиме белой пульпы селезенки становятся центральными артериолами, вокруг которых должна формироваться периартериальная Т-лимфоцитарная зона. В зависимости от формы врожденного сепсиса в центральных артериолах отмечались патоморфологические изменения по-разному. При раннем врожденном сепсисе структурные элементы стенки артериол недоразвиты и находятся в состоянии незрелости и морфофункциональной недостаточности. Эндотелиальные клетки тонкие, прерывистые, под ними базальная мембрана также рыхлая, гомогенная и не имеет волокнистых структур. Мышечный слой стенки артериол также незрелый и представлен двумя или тремя слоями гладкомышечных клеток, которые расположены неравномерно и прерывисто. Периартериальная ретикулярная строма также развита недостаточно и проявляется в виде единичных ретикулярных волокон и ретикулярных клеток (рис. 2). Такое морфологическое строение центральных артериол соответствует врожденной гипоплазии и является фоновым состоянием для развития сепсиса.
При позднем врожденном сепсисе в стенке центральных артериол и вокруг них патоморфологические изменения, характеризующие пролиферативный процесс, развивались на фоне состоятельного развития всех структурных элементов. В частности, отмечалось повышение пролиферативной активности как эндотелиальных, так и гладкомышечных клеток стенки артериол в виде гипертрофии, гиперплазии клеток, гиперхромазии ядерных структур. В составе эндотелиального слоя, между гладкомышечными клетками и в толще адвентиции обнаруживается инфильтрация лимфоидными и макрофагальными клетками, за счет чего стенка артериол утолщена, просвет сужен. При этом отмечалось вокруг центральных артериол состоятельное развитие ретикулярной стромы в виде мелкопетлистой сети ретикулярных волокон с гипертрофированными ретикулярными клетками. Находящиеся в толще ретикулярной сети лимфоциты также в состоянии пролиферативной активности с гипертрофированными ядрами (рис. 3). Можно сделать заключение, что при позднем врожденном сепсисе, на фоне морфофункционального состояния центральных артериол, развивается пролиферативное воспаление, приведшее к сужению и нарушению проницаемости стенок артериол для миграции лимфоидных клеток.
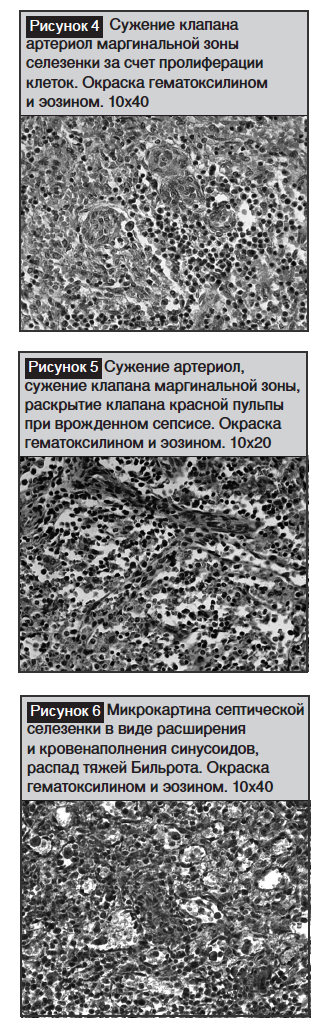
Известно, что центральная артерия покидает белую пульпу, ее лимфатическое влагалище постепенно истончается, и она делится на прямые кисточковые артериолы с наружным диаметром приблизительно 24 мкм. В области своих концов некоторые из кисточковых артериол окружаются толстой оболочкой из ретикулярных клеток, макрофагов и лимфоидных клеток, где просвет артериол сужен, и этот участок является входным клапаном в синусоиды красной пульпы или в посткапиллярные венулы маргинальной зоны (рис. 4). Такое строение артериол с наличием клапанов имеет огромное функциональное значение для нормального кровообращения как в белой, так и красной пульпе селезенки. Патоморфологические изменения, происходящие в области клапанного аппарата ангиоархитектоники между белой и красной пульпой при развитии сепсиса, по-видимому, приводит к нарушению гемодинамики в виде венозного застоя красной пульпы, отмеченного как «септическая селезенка». Выявлено, что при позднем врожденном сепсисе стенка центральной артериолы утолщена за счет пролиферации структурных элементов стенки со сужением просвета. На рисунке видны две ветви с конечными клапанами, одна ветка проникает в красную пульпу, где клапанный аппарат разрушен, артериола непосредственно открывается в синусоид, другая ветка проникает в маргинальную зону, где клапан сужен за счет пролиферации и сокращения клеточных элементов (рис. 5). Септическая селезенка микроскопически выглядит так, что синусоиды красной пульпы значительно расширены, заполнены кровью, стенки их местами разрушены, тяжи Бильрота истончены, пропитаны кровью (рис. 6).
Установлено, что синусы красной пульпы селезенки имеют входные и выходные сфинктеры. Величина просвета синусов и толщина их стенки зависит от фазы синусной функции. По-видимому, при сепсисе фаза заполнения и фильтрации синусов красной пульпы селезенки удлиняется, при этом сфинктер на венозном конце синусоида надолго закрывается, в то время как сфинктер на артериальном конце остается открытым, что обеспечивает поступление крови в синусоид с увеличением диаметра в 2–3 раза. За счет кровенаполнения синусоидов рефлекторно закрывается сфинктер на артериальном конце синусои-да и кровь в синусоидах остается долго и подвергается распаду, что проявляется увеличением кровянистой пульпы селезенки при состоянии септической селезенки. При нарастании венозного застоя синусоидов красной пульпы селезенки межсинусоидальные тяжи Бильрота истончаются, ретикулярная строма их разрыхляется, увеличивается количество эритроцитов, тромбоцитов, гранулоцитов и макрофагов, а также отмечается рост количества гемоглобиногенных пигментов.
Заключение
Установлено, что при врожденном сепсисе патоморфологические изменения развиваются в мелких артериях и артериолах, локализованных в различных морфофункциональных зонах белой пульпы селезенки.
В зависимости от формы врожденного сепсиса в центральных артериолах отмечались патоморфологические изменения по-разному. При раннем врожденном сепсисе структурные элементы стенки артериол недоразвиты и находятся в состоянии незрелости и морфофункциональной недостаточности.
При позднем врожденном сепсисе в стенке центральных артериол и вокруг них наблюдаются патоморфологические изменения, характеризующие пролиферативный процесс, которые возникали на фоне состоятельного развития всех структурных элементов. В частности, отмечалось повышение пролиферативной активности как эндотелиальных, так и гладкомышечных клеток стенки артериол в виде гипертрофии, гиперплазии клеток, гиперхромазии ядерных структур.
Патоморфологические изменения, происходящие в области клапанного аппарата ангиоархитектоники между белой и красной пульпой при развитии сепсиса, видимо, приводит к нарушению гемодинамики в виде венозного застоя красной пульпы, отмеченного как «септическая селезенка».
При сепсисе фаза заполнения и фильтрации синусов красной пульпы селезенки удлиняется, при этом сфинктер на венозном конце синусоида надолго закрывается, в то время как сфинктер на артериальном конце остается открытым, что обеспечивает поступление крови в синусоид, где она остается и подвергается распаду, что проявляется увеличением кровянистой пульпы селезенки при состоянии септической селезенки.
Л И Т Е Р А Т У Р А
1. Краюшкин А.И., Александрова Л.И., Стаценко Г.В. // Морфология. – 2000. – Т.118, №5. – С.36–39.
2. Самсыгина Г.А. Гнойно-воспалительные заболевания новорожденных (этиология, факторы риска, клинико-иммунологические критерии диагноза и тактика лечения): Дис. ... д-ра мед. наук. – М., 1986.
3. Шабалов Н.П., Цвелев Ю.В., Кира Е.Ф. и др. Основы перинатологии. – М., 2002. – С.513–531.
4. Хлыстова З.С. // Арх. патологии. – 1991. – №11. – С.11–17.
5. Kloss D.P., Vogel M. Pathologie der Perinatal periode. – Stuttgart, 1994. – 382 p.
6. Turk I.L. Angioarchytektoniks spleen in chronic infections diseases. Thymus, thymic hormones and T-lymphocytes. – London, 1980. – P.125–134.
7. Etiology and clinical signs of serious infections in young infants in developing countries: a WHO collaborative study // Pediatr. Infect. Dis. J. – 1999. – Vol.18, N10. – S8–S16.
Медицинские новости. – 2019. – №2. – С. 74-77.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.