Внимание! Статья адресована врачам-специалистам
Azizova D.M., Sabirova R.A., Kulmanova M.U.
Tashkent Medical Academy, Uzbekistan
Effects of biomaise on aterogenic plasma index during
the development of experimental hyperholesterynemia
Резюме. Проведена комплексная оценка действия БАДа «Биомайс» на биохимические изменения в динамике развития экспериментального атеросклероза. Выявлена зависимость изменения содержания аполипопротеина B (АпоВ) от содержания холестерина в липопротеидах при развитии экспериментальной гиперхолестеринемии. Полученные результаты позволяют рекомендовать применение БАДа «Биомайс» в практику здравоохранения для комплексного лечения атеросклероза.
Ключевые слова: гиперхолестеринемия, коэффициент атерогенности, атерогенный индекс плазмы.
Медицинские новости. – 2019. – №7. – С. 78–80.
Summary. A comprehensive assessment of the action of the Biomais feed on biochemical changes in the dynamics of the development of experimental atherosclerosis has been carried out. The dependence of the change in the content of ApoB on the cholesterol content of lipoproteins during the development of experimental hypercholesterolemia was revealed. The results obtained allow us to recommend Biomais to the practice of health care for the complex treatment of atherosclerosis.
Keywords: hypercholesterolemia, atherogenic coefficient, atherogenic plasma index.
Meditsinskie novosti. – 2019. – N7. – P. 78–80.
Любое нарушение одного из этапов липидного обмена приводит к тем или иным расстройствам в обмене липидов, которые проявляются качественными и количественными изменениями липидного состава крови [1]. В свою очередь, нарушения липидного обмена (дислипидемии) играют ведущую роль в патогенезе атеросклероза.
Традиционно для оценки липидного обмена используются такие показатели, как содержание общего холестерина, холестерина липопротеинов высокой плотности (ХС-ЛПВП) и триглицеридов (ТГ). Однако в последнее время исследования установили, что эти показатели липидного обмена не в полной мере отражают проатерогенный потенциал крови. Также известно, что применение липидснижающей терапии у лиц с сердечно-сосудистой патологией в ряде случаев не приводит к положительным результатам. По данным литературы, определение содержания общего холестерина и триглицеридов способствует выявлению только 50% нарушений липидного обмена [4, 5]. В связи с этим для повышения клинической информативности показателей липидного обмена исследователями было предложено использовать различные расчетные индексы. Большинство из известных индексов отражают соотношение основных классов липидов в плазме крови, другие являются суррогатными маркерами размера частиц липопротеинов [2, 3].
Цель исследования – изучить значение атерогенного индекса плазмы в развитии экспериментальной гиперхолестеринемии, а также возможность коррекции индекса при применении БАДа «Биомайс».
Материалы и методы
Эксперименты проведены на 30 кроликах-самцах породы Шиншилла массой 2400–3000 г, разделенных (в зависимости от цели исследования и способа лечения) на 5 групп (в каждой по 12 кроликов): 1-я (контрольная) – интактные кролики; 2-я – животные с моделированной экспериментальной гиперхолестеринемией; 3-я – с коррекцией экспериментальной гиперхолестеринемии статином; 4-я – с коррекцией экспериментальной гиперхолестеринемии БАДом «Биомайс»; 5-я – с коррекцией экспериментальной гиперхолестеринемии статином и БАДом «Биомайс».
Модель экспериментальной гиперхолестеринемии воспроизводили внутрижелудочным ежедневным введением холестерина по 0,2 г на кг массы тела в течение 2 месяцев. Лечение экспериментальных животных проводили после 2-месячного введения холестерина. В качестве статина использовали ультрокс (Nobel Farm), который вводили по 0,6 мг/кг в течение 30 суток, «Биомайс» – 142 мг/кг в течение 30 суток. «Биомайс» является проростком пшеницы (представлен фирмой ORION-SKORPION). Исследованные препараты вводились внутрижелудочно при помощи атравматического зонда ежедневно в утренние и вечерние часы в объеме, рассчитанном исходя из массы тела кролика. Объектом исследования служила сыворотка крови.
Все исследования проводились с соблюдением принципов, изложенных в Конвенции по защите позвоночных животных, используемых для экспериментальных и других целей (Страсбург, 1986).
В динамике развития экспериментального атеросклероза и его коррекции (каждые 20 дней) в сыворотке крови показатели липидного обмена (общий холестерин, ХС-ЛПОНП, ХС-ЛПНП, ХС-ЛПВП, ТГ) определены при помощи биола-тестов (Humen, Германия), рассчитан коэффициент атерогенности (КА). Также рассчитывали соотношение АпоВ/АпоА-I, атерогенный индекс плазмы (AIP), при этом атерогенный индекс плазмы вычисляли как логарифм отношения ТГ и ХС-ЛПВП (log[ТГ/ХС-ЛПВП]) (Dobiasova, Frohlich, 2001).
Результаты и обсуждение
Скармливание кроликам пищи с ХС в течение нескольких недель проводит к атероматозу интимы аорты. В природе кролики не потребляют ХС в пище, однако действие ХС на интиму является биологически единым. Синтез ХС регулируется на клеточном уровне; в филогенезе ХС реализует биологическую реакцию краткосрочной адаптации. Если внешняя среда становится неблагоприятной, каждая клетка запускает синтез ХС, конденсируя его в клеточной мембране между молекулами ФХ, делает мембрану менее проницаемой и отгораживается от внешней среды. Когда применяют статины, они ингибируют синтез эндогенного холестерина, вследствие чего среда нормализуется, клетки избавляются от ХС, выводя его во внешнюю среду.
Важно отметить, что в группах, получавших ультрокс и биомайс, показатели снижения общего ХС были сходными. Во всех опытных группах в сравнении с контрольной через 30 дней после сочетанного введения препаратов наблюдалась достоверная разница в снижении уровня общего ХС на 7,75–26,8% (p<0,05), что указывает на хорошую холестеринснижающую эффективность сочетания ультрокса с БАДом «Биомайс». Таким образом, сила воздействия такого сочетания превышает таковую при применении данных препаратов в отдельности.
Установлено повышение содержания ТГ у животных ГХС в 1,92 раза (p<0,05) по сравнению с контрольной группой. Лечение ультроксом достоверных изменений в содержании ТГ не вызвало. Под влиянием БАДа «Биомайс» содержание ТГ увеличено на 32,4%, а при сочетанном введении ультрокса и биомайса – наоборот, снижено на 8,9% по сравнению с группой, не подвергавшейся лечению. Приведенные результаты указывают на то, что ультрокс и биомайс, а также их сочетание особого влияния на содержание ТГ не оказывают. Полученные данные совпадают с результатами Ю.И. Рагино и соавт. (2010), изучавших действие симвагли на модели гиперхолестеринемии у кроликов [2].
Уровень ХС-ЛПВП у животных с ГХС снизился на 33,4% по сравнению с контрольной группой. В группах, получавших ультрокс и биомайс, ХС-ЛПВП повысился на 66,3% и 42,1% соответственно по сравнению животными с ГХС. Необходимо отметить, что сочетанное введение препаратов более выражено повышает содержание ХС-ЛПВП на 30,3% и 95,5% соответственно по сравнению с показателем в контрольной группе и группе без лечения.
Экспериментальная ГХС приводит к достоверному увеличению ХС-ЛПОНП в 2,4 раза (p<0,05). Если лечение ультроксом снижает содержание на 15,5%, то биомайс достоверных изменений не вызывает в содержании ХС-ЛПОНП по сравнению с группой без лечения. В то же время сочетанное введение ультрокса и биомайса снижает содержание ХС-ЛПОНП на 26,7% по сравнению с группой, не подвергавшейся лечению. Результаты работы подтверждают данные [4, 5] об эффекте фармакологического синергизма при комплексировании некоторых фармакологических соединений.
Экспериментальная ГХС характеризуется более выраженным увеличением содержания ХС-ЛПНП по сравнению с контрольной группой (270,3±2,8 при контроле 40,78±0,86 мг/дл, p<0,05). Лечение ультроксом и биомайсом в течение 30 дней приводит к снижению содержанию ХС-ЛПНП в 2,53 и 1,85 раза соответственно по сравнению с показателем в группе без лечения. Необходимо подчеркнуть, что сочетание ультрокса и биомайса оказалось более эффективным по сравнению с введением их в отдельности. Сочетанное введение снизило содержание ХС-ЛПНП в 2,97 раза по сравнению с группой без лечения. Необходимо подчеркнуть, что содержание ХС-ЛПНП в 2,23 раза выше по сравнению с показателем в контрольной группе (p<0,05).
При атеросклерозе важное значение имеет определение коэффициента атерогенности (КА). У контрольной группы этот коэффициент был равен 1,37±0,02. Экспериментальная ГХС вызвала резкое повышение данного коэффициента, то есть он в 11,4 раза стал выше по сравнению с таковым в контрольной группе. Ультрокс и биомайс снизили КА в 4 и 2,5 раза соответственно по сравнению с результатами группы без лечения. В то же время сочетанное введение использованных препаратов привело к снижению данного коэффициента в 5,6 раза по сравнению с показателем в группе без лечения (рисунок).
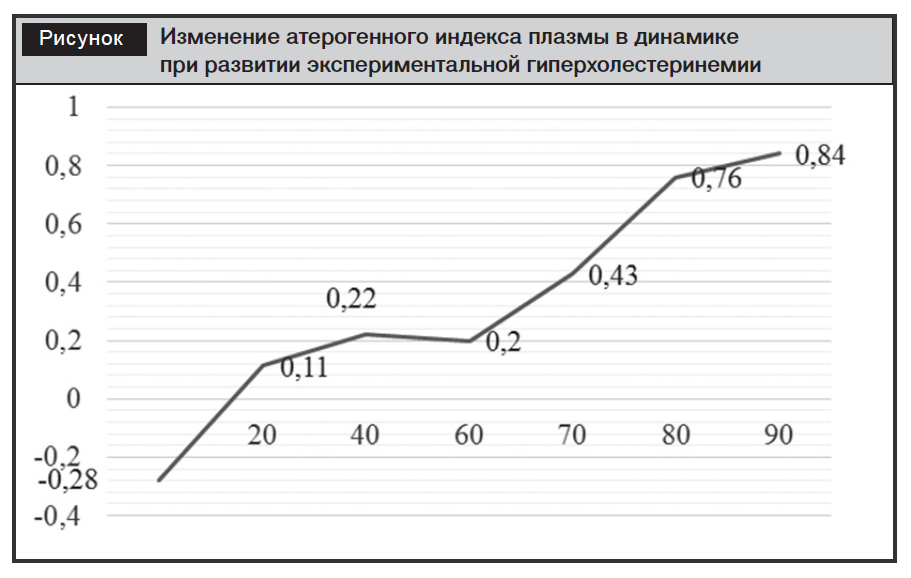
Таким образом, при развитии гиперхолестеринемии насыщенность липопротеинов триглицеридами снижается по сравнению с животными интактной группы. Лечение ультроксом и биомайсом способствует увеличению продукции печенью обогащенных триглицеридами липопротеинов у животных с экспериментальной гиперхолестеринемией.
Создание поликомпонентного биологически активного вещества, обладающего гиполипидемическими свойствами, представляется актуальным не только для потенциального использования при легких формах нарушения липидного обмена, но и в сочетании со статинами с целью снижения дозы последних, соответственно, и их побочных эффектов.
Заключение
При монотерапии статином в дозе 0,5 мг/кг и применении БАДа «Биомайс» содержание ОХС и ЛПНП статистически значимо снижается. Сочетанное применение препаратов в значительной степени снижает содержание ХС-ЛПНП, ЛПОНП и общего холестерина по сравнению с показателями в группе, не подвергавшейся лечению, что показывает их гипохолестеринемическое действие.
Л И Т Е Р А Т У Р А
1. Азизова Д.М., Сабирова Р.А. // Спорт ва тиббиёт журнали. – Ташкент. – 2018. – №4. – С.42–44.
2. Рагино Ю.И., Вавилин В.А., Салахутдинов Н.Ф., Макарова С.И., Стахнева Е.М., Сафронова О.Г. // Атеросклероз. – 2006. – Т.6, №1. – С.5–11.
3. Gutowska I., Baskiewicz M., Machalinski B., Chlubek D., Stachowska E. // Ann. Nutr. Metab. – 2010. – Vol.57, N2. – P.143–149.
4. Provost E.B., Madhloum N., Int Panis L., de Boever P., Nawrot T.S. // PLoS One. – 2015. – Vol.10, N5. – e0127014.
5. Takanashi S., Sakai J., Fujino T., et al. // J. Atheroscler. Thromb. – 2004. – Vol.11, N4. – P.200–208.
Медицинские новости. – 2019. – №7. – С. 78-80.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.