Внимание! Статья адресована врачам-специалистам
Dzenis Yu.L.
Neurosurgical Clinic, Pauls Stradins Clinical University Hospital, Riga, Latvia
A device for stereotaxic evacuation of nontraumatical deep intracerebral haematomas
Резюме. Представлено устройство для стереотаксического удаления глубоких внутримозговых гематом путем их механического раздробления. В основе устройства: канюля, шнек в виде Архимедовой спирали и разряжение (-0,2 атм.).
Ключевые слова: внутримозговая гематома, стереотаксическое удаление, инструментарий, Архимедова спираль.
Медицинские новости. – 2019. – №8. – С. 29–31.
Summary. The device for stereotaxic removal deep intracerebral haematomas by its mechanical crushing is described. The device contains: cannula, Archimedes spiral and vacuum (-0,2 atm.).
Keywords: intracerebral haematoma, stereotaxic evacuation, instrumentation, Archimedes spiral.
Meditsinskie novosti. – 2019. – N8. – P. 29–31.
В руководствах по нетравматическим внутримозговым гематомам (НВМГ) доминирует доктрина минимальной инвазивной нейрохирургии [7, 8, 11, 15]. Создание операционного канала от коры до близлежащих отделов НВМГ вызывает дополнительный отек мозга. Особое клиническое значение это имеет при глубоких (медиальных, смешанных и латеральных) НВМГ, где операционный канал значительно превышает протяженность, а именно 1–2 см [3– 5, 7, 11].
Для исключения прямого доступа и дополнительной травмы при глубоких НВМГ разработаны различные методики (локальный фибринолиз, эндоскопия и пр.) стереотаксически-ориентированного удаления этих кровоизлияний [7,8,11,15].
Одним из вариантов является механическое разрушение свертков НВМГ, что достигается канюлями, имеющими Архимедову спираль в виде шнека, а также канюлями Apollo, имеющими в просвете вибрационный стилет (провод) и обеспечивающими ирригационно-аспирационный процесс [2,6,9,10–20].
В то же время предложенные устройства имели свои недостатки и технические недоработки, что служило основанием для дальнейшего их усовершенствования.
Для стереотаксического удаления глубоких НВМГ нами было создано специальное устройство (рис. 1–4) [1], которое содержало корпус (1) с трубчатым проводником (2). Корпус был снабжен отходящим под углом 30° к оси трубчатого проводника дополнительным отводом (3) и размещенном на нем штуцере. Такое значение угла было определено экспериментально. При увеличении или уменьшении угла появлялись технические трудности проведения катетера через дополнительный отвод, который был расположен в 100–110 мм от торца трубчатого проводника. Эта величина также была установлена экспериментальным образом, исходя из локализации и размеров НВМГ. Штуцер служил как для подсоединения медицинского аспиратора, так и для введения катетера, применяющегося для введения в полость гемостазирующего раствора тромбина-контрикала. Обращенная к трубчатому проводнику часть корпуса (функциональная часть) была выполнена в виде цилиндра меньшего диаметра (5 мм), снабженная дополнительным отводом и штуцером (3). Часть корпуса (1) была выполнена в виде цилиндра большого диаметра с конечным переходом. В цилиндрической части большого диаметра корпуса (1) были расположены подшипники (4) и уплотнители (5), предназначенные для предотвращения просачивания содержимого.
.jpg)
В трубчатом проводнике (1) был расположен шнек (6), снабженный хвостовиком (7), который был предназначен для передачи вращения от электродвигателя (8) к шнеку. Электродвигатель (8) был жестко закреплен в гильзе (9), которая при надевании на корпус (1) фиксировалась зажимным винтом (10). Беспрепятственное вращение хвостовика (7) в корпусе (1) обеспечивалось наличием подшипников (4). Электродвигательпитался от блока управления, которым можно было изменить число оборотов (0÷150 оборотов в мин.). В трубчатом проводнике кроме шнека (6) могли быть функционально задействованы стержневой проводник, катетер, ригидный эндоскоп. В функционировании устройства также предусмотрено следующее: ирригация полости НВМГ раствором тромбина-контрикала; введение в полость фибрин-тромбинового клея; осмотр полости ригидным эндоскопом (диаметр 3 мм).

На начальном этапе к точке цели (ТЦ) устройство доставлялось с помощью модифицированного стереотаксического аппарата Э.И. Канделя (С.В. Войтына, 1990), а далее использовали целецентрированную стереотаксическую систему CRW-FN-159-60-001 (Radionics).

Для торца устройства осуществлялись стереотаксические расчеты координат одной или двух ТЦ. При НВМГ шарообразной формы ТЦ определяли несколько ниже геометрического центра объема, учитывая положение головы больного на операционном столе и гравитационные силы, способствующие скоплению свертков крови в нижних отделах пространства. Если НВМГ занимала удлиненную (элипсоидную) форму и относительно большие размеры, то использовались две ТЦ, которые размещались по продольной оси объема.
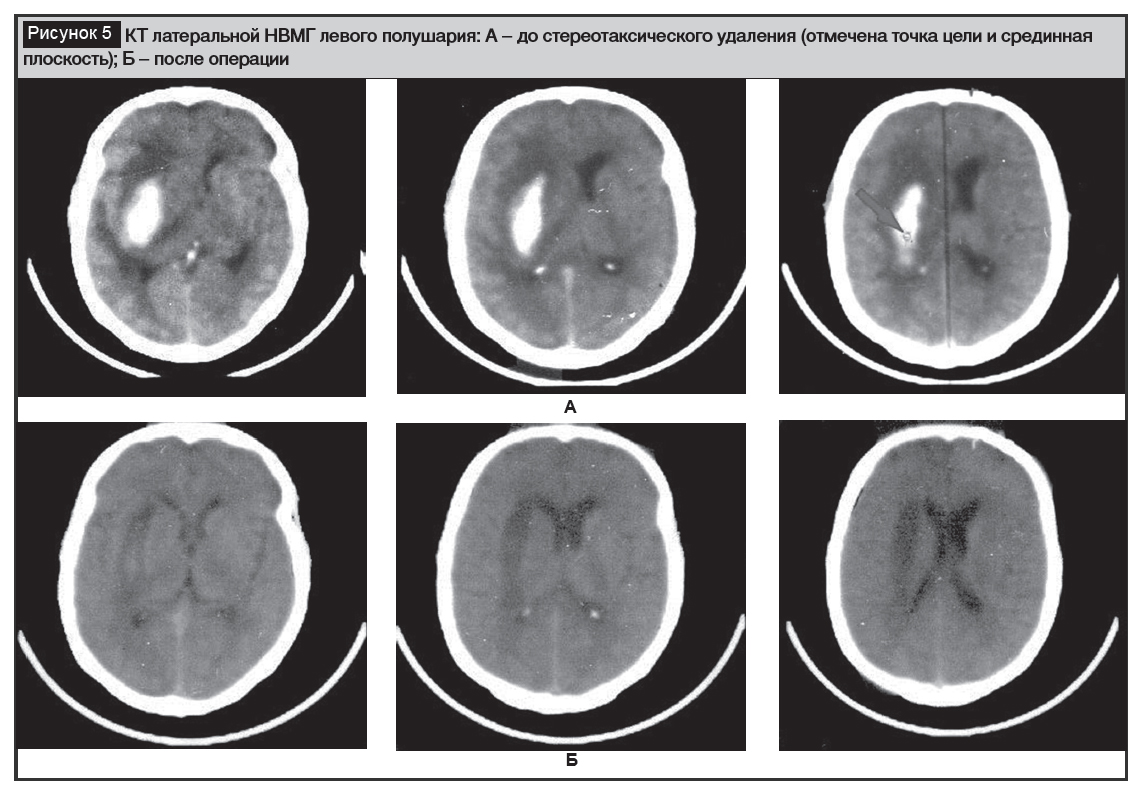
Устройство успешно было применено во многих десятках стереотаксических операций. Средний объем удаления НВМГ – около 70% изначальной величины (пример успешного удаления показан на рисунке 5) при послеоперационной летальности менее 20%.
Основным осложнением при этой методике являются повторные кровоизлияния в полость удаленной НВМГ, частота которых достигает 10%. Особенно актуально это осложнение в острой фазе НВМГ. Для уменьшения частоты этого осложнения использовалось усиление локального (интраполостного) гемостаза раствором тромбина-контрикала или фибринотромбиновым клеем (рис. 4), а также непрямой визуальный контроль ригидным эндоскопом.
Л И Т Е Р А Т У Р А
1. Дзенис Ю.Л., Переседов В.В. Способ лечения кровоизлияний в мозг и устройство для его осуществления. – Патент № 2100965. – 1994.
2. 2-й съезд нейрохирургов Российской Федерации: Тезисы докладов. – Нижний Новгород, 1998. – C.213.
3. Дзенис Ю.Л. // Украинский нейрохирургический журнал. – 2018. – №4. – С.5–16.
4. Крылов В.В., Дашьян В.Г., Буров С.А., Петриков С.С. Хирургия геморрагического инсульта. М., 2012. – 336 с.
5. Очерки ангионеврологии. – М., 2005. – С.222–230.
6. Backlund E.O., von Holst H. // Surg. Neurol. – 1978. – Vol.9. – P.99–101.
7. Broderick J., Connolly S., Feldmann E., et al. // Stroke. – 2007. – Vol.38. – P.2001–2023.
8. Broderick J.P., Adams H.P. Jr., Barsan W., et al. // Stroke. – 1999. – Vol.30. – P.905–915.
9. Broseta J., Gonzalez-Darder J., Barcia-Salorio J.L. // Appl. Neurophysiol. – 1982. – Vol.45. – P.443–448.
10. Fiorella D., Gutman F., Woo H., et al. // J. Neurointerv. Surg. – 2015. – Vol.7. – P.752–757.
11. Hemphill J.C., Greenberg S.M., Anderson C.S., et al. // Stroke. – 2015. – Vol.46. – P.2032–2060.
12. Higgins A.C., Nashold B.S. // Appl. Neurophysiol. – 1980. – Vol.43. – P.96–103.
13. Kandel E.I., Peresedov V.V. // Stereotact. Funct. Neurosurg. – 1990. – Vol.54–55. – P.427–431.
14. Kellner C.P., Chartrain A.G., Nistal D.A., et al. // J. Neurointerv. Surg. – 2018. – Vol.10. – P.771–776.
15. Morgenstern L.B., Hemphill J.C., Anderson C., et al. // Stroke. – 2010. – Vol.41. – P.2108–2129.
16. Pan D., Lee L., Chen M., Manns A. // Surg. Neurol. – 1986. – Vol.25. – P.540–544.
17. Peresedov V.V., Kandel’ E.I. // Zh. Vopr. Neirokhir. Im N.N.Burdenko. – 1983. – Vol.6. – P.53–55.
18. Tanikawa T., Amano K., Kawamura H., et al. // Appl. Neurophysiol. – 1985. – Vol.48. – P.431–439.
19. Tanizaki Y., Sugita K., Toriyama T., Hokama M. // Appl. Neurophysiol. – 1985. – Vol.48. – P.11–17.
20. Turner R.D., Vargas J., Turk A.S., et al. // Operative Neurosurgery. – 2015. – Vol.11. – P.43–51.
Медицинские новости. – 2019. – №8. – С. 29-31.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.