Внимание! Статья адресована врачам-специалистам
Alekberova S.A.
Azerbaijan Medical University, Baku
Oxidative stress and damage to the liver tissue
in experimental obstructive jaundice
Резюме. Описаны изменения, происходящие в печени крыс на гистологическом и ультраструктурном уровне при механической желтухе, а также динамика некоторых показателей оксидативного стресса в крови. Для соответствующего обследования на световом и электронном микроскопе были сделаны снимки средне- и ультратонких срезов из Araldite-Epon блоков на ультратоме ЕМ UC7 (Leica). Было отмечено, что уже с первых дней развития холестаза происходит активация процессов липопероксидации, сопровождаемая глубокими нарушениями в структурных элементах печеночной ткани.
Ключевые слова: механическая желтуха, гепатоцит, окислительный стресс, электронная микроскопия.
Медицинские новости. – 2019. – №8. – С. 74–76.
Summary. The presented article describes the changes occurring in the liver of rats at the histological and ultrastructural levels after the development of mechanical jaundice, as well as the dynamics of some indicators of oxidative stress in the blood. For an appropriate examination, light and electron microscopes were taken of medium and ultrathin sections from araldite-epon blocks on the EM UC7 (Leica) ultratome. It was noted that already from the first days of cholestasis, activation of lipid peroxidation occurs, accompanied by deep violations in the structural elements of the liver tissue.
Keywords: obstructive jaundice, hepatocyte, oxidative stress, electron microscopy.
Meditsinskie novosti. – 2019. – N8. – P. 74–76.
Актуальность проблемы механической желтухи (МЖ) объясняется высоким процентом послеоперационных осложнений, достигающих 24–54%, а также высокой летальностью, которая составляет от 7,2 до 60% [1]. Основную причину высокой летальности большинство авторов видят в повреждении печени на клеточном уровне [2]. Развившийся в результате гипоксии печеночных клеток при холестазе энергетический дефицит и митохондриальная дисфункция приводят к нарушению баланса между прооксидантными и антиоксидантными системами клетки, тем самым провоцируя развитие оксидативного стресса [3]. Накопление продуктов ПОЛ (перекисное окисление липидов) в суперизбыточных концентрациях в значительной мере утяжеляет течение патологического процесса и способствует нарастанию некротических процессов, приводящих к развитию массивной деструкции органа и острой почечной недостаточности (ПН) [4].
Детальное изучение патоморфологических изменений в печени, развивающихся при механической желтухе, может способствовать определению оптимальных методик комплексного лечения механической желтухи.
Цель исследования – изучение на гистологическом и ультраструктурном уровне изменений, происходящих в паренхиматозных и стромальных элементах печени, во взаимосвязи с некоторыми показателями окислительного стресса в первые дни экспериментальной механической желтухи.
Материалы и методы
Экспериментальные исследования были проведены на 30 белых крысах линии Вистар обоего пола массой 180–220 г. Метки и индивидуальные номера животных регистрировали в протоколах лабораторных испытаний.
Животных содержали в стандартных условиях вивария научно-исследовательского центра АМУ (температура воздуха – 22±2°C, светлый/темный цикл – 12/12 часов, неограниченное потребление корма и воды). Ограничение потребление корма было только в день операции. Лапаротомия и забор крови выполнялись после вывода животных из эксперимента методом декапитации под анестезией. Все манипуляции с животными проводили в соответствии с правилами Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и иных научных целей (ЕТS N 123, Страсбург, 18 марта 1986 г.).
Механическую желтуху вызывали у крыс путем наложения лигатуры на внепанкреатический участок общего желчного протока под наркозом. Крысам в условиях общей анестезии (каллипсол) проводилась срединная лапаротомия, органы брюшной полости сдвигались, выделялся общий желчный проток. Общий желчный проток в нижней его трети перевязывался двумя лигатурами 4-0, после чего органы брюшной полости крысы аккуратно возвращались на прежнее положение и проводилось послойное ушивание операционной раны.
Животных делили на две группы. Группа 1 (здоровые животные) (n=5) являлась контрольной. Животным группы 2 (основная) (n=25) перевязывался желчный проток с целью создания модели механической желтухи. Животных группы 2, в свою очередь, делили на 5 подгрупп по 5 голов в каждой. Такое деление осуществлялось с учетом того, что у крыс производился забор крови для биохимических исследований и биоптатов печени на 1-е, 3-и, 7-е, 10-е и 15-е сутки после моделирования у них механической желтухи.
Для морфологического исследования со средней доли забирался кусок ткани печени после выведения животных из эксперимента. Активность процессов ПОЛ оценивали по динамике некоторых показателей ПОЛ-АОС (антиоксидантная система): активность МДА (малоновый диальдегид), ДК (диеновый конъюгат) как маркеров ПОЛ и активность СОД (супероксиддисмутаза) в качестве показателя АОС. Показатель МДА оценивали в реакции с 2-тиобарбитуровой кислотой (ТБК) с помощью набора фирмы «Агат». Содержание ДК определяли по методу Гаврилова В.Б. (1988). Активность СОД определяли в гемолизате эритроцитов по методу Сирота Т.В. (1999).
Полученные цифровые данные обрабатывали методом вариационной статистики с использованием критерия Ван-дер-Вардена.
Биоптаты печени, взятые у крыс как контрольной, так и основной групп, подвергались фиксации в растворе, состоящем из 2% параформальдегида, приготовленного в фосфатном буфере (pH 7,4), 2% глутаралдегида и 0,1% пикриновой кислоты. После постфиксации в 1% растворе осмиевой кислоты, приготовленной в течение 2 часов в фосфатном буфере (pH 7,4), из данного материала были приготовлены по общепринятой в электронной микроскопии методике Araldite-Epon блоки. Полученные из данных блоков на LKB-III, Leica EM UC7 ультратомах полутонкие (1–2 μm) срезы были окрашены метиленовым синим, азур II, фуксином или же толуидиновым синим. Далее после просмотра их на микроскопе Latimet (Leitz) были сделаны снимки необходимых участков цифровой фотокамерой Pixera (ABS). Полученные из этих же блоков ультратонкие срезы толщиной 70–100 nm были сначала окрашены 2% раствором уранил-ацетата, затем 0,6% свинцовым цитратом. После этого были сделаны электронограммы под трансмиссионным электронным микроскопом JEM-1400.
Результаты и обсуждение
При исследовании окислительной активности установлено, что при моделировании механической желтухи у крыс наблюдается усиление прoцессов ПОЛ. Первое достоверное увеличение показателя МДА в крови животных опытной группы отмечалось уже через сутки от начала эксперимента и превышало уровень МДА в крови контрольных животных на 42,6% (р<0,01). Продолжение холестаза характеризовалось дальнейшим увеличением концентрации МДА с достижением к 3-м суткам после перевязки общего желчного протока 9,55 мкм/л, что превышало норму уже в 4 раза. Результаты исследований содержания ДК в крови контрольных и опытных крыс показали, что накопление продукта ПОЛ не имеет четко выраженного вида. Достоверное увеличение содержания ДК в крови крыс, превышающее нормальный уровень ДК соответственно в 3,1 и 3,2 раза на следующий день и спустя трое суток после развития желтухи. В то же время значения СОД резко снижаются уже с первых суток – его уровень был равен 29,4% ед.акт., что на 55,9% ниже нормы. Увеличение показателей ПОЛ уже с первых суток является одним из ранних признаков патологического процесса гепатоцитов.
Через сутки после создания механической желтухи среди изменений, происходящих в гистотопографии структурных элементов печени, обращает на себя внимание формирование змеевидных каналов в результате соединения полостей синусоидов (обозначены стрелкой в центральной части рисунка 1А). Это являлось следствием различной степени деформации сформированных гепатоцитами балок на фоне увеличения количества синусоидов (рис. 1А). Формирование данных каналов связано, во-первых, с нарушением топографического расположения гепатоцитов, разъединяющих синусоиды (рис. 1С), во-вторых, с образованием щелевидных каналов между гепатоцитами (указаны стрелкой на рисунке 1С) и, в-третьих, с происходящими нарушениями в топографическом положении клеток Купфера и эндотелиальных клеток, участвующих в строении стенок соседних синусоидов. Рост количества этих клеток определяется как на полутонких (рис. 1А), так и на ультратонких срезах (рис. 1В).
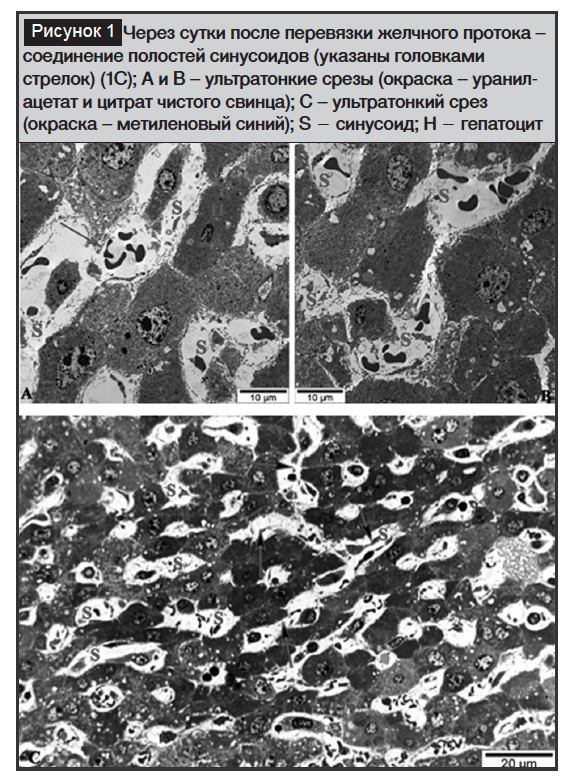
В представленном на рисунке 1 полутонком срезе особый интерес вызывает обнаружение наравне с признаками микровезикулярного стеатоза также находящихся в основном внутри печеночных клеток, а иногда в перисинусоидальных пространствах желчных капель, окрашенных метиленовым синим в желто-зеленый цвет.
С первых же дней развития механической желтухи наиболее заметны нарушения, происходящие в ультраструктуре и топографическом положении клеточных элементов, участвующих в строении стенок синусоидов (рис. 1В и 1С). Параллельно с нарушениями механического характера, с отсутствием микроворсинок участков плазмолеммы гепатоцитов обращает на себя внимание резкое снижение цистерн незернистой эндоплазматической сети в их цитоплазме и числа гликогеновых капелек. На продольных (рис. 2А) и косых (рис. 2В) полутонких срезах обнаруживались мелкие расширения в пространствах Диссе (указаны двойной стрелкой на рисунке 2В), однако в гистотопографическом расположении эндотелиальных клеток особых изменений не было обнаружено. Нахождение в большом количестве моноцитов (указаны стрелкой) и нейтрофилов в полости синусоидов свидетельствует о развитии воспалительного процесса на третьи сутки механической желтухи. На рисунке 2А отмечены нейтрофилы (указаны стрелкой), которые занимают полость синусоидов и соединены при помощи выступов с соседними клетками. На третьи сутки формирования механической желтухи на ультраструктурном уровне определяются уменьшение диаметра синусоидов, размещение в полости последних подвергнутых деформации эритроцитов (рисунки 3А и 3В), а также уплотненных отложений плазмы. Скопления уплотненных отложений плазмы отчетливо видны также в полости синусоидов между форменными элементами крови и пространствах Диссе на полутонких срезах (указаны двойной стрелкой на рисунке 2А). Наравне с описанным выше сужение полостей междолевых артерий портальных областей и ответвляющихся от них артериол указывает на снижение скорости кровотока в печеночных дольках на третьи сутки механической желтухи. Среди причин возникновения изменений, происходящих в печени в первые сутки экспериментальной механической желтухи, на первый план можно выдвинуть накопление в полости гепатоцитов токсичных желчных кислот, обладающих детергентными свойствами. Вместе с тем снижение антиоксидантных возможностей, факторы оксидативного стресса, синтезируемые в макрофагальных клетках (особенно в клетках Купфера), и нарушение метаболизма всех питательных продуктов могут привести к описываемым гепатоцеллюлярным изменениям в первые дни механической желтухи [5]. Появление признаков застоя в синусоидах и портальных областях, развитие воспалительного процесса наряду с носящей компенсаторный характер концентрацией гепатоцитов по прошествии трех суток с развития механической желтухи указывают на возможность усугубления деструктивных изменений в последующие дни.

Выводы:
1. Развитие механической желтухи после перевязки общего желчного протока у крыс приводит к деструктивным процессам в паренхиматозных и стромальных элементах печени.
2. Установлено, что патологические изменения в печеночной ткани сопровождаются высокими концентрациями показателей ПОЛ на фоне угнетения компонентов АОС.
3. Активация окислительного стресса уже в первые дни развития механической желтухи предполагает применение антиоксидантов для предотвращения более глубоких нарушений в ультраструктуре печеночной ткани.
Л И Т Е Р А Т У Р А
1. Болевич С.Б., Ступин В.А., Гахраманов Т.В. [и др.] // Хирургия. – 2010. − №1. – С.65–70.
2. Шестопалов С.С., Абрамов Е.И. Мат-лы Пленума правления ассоциации гепатопанкреатобилиарных хирургов стран СНГ. – Тюмень, 2014. – С.102–103.
3. Рязанов Д.Ю., Михеев Ю.А. // Международный медицинский журнал. – 2006. – №2. – С.115–117.
4. Perez M.J., Briz O. // World J. Gastroenterol. – 2009. – Vol.14, N15. – P.1677–1689.
5. Long Y., Dong X., Yuan Y., Huang J., et al. // J. Clin. Biochem. Nutr. – 2015. – Vol.57, N1. – P.50–59.
Медицинские новости. – 2019. – №8. – С. 74-76.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.