Внимание! Статья адресована врачам-специалистам
Chernak S.V., Liventseva M.M., Netchesova T.A., Pavlova O.S.
Republican Scientific and Practical Center «Cardiology», Minsk, Belarus
Stress and hypertension. The use of adaptol in the complex treatment
of patients with arterial hypertension
Резюме. Обследовано 60 пациентов с артериальной гипертензией II степени в сочетании с повышенным уровнем тревожности. Пациенты контрольной группы (30 человек) получали базисную комбинированную терапию фиксированной комбинацией лизиноприла / амлодипина или периндоприла / амлодипина, а в основной группе (30 пациентов) дополнительно назначался препарат «Адаптол»® (мебикар): по 500 мг 3 раза в сутки. Эффективность терапии оценивалась до начала и спустя 2 месяца лечения с помощью балльной оценки уровня тревоги Спилбергера – Ханина, опросника Вейна, уровня офисного артериального давления, суточного мониторирования артериального давления, информационной пробы, учета динамики жалоб пациентов. Показано, что назначение адаптола приводит к снижению ситуативной и личностной тревоги, повышению переносимости психоэмоциональной нагрузки, улучшению сна, значительному уменьшению вегетативного дисбаланса, а также потенцирует гипотензивный эффект базисной антигипертензивной терапии.
Ключевые слова: артериальная гипертензия, стресс, нейровегетативные расстройства, лечение, Адаптол®.
Медицинские новости. – 2019. – №9. – С. 10–16.
Summary. 60 patients with arterial hypertension II combined with an increased level of anxiety were examined. 30 patients (control group) received basic combination therapy with a fixed combination of lisinopril / amlodipine or perindopril / amlodipine, and 30 (experimental group) additionally prescribed the Adaptol (Mebicar): 500 mg 3 times a day. The efficacy of therapy was assessed before treatment and after 2 months of therapy using a Spielberger – Khanin anxiety score, Wayne questionnaire, office arterial pressure, daily blood pressure monitoring, informational test, accounting for patient complaints dynamics. Adaptol administration has been shown to reduce situational and personal anxiety, improve tolerance of psychoemotional stress, improve sleep, significantly reduce autonomic imbalance, and also potentiate the hypotensive effect of basic antihypertensive therapy.
Keywords: hypertension, stress, neurovegetative disorders, treatment, Adaptol®.
Meditsinskie novosti. – 2019. – N9. – P. 10–16.
Данные эпидемиологических исследований, проведенных в последнее время, свидетельствуют, что для современного индустриального общества характерной чертой является повышенное артериальное давление (АД). В качестве основных факторов риска развития артериальной гипертензии (АГ) выступают наследственная предрасположенность к повышению АД, избыточный вес, низкая физическая активность, большое потребление поваренной соли и алкоголя, курение, высокая стресс-реактивность. Психологический стресс в течение длительного периода рассматривается как фактор риска развития АГ и ассоциируется с увеличением риска возникновения заболевания более чем в 2,4 раза [15]. Повышенная активность центральной нервной системы (ЦНС) играет существенную роль в становлении и прогрессировании АГ. Особенно важна ее значимость при хроническом стрессе [11]. Точные механизмы развития АГ на фоне стресса остаются до конца не выясненными, однако установлена важная роль гиперсимпатикотонии и центральных механизмов, модулирующих действие ангиотензина II [16]. Пусковым фактором в развитии АГ при стрессовых воздействиях служит активация симпатоадреналовой нервной системы, в последующем приводящая к запуску ренин-ангиотензин-альдостероновой системы (РААС), потенцирующая также эндотелиальную дисфункцию, процессы сосудистого воспаления, атерогенез и инициирующая поражение сердечно-сосудистой системы.
Теория стресса была разработана Гансом Селье, который обозначил его как «общий адаптационный синдром», развивающийся в ответ на действие различных по качеству, но относительно сильных раздражителей. Главным проявлением этого синдрома можно назвать значительную активизацию высших вегетативных центров и, как следствие, адренергической и гипофизарно-адреналовой систем. Концепция стресса была развита Ф.З. Меерсоном, определившим стресс как реакцию, возникающую при воздействии на организм не только экстремальных, но и просто новых факторов окружающей среды. Ф.З. Меерсон рассматривал стресс как одно из звеньев в механизме адаптации.
Основоположниками теории патогенеза АГ традиционно много внимания уделялось роли повышенной активности центральной нервной системы в становлении и прогрессировании АГ. Г.Ф. Ланг еще в 1947 году писал, что «в основе гипертонической болезни следует предполагать состояние патологической инертности, или застойности процессов раздражения высших, регулирующих кровяное давление, нервных центров» [5]. В рамках психосоматического подхода к изучению патогенеза АГ была показана роль психогенных факторов в ее возникновении и течении, так как одним из механизмов повышения АД является нарушение психофизиологической саморегуляции. Более выраженная и длительная гипертензивная реакция в условиях психологического стресса выявляется у пациентов с различными психопатологическими изменениями. Ведущее место среди этих состояний занимают пограничные психические расстройства, в частности невротические и неврозоподобные, представленные тревожным, депрессивным, ипохондрическим, неврастеническим и истерическим синдромами либо их сочетанием. Эти состояния наблюдаются у 60–80% пациентов с АГ, они оказывают отрицательное влияние на течение заболевания, являются одной из причин снижения работоспособности, требуют особого подхода к лечению. Обычно выделяют две группы расстройств. Первая – психогенные, тесно связанные с реакцией на болезнь, вторая – неврозоподобные расстройства сосудистого генеза, находящиеся в тесной зависимости от течения АГ.
Существует две точки зрения. Согласно одной из них, ведущую роль в развитии психических расстройств при АГ играют особенности личности, а не вторичные изменения центральной нервной системы, возникающие вследствие длительного повышения АД. Согласно другой точке зрения, пограничные психические расстройства возникают соматогенно, так как длительная АГ способствует формированию невротических реакций и неврозоподобных состояний. Серьезного внимания заслуживает концепция кольцевой зависимости, рассматривающая соматические и психические расстройства при АГ как единый патологический процесс, при котором возникает порочный круг взаимовлияния соматического заболевания и психических расстройств.
Тревожность как один из самых частых синдромов у пациентов с АГ представляет первую стадию реализации стрессорного ответа организма. При воздействии хронического стресса формируется дисбаланс различных нейромедиаторных систем мозга, в результате чего тревожность превращается в синдром тревоги, оказывающий деструктивное действие на психоэмоциальную сферу человека. При прогрессировании нейромедиаторного рассогласования и нарушении центральных механизмов регуляции формируется стойкая дисфункция вегетативной регуляции в ЦНС, приводящая к развитию психосоматических расстройств, в том числе АГ.
Развитие тревоги не является результатом дисфункции одной нейромедиаторной системы, но отражает дисбаланс различных нейромедиаторов на разных уровнях структурно-функциональной организации [20].
Корреляция нарушений функций ЦНС при психосоматических заболеваниях, к которым относится и АГ, обязательно должна включать воздействие на проявления основных клинических синдромов, связанных с расстройствами адаптации. При лечении пациентов с АГ, сопровождающейся пограничными психическими расстройствами, обычно используются ноотропные средства и транквилизаторы. Учитывая побочные эффекты бензодиазепиновых транквилизаторов, особенно со стороны сердечно-сосудистой системы, предпочтение необходимо отдавать небензодиазепиновым анксиолитикам и адаптогенам, которые не вызывают миорелаксации, мнестические расстройства и синдром зависимости [4]. К таким препаратам относится Адаптол® («Олайнфарм», Латвия). Адаптол® оказывает антагонистическую активность по отношению к возбуждающей адренергической и глутаматергической системам и усиливает функционирование тормозных серотонин- и ГАМК-ергических механизмов мозга, что приводит к выраженному вегетостабилизирующему, умеренному транквилизирующему и умеренному ноотропному эффектам. Под влиянием адаптола происходит улучшение умственной и физической работоспособности. Препарат оказывает также антигипоксический и анальгетический эффекты, усиливает адаптогенную активность, проявляет антистрессовое и стресспротекторное действие. Адаптол® близок к естественным метаболитам организма (его молекула представляет собой фрагменты двух метилированных остатков мочевины), не является ксенобиотиком, что повышает его безопасность, принимается независимо от приема пищи и может сочетаться с большинством лекарственных препаратов. Важными свойствами адаптола является отсутствие синдромов привыкания и отмены, а также серьезных побочных эффектов. Главным отличием адаптола от классических анксиолитиков является сочетание системных нейромедиаторных и клеточных механизмов действия [1].
В данной статьеизучен терапевтический потенциал адаптола (мебикара) в отношении коррекции повышенной тревожности и вегетативной дисфункции, а также его влияние на переносимость психоэмоциональной нагрузки и показатели контроля АД у пациентов с АГ II степени.
Материалы и методы
В исследование было включено 60 пациентов с АГ II степени, не достигших целевого уровня АД с помощью предшествующей терапии. Критериями включения пациентов в исследование был повышенный уровень тревожности (>30 баллов по шкале Спилбергера – Ханина). В исследование не включались пациенты с симптоматической АГ, хронической сердечной недостаточностью, тяжелыми соматическими заболеваниями, сахарным диабетом, а также имевшие в анамнезе инфаркт миокарда, нестабильную стенокардию, острое нарушение мозгового кровообращения давностью менее 6 месяцев и онкологические заболевания.
Всем пациентам в течение 2 месяцев назначалась двухкомпонентная комбинированная антигипертензивная терапия (АГТ): фиксированные комбинации лизиноприла / амлодипина или периндоприла / амлодипина в сопоставимых среднесуточных дозах. Пациенты основной группы (n=30) дополнительно получали Адаптол® («Олайнфарм», Латвия) в дозе 500 мг 3 раза в сутки.
Экспериментальные группы были сопоставимы по основным клинико-демографическим показателям (табл. 1).
Таблица 1. Клинико-демографическая характеристика пациентов
|
Параметр
|
Группа, принимающая Адаптол® (n=30)
|
Контрольная группа
(n=30)
|
|
Возраст, лет
|
46,5±11,3
|
46,1±9,9
|
|
Мужчины, n (%)
|
18 (60)
|
19 (63,3)
|
|
Женщины, n (%)
|
12 (40)
|
11 (36,7)
|
|
Индекс массы тела, кг/м2
|
27,6±3,6
|
28,3±3,4
|
|
Систолическое АД, мм рт. ст.
|
153,7±9,7
|
153,9±7,1
|
|
Диастолическое АД, мм рт. ст.
|
96,4±5,1
|
97,4±5,4
|
|
ЧСС, уд./мин.
|
74,8±8,1
|
73,5±8,1
|
|
Длительность АГ, лет
|
6,6±2,0
|
5,8±2,0
|
|
Отягощенная наследственность по АГ, n (%)
|
20 (66,7)
|
21 (70)
|
|
Курение, n (%)
|
10 (33,3)
|
9 (30)
|
Примечание: Данные представлены в виде абсолютного числа пациентов (%) или M±SD, где M – среднее значение, SD – стандартное отклонение, АД – артериальное давление, ЧСС – частота сердечных сокращений, АГ – артериальная гипертензия.
Оценку уровня тревожности проводили по методике Спилбергера – Ханина [3], выполняя тестирование по двум шкалам: ситуативной тревожности (тревожность в данный момент времени) и личностной тревожности (более устойчивая характеристика). Показатель тревожности по каждой из шкал может находиться в диапазоне от 20 до 80 баллов. При этом чем выше его значение, тем выше уровень тревожности: показатели, не превышающие 30 баллов, соответствуют низкой тревожности, 31–44 балла – умеренной, а 45 и более – высокой.
Состояние вегетативной устойчивости (лабильность системы терморегуляции, вестибулярного аппарата, признаки тревожности, болевые симптомы) оценивали с помощью опросника А.М. Вейна [2]. Значение оценки выше 15 баллов свидетельствовало о наличии синдрома вегетативной дисфункции.
Обследуемым лицам была проведена информационная проба (ИП) по методике Г.И. Сидоренко и соавт. [9], моделирующая психоэмоциональную нагрузку. Эффективность переработки информации, количественно отражающую выполнение функций человека-оператора, определяли с помощью коэффициента информационной переработки (КИП). Рассчитывали индекс обобщенной работоспособности (Q), который является интегральным показателем, основанным на учете самочувствия пациентов, степени прироста ДАД во время ИП, и коэффициент информационной переработки (КИП). Показатель самочувствия пациентов определяли по шкале в баллах на основании анализа его индивидуальных ощущений.
Офисное АД регистрировалось по методу Н.С. Короткова, суточное мониторирование АД (СМАД) проводилось на аппарате Arteriograph 24 (TensioMed, Венгрия) с расчетом средних значений систолического и диастолического АД за сутки, день и ночь, вариабельности АД. Пороговыми значениями для средних величин САД/ДАД за сутки считаются <130/80 мм рт. ст., за день – <135/85 мм рт. ст., за ночь – <120/70 мм рт. ст.; для вариабельности за день – <15/14 мм рт. ст. за ночь – <15/12 мм рт. ст. [6].
Все измерения выполнялись исходно и через 2 месяца. Дополнительно проводили учет всех жалоб пациентов и оценку качества сна.
Статистическая обработка данных выполнена с помощью статистического пакета STATISTICA 10 (StatSoft, США). Данные представлены в виде абсолютного числа пациентов (%) или M±SD, где M – среднее значение, SD – стандартное отклонение. Проверка нормальности распределения количественных признаков в группах сравнения проводилась с использованием критериев Колмогорова – Смирнова, Шапиро – Уилка. Критическое значение уровня статистической значимости при проверке нулевых гипотез принимали равным 0,05. Межгрупповые и внутригрупповые сравнения проводили с использованием методов параметрической либо непараметрической статистики в зависимости от характера распределения данных. Межгрупповые сравнения частотных показателей выполнены с использованием критерия Пирсона (?2).
Результаты
Исходные уровни тревожности в основной и контрольной группах были высокими и значимо не отличались. При этом в обеих группах был выявлен повышенный уровень вегетативной лабильности (31,7±13,5 и 32,6±8,5 балла – в основной и контрольной группе) (табл. 2).
Таблица 2. Динамика уровня тревожности (тест Спилбергера – Ханина)
и выраженности вегетативной дисфункции (опросник Вейна) на фоне терапии с включением адаптола
|
Показатель
|
Исходно
|
Через 2 месяца
|
|
Адаптол® (n=30)
|
Контроль (n=30)
|
Адаптол® (n=30)
|
Контроль (n=30)
|
|
Ситуативная тревожность, баллы
|
46,2±11,4
|
45,0±7,4
|
38,0±7,8**
|
43,1±12,3
|
|
Личностная тревожность, баллы
|
48,7±10,3
|
48,8±7,5
|
42,8±8,2*
|
47,9±9,0
|
|
Вегетативная дисфункция, баллы
|
31,7±13,5
|
32,6±8,5
|
15,0±6,4*** #
|
26,7±10,2*
|
Примечание: * – достоверность различий показателя в сравнении с исходными данными, р<0,01, ** – р<0,001, *** – р<0,0001; # – достоверность различий показателя в сравнении с таковым в контрольной группе, p<0,0001.
Через 2 месяца комбинированной АГТ с включением адаптола средний уровень тревожности пациентов снизился с 46,2 до 38,0 балла (p<0,001), в то время как в контрольной группе существенной динамики не отмечалось (рис. 1).
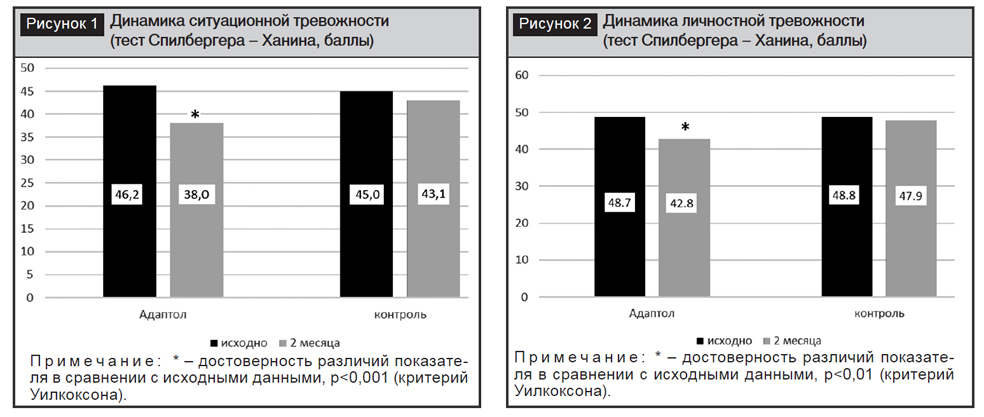
Средний уровень личностной тревоги в группе, принимающей Адаптол®, снизился с 48,7 до 42,8 балла (р<0,01) при отсутствии значимой динамики в контрольной группе (рис. 2).
Назначение адаптола привело и к уменьшению выраженности вегетативной дисфункции, оцененной по шкале Вейна, как в основной, так и в контрольной группе, однако отмеченное улучшение в группе принимающих адаптол было существенно выше (рис. 3). Среднее значение этого показателя в группе, принимающей Адаптол®, снизилось на 16,7 балла, в то время как в контрольной группе – на 5,9 балла (р<0,01).
Динамика основных жалоб пациентов в ходе наблюдения представлена в таблице 3.
Таблица 3. Динамика основных жалоб на фоне комбинированной терапии с адаптолом
|
Жалоба
|
Исходно
|
Через 2 месяца
|
|
Группа, принимающая Адаптол®, n=30
|
Контрольная группа, n=30
|
Группа, принимающая Адаптол®, n=30
|
Контрольная группа, n=30
|
|
Головная боль
|
11 (36,7)
|
12 (40)
|
2 (6,7)*
|
4 (13,3)*
|
|
Нарушение сна
|
5 (16,7)
|
6 (20)
|
1 (3,3)
|
5 (16,7)
|
|
Головокружение
|
4 (13,3)
|
3 (10)
|
3 (10)
|
4 (13,3)
|
|
Общая слабость
|
7 (23,3)
|
6 (20)
|
5 (16,7)
|
4 (13,3)
|
|
Тахикардия
|
3 (10)
|
3 (10)
|
1 (3,3)
|
3 (10)
|
|
Отсутствие жалоб
|
–
|
–
|
18 (60)#
|
10 (33,4)
|
Примечание: данные представлены в виде абсолютного числа пациентов (%); * – достоверность различий показателя в сравнении с исходными данными, р<0,05; # – достоверность различий показателя в сравнении с таковым в группе контроля, р<0,05 (критерий c2).
На фоне проводимой медикаментозной терапии в обеих группах наблюдалось улучшение общего состояния, выражающееся в уменьшении количества зарегистрированных жалоб. При этом наиболее выраженная динамика отмечена в отношении жалоб на головную боль. В группе лиц, принимающих Адаптол®, частота жалоб на головную боль снизилась с 36,7 до 6,7% случаев (р=0,005), а в контрольной – с 40,0 до 13,3% случаев (р=0,02). В целом на момент завершения наблюдения не предъявляли жалоб 60% пациентов в основной группе и 33,3% в контрольной (р=0,02). Случаев появления новых жалоб или побочных реакций, связанных с проводимой терапией, не наблюдалось.
Для выявления нарушений сна всем пациентам предлагалось оценить свой сон по качественным критериям: хороший, средний или плохой. Исходно пациенты сравниваемых групп не отличались по качеству сна, при этом преобладало плохое и среднее качество сна (рис. 4). Через 2 месяца терапии удельный вес пациентов с хорошим качеством сна возрос с 10,0 до 43,3% (p<0,05), а с плохим – уменьшился с 46,7 до 10% (p<0,05). В контрольной группе через 2 месяца терапии также наблюдалась положительная динамика качества сна, которая, однако, была менее выражена и не достигла статистически значимого уровня.
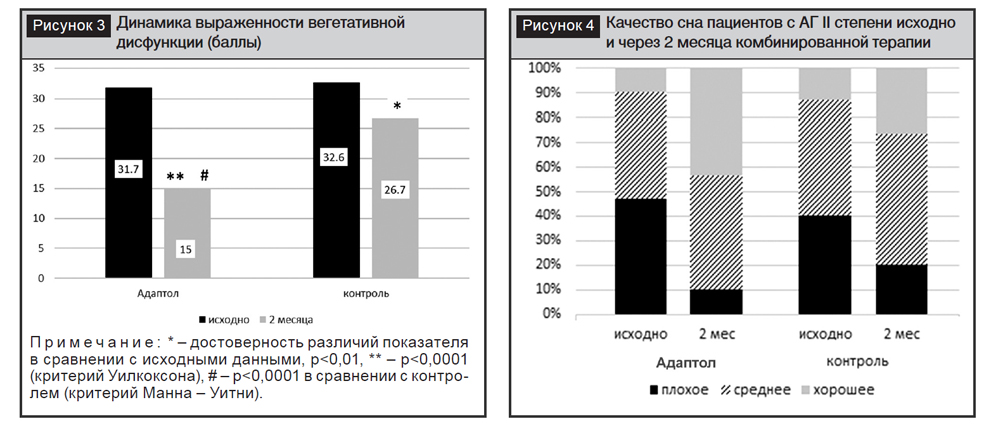
Случаев развития признаков заторможенности и дневной сонливости в ходе исследования не отмечено.
Продемонстрированные различия между основной и контрольной группами в динамике показателей тревожности и признаков вегетативной дисфункции подтверждают возможность их эффективной коррекции у пациентов с АГ препаратом «Адаптол»®.
При анализе реакции на информационную нагрузку исходно не было выявлено достоверных отличий прироста САД и ДАД у лиц основной и контрольной групп на 1-й, 3-й, 5-й минутах (табл. 4).
Таблица 4. Динамика АД, КИП и Q у пациентов основной и контрольной групп в процессе выполнения информационной пробы исходно и через 2 месяца
|
Показатель
|
Исходно
|
Через 2 месяца
|
|
Основная (n=30)
|
Контрольная (n=30)
|
Основная (n=30)
|
Контрольная (n=30)
|
|
Исходно
|
САД
|
148,1±12,1
|
150,9±11,9
|
131,4±7,8**
|
134,6±10,02*
|
|
ДАД
|
93,9±9,3
|
95,9±11,39
|
83,2±6,72**
|
86,4±6,99*
|
|
1-я минута
|
САД
|
156,1±12,1
|
158,8±15,71
|
133,1±7,96**
|
138,6±9,18*
|
|
ДАД
|
96,5±8,52
|
100,1±11,05
|
85,8±7,04**
|
89,3±8,45**
|
|
3-я минута
|
САД
|
158,6±13,9
|
159,9±15,3
|
135,2±8,3**
|
140,2±8,6*
|
|
ДАД
|
98,9±8,7
|
100,1±11,2
|
87,5±6,8**
|
90,3±8,7*
|
|
5-я минута
|
САД
|
153,7±14,6
|
155,3±14,7
|
134,2±9,7**
|
138,6±9,3*
|
|
ДАД
|
97,6±12,2
|
98,1±10,4
|
85,2±7,1**
|
90,6±8,9*
|
|
1 минута отдыха
|
САД
|
146,7±14,4
|
150,8±16,2
|
131,6±8,9**
|
135,3±9,4*
|
|
ДАД
|
95,7±5,6
|
94,1±10,4
|
81,7±6,6**
|
87,3±7,9*
|
|
КИП, %
|
74,8±2,8
|
74,1±3,1
|
75,9±2,7
|
74,2±3,1
|
|
Q
|
6,4±1,01
|
6,14±2,01
|
3,6±0,9**#
|
5,2±2,1#
|
Примечание: * – достоверность различий показателя в сравнении с исходными данными, р<0,05, ** – р<0,01; # – достоверность различий показателя в сравнении с таковым в группе контроля, р<0,05 (t-критерий Стьюдента).
Динамика прессорной реакции при выполнении ИП после 2 месяцев приема адаптола пациентами с АГ II степени (основная группа) характеризовалась снижением прироста САД на 1-й минуте ИП (?САД исходно – 8 мм рт. ст., ?САД через 2 месяца – 2 мм рт. ст.; р<0,05). В процессе комплексной терапии отмечалось уменьшение подъема АД как физиологической платы за переработку чрезмерного потока информации при выполнении ИП у пациентов с АГ основной группы, что можно объяснить положительным влиянием препарата «Адаптол»® на адаптационно-компенсаторные механизмы формирования психоэмоциональной устойчивости конкретного человека, в основном за счет влияния на тревожность.
Уменьшение прессорной реакции в ответ на психоэмоциональную нагрузку при выполнении ИП не сопровождалось достоверным увеличением КИП, однако коэффициент обобщенной работоспособности Q снизился с 6,4±1,01 до 3,6±0,98 (р<0,001), что свидетельствует о повышении общей работоспособности пациентов.
Назначение комбинированной АГТ обеспечило значимое снижение офисного САД и ДАД в обеих группах исследования. Через 2 месяца терапии уровень САД и ДАД в основной группе снизился на 16,4% и 16,7%, составив соответственно 130,6±8,3 и 82,1±6,9 мм рт. ст., в контрольной группе САД и ДАД снизились на 10,6% и 8,8%, составив соответственно 137,3±7,1 и 88,6±5,5 мм рт. ст. (рис. 5, 6).
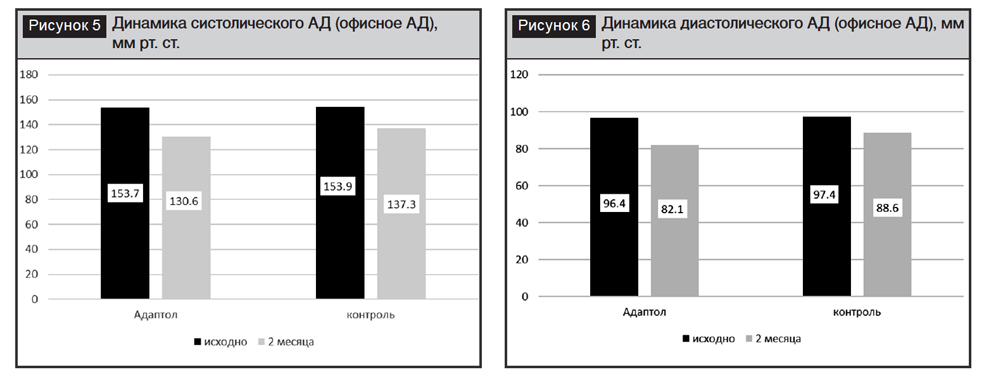
Исходные данные суточного мониторирования АД подтвердили превышение пороговых значений САД и ДАД за сутки, день и ночь как в основной, так и в контрольной группе (табл. 5).
Таблица 5. Динамика показателей СМАД и ЧСС пациентов с АГ II степени
в результате лечения
|
Показатель
|
Исходно
|
Через 2 месяца
|
|
Основная (n=30)
|
Контрольная (n=30)
|
Основная (n=30)
|
Контрольная (n=30)
|
|
Средние величины мм рт. ст.
|
САД сутки
|
140,1±14,8
|
141,6±16,4
|
125,6±8,9# **
|
132,9±15,9
|
|
ДАД сутки
|
89,1±11,8
|
87,4±13,1
|
76,4±8,8# **
|
79,5±11,9*
|
|
САД день
|
148,4±16,3
|
152,9±17,01
|
129,6±9,3# **
|
134,4±18,5*
|
|
ДАД день
|
92,3±12,9
|
94,2±13,3
|
79,5±7,4# **
|
82,2±12,9*
|
|
САД ночь
|
131,1±16,4
|
133,2±17,4
|
113,2±9,9# **
|
121,1±12,1*
|
|
ДАД ночь
|
78,9±12,4
|
78,6±13,9
|
68,4±7,9**
|
71,4±10,9*
|
|
Вариабельность, мм рт. ст.
|
САД день
|
14,6±4,2
|
16,6±5,9
|
9,1±1,5**
|
15,2±5,3
|
|
ДАД день
|
12,3±3,9
|
13,2±3,9
|
9,16±1,8**
|
12,9±5,4
|
|
САД ночь
|
13,9±4,01
|
15,3±4,7
|
8,9±2,1**
|
13,25±3,2
|
|
ДАД ночь
|
11,5±3,9
|
12,8±3,2
|
7,9±2,3**
|
11,54±2,6
|
|
ЧСС, уд. в мин.
|
72,3±8,7
|
74,4±10,1
|
66,1±7,9**
|
73,7±7,4
|
Примечание: * – достоверность различий показателя в сравнении с исходными данными, р<0,05, ** – р<0,001; # – достоверность различий показателя в сравнении с таковым в контрольной группе, р<0,05 (t-критерий Стьюдента).
Отмечалась положительная динамика показателей СМАД у пациентов в обеих исследуемых группах. Средние величины САД и ДАД в дневные и ночные часы достоверно снизились как в основной, так и в контрольной группе, при этом в основной группе эти показатели достигли пороговых значений. Существенные изменения претерпел показатель вариабельности САД и ДАД за день и за ночь с достижением пороговых значений у пациентов, в комплексную терапию которых был включен препарат «Адаптол»®. Аналогичная динамика была получена в отношении ЧСС: достоверное снижение от 72,3 до 66,1 ударов в минуту было отмечено только в основной группе.
Обсуждение
Психосоциальные факторы являются независимыми факторами риска развития ССЗ, утяжеляют клиническое течение ССЗ и повышают риск кардиальной смерти в 3–6 раз [21]. Психологическое неблагополучие распространено гораздо шире, чем ранее предполагалось. По результатам масштабного российского многоцентрового исследования КОМЕТА (Н.В. Погосова, 2018), у пациентов с АГ и/или ИБС установлена широкая распространенность клинически выраженной тревожной и депрессивной симптоматики (25,5% и 16,3% соответственно) [7]. Кроме того, тревожно-депрессивные состояния потенцируют действие других факторов риска, являются барьерами к оздоровлению образа жизни пациентов и приему рекомендованной терапии и сопровождаются высоким риском снижения трудоспособности и инвалидизации [11].
Результаты анализа динамики АД у пациентов с АГ II степени и признаками тревожности в настоящем исследовании подтверждают данные наблюдений А.В. Сафроненко [8] и свидетельствуют, что добавление к антигипертензивным препаратам адаптола усиливает их гипотензивный эффект. Показано высоко достоверное снижение как офисного АД, так и показателей его суточного ритма.
В настоящем исследовании у пациентов основной группы отмечалось более значимое снижение вариабельности САД и ДАД в дневное и ночное время на фоне АГТ с включением адаптола в отличие от пациентов контрольной группы, получающих только антигипертензивное лечение. Сегодня известно, что риск развития сердечно-сосудистых осложнений у пациентов с АГ зависит не только от уровня АД, но и повышенной его вариабельности. По результатам клинических наблюдений и данных мета-анализа, повышенная вариабельность АД рассматривается как независимый прогностический фактор риска развития ССЗ, поражения органов-мишеней и смертности [14, 17–19, 24, 25]. Например, в проспективном исследовании K. Eguchi и соавт. (2012) установлено, что повышение вариабельности САД в ночное время более чем в 2,2 раза увеличивало риск развития инфаркта миокарда, инсульта и внезапной сердечной смерти у пациентов с АГ [14]. У молодых пациентов с АГ I степени увеличение вариабельности ≥12,8 мм рт. ст. при СМАД повышало риск развития ССО в 2,75 раза и коронарных событий – в 3,8 раза [21]. Результаты этих исследований позволяют рассматривать коррекцию повышенной вариабельности АД как одну из дополнительных целей эффективной терапии АГ [22]. Основными патофизиологическими механизмами, участвующими в увеличении краткосрочной и суточной вариабельности АД, являются нейрогуморальные нарушения, вегетативная дисфункция и изменения активности СНС, обусловленной центральной регуляцией из диэнцефальной области, ответственной также за эмоции и поведенческие реакции в ответ на стресс. Пациенты с АГ часто имеют вегетативную нестабильность, что приводит к колебаниям АД.
При проведении повторной информационной пробы гипертензивная реакция, отражающая активность симпатоадреналовой системы, в результате комплексной АГТ с включением адаптола снижалась. Устойчивое эмоциональное возбуждение приводит к постоянной самоактивации различных вегетативных процессов. В коре и лимбических образованиях головного мозга пациентов с АГ формируется застойный очаг возбуждения, существующий гораздо дольше, чем продолжительность гипертензивной реакции [10]. Адаптол®, влияющий на лимбические образования головного мозга, гармонизирует вегетативные процессы.
Повышенная тревожность всегда сопровождается вегетативными симптомами, обусловленными повышением активности симпатического отдела НС, в том числе кардиальными – сердцебиением, чувством перебоев в области сердца, болями в области сердца. Неспецифические соматические жалобы у пациентов с АГ и тревожными расстройствами имеют сочетанное происхождение и частично обусловлены психопатологической составляющей. Преимущество адаптола в купировании неспецифических соматических жалоб связано с его положительным влиянием на центральный патогенетический механизм формирования АГ за счет адаптогенного эффекта. Дополнительным критерием эффективности адаптола, включенного в комплексную терапию пациентов с АГ, являлось также позитивное влияние на качество сна.
При применении адаптола у пациентов с повышенной реактивной и личностной тревожностью на фоне АГ отмечалось более существенное снижение частоты сердечных сокращений (ЧСС) в течение суток по результатам СМАД. Известно, что ЧСС является независимым предиктором неблагоприятных событий и сердечно-сосудистой смертности – увеличение ЧСС на каждые 10 ударов в минуту повышает риск ССЗ на 15% и общей смертности на 17% [13]. Повышение ЧСС ассоциируется с развитием эндотелиальной дисфункции, увеличением артериальной жесткости и пульсового давления, что приводит к дальнейшему росту САД и сопровождается повышенной нагрузкой на органы-мишени при АГ [23].
Более выраженное снижение вариабельности АД и ЧСС на фоне комплексной антигипертензивной терапии с включением адаптогена Адаптол® может свидетельствовать о его положительном влиянии на вегетативную регуляцию и активность симпатического отдела ЦНС у пациентов с АГ.
Заключение
Включение адаптола в суточной дозе 1500 мг в комплексную терапию пациентов с АГ II степени и расстройствами тревожного спектра в течение 2 месяцев потенцирует гипотензивный эффект антигипертензивных препаратов, гармонизирует циркадный ритм АД, повышает уровень контроля ряда прогностически значимых показателей (средних величин), а также вариабельности САД и ДАД в дневное и ночное время, ЧСС.
Адаптол® в дозе 1500 мг в сутки эффективно снижает тревожность и вегетативную лабильность, а также улучшает сон у пациентов с АГ, что позволяет повысить переносимость психоэмоциональной нагрузки и работоспособность пациентов, улучшить качество их жизни.
Адаптол® показал хорошую безопасность и переносимость. За время лечения адаптолом не было отмечено негативных побочных реакций.
Адаптол® в суточной дозе 1500 мг может быть рекомендован для комплексной терапии пациентов с АГ II степени и повышенной тревожностью.
Л И Т Е Р А Т У Р А
1. Бурчинский С.Г. // Семейная медицина. – 2015. ? Т.2, №8. ? С.100–105.
2. Вейн А.М. Заболевания вегетативной нервной системы. – М., 1991. – 624 с.
3. Гребень Н.Ф. Психологические тесты для профессионалов. – Минск, 2007. – 487 с.
4. Громов Л.А., Дудко Е.Т. // Вестник фармакологии и фармации. ? 2003. ? №10. ? С.1–17.
5. Ланг Г.Ф. Гипертоническая болезнь и центральная нервная система. Избранные труды. – Л., 1975. – С.37–53.
6. Павлова О.С., Ливенцева М.М. Клиническое применение суточного мониторирования артериального давления: Практическое руководство для врачей. – М., 2016. – 26 с.
7. Погосова Н.В., Бойцов С.Б., Оганов Р.Г. и др. // Кардиология. – 2018. – Т.23, №58 (11). – С.5–16.
8. Сафроненко А.В. // Фундаментальные исследования. – 2011. – №9 (ч.2). – С.295–298.
9. Сидоренко Г.И., Павлова А.И., Нечесова Т.А., Фролов А.В. Психофизиологический тест (информационная проба) и его возможности использования в кардиологии. – Мн., 1982. – 10 с.
10. Судаков К.В. Теория функциональных систем и другие ведущие теории физиологии: Функциональные системы организма. – М., 1987. – С.49–97.
11. Шулутко Б.Н. Артериальная гипертензия. – СПб, 2001. – 382 с.
12. 2016 European Guidelines on cardiovascular disease prevention in clinical practice // European Heart. – 2016. – Vol.37. – P.2315–2381.
13. Aune D., Sen A., O’Hartaigh B., et al. // Nutr. Metab. Cardiovasc. Dis. – 2017. – Vol.27. – P.504–517.
14. Eguchi K., Hoshide S., Schwartz J.E., Shimada K., Kario K. // Am. J. Hypertens. – 2012. – Vol.25, N9. – P.962–968.
15. Liu M.Y., Li N., Li W.A., Khan H. // Neurol. Res. – 2017. – Vol.39, N6. – P.573–580.
16. Marvar P.J., Harrison D.G. // Experimental physiology. – 2012. ? Vol.97, N11. ? P.1161–1167.
17. Mena L.J., Felix V.G., Melgarejo J.D., Maestre G.E. // J. Am. Heart Assoc. – 2017. – Vol.19, N6 (10). pii: e006895.
18. Palatini P., Saladini F., Mos L., et al. // J. Hypertens. – 2019. – Vol.37. , N7. – P.1419–1426.
19. Parati G., Ochoa J.E., Lombardi C., Bilo G. // Curr. Hypertens Rep. – 2015. – Vol.17, N4. – P.537.
20. Reoloux L. Neurotransmitter basis of anxiety. Anxiety: basic and clinical research. – N.Y., 2001. ?P.36–50.
21. Roest A.M., Martens E.J., de Jonge P., Denollet J. // J. Am. Coll. Cardiol. – 2010. – Vol.29, N56 (1). – P.38–46.
22. Rothwell P.M., Howard S.C., Dolan E., et al. // Lancet Neurol. – 2010. – Vol.9, N5. – P.469–480.
23. Tadic M., Cuspidi C., Grassi G. // Eur. J. Clin. Invest. – 2018. –Vol.48, N3.
24. Van den Hoogen P.C., Feskens E.J., Nagelkerke N.J., Menotti A., Nissinen A., Kromhout D. // The N. Engl. J. of Med. – 2000. – Vol.342, N1. – P.1–8.
25. Wang X., Wang F., Chen M., Wang X., Zheng J., Qin A. // Clin. Interv. Aging. – 2018. – Vol.4, N13. – P.533–540.
Медицинские новости. – 2019. – №9. – С. 10-16.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.