Внимание! Статья адресована врачам-специалистам
Mokhort T.V.
Belarusian State Medical University, Minsk
Insulin therapy in the type 2 diabetes treatment: modern accents of basal insulin therapy
Резюме. Рассмотрены принципы инициации инсулинотерапии, представлены данные по режимам интенсификации инсулинотерапии при сахарном диабете 2-го типа. Обосновано использование современных аналогов инсулина, обеспечивающих минимальный риск развития гипогликемических эпизодов. Рассмотрены возможности титрации базального инсулина с целью достижения целевых показателей.
Ключевые слова: сахарный диабет 2-го типа, базальная инсулинотерапия, гипогликемии, инсулиновые аналоги, гларгин-300.
Медицинские новости. – 2020. – №7. – С. 22–29.
Summary. This article discusses the principles of the insulin therapy initiation and presents data on the modes of the insulin therapy intensification in type 2 diabetes mellitus (DM2). The use of modern insulin analogues that provide a minimal risk of hypoglycemic episodes is justified. The possibilities of basal insulin titration in order to achieve the target indicators are considered.
Keywords: type 2 diabetes mellitus, basal insulin therapy, hypoglycemia, insulin analogues, glargine-300.
Meditsinskie novosti. – 2020. – N7. – P. 22–29.
Сахарный диабет 2-го типа (СД2) является глобальной проблемой, что обусловлено динамикой прироста количества больных и его влиянием на качество и продолжительность жизни. Данные по динамике количества пациентов с СД2 приведены на рисунке 1. Этиопатогенетические характеристики СД2 включают две базисные особенности – инсулинорезистентность (ИР) и дефицит секреции инсулина, которые наряду с другими факторами определяют хроническую гипергликемию. Доступные на современном этапе лекарственные средства оказывают влияние на различные звенья патогенеза (ИР, нарушения секреции инсулина, инкретинов, кишечной микробиоты, снижение экскреции глюкозы почками и др.). Достаточно широкий перечень антигипергликемических препаратов определил необходимость выработки алгоритма последовательного выбора тактики лечения (рис. 2). Последние рекомендации по лечению СД2 определяют этапность выбора добавляемых к метформину антигипергликемических препаратов в зависимости от коморбидной патологии и социальных условий, отдавая предпочтение ингибиторам натриевого котранспортера глюкозы-2 (ИНКТГ-2) и агонистам рецепторов глюкагон-подобного пептида 1 (арГПП-1) у пациентов с установленными сердечно-сосудистыми заболеваниями атеросклеротического генеза или признаками высокого риска (пациенты старше 55 лет со стенозом 50% в артериях нижних конечностей, каротидных, коронарных артериях, гипертрофия миокарда левого желудочка), установленными болезнями почек и сердечной недостаточностью [1, 2]. В качестве препаратов первого выбора инъекционной терапии после исчерпанности потенциального влияния пероральных глюкозоснижающих лекарственных средств называются арГПП-1, что обусловлено доказательствами во множественных исследованиях и мета-анализах не только глюкозоснижающего влияния, но также редукции массы тела и снижение смерти от всех причин и кардиоваскулярной смертности, а также нефатального инфаркта миокарда, нефатального инсульта и госпитализации по причине сердечной недостаточности [3]. Принимая во внимание неоднородность классов лекарственных средств, рекомендуется делать индивидуальный выбор, основываясь на имеющихся доказательствах, перечисленных выше преимуществах, у каждого из представителей класса в отдельности. Следует понимать, что класс препаратов арГПП-1 является достаточно дорогим, что существенно ограничивает потенциал использования. В США, по данным 2018 года, только 8% пациентов применяют этот класс в качестве препарата второй линии.
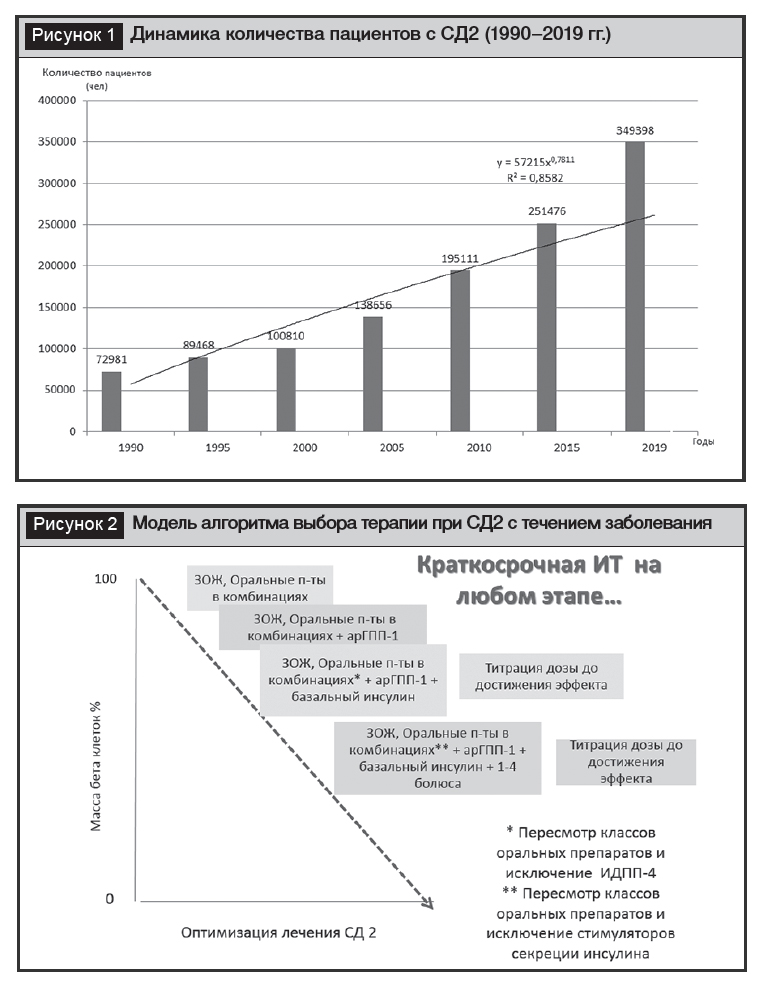
В то же время с учетом понимания прогрессивного снижения инсулиновой секреции с длительностью СД2 аксиомой диабетологии является понимание факта необходимости инсулинотерапии (ИТ) практически у всех пациентов в случаях недостижения компенсации, непереносимости или появления противопоказаний для не инсулиновых препаратов. На инициацию ИТ оказывают влияние различные факторы, включающие:
– целевые уровни компенсации, принятые для пациента;
– массу тела пациента;
– коморбидную патологию, определяющую риски гипогликемических эпизодов;
– предшествующую антигипергликемическую терапию;
– точку зрения врача, основанную на его знаниях, убеждениях и опыте;
– действующие рекомендации и протоколы.
При этом следует учитывать потенциальные пользу ИТ и факторы, требующие внимания и активного взаимодействия врача с пациентом, что может ограничивать использование ИТ.
Оценивая потенциальные влияния ИТ, следует помнить, что глюкозотоксичность, определяемая степенью гипергликемии, обусловливает снижение потенциального ответа ?-клетки. Систематический обзор 1645 исследований, из которых 7 были включены в мета-анализ (839 участников), показал, что инициация ИТ определяет оптимизацию гомеостаза функции ?-клеток по сравнению с исходным уровнем [5]. Более того, кратковременная ИТ может обеспечить краткосрочную ремиссию у пациентов с впервые выявленным СД2. В исследовании J. Weng и соавт. было показано, что доля лиц, вышедших на ремиссию СД2 при впервые выявленном заболевании с НbА1с более 9%, леченых краткосрочным назначением ИТ с многократным введением инсулина, помповой ИТ, выше, чем при использовании таблетированных препаратов [6]. Это важное наблюдение подтверждает пользу инициации ИТ при различных вариантах стрессовой гипергликемии, обусловленной интеркуррентными заболеваниями. Также доказано, что в сравнении с современными антигипергликемическими препаратами, включая арГПП-2, базальный инсулин лучше снижает уровень триглицеридов, повышение которых сопровождает декомпенсацию СД2 [7].
При принятии решения о начале ИТ вскоре или сразу после установления диагноза СД2 для постоянного лечения используются различные и неоднозначные подходы. Так, Американская ассоциация диабета рекомендует рассмотреть выбор инсулина для временной ИТ в качестве первого инъекционного препарата у пациентов с выраженными признаками декомпенсации, когда НbА1с >10% или уровень глюкозы в крови >16,7 ммоль/л, или возможен диагноз СД1. При недостижении компенсации при лечении комбинацией оптимальных доз неинсулиновых сахароснижающих препаратов, при исчерпанности рекомендаций по коррекции образа жизни или нежелании пациента следовать этим рекомендациям необходимо своевременное начало ИТ. Своевременным считается принятие решения не позднее чем через 3–6 месяцев получения терапии на предшествующем этапе (уровне) [1].
Российские алгоритмы оказания специализированной помощи больным СД предусматривают начало ИТ:
– у лиц с впервые выявленным СД2 – при уровне HbA1c, превышающем индивидуальный целевой уровень более чем на 2,5%, или наличии выраженной клинической симптоматики метаболической декомпенсации;
– у лиц с анамнезом СД2 – при отсутствии достижения индивидуальных целей гликемического контроля на фоне лечения оптимальными дозами других сахароснижающих препаратов или их комбинаций;
– при наличии противопоказаний к назначению или непереносимости других сахароснижающих препаратов [8].
Американская ассоциация клинических эндокринологов и Американская коллегия эндокринологии, рекомендовавшие в 2017 году инициацию ИТ после установления диагноза СД2 при наличии симптомного СД и HbA1c более 9,0%, в 2020 году более прагматично определили, что спустя 3 месяца лечения тремя не инсулиновыми препаратами терапия инсулином может быть инициирована при НbА1с менее 8% и более 8% (указывается на старт базального инсулина с различных доз: 0,1–0,2 и 0,2–0,3 ЕД/кг соответственно) [9].
Таким образом, различные рекомендации диктуют однотипный подход при некоторых различиях: ИТ должна быть начата своевременно (не позднее 3–6 месяцев) при стойком недостижении компенсации.
Главные факторы, требующие внимания, активного взаимодействия врача и пациента при начале ИТ и в некоторой мере лимитирующие адекватное использование ИТ, включают увеличение риска гипогликемий, массы тела и необходимость понимания пациентом правил управления заболеванием (учет питания, самоконтроль гликемии, навыки коррекции дозы инсулина и др.). (табл. 1). Именно эти факторы являются определяющими при выборе метода и оптимальных препаратов для ИТ. В то же время надо понимать, что когнитивный дефицит, зачастую имеющий место у пациентов с СД2, особенно пожилого возраста, также является фактором, требующим особого внимания медицинского персонала и лиц, осуществляющих уход.
Таблица 1. Польза ИТ и факторы, требующие внимания врача и пациента [4]
|
Полезные влияния ИТ
|
Факторы, требующие внимания, и способы управления
|
|
Снижение тощаковой и постпрандиальной гипергликемии, глюконеогенеза и продукции глюкозы печенью, неспецифического гликирования белков и липопротеинов.
Усиление секреции инсулина в ответ на прием пищи или стимуляцию глюкозой.
Подавление липолиза в постпрандиальном периоде и секреции глюкагона после приема пищи.
Стимуляция антиатерогенных изменений в профиле липидов и липопротеинов.
Активация аэробного и анаэробного гликолиза.
|
Прибавка массы тела – модификация образа жизни.
Риск гипогликемий – обучение, выбор препаратов инсулина с меньшим риском гипогликемий.
Ограничения при проведении инъекций и самоконтроля – обучение, выбор инсулинов, обеспечивающие гибкие режимы ИТ.
Необходимость адекватного реагирования на различные жизненные ситуации – обучение.
|
Гипогликемии являются фактором, существенно ограничивающим использование ИТ. При этом частота случаев гипогликемий в реальной практике выше, чем в рандомизированных клинических исследованиях (РКИ). Так, в наблюдательном исследовании 27 585 человек из 24 стран с СД1 или СД2, получавших ИТ в течение более 12 месяцев, проведено сравнение 4 РКИ и доказано, что частота симптоматических событий для общей, ночной и тяжелой гипогликемии была выше в наблюдательных исследованиях (19,3%, 3,7% и 2,5% соответственно) (рис. 3). В другом исследовании с использованием системы постоянного мониторинга гликемии у лиц с СД2 на ИТ 33% пациентов испытали ночные гипогликемии на протяжении всего 7-дневного периода мониторинга, 36% из них регистрировались в ночное время [10]. С позиции пациента, гипогликемии ограничивают достижение компенсации: страх гипогликемии снижает качество жизни, работоспособность и повышает медицинские затраты, уменьшая приверженность к лечению. Это приводит к пропуску инъекций, снижению дозы инсулина, создавая «порочный круг» и усугубляя риски развития хронических осложнений (рис. 4).
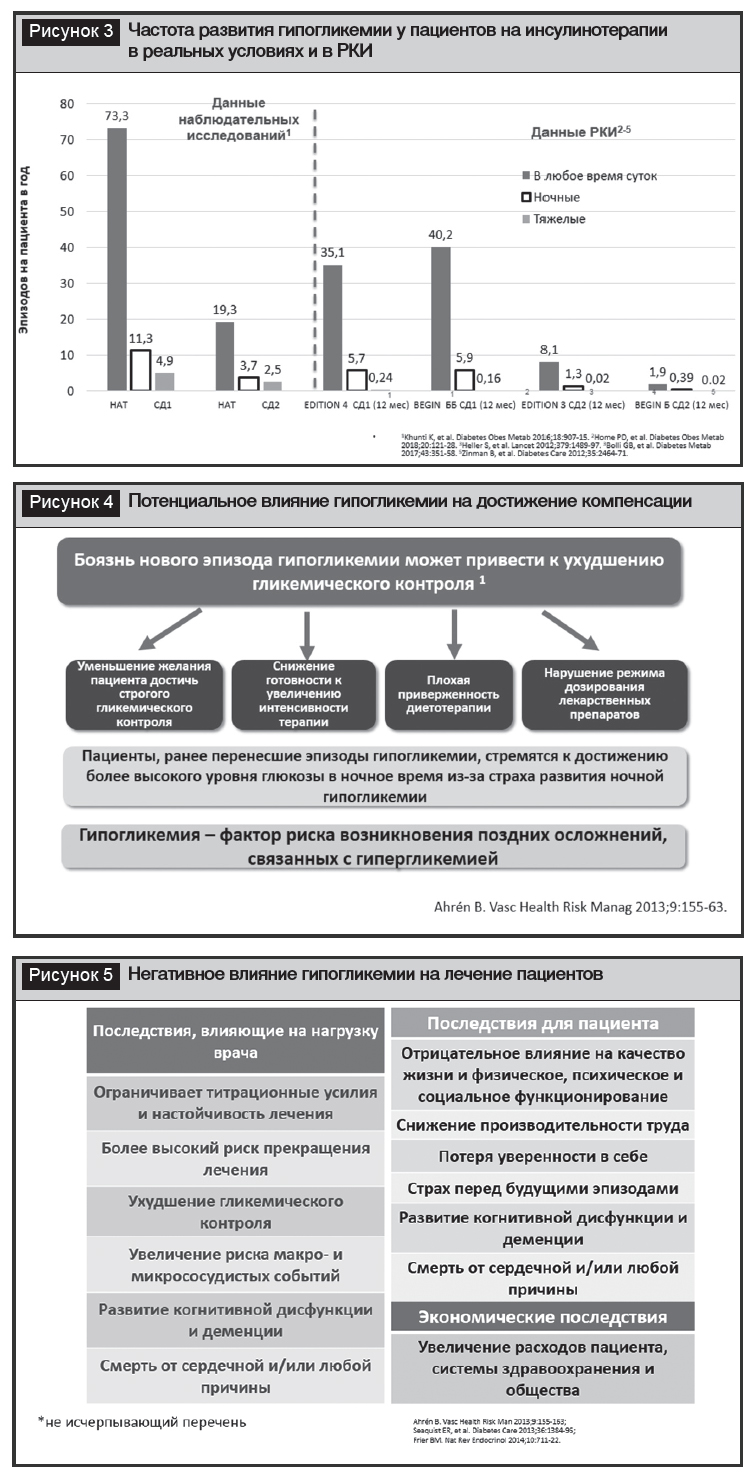
В настоящее время бесспорно доказано негативное влияние гипогликемий на увеличение кардиоваскулярной смертности [11–16], лечение лиц с СД2 включает нагрузку на врача, усугубляет последствия для пациента и системы здравоохранения (рис. 5) [17–19].
С другой стороны, существует эффект глюкозотоксичности, запускающий механизм метаболический памяти. Концепция метаболической памяти базируется на результировании стойких метаболических нарушений, следствий гипергликемии (неферментативного гликирования белков, активации оксидативного стресса, немикробного воспаления, вызывает эпигенетические изменения, включая нарушения метилирования ДНК, мРНК, модификацию гистона), в ускорение развития хронических осложнений СД. Очевидно, что тактика начала ИТ должна быть основана на балансе между минимизацией риска гипогликемий и компенсации гомеостаза глюкозы, предупреждающего развитие осложнений.
Проблема позднего начала ИТ при СД2 актуальна для большинства стран. Так, в Канаде средняя продолжительность диабета до начала ИТ – более 9 лет, а средний уровень НbА1с составляет 8,5% на момент инициации [4, 20]. Ретроспективное исследование, проведенное в Великобритании, показало, что среднее время начала ИТ – 7 лет при НbА1с ≥7,0%, а средний уровень НbА1с на начальном этапе на момент инициации составлял >9,0% [21]. В отличие от развитых стран, где более 30% больных СД2 получают различные варианты ИТ, в Беларуси только 18% пациентов получают ИТ в виде монотерапии или комбинированной терапии, что является одной из причин отсутствия компенсации СД. По данным национального регистра 2018 года, НbA1с более 7,5% зафиксирован более чем у 53% пациентов. При этом известно, что увеличение сроков инициации ИТ коррелирует с повышением частоты развития сосудистых осложнений (рис. 6) [22].
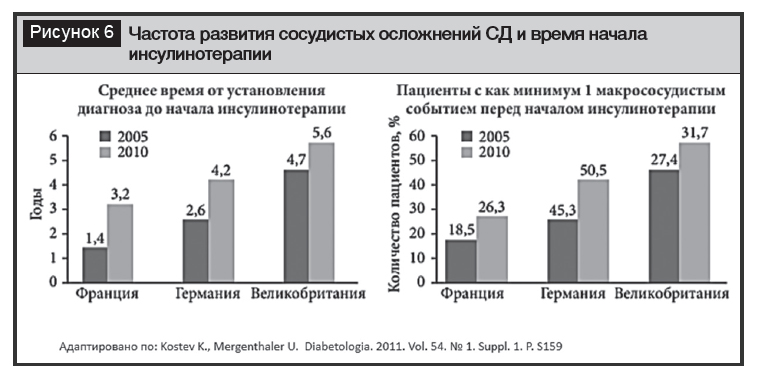
Инертность при выборе в качестве лечения ИТ обусловлена наличием психологических барьеров со стороны пациента и врача. Согласно проведенным опросам врачей и пациентов с СД2, более 75% врачей вовремя не назначают инсулинотерапию из-за опасений развития гипогликемий [23].
С этих позиций важное значение приобретают не только показания для начала постоянной ИТ, но также:
– выбор метода ИТ (базальная, базис-болюсная);
– использование оптимальных препаратов инсулина;
– грамотная титрация дозы инсулина, обеспечивающая компенсацию при минимальном риске гипогликемий.
Выбор метода ИТ
Для выбора метода начала ИТ принципиальное значение имеет тот факт, что гомеостаз глюкозы осуществляется за счет баланса между продукцией глюкозы печенью и ее утилизацией периферическими тканями. Для СД2 характерна печеночная ИР, которая приводит к чрезмерной продукции глюкозы печенью – важнейшему фактору, определяющему уровень тощаковой гликемии. Успешное снижение гепатической продукции глюкозы при СД2 достигается ингибированием двух процессов: глюконеогенеза и гликогенолиза, что обеспечивается введением инсулина. Именно понимание этого механизма определяет необходимость начинать ИТ с вечерних инъекций пролонгированных препаратов инсулина для обеспечения тощаковой нормогликемии (базальная ИТ). Для этой цели могут быть использованы препараты инсулинов пролонгированного действия (НПХ, гларгин-100, гларгин-300 (торговое название «Туджео»), детемир, деглютек-100, деглютек-200).
Дальнейшее значительное снижение эндогенной секреции инсулина течением СД2 при неэффективности режима базальной ИТ требует необходимости базис-болюсной ИТ, то есть введения инсулина короткого действия перед приемами пищи. При этом возможно использование 1 подколки перед основным приемом пищи, а возможно использование и большего количества подколок. Старт базис-болюсной ИТ диктует необходимость участия пациента в лечении на основе знаний и навыков по учету употребляемой пищи, контролю уровней гликемии 4–6 раз в сутки и способности коррекции доз инсулина. Режим интенсивной ИТ возможен только у больных с сохранным интеллектом, без выраженных когнитивных нарушений, после соответствующего обучения и при условии регулярного мониторирования гликемии в течение суток. В случаях неспособности пациента или лиц, ответственных за уход за ним, интенсивная ИТ не показана, и должен быть рассмотрен вопрос о деинтенсификации терапии на фоне изменения целевых уровней компенсации.
Использование оптимальных препаратов инсулина
Выбор препаратов инсулина – важный аспект в оптимизации ИТ. Старт ИТ при СД2 определяет первоочередное использование базальных инсулинов, по-этому важно выбрать оптимальный препарат, обеспечивающий «плавный» профиль в течение времени действия. С момента появления первого пролонгированного препарата инсулина в 1936 году эволюция привела к внедрению беспиковых аналогов инсулина, которые могут быть использованы для создания базальной инсулинемии. Пролонгация действия инсулина может достигаться изменением аминокислотной последовательности в молекуле инсулина посредством применения рекомбинантной технологии; модификацией лекарственной формы для изменения самоассоциации молекул инсулина до или после инъекции; достижением обратимого связывания с альбумином сыворотки за счет добавления цепочки жирных кислот; повышением концентрации инсулина в сочетании с преципитацией в инъекционном депо после введения [24, 25].
Наряду с используемыми в Беларуси препаратами инсулина НПХ, гларгин-100, детемир альтернативным вариантом, доступным в настоящее время, является инсулин гларгин-300, который представляет собой в 3 раза более концентрированную форму инсулина гларгин-100, прекрасно себя зарекомендовавшего. В результате этой модификации гларгин-300 приобрел измененный фармакокинетический профиль с более длительным и плавным эффектом по сравнению с гларгином-100. Поскольку скорость высвобождения молекул инсулина из депо пропорцио-нальна площади поверхности депо препарата, меньший объем преципитата гларгина-300 обеспечивает более медленное поступление (рис. 7). Уникальный механизм действия гларгина-300 обеспечивается увеличением времени его нахождения в подкожном депо при введении идентичной дозы в меньшем объеме и в конечном итоге приводит к более медленному и постепенному высвобождению мономерной формы гларгина-300 по сравнению с гларгином-100 [26, 27].
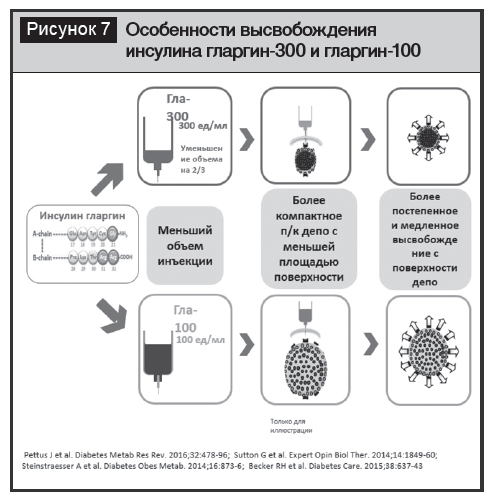
Инсулин НПХ для обеспечения суточного профиля инсулинемии должен вводиться 2 раза в сутки, гларгин-100 и детемир в большинстве случаев вводятся однократно, так как особенности структуры инсулина обеспечивают постепенный характер распределения препарата и пролонгирование фармакодинамического профиля для максимально возможного соответствия нормальным физиологическим уровням базального [28, 29]. Аналоги базального инсулина второго поколения позволяют обеспечить пролонгирование действия, превышающее суточное воздействие (гларгин-300 – приблизительно 32 часа; деглютек – минимум 42 часа), и назначаются 1 раз в сутки c возможностью смещать время инъекции (на ±3 часа для гларгина-300) при сохранении параметров эффективности и безопасности, что удобно для пациента и позволяет оптимизировать его комплаентность.
Профиль действия инсулина гларгин-300 изучен в исследовании с использованием метода клэмпа. В исследовании R.H. Becker и соавт. сравнивали фармакокинетические характеристики инсулинов гларгин-100 и гларгин-300. Согласно результатам этого исследования, при подкожном введении последнего его фармакокинетический и фармакодинамический профили были более ровными и пролонгированными, чем у гларгина-100 [30].
С позиций доказательной медицины для клиницистов имеют значение результаты использования лекарственного средства, позволяющие оценить его клинические преимущества. Факт преимущества пролонгированных аналогов инсулина первого поколения перед НПХ по влиянию на частоту гипогликемических событий бесспорен, поэтому аналоги инсулина второго поколения сравнивались для целей регистрации с общепризнанным стандартом базальных инсулинов, гларгином-100. Дилемма настоящего времени – сравнение различных пролонгированных аналогов инсулина.
Для получения доказательств сравнительной эффективности и безопасности гларгина-300 была проведена программа прямых сравнительных клинических исследований EDITION, которая состояла из 3 исследований, включающих пациентов с СД2 и объединенных схожим дизайном. Конечные точки исследований включали динамику уровня HbA1c за 6 месяцев; долю участников, имеющих хотя бы 1 эпизод подтвержденной (≤3,9 ммоль/л) или тяжелой ночной (00:00–05:59 ч) гипогликемии с 9-й недели до 6-го месяца исследования; количество гипогликемий на 1 пациента в год; уровень тощаковой гликемии (плазмы) при самоконтроле; долю участников с HbA1c менее 7,0% (6,5%) или уровня тощаковой гликемии менее 5,6 (6,7) ммоль/л; изменение базальной и общей суточной дозы инсулина; динамику массы тела. С учетом важности оценки гипогликемий они градировались по типу (тяжелая, подтвержденная, симптоматическая, бессимптомная, общая); по уровню глюкозы (≤3,9, ≤3,0 ммоль/л). Также выделялась тяжелая или подтвержденная гипогликемия, оценивалась безопасность и переносимость лекарственных средств. При проведении исследований соблюдался принцип «лечение до цели», которая определена как достижение уровня глюкозы плазмы натощак 4,4–5,5 ммоль/л.
Эти исследования включали различных пациентов с СД2:
– EDITION-1 – пациенты с недостаточно контролируемым СД2 при использовании базального, прандиального инсулина в комбинации с пероральными сахороснижающими препаратами (ПССП) [31];
– EDITION-2 – пациенты, которые получали ранее базальный инсулин в комбинации с ПССП [32];
– EDITION-3 – пациенты, которые получали ПССП, и ИТ назначалась им впервые [33].
На основании результатов перечисленных исследований был проведен мета-анализ, который позволил заключить, что при достижении равноценного гликемического контроля (по уровню НbА1с и тощаковой гликемии) у пациентов, получавших гларгин-300, была ниже частота подтвержденной (≤3,9 ммоль/л) или тяжелой гипогликемии в ночное (относительное различие 31%) и любое время (относительное различие 14%). Кумулятивное число подтвержденных (≤3,9 ммоль/л) или тяжелых гипогликемических событий в любое время суток и ночных гипогликемий было ниже у пациентов, получавших гларгин-300. Прибавка в весе была низкой (<1 кг) в обеих группах с меньшим увеличением при использовании гларгина-300 (средняя разница – 0,28 кг (95% ДИ 0,55–0,01); р=0,039) (рис. 8) [34].
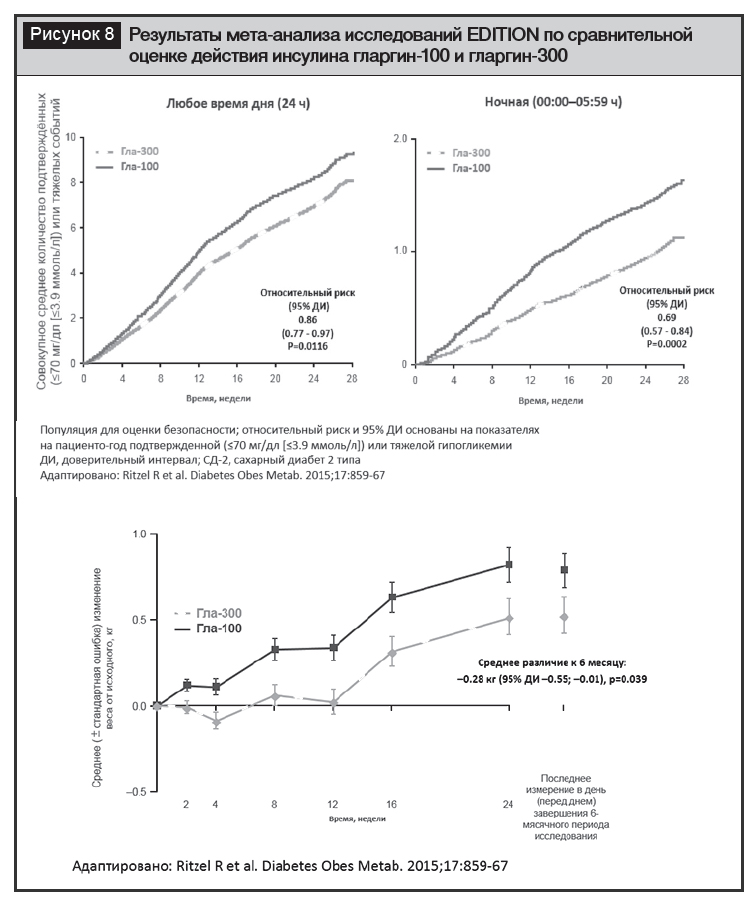
Более позднее исследование BRIGHT у пациентов с СД2, не получавших предшествующей ИТ (рандомизированное прямое сравнительное исследование), анализировало результаты использования гларгина-300 и инсулина деглудек-100 в течение 24 недель, продемонстрировало сходные результаты по контролю гликемии при сопоставимой частоте развития гипогликемических эпизодов [35]. В этом исследовании в период титрования дозы (в течение первых 12 недель лечения) в группе гларгина-300 частота гипогликемий и доля пациентов с ≥1 эпизодом гипогликемии была достоверно ниже. Частота подтвержденных (≤3,9 ммоль/л) и тяжелых гипогликемий в течение суток была на 23% (отношение частот) ниже в группе инсулина гларгина-300, а ≤3,0 ммоль/л – на 43%. Доля пациентов с ≥1 эпизодом (≤3,9 ммоль/л) и тяжелых гипогликемий в течение суток также достоверно на 26% ниже при применении гларгина-300, а ≤3,0 ммоль/л – 37%. Частота ночных подтвержденных (≤3,9 ммоль/л) и тяжелых гипогликемий была на 35% достоверно ниже в группе пациентов, получавших гларгин-300. Таким образом, авторы заключают, что выбор между этими базальными аналогами инсулина пролонгированного действия может основываться на клинических соображениях, доступности и стоимости препаратов.
Важным аспектом оценки инсулина является вариабельность его действия, влияющая на конечный результат достижения cтабильной компенсации, как показатель качества гликемического контроля и значимый самостоятельный предиктор диабетических осложнений [36]. При использовании клэмп-метода коэффициент вариабельности гларгина-300 по оценке показателя площади под кривой составил 34%, что существенно ниже, чем аналогичный коэффициент для инсулина НПХ, гларгин-100 [37]. В клэмп-исследовании фармакокинетики и фармакодинамики гларгина-300 и деглюдека в равновесном состоянии у пациентов с СД1 гларгин в дозировке 0,4 ЕД/кг/сутки продемонстрировал более стабильный фармакодинамический профиль (колебания скорости инфузии глюкозы в течение дня на 20% меньше) [38]. Инсулины гларгин-300 и деглюдек показали сходные низкие (27,6% и 28,0% соответственно) коэффициенты вариабельности инсулина по данным 8-точечного профиля глюкозы у пациентов с СД2 в исследовании BRIGHT [35].
Следует отметить, как уже известно, аналоги инсулина снижают риск развитя гипогликемических событий, а аналоги второго поколения, включая гларгин-300, полностью отвечают требованиям клиницистов и потребностям пациентов.
Титрация дозы инсулина
Этап инициации ИТ, обеспечивающий компенсацию при минимальном риске гипогликемий, важен с нескольких позиций. Во-первых, начало ИТ сопряжено с психологическим стрессом для больных, а развитие гипогликемического эпизода усугубляет боязнь следующих эпизодов и комплаентность пациента. Во-вторых,эпизоды гипогликемии в течение первых 3 месяцев после начала лечения базальным инсулином являются прогностическим фактором риска повторных гипогликемий в течение последующих 3–24 месяцев.
В одно из исследований было включено 40 627 пациентов из Европы и США, из которых 20,9% и 27,8% соответственно достигли целевого HbA1c ≤7% через 3 и 24 месяца после начала базальной ИТ. Невозможность достижения HbA1c ≤7% через 3 месяца была ассоциирована с повышенным риском недостижения цели через 24 месяца (отношение шансов 3,70 (95% ДИ 3,41–4,00)). Развитие гипогликемического эпизода в течение начального 3-месячного периода была связана с более длительным риском этих событий в течение последующих 3–24 месяцев (отношение шансов 5,71 (95% ДИ 4,67–6,99)) [39]. Приведенные результаты подтверждают необходимость ранних антигипергликемических вмешательств, которые более эффективно контролируют уровень глюкозы в крови без увеличения риска развития гипогликемии. Этому требованию соответствуют препараты длительно действующих аналогов инсулина, профиль действия которых, как указывалось выше, максимально приближен к характеристикам идеального базального инсулина, в число которых входит минимальный риск индукции гипогликемии.
В лечении инсулином выделяют два отдельных периода, каждый из них имеет потенциально различный риск развития гипогликемии. Начальный период, или период титрования дозы, в большинстве случаев продолжается 6–12 недель, а после этого начинается период поддерживающей терапии, в течение которого доза инсулина остается стабильной, за исключением случаев коррекции дозы по нуждам пациента (например, гипогликемии, погрешности питания). В начальном периоде ИТ в условиях реальной клинической практики отмечается наиболее выраженный гликемический ответ. По результатам 15 РКИ с использованием различных комбинаций антигипергликемических лекарственных средств и стратегии «терапия до достижения цели», титрование дозы инсулина проводилось преимущественно в первые 12 недель [39, 40].
Алгоритм титрации дозы базального инсулина согласно стандартам лечения СД начинается с добавления базального аналога или НПХ-инсулина перед сном со стартовой дозы выбранного препарата (обычно 10 ЕД/сутки или 0,1–0,2 ЕД/кг массы тела). Вариант титрации дозы инсулина – увеличение дозы на 2 ЕД каждые 3 дня до достижения целевого уровня гликемии натощак без гипогликемии. При регистрации эпизода гипогликемии должен быть проведен анализ причины и, в случае неясной этиологии, рекомендуется снизить дозу на 10–20%. При использовании инсулина НПХ перед сном и не достижении компенсации в течение дня следует рассмотреть переход на 2-кратный режим введения НПХ. При определении утренней дозы следует исходить из того, что вечерняя составляет 1/3 cуточной (ориентировочная суточная доза – 0,1–0,2 ЕД/кг массы тела), поэтому утренняя доза должна составить 2/3. Далее титрация проводится на основании индивидуализированных целей.
В качестве альтернативного варианта может быть использована схема титрации инсулина, основанная на дифференцированном выборе коррекционной дозы титрации в зависимости от гликемии (табл. 2).
Таблица 2. Значения коррекционной дозы титрации в зависимости от тощаковой гликемии
|
Уровень глюкозы плазмы натощак (ммоль/л)
|
Коррекция дозы инсулина
|
|
Менее 4,4
|
-2 ЕД
|
|
4,5–6,1
|
не изменяется
|
|
6,2–7,8
|
+2 ЕД
|
|
7,9–10,0
|
+4 ЕД
|
|
Более 10,0
|
+6 ЕД
|
Могут быть выбраны и другие алгоритмы титрования дозы базального инсулина, если они соответствуют требованиям. Алгоритм титрования дозы – простой, эффективный и безопасный, то есть должен быть простым для обучения и удобным для применения и в то же время снижать риск развития гипогликемических эпизодов или увеличения массы тела при обеспечении гликемического контроля.
Среди пациентов с СД2, согласно данным национального регистра СД в Республике Беларусь, среди общего количества более 23% составляют пациенты 75 лет, поэтому важно определить тактику ИТ, в частности, введения базального инсулина у пожилых. Современные рекомендации, разработанные специально для пожилых, обращают внимание на некоторые аспекты [41]. Во-первых, важно определить состояние здоровья и разумные целевые уровни гликемии (табл. 3). Во-вторых, следует помнить об ограничениях использования антигипергликемической терапии у пожилых. Основные ограничения ИТ включают высокий риск развития гипогликемий и увеличения массы тела. У пожилых пациентов важно оценивать:
Таблица 3. Концептуальная основа для учета общего состояния здоровья и ценности пациентов при определении клинических целей у пожилых
|
Общая категория здоровья
|
1-я группа
Хорошее состояние здоровья
|
2-я группа
Умеренное состояние здоровья
|
3-я группа
Плохое состояние здоровья
|
|
Характеристики пациента
|
Нет сопутствующих заболеваний
1–2 хронические болезни* (кроме СД)
И
Нет ПдД нарушения
и ≤1 ИПдД нарушения
|
3 и более хронических болезней* и/или любой из следующих:
умеренное когнитивное нарушение или ранняя деменция
≥2 ИПдД нарушения
|
Любой из следующих: терминальная стадия заболевания**
от умеренной до тяжелой деменция
≥2 ПдД нарушения проживание в учреждении долгосрочного ухода
|
|
Разумные диапазоны глюкозы и HbA1c по группам
Совместное принятие решений: индивидуализированная цель может быть ниже или выше
|
|
Использование лекарств,
которые могут вызвать гипогликемию
|
Да
|
Натощак: 5,0–7,2 ммоль/л Перед сном:
5,0–8,3 ммоль/л
НbА1с <7,5%
|
Натощак: 5,0–8,3 ммоль/л
Перед сном:
5,5–10,0 ммоль/л
НbА1с <8%
|
Натощак: 5,5–10,0 ммоль/л
Перед сном: 6,1–11,1 ммоль/л
НbА1с <8,5%
|
|
Нет
|
Натощак:
5,0–8,3 ммоль/л
Перед сном: 5,5–10,0 ммоль/л
НbА1с 7,0–7,5%
|
Натощак: 5,5–8,3 ммоль/л
Перед сном: 8,3–10,0 ммоль/л
НbА1с 7,5–8,0%
|
Натощак: 5,5–10,0 ммоль/л
Перед сном: 8,3–13,9 ммоль/л
НbА1с 8,0–8,5%
|
Примечание: * – хронические болезни: остеоартрит, артериальная гипертензия, инсульт, хроническая болезнь почек (ХБП) ст. 1–3 и др.; ** – терминальная стадия заболевания: метастатический рак, кислородно-зависимое заболевание легких, запущенное заболевание сердца, терминальная почечная недостаточность требует диализа.
– их способность к автономному функционированию;
– их комплаентность с учетом когнитивного потенциала, зрительных и моторных функций;
– скорость клубочковой фильтрации (СКФ), так как ее снижение приводит к увеличению периода полувыведения инсулина и снижению потребности в нем, что диктует необходимость регулярного контроля гликемии.
Аналоги инсулина, в том числе гларгин-300, являются прекрасной альтернативой. Недавний мета-анализ показал, что инсулин гларгин-300 у лиц старше 65 лет (662 пациента) обеспечивает снижение риска ночной гипогликемии по сравнению с гларгином-100 при равнозначной эффективности по снижению гликемии [42].
Анализ в подгруппах в зависимости от возраста пациентов в исследовании BRIGHT показал, что у пациентов пожилого возраста (≥70 лет), получавших гларгин-300, наблюдалось более выраженное снижение HbA1c (-0,34%, 95% ДИ -0,59–-0,1), чем у получавших деглюдек. При этом отмечался сопоставимый риск гипогликемии в обеих группах [43]. Субанализ BRIGHT renal показал, что у лиц с нарушением функции почек (СКФ <60 мл/мин/1,73 м2), получавших гларгин-300, было более выраженное снижение HbA1c (-0,43%, 95% ДИ -0,74–-0,12), чем у пациентов, получавших деглюдек, со сходными показателями по встречаемости и частоте эпизодов гипогликемии [44].
Сложностью проведения ИТ у пожилых пациентов часто является необходимость максимально допустимой деинтесификации режима терапии и частую потребность в помощи лица, осуществляющего уход, если возможности больного ограничены. Этот факт значимо ограничивает использование прандиальных доз инсулина. С этих позиций пролонгированные аналоги инсулина предоставляют выход, связанный с минимальным риском для пациента.
Дополнительно при ИТ важно определитьизменение алгоритма самоконтроля гликемии и переход на определение уровня гликемии несколько раз в сутки и целевой уровень глюкозы в крови натощак, который является определяющим для коррекции дозы базального инсулина, вводимого перед сном. В подавляющем большинстве случаев целевой уровень гликемии натощак – 4,4–7,0 ммоль/л.
Также важно понимать, что суточная доза базального инсулина в большинстве исследований у пациентов, не получавших ранее инсулин (инсулин-наивных), составляет 40–50 МЕ [45–47].
Заключение
Бесспорно, ИТ – рациональный метод лечения СД2, практически не имеющий ограничений. Физиологически обоснованным стартом ИТ является назначение базальной ИТ, а использование аналогов, включая современный аналог инсулина гларгин-300, ассоциировано с минимальным количеством гипогликемических эпизодов. Министерством здравоохранения Республики Беларусь 10.04.2020 года принят приказ №417 «Об обеспечении пациентов с сахарным диабетом лекарственными средствами инсулина», которым утверждена концепция поэтапного (2020–2025 гг.) расширения обеспечения лекарственными генно-инженерными инсулинами человека в картриджах и аналогами инсулина в картриджах с целью оптимизации исходов лечения СД, что отвечает мировым тенденциям проведения ИТ.
Л И Т Е Р А Т У Р А
1. American Diabetes Association. 2. Pharmacologic approaches to glycemic treatment: Standards of Medical Care in Diabetes 2020 // Diabetes Care. – 2020. – Vol.43, Suppl.1. – S98–S110.
2. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD The Task Force for diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and the European Association for the Study of Diabetes (EASD) // Eur. Heart J. – 2019. – 00. – P.1–69.
3. Wang Q., Liu L., Gao L., Li Q. // . – 2018. – Vol.143. – P.34–42. Diabetes Res. Clinical Practice
4. Berard L., Antonishyn N., Arcudi K., et al. // Diabetes Ther. – 2018. – N9. – P.501–519.
5. Kramer C.K., Zinman B., Retnakaran R. // Lancet Diabetes Endocrinol. – 2013. – Vol.1, N1. – P.28–34.
6. Weng J., Li Y., Xu W., et al. // Lancet. – 2008. – Vol.371. – P.1753–1760.
7. Rigato M., Avogaro A., Vigili de Kreutzenberg S., Fadini G.P. // JCEM. – 2020. – DOI: 10.1210/clinem/dgaa178.
8. Клинические рекомендации «Алгоритмы специализированной медицинской помощи больным сахарным диабетом» / Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова // 9-й выпуск (дополненный). – М., 2019. – 214 c.
9. Garber A.J., Handelsman Y., Grunberger G., et al. // Endocr. Pract. – 2020. – Vol.26, N1. – P.107–139.
10. Pazos-Couselo M., García-López J.M, González-Rodríguez M., et al. // Can. J. Diabetes. – 2015. – Vol.39. – P.428–433.
11. ACCORD Study Group. // NEJM. – 2008. – Vol.358. – P.2545–2559.
12. Zinman B., Marso S.P., Christiansen E., et al. // Diabetes. – 2017. – Vol.66, Suppl.1. – A95.
13. Duckworth W.C., Abraira C., Moritz T.E., et al. // J. Diabetes Complications. – 2011. – Vol.25. – P.355–361.
14. Goto A., Arah O.A., Goto M., et al. // BMJ. – 2013. – Vol.347. – P.f4533.
15. Zoungas S., et al. For the ADVANCE Collaborative Group // NEJM. – 2010. – Vol.363. – P.1410–1418.
16. Mellbin L.G., Rydén L., Riddle M.C., et al. For the ORIGIN Trial Investigators // Eur. Heart J. – 2013. – Vol.34. – P.3137–1344.
17. Ahrén B. // Vasc. Health Risk Man. – 2013. – N9. – P.155–163.
18. Seaquist E.R., Anderson J., Childs B.,et al. // Diabetes Care. – 2013. – Vol.36. – P.1384–1395.
19. Frier B.M. // Nat. Rev. Endocrinol. – 2014. – N10. – P.711–722.
20. Harris S.B., Kapor J., Lank C.N., et al. // Can. Fam. Phys. – 2010. – Vol.56, N12. – P.e418–424.
21. Khunti K., Wolden M.L., Thorsted B.L., et al. // Diabetes Care. – 2013. – Vol.36, N11. – P.3411–3417.
22. Kostev K., Mergenthaler U. // Diabetologia. – 2011. – Vol.54, N1. – S159.
23. Goodall G., Sarpong E.M., Hayes C., Valentine W.J. // BMC Endocr. Disord. – 2009. – N9. – P.199.
24. Cheng A.Y.Y., Patel D.K., Reid T.S., Wyne K. // Adv. Ther. – 2019. – Vol.36. – P.1018–1030.
25. Pettus J., Santos Cavaiola T., Tamborlane W.V., Edelman S. // Diabetes Metab. Res. Rev. – 2016. – Vol.32. – P.478–496.
26. Anderson J.E. // J. Fam. Pract. – 2016. – Vol.65. – S23–28.
27. Sutton G., Minguet J., Ferrero C., Bramlage P. // Expert Opin. Biol. Ther. – 2014. – N14. – P.1849–1860.
28. Evans M., Schumm-Draeger P.M., Vora J., King A.B. // Diabetes Obes. Metab. – 2011. – N13. – P.677–688.
29. Pandyarajan V., Weiss M.A. // Curr. Diab. Rep. – 2012. – N12. – P.697–704.
30. Becker R.H., Dahmen R., Bergmann K., et al. // Diabetes Care. – 2014. – Vol.38, N4. – P.637–643.
31. Riddle M.C., Bolli G.B., Ziemen M., et al. // Diabetes Care. – 2014. – Vol.37. – P.2755–2762.
32. Yki-Jarvinen H., Bergenstal R., Ziemen M., et al. // Diabetes Care. – 2014. – Vol.37. – P.3235–3243.
33. Bolli G.B., Riddle M.C., Bergenstal R.M., et al. // Diabetes Obes. Metab. – 2015. – N17. – P.386–394.
34. Ritzel R., Roussel R., Bolli G.B., et al. // Diabetes Obes. Metab. – 2015. – Vol.17, N9. – P.859–867.
35. Rosenstock J., Cheng A., Ritzel R., et al. // Diabetes Care. – 2018. – Vol.41. – P.2147–2154.
36. Zinman B., Marso S.P., Poulter N.R., et al. // Diabetologia. – 2018. – Vol.61. – P.48–57.
37. Becker R.H., Nowotny I., Teichert L., et al. // Diabetes Obes. Metab. – 2015. – Vol.17, N3. – P.261–267.
38. Bailey T.S., Pettus J., Roussel R., et al. // Diabetes Metab. – 2018. – Vol.44. – P.15–21.
39. Mauricio D., Meneghini L., Seufert J., et al. // Diabetes Obes. Metab. – 2017. – Vol.19, N8. – P.1155–1164.
40. Owens D.R., Traylor L., Dain M.P., Landgraf W. // Diabetes Res. Clin. Pract. – 2014. – Vol.106, N2. – P.264–274.
41. LeRoith D., Biessels G.J., Braithwaite S.S., et al. // JCEM. – 2019. – Vol.104, N5. – P.1520–1574.
42. Yale J.F., Aroda V.R., Charbonnel B., et al. // Diabetes & metabolism. – 2018. – https://doi.org/10.1016/j.diabet.2018.10.002.
43. Charbonnel B., Aroda V.R., Westerbacka J., et al. // Diabetes. – 2019. – Vol.68, N1. – DOI: 10.2337/db19-131-LB.
44. Haluzík M., Philis-Tsimikas A., Bosnyak Z., et al. // Diabetes. – 2019. – Vol.68, N1. – DOI: 10.2337/db19-146-OR.
45. Cheng A.Y.Y. // Can. Diabetes. – 2011. – Vol.24, N1. – P.3–9.
46. Zinman B., Philis-Tsimikas A., Cariou B., et al. // Diabetes Care. – 2012. – Vol.35, N12. – P.2464–2471.
47. Berard L., Bonnemaire M., Mical M., Edelman S. // Diabetes Obes. Metab. – 2018. – Vol.20, N2. – P.301–308.
Медицинские новости. – 2020. – №7. – С. 22-29.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.