Внимание! Статья адресована врачам-специалистам
Mokhort T.V.
Belarusian State Medical University, Minsk
Glucocorticosteroids in general practice: balanced approach
and features of long-term patient management
Резюме. Приведены современные данные литературы о последствиях глюкокортикостероидной терапии в терапевтической практике. Проведен анализ потенциальных проявлений ятрогенного гиперкортизолизма и надпочечниковой недостаточности после использования супрафизиологических доз глюкокортикостероидов. Особое внимание уделено режимам приема, правилам снижения дозы глюкокортикостероидов, а также особенностям диагностики надпочечниковой недостаточности на фоне отмены. Рассмотрены принципы ведения пациентов с надпочечниковой недостаточностью.
Ключевые слова: глюкокортикостероидные гормоны, супрафизиологические дозы, надпочечниковая недостаточность, ятрогенный гиперкортизолизм.
Медицинские новости. – 2020. – №8. – С.37–41.
Summary. Modern data of literature on the consequences of corticosteroid therapy in therapeutic practice are presented. The analysis of potential manifestations of iatrogenic hypercortisolism and adrenal insufficiency after using glucocorticosteroids in supraphysiological doses was performed. Special attention is paid to the reception regimens, rules for reducing the dose of glucocorticosteroids, as well as features of the diagnosis of adrenal insufficiency on the background of withdrawal. The principles of management of patients with adrenal insufficiency are considered.
Keywords: glucocorticoid hormones, supraphysiological doses, adrenal insufficiency, iatrogenic hypercortisolism.
Meditsinskie novosti. – 2020. – N8. – P.37–41.
Синтетические глюкокортикостероиды (ГКС) используются c 1948 года, когда в клинике Мейо пациенту с ревматоидным артритом начали вводить ежедневные инъекции «соединения E» – синтетической версии стероидного гормона, выделенного из надпочечников животных. В 1950 году открытие гормонов коры надпочечников было отмечено Нобелевской премией по физиологии и медицине, врученной Ф. Хенчу, Э. Кендаллу и Т. Райхштейну.
Эндогенные ГКС – это регуляторы различных физиологических и метаболических процессов, воспаления, иммунного ответа. Они являются гормонами, реализующими развитие и последствия стресса любой этиологии. На клеточном уровне регулируют пролиферацию, дифференцировку и запрограммированную гибель клеток различных типов, могут изменять статус метилирования цитозин-гуаниновых динуклеотидов (CpG), расположенных в регуляторных областях многих генов, что приводит к важным эпигенетическим изменениям. Противовоспалительные и иммуносупрессивные эффекты ГКС опосредованы главным образом их родственным глюкокортикоидным рецептором – фактором транскрипции, который принадлежит к подсемейству стероидных рецепторов суперсемейства ядерных рецепторов. В настоящее время ГКС, назначаемые при нормальной функции надпочечников в супрафизиологических (супрессивных) дозах, остаются основой для лечения ряда воспалительных и аутоиммунных заболеваний, для стимуляции лейкопоэза после химиотерапии, иммунодепрессии после трансплантации органов и др. Также ГКС являются основой заместительной терапии при хронической надпочечниковой недостаточности (ХНН). Распространенность длительного употребления глюкокортикоидов во всем мире оценивается от 1 до 3% взрослых [1]. В практике эндокринолога супрафизиологические дозы ГКС назначаются в основном при подостром тиреоидите и аутоиммунной офтальмопатии (эндокринной офтальмопатии, орбитопатии Грейвса).
При этом определено, что назначение ГКС при отсутствии ХНН сопровождается не только редукцией симптомов основного заболевания, но и целым рядом побочных эффектов, являющихся признаками ятрогенного гиперкортизолизма (ятрогенного синдрома Кушинга). В таблице 1 приведены различные потенциальные проявления избытка ГКС (не по частоте и значимости проявлений) в соответствии с мнемоникой слова «Cushingoid».
Таблица 1. Различные потенциальные проявления избытка ГКС (не по частоте
и значимости проявлений) в соответствии с мнемоникой слова «Cushingoid»
|
С
|
Cataracts (катаракта)
|
|
U
|
Ulcer (язвы желудка )
|
|
S
|
Striae (стрии и истончение кожи)
|
|
H
|
Hypertention & hirsutism (гипертензия и гирсутим)
|
|
I
|
Immunosupression & infections (иммуносупрессия и инфекции)
|
|
N
|
Necrosis of femoral head (некроз головки бедра)
|
|
G
|
Glucose evaluation (гипергликемия)
|
|
O
|
Osteoporosis & obesity (остеопороз и ожирение)
|
|
I
|
Impaired woud healing
(плохое заживление ран)
|
|
D
|
Depression (депрессия)
|
Представленные проявления использования супрафизиологических доз ГКС не описывают полный спектр потенциальных клинических проявлений, возникающих в различное время от начала использования ГКС. На начальных этапах лечения почти неизбежно появляются бессонница, эмоциональная лабильность, повышенный аппетит и/или прибавка в весе. Также возможно возникновение типичных проявлений у пациентов, имеющих факторы риска развития различной патологии – артериальная гипертензия; гипергликемия (вплоть до сахарного диабета); язвообразование в желудке и двенадцатиперстной кишке (фактор риска – использование нестероидных противовоспалительных препаратов); угревая сыпь. При длительном использовании ГКС к ожидаемым побочным эффектам (вероятно, обусловленным кумуляцией дозы) относят «кушингоидный» внешний вид; супрессию функции надпочечников, иммуносупрессию (оппортунистические инфекции); системный остеопороз (включая остео-некроз головок бедренных костей); миопатию; нарушение репаративных процессов с плохим заживлением ран; жировой гепатоз; катаракты. В эту группу также включают акселерацию атеросклероза и задержку роста у детей. Выделяют редкие и непрогнозируемые побочные эффекты, к которым относятся психоз, доброкачественная внутричерепная гипертензия (pseudotumor cerebri), глаукома, эпидуральный липоматоз, панкреатит.
В клинической практике следует отличать опасные и неприемлемые побочные явления, диктующие необходимость отмены терапии ГКС, от предвзятости и стереотипов, которые ухудшают комплаенс и несут риск терапевтических неудач. В любом случае, инициируя терапию ГКС в супрессивных дозах, врач должен оценить потенциальную пользу и вред от их использования.
Эндокринологам хорошо известно, что гиперкортизолизм (синдром Кушинга) любой этиологии, как экзогенный, так и эндогенный, является фактором негативного прогноза и определяет повышение смертности по сравнению с контрольной группой, приводя к 5-летней выживаемости лишь у 50% пациентов при отсутствии лечения [2]. В популяционном исследовании (82 202 пациента не использовали ГКС, 68 781 – принимали ГКС) была проведена оценка кардиоваскулярных рисков. Относительный риск развития сердечно-сосудистых событий у пациентов, получавших преднизолон в дозе 7,5 мг, составил 2,56 (95% ДИ 2,18–2,99) после поправки на известные коварианты [3]. Аналогичные результаты были описаны в другом наблюдательном исследовании, включавшем 50 656 пациентов и эквивалентное количество лиц контрольной группы: прием ГКС был ассоциирован с повышением относительного риска сердечной недостаточности (2,66, 95% ДИ 2,46–2,87) [4]. Также подтверждено, что у принимавших ГКС повышается риск развития фибрилляции предсердий [5]. Более того, даже субклинические формы гиперкортизолизма увеличивают риск возникновения сахарного диабета, артериальной гипертензии, дислипидемии, ожирения, остеопороза и смертности [6]. При этом не определены пороговые дозы ГКС и длительность лечения, при которых развивается симптомный гиперкортизолизм. Для оценки побочных явлений терапии представляется интересным анонсированный в 2016 году индекс GTI – индекс токсичности ГКС. Это суммированный показатель действия глюкокортикоидов на разные органы и системы по 31 показателю, которые с использованием математических коэффициентов градуированы как улучшение, отсутствие изменений, средней степени нарушения, тяжелые нарушения [7]. Тем не менее, клиническая практика позволяет сделать заключение, что терапия ГКС ставит перед врачами 2 группы вопросов:
1) необходимость минимизации курсовых доз ГКС при обеспечении адекватного лечебного эффекта для предупреждения ятрогенного гиперкортизолизма;
2) использование ГКС по закону обратной связи приводит к супрессии функции надпочечников и потенциальному развитию ХНН.
Проблема выбора курсовой дозы и схемы назначения ГКС определяется нозологической формой и степенью выраженности заболевания. Курсовые дозы и схемы лечения варьируют в широком диапазоне и не являются предметом обсуждения в данной публикации. Однако важно понимать, что врачи различных специальностей должны четко оценивать использование пациентами ГКС (с расчетом принятой дозы) и при возможности минимизировать продолжительность лечения.
Вторая группа вопросов связана с потенциальной ХНН после прекращения лечения ГКС и рисками, обусловленными этой патологией.
Применение ГКС в супрафизиологических дозах для хронического использования вызывает подавление гипоталамо-гипофизарно-надпочечниковой оси, надпочечники не способны генерировать достаточное количество кортизола, что проявляется в случае резкого прекращения лечения ГКС. Ятрогенная ХНН, индуцируемая хроническим введением высоких доз ГКС, по механизму патогенеза является третичной и наиболее распространенной причиной развития недостаточности надпочечников. Применение экзогенных ГКС, даже в небольших дозах в течение всего нескольких дней, за счет снижения синтеза и секреции кортиколиберина и высвобождения проопиомеланокортина и адренокортикотропного гормона (АКТГ) приводит к заметному подавлению гипоталамо-гипофизарно-надпочечниковой оси, а впоследствии – к атрофии кортикотрофных клеток передней доли гипофиза и потери способности пучковой зоны коры надпочечников секретировать кортизол в адекватных количествах (рисунок). Тем не менее, кора надпочечников сохраняет способность выделять кортизол в течение некоторого времени, а также минералокортикоидов клубочковой зоной, поскольку эта функция зависит главным образом от ренин-ангиотензиновой системы, а не от АКТГ.
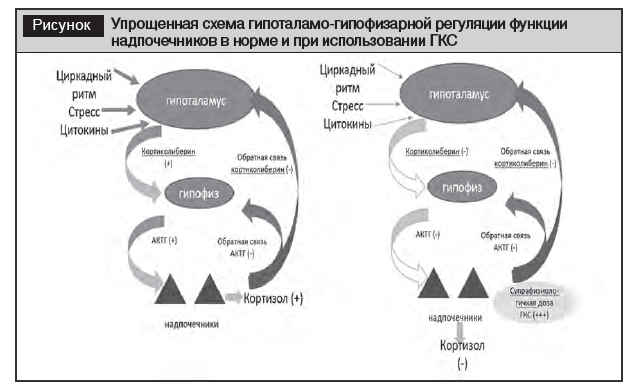
Первое исследование, в котором была доказана ассоциация повышения риска развития ХНН у лиц, получающих пероральные и ингаляционные ГКС в общей популяции, было опубликовано в 2006 году [8]. При использовании методологии «случай – контроль» проанализированы данные когорты из 2,4 млн человек. Была выявлена сильная зависимость «доза – ответ» между пероральным приемом ГКС и риском развития ХНН с относительным риском 3,4 (95% ДИ 1,6–2,5) на годовой курс лечения и ингаляционных ГКС в течение 90 дней после установления диагноза ассоциировано 3,4 (95% ДИ 1,9–5,9) соответственно. Аналогичные результаты были получены в других исследованиях [9, 10].
В систематическом обзоре литературы по оценке распространенности, влияния дозы и продолжительности терапии ГКС на развитие ХНН с использованием метода, разработанного CochraneCollaboration, результаты наблю-дения свидетельствуют о том, что ХНН сохраняется у 15% пациентов, повторно протестированных через 3 года после отмены ГКС [11].
Одно из последних исследований, проведенных в Великобритании, оценивало дозозависимые риски дисфункции надпочечников и смерти у взрослых (ретроспективное, открытое когортное исследование) в когорте 70 638 пациентов, получающих ГКС per os, и 41 166 человек, не принимавших ГКС. В течение 5,5 лет 183 пациента имели ГКС-индуцированную ХНН и 248 – ятрогенный гиперкортизолизм. При оценке исходов отмечено, что летальность (причины смерти – сердечно-сосудистая патология, рак, инфекции, болезни почек, органов дыхания) в когорте ГКС составила 31,6% против 18,3% в когорте сравнения. Частота смертельных исходов увеличивалась с повышением текущих суточных и кумулятивных доз ГКС, составив относительный риск 2,25 (95% ДИ 2,15–2,35) на 1000 мг кумулятивной дозы в год [12].
При выборе методики следует помнить, что разделение суточной дозы на несколько приемов в течение дня и вечерний (ночной) прием ГКС создают больший риск для подавления гипоталамо-гипофизарно-надпочечниковой оси. Вечерние дозы способствуют снижению нормального раннего утреннего пика секреции АКТГ и последующему угнетению надпочечников. Когда это возможно, лучше лечить пациентов одной утренней дозой или при необходимости для имитации нормальных суточных ритмов кортизола утренняя доза должна составлять две трети, а дневная – одну треть от общей суточной дозы [13]. C точки зрения более редкого приема ГКС, альтернативная методика – пульс-терапия, которая применяется с 1976 года и является методикой интермиттирующего назначения ГКС в супрафармакологических дозах для усиления терапевтического и снижения риска побочных эффектов [14]. Единой методики пульс-терапии даже для лечения одной нозологической формы не существует, тактика определяется международными рекомендациями по лечению различной патологии, выраженностью проявлений заболевания и опытом врача.
Вопрос отмены ГКС-терапии после достижения терапевтического эффекта также широко обсуждается. Причинами, вынуждающими отменять ГКС, могут быть значительные побочные эффекты (декомпенсированный сахарный диабет, психоз, тяжелая артериальная гипертензия, прогрессия остеопороза). Цель успешной отмены – переход от состояния тканевого гиперкортизолизма к состоянию полной экзогенной депривации ГКС без рецидива основного заболевания и клинических признаков ХНН. Специалисты до сих пор не пришли к консенсусу, в практике используются различные схемы отмены. Общим моментом является то, что отмена ГКС не должна быть резкой. Обзор 9 рандомизированных контролируемых клинических исследований (7 – бронхиальная астма и хроническая обструктивная болезнь легких) свидетельствует, что не было обнаружено существенной разницы между быстрым или медленным снижением дозы в отношении частоты обострений и рецидивов заболеваний [15].
В целом, пациенты, принимающие любую дозу ГКС менее 2 недель (назначение по «острым» показаниям – анафилактический шок и др.), не склонны к развитию подавления гипоталамо-гипофизарно-надпочечниковой оси и могут внезапно прекратить терапию без постепенной отмены. Возможным исключением из этого правила являются больные, которые получают частые «короткие» курсы ГКС, например, при бронхиальной астме. В случаях проведения хронической длительной терапии цель состоит в быстром сокращении терапевтической дозы до физиологического уровня (эквивалентного 7,5 мг в сутки преднизолона), например, путем снижения на 2,5 мг каждые 3–4 дня или реже в течение нескольких недель, а затем продолжить более медленную отмену, чтобы позволить гипоталамо-гипофизарно-надпочечниковой оси восстановиться [16, 17]. При этом необходимо наблюдать за пациентом, чтобы своевременно выявить клинические и, возможно, лабораторные признаки активности основного заболевания, что приводит к увеличению используемых доз.
Так называемый «синдром отмены» ГКС включает 2 блока проявлений:
1) обострение процесса, по поводу которого назначались ГКС;
2) угнетение функции надпочечников, то есть развитие ХНН [15].
Клинические симптомы ХНН многообразны, что осложняет диагностику. На начальных этапах ХНН проявляется в стрессовых ситуациях, включая развитие интеркуррентной патологии, и характеризуется прогрессивной слабостью, миопатией, снижением уровня АД и аппетита. Поскольку генез ХНН связан с нарушением продукции регуляторных гормонов гипоталамо-гипофизарно-надпочечниковой оси, для этих пациентов не характерна гиперпигментация.
Следует помнить, что оценка уровня кортизола в сыворотке крови не является диагностическим критерием надпочечниковой недостаточности, так как при использовании ГКС в условиях супрессированной функции надпочечников ожидаемы низкие значения кортизола. При отмене ГКС пациент должен быть предупрежден о потенциальном наличии сниженного резерва надпочечников и, следовательно, о вероятной поддержке экзогенными ГКС в условиях экстремальной ситуации. Если после отмены есть симптомы ХНН (артериальная гипотония, снижение массы тела, диспепсия, предпочтение соленой пищи, гликемия <2,78 ммоль/л и др.), необходимо проведение диагностических мероприятий для уточнения функции надпочечников. Центральный гипокортицизм устанавливается при уровне кортизола в сыворотке крови в ранние утренние часы (8.00–9.00) менее 3 мкг/дл (30 нг/мл, 80 нмоль/л). Значения выше 15 мкг/мл (150 нг/мл, 400 нмоль/л) исключают диагноз. Дополнительно возможно проведение диагностических нагрузочных тестов. При оценке уровня кортизола следует помнить факторы, влияющие на его уровень [18]. Повышение уровня кортизол-связывающего глобулина, то есть потенциальное увеличение свободной фракции кортизола, характерно для беременности, может быть результатом приема эстрогенов. Обратная ситуация – снижение кортизол-связывающего глобулина – может отмечаться при ожоговой болезни, обширных хирургических вмешательствах, множественных травмах, сепсисе, циррозе печени, нефротическом синдроме, редких генетических мутациях.
Следует помнить, что повышение уровня АКТГ при нормальном значении кортизола может быть первым признаком развивающейся ХНН. Также при необходимости проводится одновременное определение альдостерона и ренина в плазме крови для диагностики дефицита минералокортикоидов.
В качестве диагностического теста рекомендовано использование тетракозактида (косинтропина, препарата АКТГ) (не зарегистрирован в Республике Беларусь). Стандартный тест проводится с введением 250 мкг косинтропина внутривенно или внутримышечно с контролем уровней кортизола через 30 и 60 минут. Уровень кортизола менее 500 нмоль/л является диагностическим [19]. В России доступен пролонгированный препарат АКТГ, при использовании которого повторный забор крови выполняется через 24 часа. Альтернативным диагностическим тестом является инсулинотолерантный тест с внутривенным введением инсулина короткого действия в дозе 0,1–0,15 ЕД/кг массы тела. Забор крови проводится при гликемии менее 2,2 ммоль/л в сочетании с симптомами нейрогликопении. Отсутствие подъема уровня кортизола более 500 нмоль/л (18 мкг/дл) указывает на надпочечниковую недостаточность. Аномальные показатели тестов являются критерием необходимости реклассификации диагноза и пересмотра терапии с потенциальной пролонгацией терапии ГКС в заместительной дозе.
У госпитализированных пациентов развитие надпочечниковой недостаточности – опасное для жизни состояние, требующее раннего распознавания и немедленного лечения. Тест с АКТГ по-прежнему является стандартным тестом для диагностики патологии, однако при необходимости принятия быстрого решения тест оказывается малополезным. Есть некоторые области, где тест недоступен. В такой ситуации может быть использован тест на определение случайного уровня кортизола в комбинации с уровнем холестерина и натрия [20]. Случайное определение не позволяет достоверно установить диагноз, но результаты могут побудить врача обратить пристальное внимание на эту группу пациентов и решить, нуждаются ли они в более тщательном тестировании для постановки диагноза, включая дальнейшие динамические тесты, или инициировать лечение.
Лечение ХНН включает обучение пациента особенностям поведения при заболевании (уточняется необходимость увеличения дозы при стрессовых ситуациях и интеркуррентных заболеваниях) и назначение гидрокортизона в дозе 15–20 мг/сутки в 1–2 приема однократно утром при просыпании или поделить на 2 приема (1/2–2/3 от суточной дозы рано утром и добавка ранним вечером до 18.00) или преднизолона в суточной дозе 3–5 мг однократно утром. Назначение флудрокортизона для замещения дефицита минералокортикоидов, как правило, не показано.
В клинической практике встречаются случаи, когда пациент, получающий ГКС в течение 2–3 лет, у которого отмена не проводится в связи с ухудшением течения основного заболевания, предъявляет жалобы, которые пытаются объяснить ХНН. В такой ситуации надо обратить внимание на дозы заместительной терапии, используемые при ХНН. Если эти дозы (см. выше) превышены, то есть пациент получает терапию, равную заместительной дозе, то следует искать другую причину ухудшения состояния.
Важный момент, на который необходимо обращать внимание. При изменении лекарственного средства ГКС для корректного выбора дозы следует пользоваться калькулятором конверации доз (SteroidEquivalenceConverter), который доступен на электронном ресурсе (MedCalc.com). Также может быть использована таблица 2 эквивалентных доз ГКС для перорального приема.
Таблица 2. Эквивалентные дозы ГКС для перорального приема
|
Препарат
|
Эквивалентная доза, мг
|
|
Преднизолон
|
5
|
|
Метилпреднизолон
|
4
|
|
Дексаметазон
|
0,75
|
|
Гидрокортизон
|
20
|
Поскольку с течением времени ХНН, в том числе после отмены длительно используемых ГКС (перорально, ингаляционно, топически, интраназально), может явиться причиной развития острой надпочечниковой недостаточности в момент хирургического вмешательства, Ассоциация анестезиологов и Королевского колледжа врачей, а также Общество эндокринологов Великобритании разработали специальные рекомендации периоперативного лечения данной категории больных [21]. Все ГКС-зависимые лица имеют риск развития адреналового криза вследствие хирургического стресса или интеркуррентного заболевания; пациенты информированы о своем заболевании, поэтому важно внимательно собирать анамнез; всем получающим ГКС для лечения ХНН или супрессивные дозы ГКС (эквивалент преднизолон более 5 мг/сутки более 1 месяца) по поводу другой патологии необходимо провести коррекцию дозы в зависимости от объема хирургического лечения. Дексаметазон не является адекватным ГКС для лечения ХНН; у этих категорий пациентов повышен риск гипогликемических эпизодов, поэтому период голодания должен быть сведен к минимуму. В таб-лицах 3 и 4 приведены рекомендации по периоперативному лечению больных с первичной и вторичной ХНН и лиц, получающих супрафизиологические дозы ГКС.
Таблица 3. Рекомендации по периоперативному лечению пациентов с первичной и вторичной ХНН
|
Объем вмешательства
|
Замещение ГКС во время операции
|
Замещение ГКС после операции
|
|
Хирургия с анестезией (общей или местной), вправление вывиха, эндоскопия, ЭКО, кесарево сечение
|
Гидрокортизон 100 мг в/в в начале процедуры и затем продолжительная инфузия 200 мг/сутки
|
Гидрокортизон 200 мг/сутки в/в инфузия, при наличии послеоперационной рвоты (альтернативно, гидрокортизон 50 мг каждые 6 часов в/м) до возможности орального приема в двойной суточной дозе до 1 недели после серьезной операции. При быстром восстановлении – двойная доза на 1 сутки
|
|
Кишечные процедуры, требующие слабительного или клизмы
|
Подготовка кишечника перед исследованием
Рассмотрите введение гидрокортизона 100 мг в/в или в/м в начале процедуры
|
Возобновите оральный прием
в двойной дозе на 1 сутки
|
|
Родоразрешение
|
Гидрокортизон 100 мг в/в в начале родов, затем немедленное инициирование непрерывной инфузии гидрокортизона 200 мг/сутки Альтернатива: гидрокортизон 100 мг в/м, затем по 50 мг каждые 6 часов в/м
|
Возобновите оральный прием
в двойной дозе на 1 сутки
|
Таблица 4. Рекомендации по периоперативному лечению пациентов, получающих супрафизиологические дозы ГКС
|
Объем вмешательства
|
Замещение ГКС во время операции
|
Замещение ГКС после операции
|
|
Большая хирургия
|
Гидрокортизон 100 мг в/в в начале, затем следует непрерывная инфузия гидрокортизона 200 мг/сутки
Альтернативно: дексаметазон 6–8 мг в/в (хватит на 24 часа)
|
Гидрокортизон 200 мг/сутки в/в инфузия, при наличии послеоперационной рвоты (альтернативно
гидрокортизон 50 мг каждые 6 ч в/м)
до возможности орального приема в двойной суточной дозе до 1 недели после серьезной операции
|
|
Операции наружные
(на поверхности тела) или «малая» хирургия
|
Гидрокортизон 100 мг в/в в начале, затем следует непрерывная инфузия гидрокортизона 200 мг/сутки
Альтернативно: дексаметазон 6–8 мг в/в (хватит на 24 часа)
|
Двойная регулярная доза в течение 48 часов
|
|
Кишечные процедуры
(слабительное или клизма)
|
Продолжить прием обычной дозы ГКС или эквивалентную в/в дозу при длительном приеме
|
|
Родоразрешение
|
Гидрокортизон 100 мг в/в в начале родов, затем следует непрерывная инфузия гидрокортизона 200 мг/cутки Альтернативно: гидрокортизон 100 мг в/м, затем по 50 мг каждые 6 часов в/м
|
Актуальной проблемой настоящего времени является пандемия COVID-19, охватившая мировое сообщество. Последняя публикация по данной проблеме констатирует, что использование ГКС не продемонстрировало пользу у больных острым респираторным дистресс-синдромом и у лиц на фоне ОРВИ. Это позволило Всемирной организации здравоохранения дать рекомендации о том, что не следует назначать ГКС в качестве стрессовых доз гидрокортизона (50–100 мг внутривенно) [22, 23]. При наличии у пациента доказанной ХНН и длительного приема ГКС в анамнезе увеличение доз ГКС или их использование является необходимым компонентом терапии и требует тщательного контроля, включая контроль инфузионной терапии и электролитного баланса, что особенно важно в условиях повышенной потери жидкости при лихорадке и тахипноэ.
Заключение
Назначение супрафизиологических доз ГКС, будучи высокоэффективным методом лечения различных патологий, должно быть строго обосновано, а методика и курсовая доза выбраны с учетом особенностей течения заболевания.
Использование ГКС ассоциировано с побочными эффектами гиперкортизолизма и адреналовой недостаточности (ХНН).
Для адекватного ведения пациентов важно фиксировать используемые суточные и курсовые дозы.
После отмены ГКС показано тестирование для уточнения наличия ХНН.
При необходимости хирургического вмешательства или развитии интеркуррентных заболеваний у пациентов, получающих в настоящее время ГКС, должна быть проведена коррекция дозы.
Л И Т Е Р А Т У Р А
1. McDonough A.K., Curtis J.R., Saag K.G. // Curr. Opin. Rheumatol. – 2008. – Vol.20, N2. – P.131–137.
2. Clayton R.N., Clayton R.N. // Neuroendocrinol. – 2010. – Vol.92, Suppl.1. – P.71–76.
3. Wei L., MacDonald T.M., Walker B.R. // Ann. Intern. Med. – 2004. – Vol.141, N10. – P.764–770.
4. Souverein P.C., Berard A., Van Staa T.P., et al. // Heart. – 2004. – Vol.90, N8. – P.859–865.
5. Christiansen C.F., Christensen S., Mehnert F., et al. // Arch. Intern. Med. – 2009. – Vol.169, N18. – P.1677–1683.
6. Seung Hun Lee, Kee-Ho Song, Jinju Kim, et al. // Clin. Endocrinol. – 2017. – Vol.86. – P.10–18.
7. Miloslavsky E.M., Naden R.P., Bijlsma J.W., et al. //Ann. Rheum. Dis. – 2017. – Vol.76, N3. – P.543–546.
8. Mortimer K.J., Tata L.J., Smith C.J., et al. // Thorax. – 2006. – Vol.61, N5. – P.405–408.
9. Molimard M., Girodet P.O., Pollet C., et al. // Drug. Saf. – 2008. – Vol.31, N9. – P.769–774.
10. Einaudi S., Bertorello N., Masera N., et al. // Pediatr. Blood Cancer. – 2008. – Vol.50, N3. – P.537–544.
11. Joseph R.M., Hunter A.L., Ray D.R., et al. // Sem. Arthritis Rheum. – 2016. – Vol.46, N1. – P.133–141.
12. Mebrahtu T.F., Morgan A.W., Keeley A., et al. // JCEM. – 2019. – Vol.104, N9. – P.3757–3767.
13. Nichols T., Nugent C.A., Tyler F.H. // JCEM. – 1965. – N25. – P.343–349.
14. Panat S.R., Aggarwal A., Joshi A. // J. Dent. Sci. Oral. Rehabil. – 2012. – N3. – P.1–3.
15. Richter B., Neises G., Clar C. // Endocrinol. Metab. Clin. North Am. – 2002. – Vol.31, N3. – P.751–778.
16. Stewart P.M., Newell-Price J.D.C. The adrenal cortex / S. Melmed, K.S. Polonsky, P.R. Larsen, H.M. Kronenberg (eds). Williams Textbook of Endocrinology, 13th ed. – Philadelphia, 2016. – Ch.15.
17. Alves C., Robazzi T.C., Mendonça M. // J. Pediatr. (Rio J.). – 2008. – Vol.84, N3. – P.192–202.
18. Gagliardi L., Ho J.T., Torpy D.J. // Mol. Cell Endocrinol. – 2010. – Vol.316. – P.24–34.
19. Bornstein S.R., Allolio B., Arlt W., et al. // JCEM. – 2016. – Vol.101, N2. – P.364–389.
20. Manosroi W., Kosachunhanan N., Atthakomol P. // BMC Endocr. Disord. – 2020. – N20. – P.24. doi:10.1186/s12902-020-0508-7
21. Woodcok T., Barker P., Daniel S., et al. // Anaesthesia. – 2020. – https://doi.org/10.1111/anae.14963
22. Kaiser U.B., Mirmira R.G., Stewart P.M. // J. Clin. Endocrinol. Metab. – 2020. – Vol.105, N5. – P.1–3.
23. World Health Organization. Clinical Management of Severe Acute Respiratory Infection When Novel Coronavirus (nCoV) Infection Is Suspected: Interim Guidance. WHO/nCoV/Clinical/2020.1. – https://www.who.int/docs/default-source/coronaviruse/clinicalmanagement-of-novel-cov.pdf?sfvrsn=bc7da517_2. – Published January 28, 2020
Медицинские новости. – 2020. – №8. – С. 37-41.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.