Внимание! Статья адресована врачам-специалистам
SorokaN.F.
Belarusian State Medical University, Minsk
Osteoarthritis today: problems and disease management, considering comorbidity
Резюме. В статье обсуждаются проблемы остеоартрита (ОА), которые препятствуют эффективному лечению заболевания. Это позднее обращение к врачу, несвоевременное начало лечения, образ жизни пациента и коморбидность. Отмечены особенности рекомендаций ESCEO 2019, их отличие от рекомендаций других профессиональных сообществ. Подробно рассмотрена пошаговая терапия ОА, рекомендованная ESCEO 2019. Обсуждаются вопросы назначения хондропротекторов (SYSADOA) в первом шаге терапии вместо нестероидных противовоспалительных препаратов (НПВП). Подробно рассмотрено место и роль хондроитина сульфат в лечении ОА. Обсуждаются принципы назначения пациентам НПВП, гиалуроновой кислоты, глюкокортикоидных гормонов, опиоидных анальгетиков и хирургических методов лечения.
Ключевые слова: остеоартрит, рекомендации ESCEO, SYSADOA, хондроитина сульфат, коморбидность.
Медицинские новости. – 2020. – №9. – С. 9–16.
Summary. In this article we discuss problems of osteoarthritis (OA) that don’t let us treat it efficiently. The most important problems are overdue call to doctor, postponed treatment, patient’s lifestyle and comorbidity. We noted ESCEO 2019 recommendations and their differences from another medical societies. We described management of OA, recommended by ESCEO, in details. In the article the posibility of prescription of chondroprotectors (SYSADOA) as the first level treatment instead of nonsteroidal anti-inflammatory drugs (NSAIDs) is discussed. We present the role of chondroitin sulfate in OA treatment. NSAIDs, hyaluronic acid, corticosteroids, opioid analgesics, surgical intervention as treatment options are also discussed.
Keywords: osteoarthritis, ESCEO recommendations, SYSADOA, chondroitin sulfate, comorbidity.
Meditsinskie novosti. – 2020. – N9. – P. 9–16.
Остеоартрит (ОА) – самая распространенная форма артрита и ведущая костно-суставная патология во всем мире [1–4]. Согласно данным ACR 2019, от ОА страдает примерно 302 млн человек в мире, и он является ведущей причиной инвалидности у пожилых пациентов [4]. С возрастом заболеваемость повышается, впрочем, как и частота других хронических патологий. Так, согласно данным ОARSI и ESCEO, если у одного среднего пациента с ОА есть 4 сопутствующих заболевания [5], то у больного пожилого возраста помимо ОА есть еще 8 других хронических заболеваний [6]. Чаще всего это сахарный диабет – у 33%, дислипидемия – у 63%, заболевания желудочно-кишечного тракта – у 65%, ожирение – у 57%, патология периферических сосудов – у 18%, бронхиальная астма – у 16% пациентов [5].
Проблемы остеоартрита
Сегодня при ОА существует ряд объективных и субъективных факторов, которые не позволяют эффективно бороться с данным заболеванием.
Проблема первая, а может быть и важнейшая, – позднее обращение. По нашим данным, за медицинской помощью на I стадии ОА обращается всего 1% пациентов, на II – 18%, на III – 81%. Следовательно, на ранних стадиях заболевания, когда возможно наиболее эффективное лечение, человек с ОА за медицинской помощью не обращается. В этот период у него нет постоянных болей в суставах, беспокоят они лишь при перегрузке, могут проходить самостоятельно. Чаще пациент приходит к врачу на III стадии ОА, когда боли одолевают каждый день, а консервативное лечение уже менее эффективно. Приоритет на этой стадии получают препараты лишь обезболивающего действия.
Проблема вторая – несвоевременное лечение. Она вытекает из первой. Если пациенты с ОА на ранних стадиях болезни редко обращаются к врачу за медицинской помощью, значит, большинство из них в этот период не получают структурно-модифицирующее лечение и, следовательно, не замедляют прогрессирование болезни. ОА у таких лиц прогрессирует естественным путем. Именно на ранних стадиях структурно-модифицирующие препараты наиболее показаны для долгосрочного приема, именно тогда можно добиться наилучшего результата в лечении (рис. 1) [7].
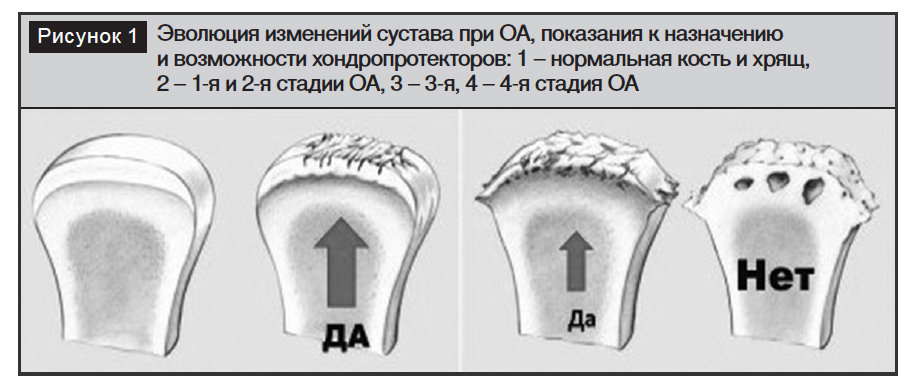
Третья проблема – образ жизни – заключается в том, что большинство пациентов с ОА имеют избыточную массу тела либо метаболический синдром, но бороться с этим не настроены. Существует своеобразный порочный круг. Человеку с избыточной массой тела рекомендуют снизить вес. Один из путей – увеличение физической нагрузки. Но последнее приводит к усилению болей в суставах, и пациент прекращает физические занятия. Вес нарастает. С другой стороны, добиться снижения веса гораздо труднее, чем принимать несколько лекарственных препаратов. И пациенты следуют обычно именно этим путем.
Четвертая проблемапри ОА связана с коморбидностью. Редко можно встретить пожилого пациента с ОА, который бы не имел сопутствующих заболеваний. Коморбидность при ОА – будто две стороны одной медали. С одной стороны, ОА существенно ограничивает способность человека самостоятельно управлять другими состояниями, такими как сахарный диабет или артериальная гипертензия (боль, пониженная физическая активность, прием нестероидных противовоспалительных препаратов (НПВП) и др.). С другой стороны,наличие сопутствующих заболеваний ограничивает применение многих методов терапии ОА (физиотерапевтические воздействия, прием НПВП и др.). Лечить пациентов с ОА в условиях коморбидности традиционной последовательностью «диагноз – лечение»невозможно. Прием одним больным по 1–2 лекарства от каждого заболевания приводит к другой проблеме – безопасности фармакотерапии с учетом полипрагмазии.
Рекомендации по ведению пациентов с ОА
В мире существует ряд международных организаций и профессиональных сообществ, которые постоянно занимаются изучением и анализом проблем ОА, периодически представляют для врачей свои рекомендации по ведению таких пациентов. Среди наиболее влиятельных организаций и обществ можно назвать Европейскую антиревматическую лигу (EULAR) (рекомендации по ведению пациентов с ОА 2003, 2005, 2007, 2018 годов), Международное общество по изучению остеоартрита (OARSI) (рекомендации 2007, 2008, 2010, 2014),Американский колледж ревматологов (ACR) (рекомендации2012, 2019),Британский национальный институт здравоохранения (NICE) (рекомендации 2014),Европейское общество клинических и экономических аспектов остеопороза и остеоартроза (ESCEO) (рекомендации 2014, 2016, 2019). У каждого общества свой взгляд на проблему ОА, но большинство едино в том, что любой пациент с ОА должен получать обезболивающую терапию и структурно-модифицирующие средства. Оговоримся сразу. На Западе структурно модифицирующие средства для лечения ОА обозначают аббревиатурой SYSADOA (SYmptomatic Slow Acting Drugs for OsteoArthritis; симптоматические медленно действующие лекарственные средства для остеоартрита). В русскоговорящих странах этот длинный термин с аббревиатурой SYSADOA заменяется обычно одним словом «хондропротекторы». Речь идет об одних и тех же лекарственных препаратах.
В последние годы высокий авторитет завоевало Европейское общество клинических и экономических аспектов остеопороза и остеоартроза (ESCEO). Не только потому, что общество является не коммерческим, а в состав его экспертов входят ведущие специалисты из разных континентов, но и благодаря оригинальному, принципиально иному подходу к ведению пациентов с ОА. Последний обновленный алгоритм рекомендаций по ведению лиц с ОА коленных суставов был принят ESCEO в 2019 году [3]. Ранее были опубликованы рекомендации в 2014 и 2016 годах [8, 9].
При подготовке рекомендаций для каждого вмешательства эксперты ESCEO оценивали величину эффекта (effect size, ES). Величина эффекта по воздействию на боль или функцию оценивалась от нуля до единицы (0–1). Кроме того, анализировали соотношение польза – риск, качество доказательств эффективности, ценность и преимущества каждого метода для пациента, а также стоимость лечения. На основе системы GRADE каждое вмешательство экспертами ESCEO:
– сильно рекомендовано;
– слабо рекомендовано;
– сильно не рекомендовано;
– слабо не рекомендовано.
Особенности рекомендаций ESCEO 2019
Впервые представлен пошаговый алгоритм ведения пациентов с ОА коленных суставов. Когда больной впервые обращается к врачу, то определение лечебных вмешательств должно начинаться с первого шага. Данный алгоритм рекомендаций ESCEO для лечения ОА коленного сустава был хорошо принят практическими врачами. На наш взгляд, это связано с предельной ясностью изложения пошаговых вмешательств, четким представлением действий в случае слабой эффективности терапии на том или ином шаге, включении в рекомендации некоторых принципиально новых подходов к ведению пациентов.
Основной принцип алгоритма ESCEO – это комбинация методов лечения, включая нефармакологические и фармакологические вмешательства (рис. 2) [3].
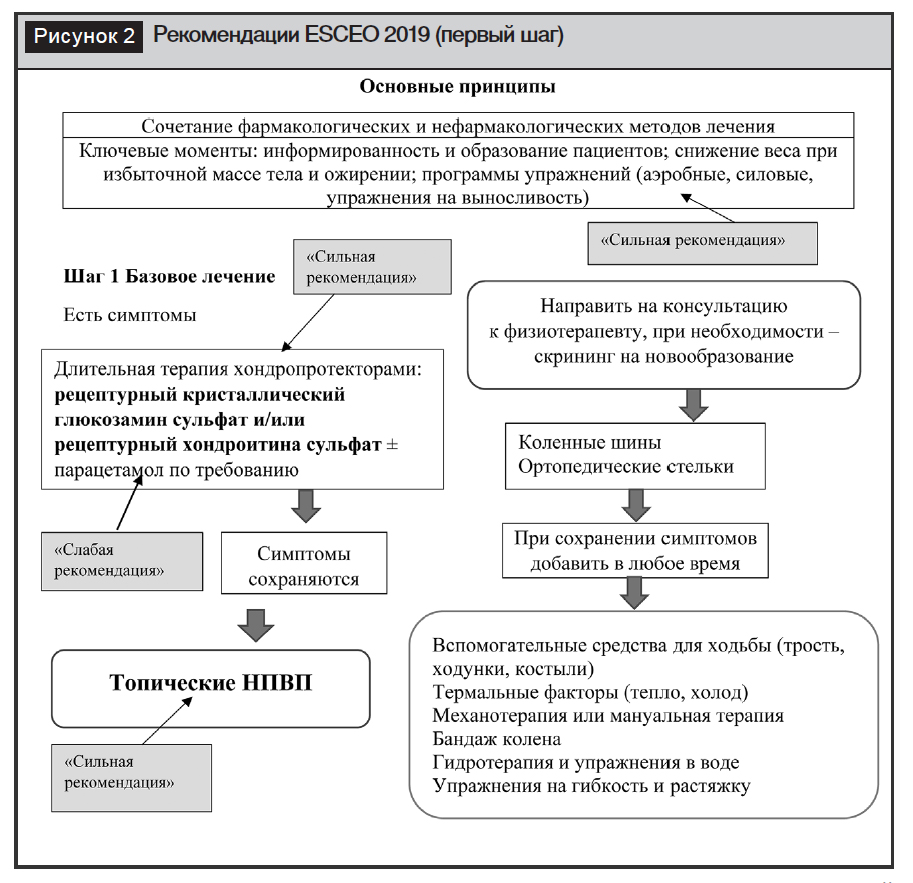
В обновленных рекомендациях усилена значимость в комплексной терапии немедикаментозных методов лечения. Подчеркивается важность использования дешевых, сравнительно безопасных и во многом эффективных нефармакологических методов воздействия. Это важно и потому, что в настоящее время решить проблему ОА только лекарственными средствами нереально.
Среди нефармакологических методов воздействия речь прежде всего идет об образовании пациента, смене привычного, устоявшегося образа жизни, потере веса при избыточной массе тела или ожирении [10], которым рабочая группа ESCEO дает сильную рекомендацию.
В обсуждаемом алгоритме впервые уменьшена значимость парацетамола в лечении ОА. Его рекомендуют использовать лишь как дополнительное средство при сохранении клинической симптоматики на фоне приема хондропротекторов. Ранее лечение ОА рекомендовалось начинать с приема именно парацетамола. Особенно четко это было прописано в американских рекомендациях. Во главу угла ставилась дешевизна препарата. Нам всегда казалось странным, как лекарственное средство, механизм действия которого связан главным образом с блокадой ЦОГ-3 – изофермента, локализованного в основном в головном мозге, – может вызывать противовоспалительный и обезболивающий эффект у пациентов с ОА, когда поражены периферические суставы. В последнее десятилетие увеличилось также число доказательств наличия у парацетамола нежелательных желудочно-кишечных, сердечно-сосудистых, печеночных и почечных побочных действий [11].
В первом шаге лечения ОА коленного сустава рабочая группа ESCEO рекомендует назначать базисную терапию хондропротекторами (SYSADOA) [3]. Цель структурно-модифицирующей терапии при ОА – восстановление хряща, так как хондроциты даже в серьезно поврежденных зонах хряща сохраняют способность к синтезу компонентов матрикса. Однако в классе хондропротекторов имеется много различных агентов, включая глюкозамин, хондроитин, диацереин, неомыляемые вещества сои – авокадо, что подтверждается различной степенью клинической эффективности данных препаратов.
Итак, в рекомендациях ESCEO хондропротекторы рекомендуется применять уже на первом этапе фармакологического лечения. Это принципиально новый подход. Опять же ранее всегда считалось, что главная и первая задача при лечении больного с ОА – снять боль. Лечение начинали с назначения обезболивающей терапии, то есть парацетамола или НПВП. На ранних стадиях болезни пациент получал хороший терапевтический, в основном обезболивающий эффект. Когда через определенное время боль в суставах рецидивировала, пациент знал, что ему, к примеру, хорошо помогал нимесулид или мелоксикам. Он самостоятельно находил препарат в домашней аптечке, принимал его и за медицинской помощью не обращался. Так продолжалось на протяжении ряда лет, пока боль в суставах не становилась ежедневной, а НПВП были недостаточно эффективны. Но это уже была III стадия ОА. Время для эффективного патогенетического лечения упущено.
Среди всех доступных продуктов с глюкозамином и хондроитином ESCEO настоятельно рекомендует использовать конкретно только запатентованные оригинальные препараты кристаллического глюкозамина сульфата и хондроитина сульфата, для которых доказательная база однозначна [3].
Хондроитина сульфат является типичным представителем группы хондропротекторов (SYSADOA). Он используется в медицинской практике более 40 лет. Международное общество по изучению ОА (OARSI) и EULAR давно включили его в рекомендации по ведению пациентов с ОА.
Хондроитина сульфат – один из основных компонентов соединительной ткани, он входит в состав кости, хряща, сухожилий, связок, выполняя ряд важнейших обменных и биомеханических функций. Молекула хондроитина сульфата представляет собой сульфатированный глюкозаминогликан, состоящий из длинных неразветвленных цепей с повторяющимися остатками N-ацетилгалактозамина и глюкуроновой кислоты. Большинство N-ацетилгалактозаминовых остатков сульфатированы в 4-м или в 6-м положениях (хондроитин-4-сульфат, хондроитин-6-сульфат). Подобное строение молекулы обусловливает ее участие в процессах транспорта воды, аминокислот и липидов в гиалиновый хрящ. Длинные цепи хондроитина сульфата, входящие в состав экстрацеллюлярного матрикса, определяют важнейшие биомеханические свойства хрящевой ткани: вязкость синовиальной жидкости и эластичность хряща.
В хряще человека содержатся только хондроитин-4-сульфат и хондроитин-6-сульфат в соотношении 3:1. Хондроитин-4-сульфат преобладает, и он же преимущественно теряется при ОА, а также у него лучшая способность притягивать воду и лучшие амортизационные свойства. Для получения хондроитина сульфата в основном используют сырье, получаемое из птиц, быков или акул. Кроме разного происхождения его получают на разных производствах, он может иметь разную степень очистки, отличаться по молекулярному весу, длине дисахаридов, плотности заряда, сульфатности, содержанию разных примесей (белки, вирусы, прионы, растворители). В таблице 1 представлены расхождения по составу различных препаратов с хондроитина сульфатом [12]. От происхождения и качества лекарственного средства зависит его клиническая эффективность и безопасность.
Таблица 1. Расхождения по составу хондроитина сульфатов разного происхождения
|
Характеристика
|
Происхождение
|
|
птичий
|
бычий
|
акулий
|
|
Молекулярный вес, кДа
|
13
|
21
|
70
|
|
Хондроитин-4-сульфат, %
|
72
|
61
|
32
|
|
Хондроитин-6-сульфат, %
|
28
|
33
|
50
|
|
Несульфатированные хондроитина сульфаты,
дисульфатированые хондроитина сульфаты, %
|
–
|
6
|
18
|
В разном по происхождению хондроитина сульфате также существенно различается соотношение хондроитин-4-сульфата/хондроитин-6-сульфата. В акульем хондроитина сульфате это соотношение менее 0,7, в бычьем – 1,5–2, птичьем – 3–4. Следовательно, наиболее качественным можно считать хондроитина сульфат птичьего происхождения. Выпускаемые препараты имеют разную степень очистки от примесей. Все эти отличия могут в конечном счете обусловливать и различный биологический эффект хондроитина сульфата [13–16], что следует учитывать при назначении оригинальных препаратов или дженериков. Среди рекомендованных ESCEO лекарственных препаратов хондроитина сульфата птичье происхождение имеет препарат Структум (Пьер Фабр, Франция).
По оценке EULAR, хондроитина сульфат является самым безопасным лекарственным средством для лечения ОА, имеющим значение токсичности, равное 6 по 100-балльной шкале [17, 18]. Важнейшее его достоинство и в отсутствии лекарственного взаимодействия с другими средствами. Метаболизм происходит без участия системы цитохрома Р450 в печени, хондроитина сульфат не является субстратом изоферментов Р450 (CYP), не ингибирует и не индуцирует изоферменты цитохрома Р450. Следовательно, риск развития нежелательных явлений при совместном применении хондроитина сульфата с другими препаратами маловероятен. Он не взаимодействует с НПВП, анальгетиками, антибиотиками, гипотензивными препаратами. Это весьма значимо для пациентов старших возрастных групп, у которых отмечаются высокая коморбидность и имеется потребность в одновременном использовании большого количества лекарственных средств [19].
При применении хондроитина сульфата в клинике было показано, что он не отличается от целекоксиба с точки зрения эффективности при симптоматическом ОА коленного сустава [20]. Сообщалось также, что хондроитина сульфат оказывает положительное влияние на структуру сустава, что оценивали по изменениям, визуализированным с помощью магнитно-резонансной томографии [21]. В специально выполненном мета-анализе по оценке эффективности хондроитина сульфата у пациентов с ОА, используемого в виде оригинального препарата Структум в дозе 1 г/сутки, было показано, что хондроитина сульфат эффективно снижает интенсивность боли по ВАШ на 26 мм против исходного в течение 3–6 месяцев лечения. Кроме того, лечение Структум улучшает функциональные возможности пациента при оценке индекса Лекена (на 0,73 балла больше плацебо) [22].
Рабочая группа ESCEO настоятельно рекомендует использовать запатентованный оригинальный хондроитина сульфат в качестве долгосрочной фоновой терапии на первом шаге лечения ОА коленного сустава. Одновременно следует отличать рецептуру оригинального препарата от низкокачественных препаратов хондроитина, в том числе биологических активных добавок (диетических добавок).
Кроме того, хондроитина сульфат – это единственный из хондропротекторов, который рекомендуется пациентам с ОА суставов кистей согласно обновленным рекомендациям EULAR 2018 года. Он может назначаться для уменьшения боли и улучшения функции у лиц с ОА кистей [23].
Более того, хондроитина сульфат впервые появился в последних рекомендациях ACR 2019 по ведению пациентов с ОА [4]. Это можно рассматривать как большой прорыв. Другие хондропротекторы не упоминаются или строго не рекомендованы. Хондроитина сульфат условно рекомендован ACR к применению для лечения ОА кистей (рис. 3).

Таким образом, сегодня хондроитина сульфат – это единственный хондропротектор, рекомендованный одновременно для лечения ОА коленных, тазобедренных суставов и суставов кистей в соответствии со следующими рекомендациями по лечению ОА: EULAR (2003, 2005, 2018), ESCEO (2019), ACR (2019) [3, 4, 17, 23, 24]. Причем в большинстве рекомендаций хондроитина сульфат имеет высокий уровень доказательств («А») или сильную силу рекомендаций (табл. 2).
Таблица 2. Рекомендации по применению отдельных хондропротекторов с позиций доказательной медицины
|
Хондропротекторы
|
Гонартроз EULAR 2003 [17]
|
Коксартроз EULAR 2005 [24]
|
Суставы кистей рук EULAR 2018 [23]
|
Гонартроз ESCEO 2019 [3]
|
Суставы кистей рук ACR 2019 [4]
|
|
Хондроитина сульфат
|
А
|
A
|
A
|
Сильная
|
Условно
рекомендовано
|
|
Глюкозамин
|
A
|
Не применяется из-за отсутствия данных при коксартрозе
|
–
|
Сильная*
|
Строго
не рекомендовано
|
|
Комбинация глюкозамина
и хондроитина
|
–
|
–
|
–
|
Слабая
|
|
|
Не должно применяться
|
Строго
не рекомендовано
|
|
|
|
|
|
Неомыляемые
соединения авокадо и сои
|
В
|
Не рекомендовано
|
–
|
Слабая
|
–
|
|
Диацереин
|
В
|
Неубедительно
|
–
|
Слабая
|
–
|
В официальных документах фигурирует использование только перорального хондроитина сульфата. В рекомендациях применение хондроитина сульфата внутримышечно или внутрисуставно не упоминается, так как нет убедительных исследований, подтверждающих терапевтическую эффективность парентеральных форм.
Кроме хондроитина сульфата на первом шаге фармацевтического лечения ОА коленного сустава ESCEO рекомендует использовать также кристаллический глюкозамин сульфат, ES которого при боли составляет 0,27, что практически в 2 раза больше, чем действие парацетамола (ES=0,14) [25]. Глюкозамина сульфат кристаллический обладает не только обезболивающим эффектом, но и влияет на функцию суставов, а при длительном приеме оказывает структурно-модифицирующее действие [26–28]. Только кристаллизованный глюкозамина сульфат в отличие от других глюкозаминов тормозит сужение суставной щели (эффект через 3 года приема – 0,32) [8].
Другие формы глюкозамина (глюкозамина сульфат обычный, глюкозамина гидрохлорид) в клинических исследованиях не показали терапевтической эффективности [25, 29]. Это связано, очевидно, с особенностями фармакокинетики разных форм глюкозамина.
Рабочая группа ESCEO настоятельно рекомендует использовать кристаллический глюкозамина сульфат в качестве первого этапа долгосрочной фоновой терапии для лечения ОА коленного сустава и не рекомендует применять другие составы глюкозамина.
Учитывая доказанную клиническую эффективность и хорошую переносимость лекарственных средств хондроитина сульфата и глюкозамина сульфата, их можно рассматривать в качестве наиболее предпочтительных препаратов для лечения клинических проявлений ОА у больных с коморбидной патологией. Однако, используя сравнительно безопасные и качественные хондропротекторы, и даже здесь следует помнить о предупреждениях при их назначении, что особенно актуально у коморбидных пациентов (табл. 3).
Таблица 3. Предупреждения при применении отдельных хондропротекторов
|
Лекарственное средство
|
Предупреждения
|
|
Хондроитина сульфат (Структум)*
|
Не применимо
|
|
Глюкозамин**
|
Сахарный диабет
Высокий уровень холестерина/триглицеридов
Рак
Заболевания печени
Бронхиальная астма или другие расстройства дыхания
Аллергия на морепродукты
|
|
Комбинация глюкозамина
и хондроитина**
|
Сахарный диабет
Высокий уровень холестерина
Высокое кровяное давление
Рак простаты
Бронхиальная астма
Гемофилия
Аллергия на морепродукты
|
Примечание: * – согласно инструкции по медицинскому применению в Республике Беларусь; ** – подается в сокращении, согласно Drugs.com.
Предупреждения не содержат только инструкция по медицинскому применению хондроитина сульфата (Структума). По официальной позиции ЕULAR, хондроитина сульфат показан всем пациентам с ОА или остеохондрозом любой локализации и сопутствующими состояниями (метаболическим синдромом, сахарным диабетом, дислипидемией, сердечно-сосудистыми, онкологическими заболеваниями) [30].
Комбинация глюкозамина и хондроитина. Глюкозамин и хондроитина сульфат часто встречаются в комбинации как в качестве БАД (диетических добавок), так и в качестве лекарственных препаратов. Клинические исследования дают противоречивые результаты относительно того, есть ли какие-либо дополнительные преимущества, которые можно извлечь из комбинации. По мнению многих исследователей, глюкозамина и хондроитина сульфат в комбинации не облегчают симптомы и не влияют на прогрессирование заболевания у пациентов с ОА [31, 32]. Как известно, при использовании комбинации препаратов хондроитина сульфат влияет на всасывание глюкозамина, снижая его биодоступность на 50–75% [33, 34].
Рабочая группа ESCEO слабо не рекомендует комбинацию глюкозамина и хондроитина сульфата на первом этапе фоновой терапии, поскольку нет препарата, который одновременно содержал бы оба запатентованные оригинальные действующие вещества и нет убедительных доказательств клинической эффективности такой комбинации.
Другие хондропротекторы. В качестве таковых используются неомыляемые соевые бобы и авокадо. Эта комбинация представляет собой сложную смесь многих натуральных растительных экстрактов, взятых из авокадо и соевых масел. В ранее проведенных клинических исследованиях было показано некоторое уменьшение боли, скованности и физической функции при использовании неомыляемых соевых бобов и авокадо, что приводило к снижению потребности в приеме обезболивающих препаратов [35].
Диацереин – производное антрахинона с противовоспалительной активностью. В мета-анализах диацереин при длительном приеме оказывает небольшое положительное влияние на боль, что эквивалентно снижению боли на 9% и величиной эффекта (ES) 0,24, что выше, чем у парацетамола [36]. Безопасность диацереина была поставлена под сомнение после сообщений о тяжелой диарее и редких случаях потенциально серьезной гепатотоксичности. Основные побочные действия возникают со стороны желудочно-кишечного тракта (диарея, боль в животе, мягкий стул, колит), а также может изменяться цвет мочи [37]. Частота возникновения диареи после ежедневного лечения диацереином 100 мг, по сообщениям, варьирует от 2,3 до 45,9%. Этот широкий диапазон результатов может быть частично объяснен изменчивостью продуктов, содержащих диацереин, на рынке [38]. Тем не менее EMA сделан вывод о том, что баланс диацереина в отношении пользы и риска остается положительным для ОА тазобедренного и коленного сустава у пациентов в возрасте до 65 лет [39].
Рабочая группа ESCEO дает слабую рекомендацию использовать неомыляемые соединения авокадо – сои и диацереин в качестве альтернативной терапии на первом этапе лечения.
Если у пациента сохраняется симптоматика после установления соответствующей фоновой фармакологической терапии хондропротекторами, а спасательная анальгезия с парацетамолом обеспечивает недостаточное облегчение симптомов, к схеме лечения на первом шаге могут быть добавлены топические НПВП.
Если лечение на первом шаге показывает недостаточную эффективность, у пациента сохраняется болевой синдром, прибегают к назначению НПВП внутрь. Это уже второй шаг терапии (рис. 4). Пероральные НПВП эффективны для лечения боли при ОА, оказывая слабое или умеренное влияние. При этом величина эффекта составляет 0,35–0,58 [40]. Разницы в эффективности селективных ингибиторов ЦОГ-2, частично селективных или неселективных НПВП при ОА, не отмечается [41, 42].
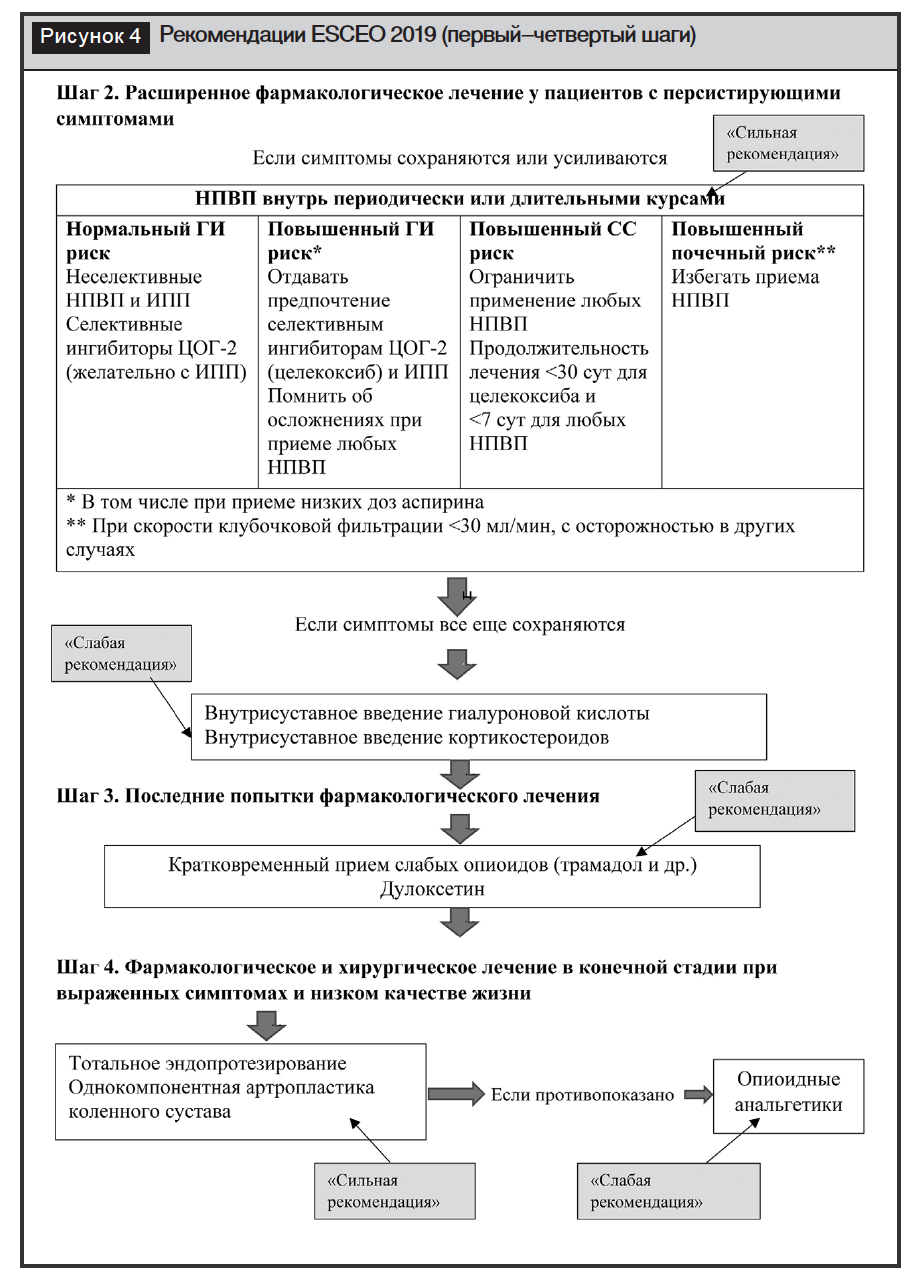
Проведенные мета-анализы по оценке безопасности НПВП свидетельствуют, что все НПВП, в том числе и ингибиторы ЦОГ-2, обладают потенциальной токсичностью для желудочно-кишечного тракта и сердечно-сосудистой системы. НПВП могут обострять течение сердечно-сосудистых заболеваний, способствовать дестабилизации артериальной гипертензии, вызывать прогрессирование хронической сердечной недостаточности, снижать эффективность препаратов, используемых в лечении сердечно-сосудистых заболеваний (?-адреноблокаторы, диуретики, ингибиторы АПФ) [43–45].
С повышенным кардиоваскулярным риском особенно ассоциирован длительный прием НПВП. У пациентов с артериальной гипертензией рекомендуется измерять артериальное давление до начала приема НПВП и контролировать его после начала терапии. При ранее существовавшей гипертензии рекомендуется контроль артериального давления даже при кратковременном приеме НПВП. У пациентов с резистентной к лечению гипертензией следует вообще избегать приема НПВП, если это возможно [45].
Все НПВП также связаны с повышенным риском острого повреждения почек, которое может быть особенно высоким в первые 30 дней после начала терапии [46]. Вероятность повреждения почек у пациентов с ОА меньше при сохраненной функции, но опасность повреждения заметно повышается при сопутствующей артериальной гипертензии, сердечной недостаточности или сахарном диабете.
При ОА рекомендуется использовать НПВП в самой эффективной дозе в течение короткого периода времени, необходимого для контроля боли, а не в хроническом использовании. В целом, при ОА предпочтителен прием НПВП по требованию [47]. Поэтому анахронизмом выглядят ситуации, когда НПВП содержатся в комбинированных хондропротекторах, что исключает возможность отмены НПВП без отмены хондропротектора.
Рабочая группа ESCEO настоятельно рекомендует использовать пероральные НПВП (селективные или неселективные) в качестве терапии второго шага. Использование оральных НПВП должно основываться на профиле риска пациента и клиническом опыте врача.
Поскольку болевой синдром занимает одно из ведущих мест среди жалоб пожилых больных, то они самостоятельно или по назначению врача для купирования боли наиболее часто употребляют НПВП. Выбор эффективного и безопасного препарата для этой цели является актуальной задачей для специалистов различных специальностей. У коморбидных пациентов для каждого лекарственного средства особенно тщательно следует учитывать противопоказания к назначению, предостережения, особенности применения и взаимодействие.
В качестве примера можно рассмотреть применение одного из НПВП – ибупрофена – у коморбидного пациента с ОА, тем более что именно ибупрофен входит в состав некоторых комбинированных препаратов для лечения ОА (Терафлекс адванс). В инструкции по применению указан ряд предупреждений, перечислены взаимодействия препарата, что важно учитывать при лечении (табл. 4).
Таблица 4. Ибупрофен*: предупреждения и взаимодействия
|
Предупреждения
|
Взаимодействия
|
|
Противопоказан при астме, уртикарии, системной красной волчанке, воспалительных заболеваниях кишечника Риск инфаркта миокарда или инсульта Риск побочных эффектов со стороны желудочно-кишечного тракта: кровотечения, язвы, перфорации язвы желудка
или кишечника, которые могут быть летальными Ухудшает течение артериальной гипертензии Осторожно при тяжелой сердечной
недостаточности При заболеваниях печени – контроль функции печени Контроль свертываемости крови
|
НПВП, метотрексат
Аспирин
Антигипертензивные
Антидиуретические
Антикоагулянты
Кортикостероиды
Витамины С, В12, D3
|
Примечание: *подается в сокращении, согласно Drugs.com.
Предупреждений частично можно избежать или их предупредить. Но важнейшее в данном случае даже не предупреждения, а возможность взаимодействия ибупрофена с аспирином. Ибупрофен может конкурировать с аспирином за связывание с активным центром ЦОГ-1 и отменять антиагрегантный эффект аспирина. Если пациент по поводу сопутствующей ишемической болезни сердца или после стентирования коронарных артерий принимает аспирин, то назначение ему ибупрофена противопоказано, так как это заметно увеличивает кардиоваскулярный риск. Больным ОА с высоким кардиоваскулярным риском НПВП следует назначать с большой осторожностью, соблюдая принятые рекомендации.
Внутрисуставные вмешательства: гиалуроновая кислота и кортикостероиды. В случае противопоказаний к назначению НПВП или если у пациента сохраняется симптоматика, несмотря на применение НПВП, может быть рассмотрено внутрисуставное введение гиалуроновой кислоты. Это хорошая альтернатива НПВП при ОА коленных суставов с более благоприятным профилем безопасности, особенно для пожилых пациентов или лиц с более высоким риском развития осложнений НПВП. Гиалуроновая кислота при ОА оказывает благотворное влияние на боль, функцию и общую оценку состояния пациента [48, 49].
Терапевтический эффект инъекций гиалуроновой кислоты может сохраняться до 6 месяцев. Обычно на курс лечения рекомендуется ввести в целевой сустав 3 инъекции препарата. Дополнительной пользы от 5-инъекционного курса гиалуроновой кислоты по сравнению с 3 инъекциями не получают [50]. Побочные реакции при технически правильном введении гиалуроновой кислоты и соблюдении показаний к применению возникают крайне редко.
Применение низкомолекулярных препаратов гиалуроновой кислоты в большей степени показано с целью вискоиндукции (ранние стадии ОА), а высокомолекулярная – предпочтительнее с целью вискосапплементации (поздние стадии ОА). Используя дифференцированный подход, гиалуроновую кислоту можно применять при любой стадии ОА.
Рабочая группа ESCEO дает слабую рекомендацию относительно использования гиалуроновой кислоты у пациентов, у которых есть противопоказания к применению НПВП, или если больной все еще имеет симптомы, несмотря на применение НПВП.
Кортикостероидные гормоны, введенные в сустав, быстро и эффективно подавляют боль и воспаление при синовитах (отек и припухание сустава).Проблема заключается в том, чтосам ОА кортикостероиды не лечат и лечить не могут, они не в состоянии предотвратить и развитие артрозных изменений. Кортикостероиды не улучшают состояние суставного хряща, не укрепляют костную ткань и не восстанавливают нормальное кровообращение. Однако они более эффективны, чем плацебо и препараты гиалуроновой кислоты в краткосрочной перспективе (2–4 недели), их эффективность может быть выше у лиц с более сильной болью [51, 52].
Для внутрисуставных инъекций используют обычно пролонгированные формы бетаметазона, метилпреднизолона или триамцинолона. Если первое внутрисуставное введение кортикостероидов у пациента с ОА не дало положительного результата, маловероятно, что его даст второе или третье введение. Применять внутрисуставные инъекции кортикостероидов как самостоятельный метод лечения ОА бессмысленно. Они должны использоваться только в комплексной терапии.
Рабочая группа ESCEO дает слабые рекомендации по применению кортикостероидов внутрисуставно.
Третий шаг – последние попытки фармакологического лечения. При сохранении клинической симптоматики у пациента с ОА переходят к третьему шагу в терапии. В схему лечения могут быть включены либо слабые опиоиды (трамадол, кодеин), либо дулоксетин. При ОА коленных суставов имеются доказательства обезболивающего эффекта трамадола [53]. Правда, есть и сообщения, что среди пациентов с ОА в возрасте 50 лет и старше начальное назначение трамадола ассоциировалось со значительно более высоким уровнем смертности в течение первого года наблюдения по сравнению с обычно назначаемыми НПВП, но не по сравнению с кодеином [54]. Меньше побочных действий отмечают при использовании трамадола с замедленным высвобождением (SR).
Антидепрессант дулоксетин используют при нейропатической боли, хронических болевых синдромах, и некоторые доказательства эффекта показаны при ОА, особенно у пациентов с болью от центральной сенсибилизации [55].
Дулоксетин относится к антидепрессантам из группы ингибиторов обратного захвата серотонина и норадреналина. От других его отличает наличие антидепрессивного и одновременно обезболивающего эффектов. Дулоксетин подавляет обратный захват серотонина и норадреналина, в результате чего повышается серотонинергическая и норадренергическая нейротрансмиссия в ЦНС. Центральный механизм подавления болевого синдрома проявляется повышением порога болевой чувствительности при нейропатической боли.
Проанализировав результаты проведенных исследований, ESCEO дает слабую рекомендацию об использовании слабых опиоидов, а также дулоксетина в качестве альтернативы на третьем шаге алгоритма лечения в качестве последней фармакологической попытки перед операцией.
Четвертый шаг – фармакологическое и хирургическое лечение в конечной стадии ОА при выраженных симптомах и низком качестве жизни. Когда возможности фармакологического лечения исчерпаны, переходят к четвертому шагу лечения. Хирургические методы, которые могут быть использованы, включают тотальное эндопротезирование или однокомпонентную артропластику коленного сустава. В последние десятилетия повсеместно наблюдается увеличение количества выполненных операций по замене суставов. Тотальное эндопротезирование сустава имеет лучшую долгосрочную эффективность. Эндопротезирование дает лучшие результаты, когда пациенты тщательно отобраны, операция выполнена профессионально, проведена подходящая реабилитация.
Для пациентов с выраженной симптоматикой, которым хирургическое вмешательство назначено, и они находятся в листе ожидания, или которые не желают подвергаться хирургическому вмешательству, или имеются противопоказания к операции последними фармакологическими средствами могут быть классические пероральные опиоиды или трансдермальные опиоидные системы [56].
ESCEO настоятельно рекомендует (сильная рекомендация) проводить эндопротезирование коленных суставов у лиц с ОА на конечной стадии заболевания. Других эффективных методов лечения ОА в этой стадии болезни просто не существует.
Применение же классических оральных или трансдермальных опиоидов на конечной стадии ОА коленного сустава расценено как слабая рекомендация.
Заключение
Таким образом, лечение ОА в настоящее время не является столь безуспешным, как это было 30–40 лет назад. В арсенале врача имеется комплекс нефармакологических, фармакологических и, наконец, хирургических методов воздействия. Важнейшая из задач – максимально ранняя диагностика заболевания, своевременное назначение адекватной и рациональной терапии с учетом наличия сопутствующих заболеваний и мнения самого пациента. Принципиально новый подход в современных рекомендациях по ведению пациентов с ОА – начало фармакологического лечения с назначения хондропротекторов (SYSADOA). Многочисленные исследования подтверждают, что хондроитина сульфат улучшает клиническое течение болезни: способствует снижению выраженности хронического болевого синдрома, при длительном применении обладает структурно-модифицирующим действием; безопасен для пациентов с любой сопутствующей патологией, единственный из хондропротекторов, рекомендованный при любой локализации ОА (коленного, тазобедренного и ОА суставов кистей).
Л И Т Е Р А Т У Р А
1. Allen K.D., Golightly Y.M. // Curr. Opin. Rheumatol. – 2015. – Vol.27, N3. – P.276–283.
2. Vina E.R., Kwoh C.K. // Curr. Opin. Rheumatol. – 2018. – Vol.30, N2. – P.160–167.
3. Bruyere O., Honvoa G., Veronesec N., et al. // Sem. Arthritis Rheumatism. – 2019. – N49. – P.337–350.
4. Sharon L., Kolasinski S.L., Neogi T., et al. // Arthritis Care & Research. – 2020. – Vol.72, N2. – P.149–162.
5. OARSI. Osteoarthritis: A Serious Disease, Submitted to the U.S. Food and Drug Administration December 1, 2016.
6. Atlas of Osteoarthritis, ESCEO, 2018.
7. Сорока Н.Ф. // Здравоохранение. – 2008. – №9. – С.65–67.
8. Bruyere O., Cooper C., Pelletier J.-P., et al. // Semin. Arthritis Rheum. – 2014. – Vol.44, N3. – P.253–263.
9. Bruyere O., Cooper C., Pelletier J.-P., et al. . Arthritis Rheum. – 2016. – Vol.45, Suppl.4S. – P3–11.// Semin
10. Messier S.P., Resnik A.E., Beavers D.P., et al. // Arthritis Care Res. (Hoboken). – 2018. – Vol.70, N11. – P.1569–1575.
11. Conaghan P.G., Arden N., Avouac B., et al. // Drugs Aging. – 2019. – Vol.36, Suppl.1. – P.7–14.
12. Martel-Pelletier J., Farran A., Montell E., et al. // Molecules. – 2015. – Vol.20, N3. – P.4277–4289.
13. Imada K., Oka H., Kawasaki D., et al. // Biol. Pharm. Bull. – 2010. – Vol.33, N3, – P.410–414.
14. Volpi N. // J. Pharm. Pharmacol. – 2009. – Vol.61, N10. – P.1271–1280.
15. Rainsford K.D. // J. Pharm Pharmacol. – 2009. – Vol.61, N10. – P.1263–1270.
16. Lauder R.M. // Complement. Ther. Med. – 2009. – Vol.17, N1. – P.56–62.
17. Jordan K.M., Arden N.K., Doherty M., et al. // Ann. Rheum. Dis. – 2003. – Vol.62, N12. – P.1145–1155.
18. Volpi N. Chondroitin Sulfate Safety and Quality. Molecules. – 2019. – Vol.24, N8. – P.1447.
19. Аникин С.Г, Алексеева Л.И. // Современная ревматология. – 2012. – №2. – С.78–82.
20. Reginster J.Y., Dudler J., Blicharski T., Pavelka K. // Ann. Rheum. Dis. – 2017. – Vol.76, N9. – P.1537–1543.
21. Pelletier J.P., Raynauld J.P., Beaulieu A.D., et al. // Arthritis Res. Ther. – 2016. – Vol.18, N1. – P.256.
22. Schneider H., Maheu E., Cucherat M. // Open Rheumatol. J. – 2012. – N6. – P.183–189.
23. Kloppenburg M., Fйline P.B. Kroon F.P.B., et al. // Ann. Rheum. Dis. – 2019. – Vol.78, N1. – P.16–24:DOI:10.1136.
24. Zhang W. // Ann. Rheum. Dis. – 2005. – Vol.64. – P.669–681.
25. Eriksen P., Bartels E.M., Altman R.D., et al. // Arthritis Care Res. (Hoboken). – 2014. – Vol.66, N12. – P.1844–1855.
26. Pavelka K., Gatterova J., Olejarova M., et al. // Arch. Intern. Med. – 2002. – Vol.162, N18. – P.2113–2123.
27. Bruyere O., Pavelka K., Rovati L.C., et al. // Osteoarthritis Cartilage. – 2008. – Vol.16, N2. – P.254–260.
28. Gregori D., Giacovelli G., Minto C., et al. // JAMA. – 2018. – Vol.320, N24. – P.2564–2579.]
29. Runhaar J., Rozendaal R.M., Middelkoop M.V., et al. // Ann. Rheum. Dis. – 2017. – Vol.76, N11. – P.1862–1869.
30. Sakellariou G., Conaghan P.G., Zhang W. et al. // Ann. Rheum. Dis. – 2017. – Vol.76, N9. – P.1484–1494.
31. Yang S., Eaton C.B., McAlindon T.E., Lapane R.L. // Arthritis Rheumatol. – 2015. – Vol.67, N3. – P.714–723.
32. Roman-Blas J.A., Castaneda S., Sanchez-Pernaute O., et al. // Arthritis Rheumatol. – 2017. – Vol.69, N1. – P.77–85.
33. Altman R.D. // Expert Rev. Clin. Pharmacol. – 2009. – Vol.2, N4. – P.359–371.
34. Jackson C.G., Plaas A.H., Sandy J.D., et al. // Osteoarthritis Cartilage. – 2010. – Vol.18, Issue 3. – P.297–302.
35. Appelboom T., Schuermans J., Verbruggen G., Henrotin Y., Reginster J.Y. . – 2001. – Vol.30, N4. – P.242–247.// J. Rheumatol
36. Bartels E.M., Bliddal H., Schondorff P.K., et al. // Osteoarthritis Cartilage. – 2010. – Vol.18, N3. – P.289–296.
37. Honvo G., Reginster J-Y., Rabenda V., et al. // Drugs Aging. – 2019. – Vol.36, Suppl.1. – P.65–99.
38. Pelletier J.P., Martel-Pelletier J. // Aging Clin. Exp. Res. – 2018. – Vol.30, N4. – P.411–412.
39. EMA. European Medicines Agency. Assessment report for diacerein containing medicinal products. EMA/527347/2014. Available from: http://www.ema. europa.eu/docs/en_GB/ document_library/ Referrals_document/Diacerein/ Euro[Accessed 27 April 2018].pean_Commission_final_decision / WC500173145.pdf
40. da Costa B.R., Reichenbach S., Keller N., et al. // Lancet. – 2017. – Vol.390 (10090). – e21–33.
41. Pelletier J.-P., Martel-Pelletier J., Rannou F., Cooper C. // Semin Arthritis Rheum. – 2016. – Vol.45, Suppl.4. – P.22–27.
42. Jung S.Y., Jang E.J., Nam S.W., et al. // Mod. Rheumatol. – 2018. – Vol.28, N6. – P.1021–1028.
43. Cooper C., Chapurlat R., Al-Daghri N., et al. // Drugs Aging. – 2019. – Vol.36, Suppl.1. – P.15–24.
44. Alekseeva L.I., Nasonov E.L. // Medicographia. – 2013. – N35. – P.152–157.
45. Szeto C.-C., Sugano K., Wang J-G., et al. // Recommendations Gut. – 2020. – Vol.69, N4. – P.617–629.
46. Ungprasert P., Cheungpasitporn W., Crowson C.S., Matteson E.L. // Eur. J. Intern. Med. – 2015. – Vol.26, N4. – P.285–291.
47. Ho K.Y., Gwee K.A., Cheng Y.K., et al. // J. Pain Res. – 2018. – N11. – P.1937–1948.
48. Cooper C., Rannou F., Richette P., Bruyere O., et al. // Arthritis Care Res. (Hoboken). – 2017. – Vol.69, N9. – P.1287–1296.
49. Pelletier J-P., Raynauld J.P., Abram F., et al. // Arthritis Res. Ther. – 2018. – Vol.20, N1. – P.40.
50. Stitik T.P., Issac S.M., Modi S., et al. // Arch. Phys. Med. Rehabil. – 2017. – Vol.98, N5. – P.1042–1050.
51. van Middelkoop M., Arden N.K., Atchia I., et al. // Osteoarthritis Cartilage. – 2016. – Vol.24, N7. – P.1143–1152.
52. Juni P., Hari R., Rutjes A.W., et al. // Cochrane Database Syst. Rev. – 2015. – N10: CD005328.
53. Pelletier J.P., Martel-Pelletier J., Rannou F., Cooper C. // Semin. Arthritis Rheum. – 2016. – Vol.45, Suppl.4. – P.22–27.
54. Zeng C., Dubreuil M., LaRochelle M.R., et al. // JAMA. – 2019. – Vol.321, N10. – P.969–982.
55. Wang Z.Y., Shi S.Y., Li S.J., et al. // Pain Med. – 2015. – Vol.16, N7. – P.1373–1385.
56. Nuesch E., Rutjes A.W., Husni E., et al. // Cochrane Database Syst. Rev. – 2009. – N4: CD003115.
Медицинские новости. – 2020. – №9. – С. 9-16.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.