Внимание! Статья адресована врачам-специалистам
Dotsenko E.A., Sholkava M.V.
Belarusian State Medical University, Minsk
Application of angiotensin-converting enzyme inhibitors
in general medical practice
Резюме. Обзор посвящен препаратам группы ингибиторов ангиотензинпревращающего фермента (иАПФ) и их назначению врачами практического здравоохранения. Сделан акцент на механизм действия, особенности фармакодинамики различных представителей группы иАПФ, выраженность их клинических эффектов, представлены результаты современных многоцентровых исследований. Изложены общие принципы назначения препаратов иАПФ для терапевтов и врачей общей практики.
Ключевые слова: ингибиторы ангиотензинпревращающего фермента, артериальная гипертензия, общая врачебная практика.
Медицинские новости. – 2020. – №9. – С. 32–38.
Summary. The review is devoted to the group of angiotensin-converting enzyme inhibitors (ACE inhibitors) and their prescription by physicians of practical healthcare settings. The emphasis is done on the mechanism of action, the pharmacodynamics of various medications of the ACE inhibitor group, their clinical effects. The results of modern multicenter studies are presented. The purpose of this article is to summarize data on the general principles of prescribing ACE inhibitors for physicians and general practitioners.
Keywords: inhibitors of angiotensin-converting enzyme, arterial hypertension, general medical practice.
Meditsinskie novosti. – 2020. – N9. – P. 32–38.
Ингибиторы ангиотензинпревращающего фермента (иАПФ) являются базисными лекарственными средствами для лечения артериальной гипертензии (АГ). иАПФ и их влиянию на патофизиологические механизмы и клинической эффективности посвящено множество оригинальных статей, обзоров, мета-анализов, в которых однозначно доказана позитивная роль этих препаратов в снижении общей смертности, числа фатальных и нефатальных сердечно-сосудистых событий, в предотвращении патологического ремоделирования отдельных органов и систем [14, 16, 17, 36].
Вместе с тем, если назначение иАПФ пациенту с АГ не подвергается сомнению, то выбор препарата у конкретного пациента порой затруднителен и определяется формулой «назначаем то, что более популярно». Почему это происходит? С одной стороны, только у нас в стране зарегистрировано более 100 лекарственных средств на основе иАПФ как в виде монопрепаратов, так и в составе комбинированных. С другой стороны, практически ежегодно появляются обновленные рекомендации по лечению АГ, хронической сердечной недостаточности (ХСН), ишемической болезни сердца (ИБС) и др., в которых в той или иной степени меняются названия препаратов, рекомендации по выбору иАПФ, уточняются клинические ситуации, когда предпочтительнее назначение того или иного препарата. Практикующий терапевт или врач общей практики далеко не всегда успевает уследить за обновлениями. Более того, он не может оценить клиническую эффективность обновлений.
Еще одна проблема состоит в том, что иАПФ в подавляющем большинстве случаев назначает именно терапевт или врач общей практики, а не кардиолог. Если последний, как узкий специалист, сравнительно легко может воспринять и проанализировать подробные, детальные, но достаточно громоздкие описания результатов многочисленных мультицентровых исследований иАПФ, то врач общей практики вынужден изучать аналогичные исследования по множеству разделов клинической медицины, с которыми он сталкивается в своей практике: гастроэнтерология, нефрология, неврология и т.д. Такая ситуация, по нашему мнению, создает определенную проблему во взаимопонимании между узким специалистом (в данном случае – кардиологом) и терапевтом, врачом общей практики, которые оценивают пациента в целом, взвешивая риски между двумя «поли-»: лечением полиморбидной патологии и полипрагмазией.
Цель настоящей статьи – представить терапевтам, врачам общей практики информацию об общих принципах назначения иАПФ пациентам с АГ.
Механизм действия иАПФ и основные патофизиологические эффекты
Группа иАПФ включает в себя разнородные по химическому строению вещества, обладающие сходным свойством: подавлять активность одного из ферментов ренин-ангиотензин-альдостероновой системы (РААС) – ангиотензинпревращающего фермента (дипептидилкарбоксипептидазы, киназы II). Несколько упрощенно процесс регуляции артериального давления с участием РААС выглядит следующим образом (рисунок): в печени синтезируется ангиотензиноген, который в плазме крови расщепляется ренином, превращая его в слабоактивный декапептид – ангиотензин I; последний под воздействием АПФ (синтезируется в легких) превращается в ангиотензин II; дальнейшее превращение ангиотензина II в ангиотензин III происходит под влиянием ангиотензиназы, что сопровождается снижением вазоконстрикторной активности. Ангиотензин II обладает широким спектром биологических эффектов, в частности, вазоконстрикторным (сильнее и длительнее норадреналина); стимулирует синтез альдостерона, активируя реабсорбцию натрия в почках и, соответственно, пассивную реабсорбцию воды; стимулирует синтез антидиуретического гормона, который повышает синтез аквапориновых каналов в собирающих клубочках почки, следовательно, реабсорбцию воды. За счет периферической вазоконстрикции, увеличения объема циркулирующей крови артериальное давление повышается. иАПФ, конкурентно ингибируя активность ангиотензинпревращающего фермента, снижают активность РААС, одновременно повышают уровень брадикинина, который инактивируется тем же АПФ [13]. Кроме того, в сердечной мышце наряду с констрикцией коронарных артерий ангиотензин II обусловливает положительный инотропный эффект (непосредственно или в результате пресинаптического высвобождения нор-адреналина), что может способствовать развитию аритмий в условиях ишемии.
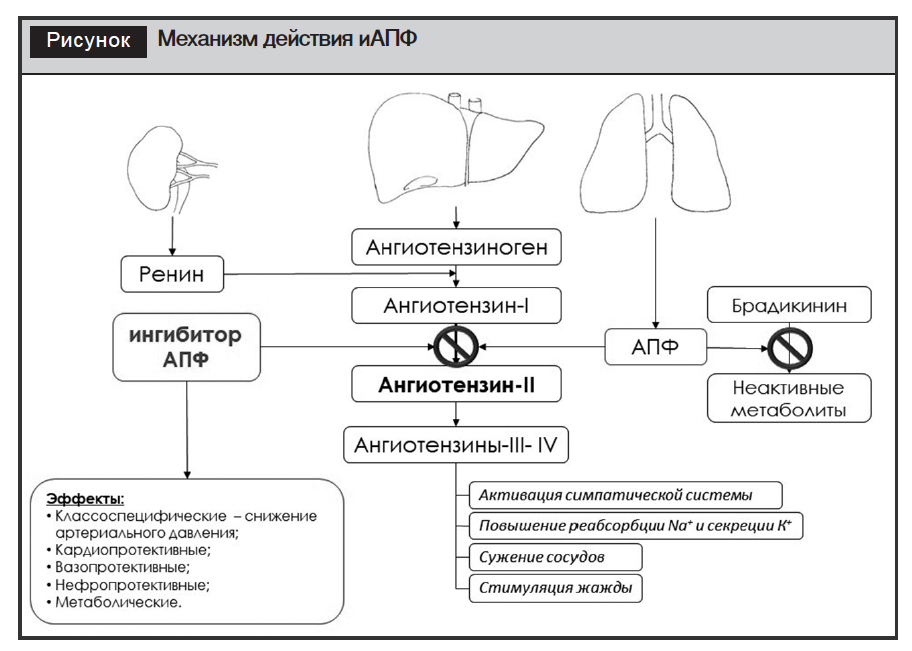
Таким образом, основной эффект иАПФ – гемодинамический – заключается в периферической вазодилятации (преимущественно артериальной), что и обусловливает гипотензивное действие препаратов.
Образование ангиотензина II происходит не только под влиянием АПФ, но и под действием ферментов, на которые не влияют иАПФ: химаз (в сердце), катепсина-G, эндотелиальной клеточной пептидилдипептидазы, почечной карбоксипептидазы. Более того, некоторые исследователи считают, что АПФ-зависимое образование ангиотензина II составляет лишь около 10–15%, тогда как альтернативные пути ответственны за образование остальных 85–90% пептида. Об этом феномене важно помнить, поскольку он объясняет известный всем клиницистам эффект «ускользания» из-под влияния иАПФ, что проявляется в снижении антигипертензивного эффекта иАПФ при их длительном приеме и в отсутствии дополнительного эффекта при повышении дозировок.
Вазоконстрикторная функция РААС в норме уравновешивается вазодилятирующим влиянием каллекреин-кининовой системы, в основе которой лежат эффекты брадикинина. При АГ, ХСН баланс нарушается в пользу РААС с преобладанием спазма сосудов [10].
Важно помнить еще об одном обстоятельстве. РААС является двухкомпонентной системой, имеющей циркулирующее и локальное звенья. Полагают, что 90–99% АПФ содержится в тканях, среди которых первое место занимает мембрана клеток сосудистого эндотелия и лишь 1–10% находится в циркулирующем русле крови. Тканевые АПФ синтезируются клетками эндотелия, сердца, почек, головного мозга, кишечника, надпочечников [5, 8]. Циркулирующий компонент РААС обеспечивает кратковременный контроль над состоянием сердечно-сосудистого и почечного гомеостаза (по принципу «быстрого реагирования»). Тканевая РААС является системой длительного действия, и ее активность нарастает постепенно. Именно тканевые компоненты РААС вызывают хронические неблагоприятные и трудно устранимые последствия. В миокарде локально синтезируются факторы, регулирующие процессы клеточного роста и деления (проонкогены), которые вызывают развитие гипертрофии мышечных волокон и изменение архитектоники миокарда, стимулируют рост фибробластов и выработку ими белков соединительной ткани, вследствие чего активируются фибротические процессы и отложение соединительной ткани между мышечными волокнами. Ангиотензин II ускоряет программируемую смерть клеток (апоптоз). Аналогичные изменения развиваются в гладкой мускулатуре. Повышенная активность РААС в почках приводит к гипертрофии мезангия, фиброзу интерстиция, атрофии клубочков и канальцев; в сосудах – гипертрофии и гиперплазии гладкомышечных клеток. Следует отметить, что среди иАПФ периндоприл характеризуется самой высокой селективностью связывания с брадикинином, что существенно увеличивает местную продукцию брадикинина тканями и снижает апоптоз эндотелиальных клеток. Брадикинин увеличивает экспрессию NО-синтезы, улучшает функцию эндотелия, оказывает антиоксидантное действие и усиливает фибринолиз (за счет высвобождения тканевого активатора плазминогена) [6]. Влияние периндоприла на показатели апоптоза превосходит аналогичный эффект других иАПФ.
В почках иАПФ расширяют преимущественно эфферентные артериолы и меньше влияют на афферентные. Нефропротективные эффекты иАПФ связывают с их способностью снижать системное и клубочковое давление; подавлять гиперпластические процессы в клубочках почек, уменьшать проницаемость клубочковых капилляров для белков, тормозить накопление внеклеточного матрикса в клубочках почек, уменьшать воспалительную реакцию и снижать фибропластическую активность в тубуло-интерстициальной ткани. Интересно, что положительный эффект применения иАПФ имеет место при изолированной микроальбуминурии – раннем признаке поражения почек [3].
Сродство отдельных представителей иАПФ только к плазменному ангиотензинпревращающему ферменту и/или к тканевым молекулам существенно влияет как на степень блокады АПФ, так и на продолжительность эффекта препарата. Например, период полувыведения (Т½) квинаприла составляет 1 час, его активного метаболита – 3 часа, однако препарат имеет полупериод уменьшения ингибиторной активности АПФ около 25 часов из-за высокой тропности к тканевым ферментам и назначается 1–2 раза в сутки.
За счет блокады, прежде всего тканевой РААС, иАПФ и оказывают кардиопротективное (замедление гипертрофии и ремоделирования миокарда), вазопротективное (улучшение эндотелиальной функции) и нефропротективное (предотвращение прогрессирования хронической болезни почек) действия, а также благоприятное влияние на метаболизм углеводов (уменьшение инсулинрезистентности) и жиров (антиатерогенные сдвиги в липидном спектре) [32].
Основные клинические эффекты иАПФ:
– классоспецифические – снижение артериального давления;
– кардиопротективные;
– вазопротективные;
– нефропротективные;
– метаболические.
Классификация
иАПФ – большая и неоднородная группа препаратов, представители которой имеют существенные различия между собой. Различия в молекулярной структуре позволяют классифицировать препараты по химическому строению: содержащие сульфгидрильную (каптоприл), карбоксильную (эналаприл, лизиноприл, рамиприл, периндоприл, спираприл), фосфорильную (фозиноприл) группу. Для клинициста такая классификация не очень интересна, но именно химические особенности иАПФ определяют фармакодинамические и фармакокинетические свойства препаратов (табл. 1): продолжительность ингибирования активности АПФ и соответственно действия, всасываемость в желудочно-кишечном тракте, биодоступность, связывание с белками плазмы и сродство к тканевым компонентам РААС.
Таблица 1. Фармакодинамические и фармакокинетические свойства отдельных представителей иАПФ
|
Препарат*
|
Коэффициент липофильности
|
Биодоступность натощак, %
|
Биодоступность после еды, %
|
Т½, ч**
|
Кратность приема
|
Элиминация печень/ почки
|
|
Каптоприл
|
0,044
|
75
|
35
|
2–3
|
3
|
10/90
|
|
Эналаприл
|
0,07
|
60
|
60
|
11
|
2
|
10/90
|
|
Лизиноприл
|
<0,01
|
25
|
25
|
12
|
2
|
0/100
|
|
Рамиприл
|
1,12
|
60
|
60
|
8–14 (18)
|
1
|
40/60
|
|
Фозиноприл
|
2
|
36
|
36
|
12
|
1
|
50/50
|
|
Периндоприл
|
3,4
|
70
|
55
|
1–5 (24)
|
1
|
10/90
|
|
Трандалоприл
|
0,33
|
10
|
10
|
16–24
|
1
|
67/33
|
|
Квинаприл
|
1,12
|
38
|
38
|
2–4 (24)
|
1–2
|
50/50
|
|
Спираприл
|
0,05
|
50
|
50
|
1,5 (20)
|
1
|
55/45
|
|
Моэксиприл
|
0,06
|
13
|
3
|
1–9 (24)
|
1
|
55/45
|
|
Зофеноприл
|
35
|
90
|
90
|
5,5 (24)
|
1
|
30/70
|
Примечание: * жирным шрифтом выделены лекарственные вещества, зарегистрированные в Республике Беларусь по состоянию на июль 2020 г.; ** указана Т½ для метаболитов и анти-АПФ активности.
иАПФ делятся на лекарства (каптоприл, лизиноприл) и пролекарства (все остальные). В первом случае эффектом обладает сам препарат, во втором – его метаболит. Существенного клинического значения это не имеет за исключением того, что лекарства действуют быстрее, поскольку не требуют биотрансформации.
Время полувыведения. В клинике удобнее использовать классификацию иАПФ по продолжительности действия [9].
1) препараты короткого действия, назначаются 2–3 раза в сутки (каптоприл);
2) препараты со средней продолжительностью действия, которые необходимо принимать до 2 раз в сутки (зофеноприл, эналаприл);
3) препараты длительного действия, назначаются 1 раз в сутки (квинаприл, лизиноприл, периндоприл, рамиприл, фозиноприл, трандолаприл).
Прием препаратов один раз в сутки повышает приверженность к лечению при длительном приеме, однако пациентам с высокой вариабельностью гипертензии (при лабильных цифрах артериального давления) и для экстренной помощи лучше подходят иАПФ короткого действия. В то же время имеются данные о том, что продолжительность блокады ангиотензинпревращающего фермента в тканях может продолжаться и после снижения концентрации препарата в плазме крови [2].
Липофильность/гидрофильность. К липофильным иАПФ относят каптоприл, эналаприл, периндоприл, рамиприл, квинаприл, трандалоприл, фозиноприл (препараты расположены в порядке нарастания липофильности). Гидрофильными свойствами обладает лизиноприл. Важной характеристикой также является показатель липофильности, который у периндоприла очень высок. Квинаприл, самый липофильный препарат, ингибирует АПФ в плазме, легких, почках, сердце, не попадает в головной мозг и гонады. Лизиноприл (гидрофильный) не «уходит» в жировую ткань, не метаболизируется в печени (что имеет значение для тучных пациентов и при поражении печени). Рамиприл, трандалоприл и периндоприл превосходят эналаприл по способности ингибировать АПФ в тканях легких, сердца, почек, надпочечников и в аорте.
Считается, что липофильные иАПФ имеют более высокую системную биодоступность и лучшее проникновение в ткани, нежели гидрофильные [8], однако существенных различий в клинической эффективности гидро/липофильных иАПФ не выявлено.
Путь выведения печень/почки. Почечный путь элиминации из иАПФ имеют лизиноприл, эналаприл, квинаприл, периндоприл. Преимущественно с желчью выводятся спираприл, трандолаприл. Ряд препаратов выводятся как через почечный, так и через печеночный пути элиминации: рамиприл, фозиноприл, моэксиприл. При наличии у пациента снижения скорости клубочковой фильтрации препараты со смешанным выведением обладают лучшим профилем безопасности [5, 13].
Следует признать, что классоспеци-фический эффект – снижение артериального давления – у всех иАПФ практически одинаков, естественно, с учетом дозирования, кратности приема и т.д.; различий, какой препарат мы будем использовать, нет. А вот с точки зрения органопротективных эффектов, препараты могут различаться. Наибольшего эффекта следует ожидать от иАПФ с высокой тканевой специфичностью [25]. Справедливости ради, следует отметить, что такая точка зрения поддерживается не всеми исследователями.
Акцент на периндоприл
Если в открытой базе Центра экспертиз и испытаний в здравоохранении в строку «Международное наименование» ввести слово «pril» появится 122 записи, включающие моно- или комбинированные препараты; в их составе: каптоприл, эналаприл, лизиноприл, периндоприл, фозиноприл и рамиприл (https://www.rceth.by/Refbank/reestr_lekarstvennih_sredstv/results). В клинических протоколах диагностики и лечения АГ учитывается только классоспецифический эффект иАПФ, равнозначное назначение: эналаприл, фозиноприл, периндоприл, лизиноприл, рамиприл, квинаприл, каптоприл.
Клинических исследований, касающихся прямых сравнений эффективности отдельных иАПФ, известно мало. Идеальный иАПФ должен обладать как классоспецифическими эффектами – снижение артериального давления, так и тканеспецифичными – кардио-, вазо-, нефропротективными, метаболическими эффектами. Очевидно, препарат должен быть изучен в хорошо организованных клинических исследованиях.
Одним из таких лекарственных средств является периндоприл. Препарат обладает оптимальным фармакокинетическим профилем, что, в частности, повышает приверженность пациентов к терапии высокой безопасностью [4].
Периндоприл представляет собой пролекарство с высокими липофильными свойствами, что обусловливает высокую степень ингибирования тканевой РААС. Метаболически неактивный периндоприл имеет сравнительно короткий Т½ – всего 1 час, однако его активный метаболит периндоприлат выводится почками медленно, его Т½ составляет 17 часов. Связь периндоприла с АПФ довольно прочная, «эффективный» Т½ составляет 25–30 часов, поэтому препарат назначается 1 раз в сутки. Биодоступность периндоприла составляет 75–95% и не зависит от приема пищи.
На протяжении последних двух десятилетий периндоприл неоднократно исследовался в крупных многоцентровых двойных слепых рандомизированных исследованиях (табл. 2). ASCOT, PROGRESS, EUROPA, PEP-CHF, PREAMI, ADVANCE, HYVET и PICXEL с участием пациентов разного возраста, с различной патологией и тяжестью заболевания, разным прогнозом неизменно демонстрировали высокий потенциал периндоприла в снижении смертности. Дальнейшая информация в статье основана на указанных исследованиях.
Таблица 2. Наиболее значимые многоцентровые клинические испытания периндоприла
|
Исследование
|
Год/источник
|
Цель
|
Сравниваемые
препараты
|
Число пациентов
|
Вывод
|
|
ASCOT
Anglo-Scandinavian Cardiac Outcomes Trial
|
2005 [31]
|
Оценка влияния различных комбинаций гипотензивных препаратов
|
Атенолол + тиазидный диуретик против амлодипин + периндоприл (5,5 года)
|
19 257
|
Снижение смертности от всех причин на 11%
|
|
PROGRESS
Perindopril Protection aGainst REcurrent Stroke Study
|
2001 [22]
|
Оценка влияния периндоприла на риск развития повторного инсульта
|
Периндоприл 4 мг ± индапамид против плацебо (3,9 года)
|
6105
|
Снижение частоты фатального/нефатального инсульта на 28%
|
|
EUROPA
The EURopean trial On reduction of cardiac events with Perindopril in stable coronary Artery disease
|
2003 [21, 28]
|
Оценка добавления периндоприла к терапии стабильной ИБС, включавшей антиагреганты, β-блокаторы и статины у пациентов после перенесенного инфаркта миокарда
|
Периндоприл 8 мг против плацебо (4,2 года)
|
12 218
|
Снижение риска инфаркта миокарда на 24% и смерти от сердечно-сосудистой патологии на 20%
|
|
PEP-CHF
Perindopril in Elderly People with Chronic Heart Failure
|
2006 [23]
|
Оценка влияния периндоприла у лиц старше 70 лет с диастолической дисфункцией и ХСН
|
Периндоприл 4 мг против плацебо (1 год)
|
850
|
Снижение смертности
на 31%, госпитализации –
на 38%
|
|
PREAMI
Perindopril and Remodelling in Elderly with Acute Myocardial Infarction study
|
2005 [27]
|
Оценка эффекта периндоприла у пациентов с острым инфарктом миокарда
|
Периндоприл 8 мг против плацебо (1 год)
|
1252
|
Предотвращение ремоделирования левого желудочка
|
|
ADVANCE
The Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation
|
2007 [33]
|
Оценка эффекта периндоприла на развитие макро- и микрососудистых осложнений у пациентов с сахарным диабетом
|
Периндоприл 4 мг ± индапамид против плацебо (4,3 года)
|
11 140
|
Снижение риска смерти
от сердечно-сосудистых событий на 18%,
от всех причин – на 14%
|
|
HYVET
HYpertension in the Very Elderly Trial
|
2008 [19, 35]
|
Оценка преимуществ лечения АГ у лиц старше 80 лет
|
Индапамид 1,5 мг ± периндоприл 2–4 мг против плацебо (1,8 года)
|
3845
|
Снижение риска развития инсульта на 30%, смерти от инсульта – на 39%, от всех причин – на 21%. Снижение риска смерти от сердечно-сосудистых заболеваний – на 23%, риска сердечной недостаточности – на 64%
|
|
PICXEL
The Perindopril/Indapamide in double-blind Controlled study versus Enalapril in Left ventricular hypertrophy
|
2005 [24, 30]
|
Оценка преимуществ стартовой комбинированной терапии периндоприлом и индапамидом в сравнении с монотерапией эналаприлом в развитии гипертрофии миокарда у пациентов с АГ
|
Периндоприл 2 мг + индапамид 0,625 мг против эналаприл 10 мг (1 год)
|
556
|
Значительно более выраженное обратное развитие гипертрофии миокарда. Снижение индекса массы миокарда левого желудочка на 13,6 г/м2 при приеме периндоприла и на 3,9 г/м2 – эналаприла
|
Официальными показаниями к назначению периндоприла, приведенными в инструкции по медицинскому применению, являются: АГ; ХСН; профилактика повторного инсульта у пациентов, перенесших инсульт или транзиторное нарушение мозгового кровообращения по ишемическому типу (в комбинации с индапамидом); стабильная ИБС. Вместе с тем очевидно, что эти показания не охватывают весь спектр коморбидности у лиц с АГ. Основываясь на результатах перечисленных мультицентровых исследований, мы укажем те клинические ситуации, при которых периндоприл и другие иАПФ оказываются полезными и имеют некоторые преимущества перед другими иАПФ. В одном из мета-анализов (включено более 250 публикаций, из которых 30 – рандомизированные клинические испытания) [38] сделан вывод, что периндоприл в виде монотерапии более эффективен в отношении снижения частоты инфарктов миокарда, инсульта и общей смертности по сравнению с другими иАПФ и даже комбинированной терапией.
Артериальная гипертензия. Основным показанием применения периндоприла является АГ. Мы уже указывали, что классоспецифический эффект у всех иАПФ одинаков – снижение артериального давления, поэтому для его контроля существенной разницы в том, какой препарат принимать, нет. Во многом назначение иАПФ определяется персональными предпочтениями врача, переносимостью препарата, выбором дозы. Периндоприл удобен тем, что принимается 1 таблетка в сутки, что значительно повышает приверженность пациентов к лечению.
Был проведен анализ данных трех самых значительных исследований – ADVANCE, EUROPA и PROGRESS – с общим количеством пациентов 29 463 [22]. Оказалось, что у лиц, принимавших b-блокаторы с периндоприлом произошло снижение риска комбинированной первичной конечной точки (сердечно-сосудистая смертность, нефатальный инфаркт миокарда и инсульт) на 20%, смерти от сердечно-сосудистых заболеваний – на 27%, нефатального инфаркта миокарда – на 23%, смерти от всех причин – на 22% по сравнению с теми пациентами, которые принимали b-блокаторы и плацебо. Была выделена подгруппа лиц с АГ, у которых добавление периндоприла к ?-блокатору было еще более эффективно: произошло снижение риска первичной конечной точки на 28%, нефатального инфаркта миокарда – на 26%, смерти от всех причин – на 32%. Таким образом, периндоприл оказывает более выраженное положительное влияние у пациентов с АГ, когда метаболические эффекты блокады РААС суммируются с гемодинамическим гипотензивным эффектом.
Основные преимущества периндоприла проявляются при лечении лиц с АГ в сочетании с другой патологией – полиморбидных пациентов.
АГ в сочетании с ХСН. Применение иАПФ у данной категории больных основано на тканевых эффектах препаратов. иАПФ замедляют прогрессирование ХСН, увеличивая продолжительность жизни, что позволяет рекомендовать их в качестве базисной терапии всем больным с ХСН независимо от наличия у них АГ, ее этиологии и стадии. Они повышают качество жизни, замедляют прогрессирование болезни и улучшают прогноз пациентов с ХСН. Чем раньше начато лечение иАПФ, тем более выраженным является их влияние на продолжительность жизни. Назначение иАПФ обосновано у пациентов с ХСН с сохранной систолической функцией левого желудочка. В данной ситуации отчетливо проявляются преимущества периндоприла, связанные с блокадой тканевой РААС. Обычно лечение начинают с малых доз иАПФ, постепенно увеличивая их до эффективных, под контролем самочувствия больного, уровня артериального давления, содержания креатинина и калия в сыворотке крови.
АГ в сочетании с сахарным диабетом (СД). Одна из многочисленных категорий пациентов – лица с ожирением и метаболическим синдромом. Важным преимуществом периндоприла являются его благоприятные эффекты у больных с нарушениями углеводного и липидного обменов. Доказано положительное влияние периндоприла на липидный состав крови и уровень глюкозы. Влияние терапии, основанной на периндоприле, на риск развития макро- и микрососудистых осложнений у лиц с СД хорошо изучено в крупном рандомизированном исследование ADVANCE, результаты которого послужили убедительным аргументом в пользу назначения иАПФ. Механизмы влияния периндоприла на углеводный обмен разнообразны. Он положительно влияет на метаболизм углеводов и чувствительность периферических тканей к инсулину, что, вероятно, связано с прямым действием ингибиторов АПФ – снижением концентрации ангиотензина II и повышением уровня в крови кининов. Ангиотензин II является конкурентным антагонистом инсулина, а кинины повышают стимулированный инсулином периферический захват глюкозы клетками, ускоряют ее окисление и снижают продукцию эндогенной глюкозы. иАПФ способны также восстанавливать ранний пик секреции инсулина. Эффекты периндоприла при СД реализуются также в виде нефропротективного эффекта и благоприятного влияния на развитие диабетической ретинопатии, что связано со снижением активности фактора роста эндотелия сосудов [7, 37, 40].
АГ в сочетании с дислипидемией. Улучшение липидного состава крови при терапии периндоприлом – один из ключевых механизмов, объясняющих улучшение эластичности крупных сосудов [15]. Способность периндоприла уменьшать гипертриглицеридемию объясняет благоприятное влияние препарата на количество подкожного и висцерального жира, уровень мочевой кислоты и снижение риска фиброза при неалкогольной жировой болезни печени. По влиянию на лептин адипонектин, С-реактивный белок, фактор некроза опухоли α, интерлейкин-1β и др., маркеры активности адипокинов периндоприл превосходит другой иАПФ – эналаприл, который отличается более низкой тропностью к тканевым компонентам РААС.
АГ у пациентов, перенесших инсульт или транзиторную ишемическую атаку. Большинство иАПФ примерно одинаково эффективны в плане уменьшения нарушений когнитивных функций, но преимуществами обладают те из них, которые проникают через гематоэнцефалический барьер и подавляют активность тканевой РААС нервной ткани. Результаты исследования PROGRESS показали, что терапия на основе периндоприла снижает риск развития повторного инсульта у больных с цереброваскулярными заболеваниями в анамнезе. Добавление периндоприла к традиционной терапии снижало риск развития повторного инсульта на 28% у лиц с цереброваскулярными заболеваниями как на фоне АГ, так и без нее, общего числа сердечно-сосудистых осложнений – на 26%, в том числе инфаркта миокарда – на 38%. Применение периндоприла не только предупреждает развитие повторного инсульта, но также снижает риск развития нарушений когнитивных функций и постинсультной деменции у больных, перенесших инсульт или транзиторную ишемическую атаку [6].
АГ у пациентов с гипертрофией левого желудочка. Убедительно доказано, что низкие дозы периндоприла в составе фиксированной комбинации с индапамидом способствуют регрессу гипертрофии миокарда левого желудочка [24, 30].
АГ в сочетании с ИБС. В крупном многоцентровом исследовании EUROPA участвовало более 12 000 человек с документированной ИБС без признаков ХСН. Одна группа пациентов получала стандартное лечение ИБС, другая – в сочетании с периндоприлом. Продолжительность наблюдения составила 4,2 года. На фоне лечения периндоприлом снизилось артериальное давление (в среднем на 5 мм рт. ст.), суммарный риск развития первичной конечной точки – нефатального инфаркта миокарда, остановки сердца с успешной реанимацией, смерти от сердечно-сосудистых причин – уменьшился на 20% [21, 36]
АГ в пожилом возрасте. Прием периндоприла пациентами с АГ, ИБС, лицами старше 80 лет приводил к достоверному снижению летальности как от сердечно-сосудистой патологии, так и общей смертности. Кроме того, периндоприл отличается «мягкостью» действия, что позволяет избежать эффекта первой дозы – резкого снижения артериального давления при приеме первой дозы препарата, что часто встречается у пожилых пациентов [19].
АГ и недиабетическая нефропатия. Проведенный I. Giatras и соавт. [29] мета-анализ рандомизированных клинических испытаний, в которых оценивалось действие иАПФ при недиабетических нефропатиях, показал, что прием этих препаратов существенно снижает риск развития почечной недостаточности. Данная работа подтвердила, что лекарственные препараты этой группы замедляют прогрессирование хронической нефропатии более эффективно, чем другие антигипертензивные средства.
иАПФ против сартанов. Потенциально группа препаратов антагонистов рецептора ангиотензина (АРА) обладает сходными характеристиками без частого побочного эффекта – кашля, вызванного нарушением распада брадикинина. Действительно, АРА хорошо переносятся пациентами и обладают гипотензивным эффектом. Однако проведенный L.C. Van Vark и соавт. [39] в 2012 году мета-анализ сравнения применения иАПФ и АРА у лиц с АГ продемонстрировал существенные различия между этими двумя группами. В мета-анализ было включено 20 крупных рандомизированных испытаний, общее число участников составило 158 998. Оказалось, что прием иАПФ сопровождался 10% снижением летальности от всех причин, тогда как прием АРА не влиял на смертность пациентов. Различия в смертности между иАПФ и АРА достигли уровня статистической значимости (р=0,036). Поэтому во всех клинических руководствах и рекомендациях последних лет АРА теряют свои позиции: если 5–6 лет назад они позиционировались как равноправные иАПФ препараты, теперь в большинстве случаев они рекомендуются только при непереносимости иАПФ. К чести АРА можно добавить, что они снижают риск инсульта на 10%, сердечной недостаточности – на 13%, СД – на 15% [18].
Какой иАПФ лучше. Как уже отмечалось, прямых сравнений эффективности различных иАПФ проведено мало. Можно отметить несколько исследований. J.J. DiNicolantonio и соавт. [26] при проведении мета-анализа более 4 тыс. статей смогли выделить всего 3 исследования, где сравнивалась эффективность эналаприла и периндоприла у лиц с ХСН. Общее число пациентов составило 116 человек, все три исследования не были рандомизированы. На фоне приема периндоприла отмечалось улучшение фракции выброса левого желудочка, снижение уровня натрийуретического пептида и функционального класса ХСН. Смертность в этих исследованиях не сравнивалась. L. Pilote и соавт. [34] в 2004 году опубликовали исследование, посвященное сравнению смертности пациентов после перенесенного инфаркта миокарда в зависимости от назначенного иАПФ. Исследование носило наблюдательный характер и имело ряд ограничений, однако самый низкий риск смерти на протяжении года после инфаркта миокарда имели пациенты, которые принимали рамиприл и периндоприл, тогда как самая высокая смертность была при приеме каптоприла. С. Borghi и соавт. [20] провели сравнение зофинаприла и рамиприла у лиц после инфаркта миокарда и выявили снижение риска смерти при приеме зофинаприла только у определенных подгрупп пациентов – с систолической дисфункцией левого желудочка, СД и АГ.
Противопоказания к применению иАПФ. Периндоприл противопоказан при гиперчувствительности, двустороннем стенозе почечных артерий, во время беременности и лактации; не назначается лицам моложе 18 лет и совместно с ингибитором ренина (алискиреном) при нарушении функции почек. К относительным противопоказаниям относится хроническая болезнь почек, стенозы сердечных клапанов (аортального и митрального), гипертрофическая обструктивная кардиомиопатия, негроидная раса.
Нежелательные явления при приеме периндоприла в основном обусловлены чрезмерным или быстрым снижением артериального давления, реакциями гиперчувствительности. Отдельно необходимо отметить такие нежелательные явления, как нарушение функции почек, гиперкалиемия и сухой кашель, характерные для всех препаратов группы.
Таким образом, периндоприл с точки зрения изученности и клинической эффективности является одним из лучших представителей иАПФ, сочетающих классоспецифические и тканевые эффекты. В Республики Беларусь имеется многолетний опыт применения периндоприла [1, 11–13], а в 2008 году на рынке нашей страны появилось отечественное лекарственное средство, содержащее третбутиламиновую соль периндоприла – «Периндоприл-МИК» в капсулах по 2 мг, 4 мг и 8 мг производства УП «Минскинтеркапс». Периндоприл-МИК проявил свою антигипертензивную активность, хорошую переносимость и положительное влияние на качество жизни.
Заключение
Периндоприл-МИК может быть рекомендован как в качестве монотерапии у пациентов, страдающих АГ, так и у коморбидных больных. В последнем случае периндоприл обладает доказанными преимуществами перед другими иАПФ при лечении лиц с АГ в сочетании с ИБС, ХСН независимо от этиологии и стадии ее развития, нефропатией различного (в том числе и недиабетического) генеза. Периндоприл-МИК является базовым препаратом у пациентов с АГ, перенесших инсульт или транзиторную ишемическую атаку. Периндоприл-МИК оптимален у лиц пожилого возраста, пациентов с АГ как при наличии дополнительных факторов риска(наследственность, избыточная масса тела, метаболический синдром, стресс, курение), так и в сочетании с уже имеющимися метаболическими нарушениями (сахарный диабет, дислипидемия).
Л И Т Е Р А Т У Р А
1. Володько Ю.С., Пырочкин В.М. // Кардиология в Беларуси. – 2011. – №1. – С.54–63.
2. Добровольский А.В. // РМЖ. – 2006. – Т.14, №20. – С.1443.
3. Дралова О.В., Максимов М.Л. // Рац. фармакотерапия. – 2011. – №7 (4). – С.501–506.
4. Карпов Ю.А. // Сердце: журнал для практикующих врачей. – 2009. – Т.8, №4 (48). – С.192–196.
5. Кукес В.Г., Сычев Д.А., Андреев Д.А. и др. Клиническая фармакология. – М., 2015. – 964 с.
6. Морозова Т.Е., Гонтаренко С.В., Кузьмина Е.Р. // Тер. архив. – 2014. – №9. – С.115–118.
7. Нероев В.В., Рябина М.В., Охоцимская Т.Д. и др. // Вестник офтальмологии. – 2006. – Т.122, №4. – С.31–33.
8. Новиков В.Е. // Обзоры по клин. фармакол. и лекарственной терапии. – 2007. – Т.5, №2. – С.43–48.
9. Остроумова О.Д., Смолярчук Е.А., Зыкова А.А., Пиксина Г.Ф. // Лечеб. дело. – 2018. – №1. – С.46–59.
10. Остроумова О.Д., Максимов М.Л., Дралова О.В., Ермолаева А.С. // Мед. совет. – 2014. – №12. – С.86–91.
11. Полюхович Ю.И., Пырочкин В.М., Богданович В.Ч. // Кардиология в Беларуси. – 2013. – №1. – С.19–31.
12. Трисветова Е.Л. // Мед. новости. – 2015. – №6. – С.26–30.
13. Хапалюк А.В. // Лечеб. дело. – 2010. – №6 (16). – С.54–62.
14. 2016 ACC/AHA/HFSA Focused Update on New Pharmacological Therapy for Heart Failure: An Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America // J. Card. Fail. – 2016. – Vol.22, N9. – P.659–669.
15. 2016 ESC/EAS Guidelines for the Management of Dyslipidemias. The task for the management of dyslipidemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS) // Eur. Heart. J. – 2016. – Vol.37, N39. – Р.2999–3058.
16. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: the sixth joint task force of the Еuropean society of cardiology and other societies on cardiovascular disease prevention in clinical practice // Eur. Heart J. – 2016. – Vol.37, N29. – Р.2315–2381.
17. 2017ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults // J. Am. Coll. Cardiol. – 2018. – Vol.71, N19. – e127–248.
18. Bangalore S., Kumar S., Wetterslev J., Messerli F.H. // BMJ. – 2011. – Vol.342. – d2234.
19. Beckett N.S., Peters R., Fletcher A.E., et al. // N. Engl. J. Med. – 2008. – Vol.358, N18. – P.1887–1898.
20. Borghi C., Omboni S., Novo S., et al. // Adv. Therapy. – 2018. – Vol.35, N5. – P.604–618.
21. Bots M.L., Remme W.J., Luscher T.F., et al. // Cardiovasc. Drugs Ther. – 2007. – Vol.21, N4. – P.269–279.
22. Brugts J.J., Bertrand M., Remme W., et al. // Cardiovasc. Drugs Ther. – 2017. – Vol.4. – P.391–400.
23. Cleland J.G.F., Tendera M., Adamus J., et al. // Eur. Heart J. – 2006. – Vol.27, Is. 19. – P.2338–2345.
24. Dahlöf B., Gosse P., Guéret P., et al. // J. Hypertens. – 2005. – Vol.23, N11. – P.2063–2070.
25. Dell’Italia L.J., Rocic P., Lucchesi P.A. // Curr. Prob. Cardiol. – 2002. – Vol.27, N1. – P.6–36.
26. DiNicolantonio J.J., Hu T., Lavie C.J., et al. // Ochsner. J. – 2014. – Vol.14, N3. – P.350–358.
27. Ferrari R. // Arch. Intern. Med. – 2006. – Vol.166, N6. – P.659–666.
28. Fox K.M. // Lancet. – 2003. – Vol.362 (9386). – P.782–788.
29. Giatras I., Lau J., Levey A.S. // Ann. Intern. Med. – 1997. – Vol.127. – P.337–345.
30. Gosse Р., Dubourg О., Gueуret P., et al. // J. Human Hypertension. – 2002. – Vol.16. – P.653–659.
31. Gupta A., Mackay J., Whitehouse A., et al. // Lancet. – 2018. – Vol.392 (10153). – P.1127–1137.
32. Muñoz-Durango N., Fuentes C.A., Castillo A.E., et al. // Int. J. Mol. Sci. – 2016. – Vol.17, N7. – e797.
33. Patel A., MacMahon S., Chalmers J., et al. // Lancet. – 2007. – Vol.370 (9590). – P.829–840.
34. Pilote L., Abrahamowicz M., Rodrigues E., et al. // Ann. Intern. Med. – 2004. – Vol.141, N2. – P.102.
35. Rodriguez-Granillo G.A., Vos J., Bruining N., et al. // Am. J. Cardiol. – 2007. – Vol.100. – P.159–163.
36. Rodriguez-Granillo G.A., de Winter S., Bruining N., et al. // Eur. Heart. J. – 2007. – Vol.28. – P.2326–2331.
37. Silvestre J.S., Levy B.I. // Eur. Heart. J. – 2009. – Vol.11, Suppl.E. – E17–E21.
38. Snyman J.R., Wessels F. // Cardiovasc. J. Afr. – 2009. – Vol.20, N2. – Р.127–134.
39. Van Vark L.C., Bertrand M., Akkerhuis K.M., et al. // Eur. Heart J. – 2012. – Vol.33, N16. – Р.2088–2097.
40. Zheng Z., Chen H., Ke G., et al. // Diabetes. – 2009. – Vol.58. – P.954–964.
Медицинские новости. – 2020. – №9. – С. 32-38.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.