Внимание! Статья адресована врачам-специалистам
Valeria Yaschuk, Assistant of the Department of General Dentistry of the Belarusian State Medical University, Minsk
Olga Malkovets, PhD, Associate Professor of the Department of General Dentistry of the Belarusian State Medical University, Minsk
Evgeniya Manak, Assistant of the Department of General Dentistry of the Belarusian State Medical University, Minsk
Study of infectious safety of a water-air gun in dentistry
Цель. Изучить инфекционную безопасность во время стоматологического приема и предложить метод предотвращения контаминации стерильного носика водовоздушного пистолета микроорганизмами, содержащимися в воздухе стоматологического кабинета.
Материалы и методы. Объектами исследования являлись водовоздушный пистолет, турбинный наконечник, микромоторный наконечник, воздух помещения стоматологического кабинета, водовоздушная смесь и термоусадочная пленка. Для обеспечения объективной и достоверной оценки результатов исследований использовались питательные среды и растворы, прошедшие проверку на подтверждение их ростовых, селективных, дифференциальных свойств и стерильности, стерильные свабы, лабораторные пробирки и стерильные чашки Петри, прошедшие проверку на подтверждение их стерильности.
Результаты. Сравнивая обсемененность наружной поверхности, внутренних каналов, воды, воздуха и спрея водовоздушного пистолета после двукратного протирания носика водовоздушного пистолета и после химической дезинфекции раствором Ультрацид и упаковки термоусадочной пленкой, выявлено значительное снижение риска заражения пациентов, как следствие сокращение общей микробной контаминации оборудования стоматологического кабинета.
Ключевые слова: водовоздушный пистолет, микробная контаминация стоматологического оборудования, стерилизация.
Современная стоматология. – 2020. – №3. – С. 69–74.
Objective. To study infectious safety during a dental appointment and propose a method to prevent contamination of a sterile air gun nose with microorganisms contained in the air of a dental office.
Materials and methods. The objects of the study were a water-air gun, a turbine handpiece, a micromotor handpiece, the air of the dental office, a water-air mixture, and a shrink film. To ensure an objective and reliable assessment of the research results, culture media and solutions were used that were tested to confirm their growth, selective, differential properties and sterility, sterile swabs, laboratory tubes and sterile Petri dishes that were tested to confirm their sterility.
Results. Comparing the contamination of the outer surface, internal channels, water, air and spray of a water-air gun after wiping the nozzle of a water-air gun twice and after chemical disinfection with Ultracid solution and packing with heat-shrinkable film, a significant decrease in the risk of infection of patients was revealed, as a result of a reduction in the general microbial contamination of the dental office equipment.
Keywords: water-air gun, microbial contamination of dental equipment, sterilization.
Sovremennaya stomatologiya. – 2020. – N3. – P. 69–74.
Одним из показателей качества лечения и безопасности оказания медицинской помощи в медицинских учреждениях является уровень внутрибольничных инфекций (ВБИ) [1]. Снижение риска инфицирования пациентов опасными инфекционными болезнями является основным фактором оказания качественной медицинской стоматологической помощи. Микроорганизмы, находящиеся в полости рта, напрямую или через контаминированные предметы, могут способствовать возникновению и дальнейшему развитию госпитальной инфекции [2]. По данным Международной ассоциации стоматологов представлен список некоторых опасных инфекционных болезней, имеющих место в стоматологии (табл. 1).
Таблица 1. Опасные инфекционные заболевания, имеющие место в стоматологии
|
Болезнь
|
Возбудитель
|
Способ
инфицирования
|
Инкубационный период
|
Возможные осложнения
|
|
Синдром приобретенногоиммунодефицита (СПИД)
|
Вирус
|
Предполагаемый прямойконтакт, кровь
|
12 месяцев или больше
|
Смерть
|
|
Ветряная оспа
|
Вирус
|
Слюна, кровь, воздушно-капельнаяинфекция
|
10–21 день
|
Конъюнктивит, опоясывающий лишай, энцефалит
|
|
ОРЗ
|
Вирус
|
Слюна, кровь, воздушно-капельнаяинфекция
|
48–72 часа
|
Временная нетрудоспособность
|
|
Гепатит А
|
Вирус
|
Оральный
|
2–7 недель
|
Нетрудоспособность
|
|
Гепатит В
|
Вирус
|
Слюна, кровь, воздушно-капельнаяинфекция
|
От6 недель до6 месяцев
|
Хроническая нетрудоспособность, смертоносный бациллоноситель
|
|
Герпетический конъюнктивит
|
Вирус
|
Слюна, кровь, воздушно-капельнаяинфекция
|
6–10 недель
|
Возможная слепота
|
|
Герпес простойII
|
Вирус
|
Половыесношения; возможнослюна, кровь
|
До 2 недель, также латентно
|
Болезненноепоражениеорганов, нетрудоспособность, вдетскомвозрастесмерть
|
|
Герпетический панариций
|
Вирус
|
Слюна, кровь, воздушно-капельнаяинфекция
|
2–12 дней,
также латентно
|
Сильные боли, нетрудоспособность
|
|
Инфекционный мононуклеоз
|
Вирус
|
Слюна, кровь, воздушно-капельнаяинфекция
|
4–7 недель
|
Временная нетрудоспособность
|
|
Грипп
|
Вирус
|
Слюна, воздушно-капельная инфекция
|
1–3 дня
|
Смерть
|
|
Болезнь легионеров
|
Бактерии
|
Дыхание
|
2–10 дней
|
Смерть
|
|
Корь (немецкая)
|
Вирус
|
Слюна, назально, воздушно-капельнаяинфекция
|
9–11 дней
|
Врожденныепороки, вдетскомвозрастесмерть
|
|
Корь (коревая краснуха)
|
Вирус
|
Слюна, назально, воздушно-капельнаяинфекция
|
9–11 дней
|
Временная нетрудоспособность, энцефалит
|
|
Эпидемический паротит (мужчины)
|
Вирус
|
Дыхание
|
14–25 дней
|
Временная нетрудоспособность, стерильность
|
|
Пневмония
|
Бактерии, вирус
|
Дыхание, кровь
|
Зависит оторганизма
|
Смерть
|
|
Стафилококковые инфекции
|
Бактерии
|
Слюна, воздушно-капельнаяинфекция, нозокомиально
|
4–10 дней
|
Поражение кожи, остеомиелит, смерть
|
|
Стрептококковые инфекции
|
Бактерии
|
Слюна, кровь
|
1–3 дня
|
Ревматизмсердца, проблемыспочками
|
|
Сифилис
|
Бактерии
|
Половые сношения, врожденный
|
2–12 недель
|
Поражение ЦНС, смерть
|
|
Столбняк
|
Бактерии
|
Открытые раны
|
7–10 дней
|
Нетрудоспособность, смерть
|
|
Туберкулез
|
Бактерии
|
Слюна, кровь, также латентно
|
До 6 месяцев
|
Нетрудоспособность, смерть
|
При оказании стоматологической помощи пациентам действуют разные механизмы инфицирования: естественный (аэрозольный, контактный) и артифициальный, или медицинский, вызванный передачей инфекции от медицинского персонала пациенту через руки медработников, инструменты, перевязочный материал.
Высокий риск передачи инфекций обусловлен также обслуживанием пациентов без предварительного клинического обследования на возможные инфекционные заболевания или их носительство. Поэтому профилактика ВБИ является одной из самых актуальных проблем стоматологической практики, прежде всего с позиции профилактики перекрестного инфицирования [4, 5].
Необходимыми этапами в профилактике ВБИ являются выполнение всех требований по организации и проведению дезинфекции, стерилизации, направленных на прерывание путей передачи.
Согласно приказу Министерства здравоохранения Республики Беларусь от 25.11.2002 г. №165 «О проведении дезинфекции и стерилизации учреждениями здравоохранения», стерилизации подлежат все изделия, соприкасающиеся с раневой поверхностью, контактирующие с кровью в организме пациента, а также изделия, которые в процессе эксплуатации контактируют со слизистой оболочкой и могут вызвать ее повреждение. Однако имеются противоречия между методическими рекомендациями и отраслевыми стандартами по обработке некоторых медицинских изделий, к примеру, водовоздушного пистолета [3].
Водовоздушный пистолет представляет собой корпус, внутри которого имеются каналы для подачи под давлением воздуха, воды или одновременно воздуха и воды (спрея). В процессе работы врача носик водовоздушного пистолета соприкасается со слизистой оболочкой полости рта, ротовой жидкостью, кровью и частицами инфицированных масс твердых тканей зубов. Кроме наличия внутренних каналов, опасность инфицирования инструмента заключается и в возможности возникновения аспирационного эффекта. Следовательно, после использования водовоздушный пистолет, и особенно его носик, должен быть подвергнуты тщательной обработке. Согласно приказу Министерства здравоохранения Республики Беларусь от 25.11.2002 г. №165, дезинфекционную обработку наконечников и водовоздушного пистолета осуществляют методом двукратного протирания поверхности 76% спиртом.
Цель исследования – изучить инфекционную безопасность во время стоматологического приема и предложить метод предотвращения контаминации стерильного носика водовоздушного пистолета микроорганизмами, содержащимися в воздухе стоматологического кабинета.
В ходе исследования предстояло оценить эффективность дезинфекции и стерилизации наружной поверхности и внутренних каналов стоматологического турбинного, микромоторного наконечника и водовоздушного пистолета, изучить возможность контаминации воды из турбинного наконечника и водовоздушного пистолета, установить обсемененность воздуха в стоматологическом кабинете и сравнить с нормативными показателями. Предложить меры по снижению контаминации стерильного носика водовоздушного пистолета микроорганизмами, содержащимися в воздухе стоматологического кабинета.
Материалы и методы
Объектами нашего исследования являлись водовоздушный пистолет, турбинный наконечник, микромоторный наконечник, воздух помещения стоматологического кабинета, водовоздушная смесь и термоусадочная пленка.
Для обеспечения объективной и достоверной оценки результатов исследований использовались питательные среды и растворы, прошедшие проверку на подтверждение их ростовых, селективных, дифференциальных свойств и стерильности, стерильные свабы, лабораторные пробирки и стерильные чашки Петри, прошедшие проверку на подтверждение их стерильности.
Температура инкубации соответствовала температуре, необходимой для роста определенного микроорганизма, время инкубации должно быть не больше, чем самый короткий период инкубации, указанный в испытаниях (Государственная фармакопея Республики Беларусь, т.1, п.2.6.12–2.6.13).
Агаризованная питательная среда считается пригодной по ростовым свойствам к использованию, если в испытаниях количество колониеобразующих единиц (КОЕ) на чашках с испытуемой средой не отличается от такового на чашках с контрольной средой или раствором более чем в 2 раза, то есть критерий приемлемости (кратность) – менее 2.
Жидкая питательная среда считается пригодной к использованию в испытаниях по ростовым свойствам, если наблюдается хороший видимый рост (помутнение среды) с или без изменения начального цвета в пробирках с испытуемой питательной средой или раствором, сопоставимым с ростом в пробирках с контрольной средой, или раствором, если при пересеве на чашки с агаризованной дифференциальной средой наблюдается рост характерных колоний тест-микроорганизмов.
Проводили испытания по определению ростовых свойств агаризованных питательных сред. По 0,1 мл рабочей взвеси тест-микроорганизма (не более 102 КОЕ в 0,1 мл) внесли в чашки с испытуемой и контрольной питательными средами и тщательно растерли шпателем.
Инкубировали в соответствии с температурой и рекомендованным временем для конкретного тест-микроорганизма, указанными в Протоколах микробиологического контроля ростовых свойств на конкретную питательную среду.
По истечении времени инкубации подсчитывали количество колониеобразующих единиц на чашках с испытуемой и контрольной питательными средами и определяли критерий приемлемости по следующей формуле.
КОЕ контр / КОЕ исп,
где КОЕ контр – среднее арифметическое количество микроорганизмов, выросшее на чашке с контрольной питательной средой, КОЕ исп – среднее арифметическое количество микроорганизмов, выросшее на чашке с испытуемой питательной средой.
В ходе исследования описали и сравнили морфологические признаки выросших колоний на испытуемой и контрольной питательных средах. Все результаты испытаний зарегистрировали в Протоколах микробиологического контроля ростовых свойств на конкретную питательную среду.
Для проверки ростовых свойств среды при использовании глубинного метода посева необходимо взять 1 мл рабочей взвеси тест-микроорганизма с концентрацией 102 КОЕ/мл и внести в чашки с испытуемой и контрольной питательными средами, затем внести в эти чашки по 20 мл расплавленной и охлажденной до 44 °С питательной среды, быстрым покачиванием чашки равномерно распределить среду с взвесью микроорганизмов.
Для исключения получения ложноположительных результатов исследований ставился отрицательный контроль забуфференного раствора натрия хлорида и пептона рН 7,0, используемого для смачивания головки сваба: по 1 мл забуференного раствора натрия хлорида и пептона рН 7,0 внесли в четыре стерильные чашки Петри. Залили две чашки Петри 20 мл среды КСА и поставили инкубироваться при температуре 30–35 °С на протяжении 5 суток. Две другие чашки Петри – 20 мл среды ДАС и поставили инкубироваться при температуре 20–25 °С на протяжении 7 суток.
Контроль микробиологической чистоты поверхностей проводился методом взятия смывов при помощи протирания всей поверхности носика водовоздушного пистолета, турбинного наконечника, микромоторного наконечника свабами, смоченными в забуференном растворе натрия хлорида и пептона рН 7,0, параллельными аккуратными движениями близко расположенными линиями под углом 5–10° в горизонтальном направлении и второй стороной головки в вертикальном направлении.
Извлечение микроорганизмов с головки сваба проводилось методом штриха по поверхности агаризованной питательной среды на чашках с казеино-соевым агаром и чашках с агаром Сабуро. Далее чашки инкубировались: со средой Сабуро при температуре 20–25 °С на протяжении 7 суток, с казеино-соевым агаром при температуре 30–35 °С на протяжении 5 суток.
Контроль микробиологической чистоты поверхности термоусадочной пленки проводился тем же методом, только мазок отбирался не со всей поверхности пленки, а со 100 см2 с использованием рамки-трафарета для ограничения площади смыва.
Проводили смывы с поверхностей оборудования и помещений, тары и инвентаря с использованием тампонов (метод смыва). Тщательно протирали увлажненным тампоном участок общей площадью 25 см2, используя трафареты, увлажненным тампоном под углом 5–100° густо заштриховывали поверхность квадрата в горизонтальном направлении, прижимая тампон к поверхности. Поворачивали тампон на 90° и аналогично заштриховывали поверхность в вертикальном направлении. Тампон помещали в пробирку, не касаясь наружной поверхности пробирки. Пробирку промаркировывали с указанием даты и наименования контролируемой поверхности.
Контроль микробиологической чистоты воздуха в стоматологическом кабинете проводился аспирационным методом с применением прибора Air Ideal, который прошел внутреннюю квалификацию с подтверждением технических характеристик. Этот метод основан на том, что воздух, просасываемый через отверстия в крышке аппарата, ударяется о поверхность питательной среды, при этом частицы пыли и аэрозоля прилипают к среде, а вместе с ними и микроорганизмы, находящиеся в воздухе. Чашку Петри с тонким слоем среды укрепляют на вращающемся столике аппарата, что обеспечивает равномерное распределение бактерий на ее поверхности. После отбора 1 м3 воздуха, чашку вынимали, закрывали крышкой и инкубировали: со средой Сабуро при температуре 20–25 °С на протяжении 7 суток, с казеино-соевым агаром при температуре 30–35 °С на протяжении 5 суток.
Использовали чашки Петри с агаризованной средой на основе гидролизатов казеина и соевых (триптонсоевой средой) или декстрозным агаром Сабуро, предварительно проверенные на стерильность, либо контактные слайды; стерильные тампоны для смывов или слайды; стерильные трафаретные рамки; проавтоклавированные решетки для отбора проб воздуха; стерильные флаконы объемом 250 мл.
Пробоотборник воздуха, пробоотборник сжатого воздуха и счетчик частиц были подготовлены к работе согласно СОП. В пробирки с тампонами внесли по 2 мл стерильного буферизированного раствора хлорида натрия и пептона рН 7,0. Готовые пробирки завернули в 2 слоя стерильной упаковочной бумаги, следовали рабочему плану отбора проб воздуха и смывов.
С помощью аспирационного метода осуществляли контроль воздуха во время рабочего процесса. Чашки Петри с агаризованной средой на основе гидролизатов казеина и соевых бобов и декстрозным агаром Сабуро промаркировали с указанием места отбора пробы и даты. Пробоотборник воздуха устанавливали в горизонтальное положение на уровне проведения технологических операций, после чего проводили отбор проб воздуха.
Водовоздушная смесь подавалась в стерильную пробирку через носик водовоздушного пистолета путем одновременного нажатия кнопок подачи воды и подачи воздуха. Далее из пробирки отбирался 1 мл смеси и переносился в 2 пробирки с 15 мл расплавленного и охлажденного по 45° козеино-соевого агара и в 2 пробирки с 15 мл подготовленным таким же образом агаром Сабуро. Содержимое пробирок тщательно перемешивалось и переносилось в стерильные чашки Петри, которые оставались на рабочем столе до полного остывания обеих сред. Затем чашки инкубировали со средой Сабуро при температуре 20–25 °С на протяжении 7 суток, с казеино-соевым агаром при температуре 30–35 °С на протяжении 5 суток.
Результаты и обсуждение
При определении уровня контаминации внешней поверхности инструментов аэробной микрофлорой было выявлено, что во всех случаях он незначителен и составляет 1 КОЕ/мл смыва. Возможно, это связано с вторичной контаминацией посредством воздуха. Грибов на наружной поверхности не было обнаружено.
Оценив уровень контаминации внутренних каналов стоматологических наконечников и водовоздушного пистолета, определили, что наиболее загрязненными оказались внутренние каналы пистолета (10 КОЕ/мл смыва), турбинного (8 КОЕ/мл смыва) и микромоторного наконечника (5 КОЕ/мл смыва) (табл. 2). Причем во внутренних полостях водовоздушного пистолета имел место рост грибов.
Таблица 2. Уровень контаминации внешних поверхностей и внутренних каналов исследуемых объектов аэробной микрофлорой
|
Уровень контаминации
|
Внешние поверхности
|
Внутренние каналы
|
|
ТН
|
МН
|
ВВП
|
ТН
|
МН
|
ВВП
|
|
Объект №1, КОЕ
|
1
|
0
|
2
|
9
|
6
|
9
|
|
Объект №2, КОЕ
|
1
|
0
|
1
|
9
|
5
|
10
|
|
Объект №3, КОЕ
|
1
|
0
|
1
|
7
|
4
|
11
|
|
Объект №4, КОЕ
|
1
|
0
|
1
|
7
|
5
|
12
|
|
Объект №5, КОЕ
|
1
|
0
|
1
|
8
|
4
|
11
|
|
Объект №6, КОЕ
|
0
|
0
|
1
|
8
|
5
|
10
|
|
Среднее значение
|
1
|
0
|
1
|
8
|
5
|
9
|
|
Относительное стандартное отклонение (RSD), %
|
–
|
–
|
–
|
11,1
|
15,5
|
9,9
|
Примечание. ТН – турбинный наконечник, МН – микромоторный наконечник; ВВП – водовоздушный пистолет. Величину случайной погрешности оценивают относительным стандартным отклонением. Относительное стандартное отклонение RSD – отношение стандартного отклонения к среднему значению выборки.
Сравнивая уровень контаминации внешней и внутренней поверхностей исследуемых объектов, видим явное преобладание последних (рис. 1). Это говорит о том, что двукратное протирание наружной поверхности наконечников и водовоздушного пистолета не может обеспечить снижение контаминации внутренних полостей водовоздушного пистолета. Имел место рост грибов.
Уровень обсемененности спрея из водовоздушного пистолета загрязнен в большей степени, чем спрей из турбинного наконечника (256 и 195 КОЕ/мл смыва соответственно) (табл. 3). В обоих случаях имел место рост грибов.
Таблица 3. Уровень обсемененности спрея из турбинного наконечника и водовоздушного пистолета
|
Уровень обсемененности спрея
|
ТН
|
МН
|
ВВП
|
|
Объект №1, КОЕ
|
256
|
0
|
0
|
|
Объект №2, КОЕ
|
195
|
0
|
0
|
|
Объект №3, КОЕ
|
200
|
0
|
0
|
|
Объект №4, КОЕ
|
205
|
0
|
0
|
|
Объект №5, КОЕ
|
220
|
0
|
0
|
|
Объект №6, КОЕ
|
235
|
0
|
0
|
|
Среднее значение
|
218
|
0
|
0
|
|
Относительное стандартное отклонение (RSD), %
|
10,7
|
–
|
–
|
Уровень обсемененности воздуха отмечался при использовании водовоздушного пистолета (табл. 4) и составлял 10 КОЕ/мл смыва, в то время когда у турбинного наконечника данный показатель не превышал 4 КОЕ/мл смыва. В исследуемых образцах воздуха грибов не обнаружено. Сравнивая обсемененность спрея и воздуха водовоздушного пистолета (256 и 10 КОЕ/мл смыва) и турбинного наконечника (195 и 4 КОЕ/мл смыва), видим явное превышение уровня спрея (рис. 2, табл. 5).
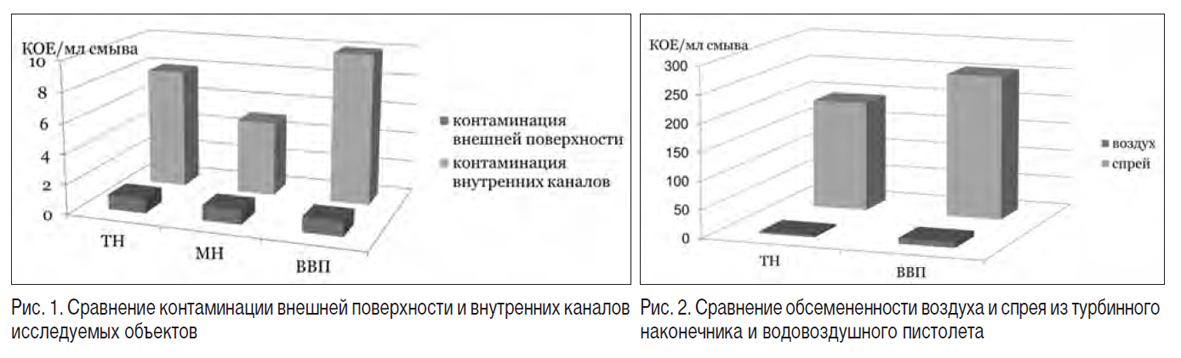
Таблица 4. Уровень обсемененности воздуха из турбинного наконечника и водовоздушного пистолета
|
Уровень обсемененности воздуха
|
ТН
|
ВВП
|
|
Объект №1, КОЕ
|
3
|
10
|
|
Объект №2, КОЕ
|
5
|
10
|
|
Объект №3, КОЕ
|
4
|
11
|
|
Объект №4, КОЕ
|
6
|
11
|
|
Объект №5, КОЕ
|
2
|
9
|
|
Объект №6, КОЕ
|
4
|
10
|
|
Среднее значение
|
4
|
10
|
|
Относительное стандартноеотклонение (RSD), %
|
35,5
|
7,4
|
В ходе исследования уровня обсемененности воды из водовоздушного пистолета (450 КОЕ/мл смыва) оказалось, что он превышает нормы по Кунину в 4,5 раза (102 КОЕ/мл смыва) (рис. 3, табл. 6). Имел место рост грибов.
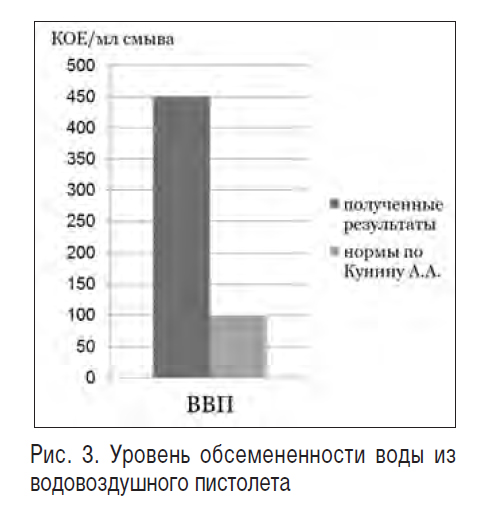
Таблица 5. Сравнение обсемененности воздуха и спрея из турбинного наконечника и водовоздушного пистолета
|
Показатель
|
ТН
|
ВВП
|
|
Объект №1, КОЕ
|
195
|
256
|
|
Объект №2, КОЕ
|
4
|
10
|
|
Объект №3, КОЕ
|
190
|
56
|
|
Объект №4, КОЕ
|
56
|
250
|
|
Объект №5, КОЕ
|
8
|
10
|
|
Объект №6, КОЕ
|
4
|
56
|
|
Среднее значение
|
76
|
106
|
|
Относительное стандартное отклонение (RSD), %
|
121
|
108
|
Полученные результаты приводят нас к выводу, что риск заражения пациентов стоматологического профиля выше при использовании спрея водовоздушного пистолета.
Таблица 6. Уровень обсемененности воды из водовоздушного пистолета
|
Уровень обсемененностиводы
|
ВВП
|
|
Объект №1, КОЕ
|
450
|
|
Объект №2, КОЕ
|
400
|
|
Объект №3, КОЕ
|
420
|
|
Объект №4, КОЕ
|
425
|
|
Объект №5, КОЕ
|
430
|
|
Объект №6, КОЕ
|
440
|
|
Среднее значение
|
428
|
|
Относительное стандартноеотклонение (RSD), %
|
4
|
Определив уровень загрязненности воздуха стоматологического кабинета аспирационным методом в трех зонах (50 см, 1 м и 1,5 м от полости рта пациента), мы получили следующие результаты: в первой зоне уровень загрязненности составил 273 КОЕ/м3, во второй – 192 КОЕ/м3, в третьей – 152 КОЕ/м3. Это соответствует санитарным нормам, которые, согласно постановлению Министерства здравоохранения Республики Беларусь от 09.09.2010 г. №109, составляют 500 КОЕ/м3.
Для первичной дезинфекции носика водовоздушного пистолета использовалось замачивание в растворе Ультрацид (экспозиция 15 минут). После дезинфекции смыв с поверхности носика водовоздушного пистолета показал отсутствие аэробных микроорганизмов и грибов.
Далее носик водовоздушного пистолета упаковывался в термоусадочную пленку и после хранения в стоматологическом кабинете в течение суток осуществлялся повторный микробиологический посев воды, спрея и воздуха для определения уровня обсемененности содержимого водовоздушного пистолета. Сравнивая обсемененность наружной поверхности, внутренних каналов, воды, воздуха и спрея водовоздушного пистолета после двукратного протирания носика водовоздушного пистолета (1, 10, 450, 256 и 10 КОЕ/мл смыва) и после химической дезинфекции раствором Ультрацид и упаковки термоусадочной пленкой (0, 0, 197, 85, 0) выявлено значительное снижение риска заражения пациентов, как следствие – сокращение общей микробной контаминации оборудования стоматологического кабинета.
Выводы:
1. Контаминация внешней поверхности наконечников и водовоздушного пистолета незначительна, составляет 1 КОЕ/мл смыва, что, возможно, связано с вторичной контаминацией из обсемененного воздуха.
2. Уровень обсемененности воздуха по загрязненности аэробными микроорганизмами соответствует нормативным показателям.
3. Контаминация внутренних каналов инструментов значительно превышает уровень загрязненности наружной поверхности, причем максимальные показатели отмечали у водовоздушного пистолета, в связи чем последний был выбран объектом дальнейшего исследования.
4. Применение химической дезинфекции в сочетании с использованием термоусадочной пленки для упаковки носика стоматологического наконечника приводит к снижению количества аэробных микроорганизмов в образцах.
5. Двукратное протирание наружной поверхности водовоздушного пистолета в качестве дезинфекции не может обеспечить снижение контаминации внутренних полостей инструмента. Для повышения качества лечения и безопасности оказания стоматологической помощи необходима разработка и внедрение новых методов дезинфекции и стерилизации стоматологического оборудования.
ЛИТЕРАТУРА / REFERENCES
1. Мороз Б.Т., Мироненко О.В. Особенности дезинфекции и стерилизации в амбулаторной стоматологии: Практическое руководство. – СПб.: Человек, 2008. – 128 с. / Moroz B.T., Mironenko O.V. Osobennosti dezinfektsii i sterilizatsii v ambulatornoy stomatologii: Prakticheskoye rukovodstvo [Features of disinfection and sterilization in outpatient dentistry: A Practical Guide]. SPb.: Chelovek, 2008, 128 p. (in Russian)
2. Рабинович И.М., Шатохин А.И. Средства индивидуальной защиты стоматологической команды в профилактике перекрестного инфицирования вич-инфекцией и вирусными гепатитами // Клиническая стоматология. – 2008. – №3. – С.64–66. / Rabinovich I.M., Shatokhin A.I. Sredstva individual’noy zashchity stomatologicheskoy komandy v profilaktike perekrestnogo infitsirovaniya vich-infektsiyey i virusnymi gepatitami [Personal protective equipment of the dental team in the prevention of cross-infection with HIV infection and viral hepatitis]. Klinicheskaya stomatologiya, 2008, vol.3, pp.64–66. (in Russian)
3. Инфекционный контроль – главенствующий фактор в стоматологии XXI века // Маэстро. – 2004. – №1–2 (14). / Infektsionnyy kontrol’ – glavenstvuyushchiy faktor v stomatologii XXI veka [Infection control is the dominant factor in dentistry of the XXI century]. Maestro, 2004, vol.14, no.1–2. (in Russian)
4. Ninemeier J. Central Service Technical Manual. – 6 th. – International Association of Healthcare Central Service Materiel Management. Control of microbes.
5. Raju G.K., Cooney C.L. Media and air sterilization. – Biotechnology Set, Second Edition, 2008. pp.157–184.
Конфликт интересов
Согласно заявлению авторов, конфликт интересов отсутствует.
Современная стоматология. – 2020. – №3. – С.69-74.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.