Внимание! Статья адресована врачам-специалистам
ZhukE.G.
Belarusian Medical Academy of Post-Graduate Education, Minsk
Republican Scientific and Practical Center of Oncology and Medical Radiology named after N.N. Alexandrova, Minsk, Belarus
The results of validation of the prognostic model of metastatic lymph node involvement risk in patients with cervical cancer
Резюме. Обследованы 175 пациентов с гистологически подтвержденным диагнозом «рак шейки матки» (РШМ), которым была выполнена магнитно-резонансная томография (МРТ). Данные МРТ 104 пациентов, пролеченных консервативно, были проанализированы в сопоставлении с заключительными диагнозами. Данные МРТ 71 прооперированного пациента сопоставляли с результатами морфологического исследования резецированных препаратов. С целью оценки предсказательной значимости МРТ-признаков метастатического поражения лимфатических узлов (ЛУ) были проведены моно- и мультивариантный регрессионные логистические анализы. Размер ЛУ по короткой оси, индекс конфигурации, отсутствие сигнала от жировой ткани ворот ЛУ, наличие неоднородности МР-сигнала ЛУ, коэффициент интенсивности сигнала ткани ЛУ к интенсивности сигнала ткани опухоли являются независимыми предикторами метастатического поражения ЛУ (р<0,05). На основании независимых прогностических факторов разработана диагностическая модель прогнозирования метастатического поражения ЛУ при РШМ. Прогностическая модель была валидизирована на экзаменационной группе из 71 пациента, подвергшихся оперативному лечению. Полученная модель продемонстрировала высокую прогностическую ценность, обладая индексом конкордации 0,743 (95% ДИ 0,67–0,81), что свидетельствует о правомочности ее применения на практике.
Ключевые слова: рак шейки матки, компьютерная томография, магнитно-резонансная томография, лимфатический узел, метастатический лимфатический узел.
Медицинские новости. – 2020. – №12. – С. 19–22.
Summary. The study included data on 175 patients with histologically verified diagnosis of cervical cancer, who underwent MRI. The MRI findings of 104 patients were treated conservatively analyzed in comparison with the final diagnoses. The MRI findings of the 71 operated patients were compared with the morphological features. To assess the predictive value of MRI signs of metastatic LN involvement, uni- and multivariate regression logistic analyses were performed. The size of the LN along the short axis, the configuration index, the absence of a signal from the adipose tissue of the LN hilus, the presence of heterogeneity of LN MR signal, the signal intensity of LN tissue/ signal intensity of tumor coefficient (SILN/SI tumor) are independent predictors of metastatic LN involvement (p<0.05). A diagnostic model has been developed for predicting metastatic LN involvement in cervical cancer using independent prognostic factors, being of high prognostic value. The prognostic model was validated in a checking sample of 71 patients who underwent surgical treatment. The resulting model has demonstrated high prognostic value with a concordance index of 0.743, which is a convincing indicate reason for its application in practice.
Keywords: cervical cancer, computed tomography, magnetic resonance imaging, lymph nodes, metastatic lymph nodes.
Meditsinskie novosti. – 2020. – N12. – P. 19–22.
Рак шейки матки (РШМ), по данным GLOBOCAN 2018, занимает 4-е место в мире в структуре злокачественных новообразований у женщин после рака молочной железы, колоректального рака и рака легких [1]. В России прирост стандартизованных показателей за 1991–2016 годы составил 44% [2]. В Республике Беларусь прирост заболеваемости РШМ за 10 лет (2008–2017) составил 2,7% [3]. Анализ возрастных показателей выявил смещение пика заболеваемости за последние 25 лет к более молодому возрасту, и общее увеличение ее уровня произошло за счет лиц в возрасте от 30 до 50 лет [4]. В то же время одним из наиболее неблагоприятных факторов прогноза при РШМ, увеличивающим частоту рецидивов, является метастатическое поражение лимфатических узлов (ЛУ), в связи с чем оценка состояния тазовых и забрюшинных ЛУ является важной клинической задачей [5].
Основными методами лечения РШМ являются хирургический, комбинированный и сочетанный лучевой. Результаты радикального хирургического вмешательства и сочетанной лучевой терапии у пациентов с РШМ I и II стадий одинаковы. Однако сочетание хирургического и лучевого методов лечения приводит к увеличению числа осложнений. В связи с этим на дооперационном этапе в каждом конкретном случае следует максимально использовать весь диагностический комплекс для определения критериев онкологического риска и использовать хирургический метод только у пациентов низкого онкологического риска [6].
Успех лучевой терапии РШМ во многом зависит oт точности оценки распространенности злокачественного процесса. Выбор объема облучаемых тканей определяется вероятностью метастатического поражения регионарного лимфатического аппарата, поскольку при низком риске его вовлечения можно ограничиться только локальным облучением.
Проведение тазовой лимфоаден-эктомии (ЛАЭ) или биопсии ЛУ таза при РШМ с целью определения стадии процесса не всегда возможно и рационально, в связи с чем создание прогностической модели, позволяющей определить риск наличия метастатического поражения лимфатических узлов (МТЛУ) для определения оптимальной лечебной тактики, является крайне актуальным [7].
Материалы и методы
Проведен анализ данных 175 пациентов с гистологически подтвержденным диагнозом РШМ: 104 пациента пролечены консервативно, 71 женщине было выполнено радикальное хирургическое лечение со стандартной ЛАЭ. Для определения прогностических критериев МТЛУ малого таза были проанализированы данные магнитно-резонансного исследования 104 пациентов, пролеченных консервативно в сопоставлении с заключительными диагнозами, основанными на результатах комплексного обследования и результатах динамического наблюдения (медиана наблюдения составила 50,75 месяца). Данные магнитно-резонансной томографии (МРТ) у 71 прооперированного пациента сопоставляли с результатами морфологического исследования резецированных препаратов (табл. 1).
Таблица 1. Общая характеристика пациентов I и II групп
|
Показатель
|
Значение
|
|
Число пациенток
|
РШМ (I группа), n=104
|
РШМ (II группа), n=71
|
|
Возраст, лет
|
48
|
42
|
|
Гистологическая структура опухоли, n (%)
|
|
Плоскоклеточный рак
|
96 (92,3%)
|
57 (80,3%)
|
|
Аденокарцинома
|
5 (4,8%)
|
13 (18,3%)
|
|
Светлоклеточный рак
|
2 (1,9%)
|
–
|
|
Недифференцированный
|
1 (0,96%)
|
1 (1,4%)
|
|
Распространение опухоли, n (%)
|
|
T1aN0M0
|
–
|
6 (8,5%)
|
|
T1bN0M0
|
9 (8,65%)
|
48 (67,6%)
|
|
T1bN1M0
|
–
|
10 (14%)
|
|
T1bN1M1
|
–
|
1 (1,4%)
|
|
T2aN0M0
|
2 (1,92%)
|
–
|
|
T2aN1M0
|
–
|
6 (8,5%)
|
|
T2bN0M0
|
38 (36,5%)
|
–
|
|
T2bN1M0
|
13 (12,5%)
|
–
|
|
T2bN1M1
|
3 (2,88%)
|
–
|
|
T3aN1M0
|
1 (0,96%)
|
–
|
|
T3bN0M0
|
10 (9,61%)
|
–
|
|
T3bN1M0
|
22 (21,15%)
|
–
|
|
T3bN1M1
|
4 (3,84%)
|
–
|
|
T4N1M0
|
1 (0,96%)
|
–
|
|
T4N1M0
|
1 (0,96%)
|
–
|
Исследование выполняли на МР-томографах Magnetom Avanto (Siemens) и Optima 450 W (General Electric) с напряженностью магнитного поля 1,5 Тесла с применением следующих импульсных последовательностей: Т2-взвешенные изображения (ВИ) в аксиальной, сагиттальной, коронарной плоскостях сканирования; Т1-ВИ в аксиальной плоскости сканирования; Т2-ВИ с подавлением сигнала от жировой ткани (fat suppression) в аксиальной плоскости сканирования; диффузионно-взвешенная МРТ выполнялась при факторе диффузии b 0, b 1000 с/мм2 с последующим построением карты измеряемого коэффициента диффузии (ИКД 10-3 мм2/с).
Для визуализации забрюшинных ЛУ дополнительно использовали две последовательности в коронарной плоскости сканирования: Т2-ВИ и T2-ВИ с подавлением сигнала от жировой ткани.
Для оценки диагностических возможностей в выявлении МТЛУ вычисляли диагностическую чувствительность (ДЧ), диагностическую специфичность (ДС) метода. Доверительный интервал (ДИ) представлен с 95% достоверностью.
Диагностическую информативность МРТ оценивали с помощью построения характеристических кривых (Receiver Operating Characteristic curve – ROC), с расчетом площадей под ними (Area Under Curve – AUC).
Для определения предсказательной значимости МРТ-признаков метастатического поражения ЛУ были проведены моно- и мультивариантный регрессионные логистические анализы. На основе полученных результатов создана модель прогнозирования метастазов в ЛУ, которая была валидизирована на экзаменационной группе, состоящей из 71 пациента, подвергнувшегося оперативному лечению с ЛАЭ. Точность модели оценивали с помощью индекса конкордации. Анализ результатов исследования выполнен с использованием программного пакета SPSS 22.0.
Результаты и обсуждение
Состояния регионарных ЛУ оценивали с учетом следующих признаков: наличие или отсутствие регионарных ЛУ (на уровне сканирования) наличие единичных и сгруппированных измененных ЛУ, соответствующих стороне поражения, размер ЛУ по короткой оси, соотношение размера ЛУ по длинной и короткой осям (индекс конфигурации), наличие или отсутствие сигнала от жировой ткани ворот ЛУ, наличие шиповатости контура ЛУ, наличие перинодулярного отека, субкапсулярного отека, наличие центрального отека ЛУ, некроза, наличие неоднородности МР-сигнала ЛУ, значения интенсивности МР-сигнала (ИС) и ИКД.
При МРТ-исследовании в I группе пациентов были визуализированы 240 ЛУ, в 127 (52,9%) из них присутствовали признаки МТЛУ, а в 113 (47,1%) ЛУ – отсутствовали.
Для оценки эффективности диагностического критерия размер ЛУ по короткой оси был проведен ROC-анализ пороговых значений размера. Значение площади под ROC-кривой – параметр AUC составил 0,963 (p<0,001), что позволяет оценить его как значимый. Оптимальная точка разделения соответствовала значению 0,75 см, в связи с чем параметр размера ЛУ по короткой оси больше 0,75 см рассматривается как критерий вероятности метастатического поражения.
ДЧ данного показателя составила 79,5%, ДС – 97,3%.
Для оценки конфигурации ЛУ измеряли соотношение его размера по длинной оси к размеру по короткой оси – индекс конфигурации (ИК). Размер по короткой оси измеряли перпендикулярно размеру по длинной оси.
Площадь под кривой составила 0,957 (р<0,001), что позволяет оценить ИК как значимый. ДЧ данного показателя в выявлении метастатического поражения составила 89%, ДС – 92,9%. Точке, наиболее удаленной от диагонали, соответствует значение ИК меньше или равно 1,55, в связи с чем данное соотношение принято как вероятность метастатического поражения.
При метастатическом поражении ЛУ происходит частичное или полное замещение его жировых ворот опухолевыми клетками, что приводит к отсутствию гипоинтенсивного сигнала от жировых ворот ЛУ на сканах МРТ при использовании последовательности с подавлением сигнала от жировой ткани.
AUC для признака отсутствие сигнала от жировой ткани ворот ЛУ составила 0,925 (р<0,001). ДЧ данного показателя в выявлении метастатического поражения составила 92,9%, ДС – 92%.
Позднее, на стадии пролиферации метастаза, в ЛУ происходит «блокирование» лимфотока через узел, что приводит к появлению шиповатости контура ЛУ за счет расширения дистальных отделов приводящих лимфатических сосудов [8].
AUC для признака наличие шиповатого контура составила 0,734 (p<0,001). ДЧ данного показателя в выявлении метастатического поражения – 56,7%, ДС – 92%.
На начальных стадиях метастазирования появляется отечная реакция ЛУ в ответ на инвазию метастатических клеток – перинодулярный отек, позднее – субкапсулярный и центральный отек.
AUC для признака наличие перинодулярного отека составила 0,674 (p<0,001). ДЧ данного показателя в выявлении метастатического поражения – 48%, ДС – 86,7%.
Для признака наличие субкапсулярного отека AUC – 0,73 (p<0,001), при этом ДЧ составила 64,6%, ДС – 81,4%.
AUC для признака наличие центрального отека ЛУ составила 0,649 (p<0,001), ДЧ – 38,6%, ДС – 91,2%.
При наличии признака некроза AUC составила 0,583 (p<0,05), ДЧ –16,5%, ДС – 100%. Признак некроза присутствовал только при N1 и только в 21 случае из 240.
Метастатический локус, впервые появляющийся в корковой части узла, и наличие отечной реакции проявляются в виде гетерогенности МРТ-сигнала (в норме ЛУ гомогенный).
При оценке признака наличие неоднородности МР-сигнала ЛУ AUC составила 0,91 (p<0,001), ДЧ – 95,3%, ДС– 83,2%.
Метастатические локусы имеют изоинтенсивный сигнал, схожий по интенсивности с сигналом опухолевой ткани в шейке матки.
AUC при оценке признака интенсивности МР-сигнала ЛУ, который рассматривается в соотношении с интенсивностью сигнала опухоли (ИСлу/ИСопух), составила 0,94 (p<0,001), ДЧ – 87,4%, ДС – 89,4%. Оптимальная точка разделения соответствовала значению 1,265.
По данным монофакторного анализа, такие признаки, как размер ЛУ по короткой оси, индекс конфигурации, отсутствие сигнала от жировой ткани ворот ЛУ, наличие шиповатости контура ЛУ, наличие перинодулярного отека, наличие субкапсулярного отека, центрального отека ЛУ, некроза, наличие неоднородности МР-сигнала ЛУ, отношение интенсивности МР-сигнала ЛУ к интенсивности МР-сигнала опухоли (показатель ИСЛУ/ИСопух.) и значение ИКДЛУ, явились прогностическими факторами метастатического поражения тазовых ЛУ (р<0,05).
Далее все рассмотренные признаки прогноза были включены в мультифакторный анализ, по результатам которого размер ЛУ по короткой оси, индекс конфигурации, отсутствие сигнала от жировой ткани ворот ЛУ, наличие неоднородности МР-сигнала ЛУ, показатель ИСлу/ИСопух явились независимыми предикторами метастатического поражения ЛУ (р<0,05). Анализ полученных данных позволил создать модель прогнозирования положительных признаков в плане выявления метастазов в ЛУ по данным МРТ:
P=l/l+e-z, где
Р – вероятность выявления метастазов; число е – основание натурального логарифма (=2,71); Z=-1,24+17,516×Х1+2,67×Х2+32,056×Х3 - 32,868×Х4 -1,69×Х5
X1 – размер ЛУ по короткой оси (0–≤0,75, 1–>0,75); Х2 – наличие или отсутствие неоднородности МР-сигнала ЛУ (0 – нет неоднородности, 1 – есть неоднородность); Х3 – наличие или отсутствие сигнала от жировой ткани ворот ЛУ (0 – есть, 1 – нет сигнала); Х4 – ИСлу/ИС опухоли (0–>1,265, 1–≤1,265,); Х5 – индекс конфигурации (0–>1,55, 1–≤1,55).
Диагностическую информативность модели оценена с помощью ROC-кривой (рис. 1).
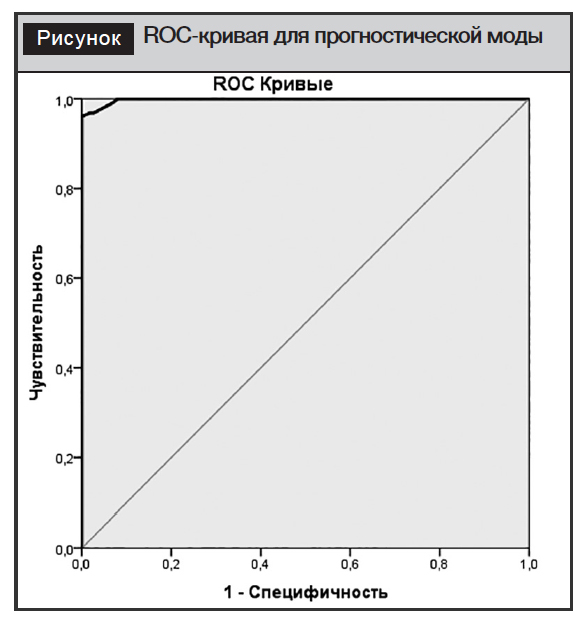
AUC составила 0,998 (p<0,001). ДЧ данного показателя – 96,9% (95% ДИ 96,1–99,2), ДС – 97,3% (95% ДИ 92,9–98,2).
На основании полученных данных риск развития метастатического поражения ранжировали следующим образом:
– низкий – вероятность меньше или равно 54,5%;
– высокий – вероятность больше 54,5% (табл. 2).
Таблица 2. Частота выявления МТЛУ в зависимости от сочетания независимых предикторов
|
Данные МРТ
|
Данные заключительных диагнозов
|
Достоверность
|
|
Риск развития метастатического поражения
|
Число выявленных МТЛУ
|
|
число ЛУ N1 / общее число
лимфоузлов
|
95% ДИ
|
|
Низкий ≤54,5%
|
4/115
|
0,96–8,7
|
р<0,001
|
|
Высокий >54,5%
|
123/125
|
94–99,8
|
Полученная модель продемонстрировала высокую прогностическую ценность, обладая индексом конкордации 0,908 (95% ДИ 0,82–0,99).
Диагностическая информативность предложенной прогностической модели была валидизирована на группе из 71 пациента, которые подверглись хирургическому лечению со стандартной ЛАЭ.
Оценка эффективности аналогичных диагностических критериев метастатического поражения ЛУ проводилась на основе ROC-анализа в зависимости от площади под ROC-кривой. Для II группы пациентов (n=71) показатели были следующими.
AUC для признака размер ЛУ по короткой оси составила 0,816 (p<0,001). Оптимальная точка разделения соответствовала значению 0,65 см. Параметр размера ЛУ по короткой оси больше 0,65 см рассматривается как критерий вероятности метастатического поражения. ДЧ данного показателя составила 51,2%, ДС – 86,2%.
AUC для признака индекс конфигурации составила 0,968 (р<0,001), что позволяет оценить ИК как значимый. ДЧ данного показателя в выявлении метастатического поражения – 83,7%, ДС – 94%. Точке, наиболее удаленной от диагонали, соответствует значение ИК меньше или равно 1,65, поэтому данное соотношение принято как вероятность метастатического поражения.
AUC для признака отсутствие сигнала от жировой ткани ворот ЛУ составила 0,912 (р<0,001), ДЧ – 88,4%, ДС – 94,0%.
Для признака наличие шиповатого контура AUC составила 0,865 (p<0,001), ДЧ – 79,1%, ДС – 94,0%.
Для признака наличие перинодулярного отека ЛУ AUC – 0,819 (p<0,001), ДЧ – 76,7%, ДС – 87,1%.
AUC для признака наличие субкапсулярного отека ЛУ – 0,710 (p<0,001), ДЧ – 55,8%, ДС – 86,2%.
Признак наличие центрального отека ЛУ имеет AUC 0,619 (p<0,001), ДЧ – 25,6%, ДС – 98,3%.
Для признака неоднородности МР-сигнала ЛУ AUC составила 0,870 (p<0,001), ДЧ – 96,3%, ДС – 81,0%.
При проведении монофакторного анализа признак некроз был определен как значимый (р=0,034). AUC для данного признака составила 0,545 (p=0,382), ДЧ – 11,6%, ДС – 97,4%. Всего было 8 случаев с некрозом.
AUC для признака оценки интенсивности МР-сигнала ЛУ, который рассматривается в соотношении с интенсивностью сигнала опухоли (ИСЛУ /ИСопух.), составила 0,870 (p<0,001), ДЧ – 79,1%, ДС – 79,3%. Оптимальная точка разделения соответствовала значению 1,34.
Для признака оценки значения ИКДЛУ AUC составила 0,726 (p<0,001). ДЧ данного показателя в выявлении метастатического поражения – 67,4%, ДС – 68,1%. Оптимальная точка разделения соответствовала значению 0,885.
Частота выявления МТЛУ в экзаменационной группе прооперированных пациентов составила 27%. Анализ зависимости частоты обнаружения МТЛУ от сочетания прогностических признаков, использованных в прогностической модели, выявил их статистически значимую корреляцию.
Наибольшая частота наблюдалась при следующих показателях: размер ЛУ по короткой оси >0,75 см и составила 73,9% (95% ДИ 51,6–89,8) (p<0,001); индекс конфигурации ≤1,55–87,5% (95% ДИ 73,2–95,8) (p<0,001), отсутствие сигнала от жировой ткани ворот ЛУ – 84% (95% ДИ 70,5–93,5) (p<0,001), наличие неоднородности МР-сигнала ЛУ – 64,5% (95% ДИ 51,3–76,3) (p<0,001), ИСЛУ/ИСопух. ≤1,265 – 68,2% (95% ДИ 52,4–81,4) (p<0,001).
По результатам валидизации наблюдалась статистически значимая прямая зависимость между группой риска и частотой выявления метастазов в ЛУ: в группе пациентов низкого риска (меньше или равно 54,5%) МТЛУ обнаружены у 4% пациентов, в то время как при риске 54,5% и больше – у 96%.
Диагностическая информативность предложенной прогностической модели на этапе валидизации также была оценена при помощи ROC-анализа. AUC составила 0,877 (95% ДИ 0,805–0,949), что свидетельствует о воспроизводимости разработанной модели на экзаменационной выборке.
Заключение
По данным мультивариантного регрессионного логистического анализа, независимыми прогностическими факторами статистически значимо ассоциированными с наличием МТЛУ у пациентов с РШМ являются размер ЛУ по короткой оси, индекс конфигурации, отсутствие сигнала от жировой ткани ворот ЛУ, наличие неоднородности МР-сигнала ЛУ, значение показателя ИСЛУ/ИСопух. (р<0,05).
Разработанная модель прогнозирования вероятности МТЛУ с использованием независимых прогностических факторов обладает высокой прогностической ценностью. Эффективность предложенной классификации подтверждена методом ROC-анализа: AUC составила 0,998 (95% ДИ 0,977–0,999). ДЧ данного показателя – 96,9% (95% ДИ 96,1–99,2), ДС – 97,3% (95% ДИ 92,9–98,2).
При проведении внешней валидизации на экзаменационной группе прооперированных пациентов с тазовой ЛАЭ индекс конкордации составил 0,743 (95% ДИ 0,67–0,81) (p<0,001), что свидетельствует о правомочности ее применения на практике для оценки распространенности процесса.
Л И Т Е Р А Т У Р А
1. Bray F., Ferlay J., Soerjomataram I., et al. // CA Cancer J. Clin. – 2018. – Vol.68, N6. – P.394–424. doi.org:10.3322/caac.21492
2. Аксель Е.М., Виноградова Н.Н. // Онкогинекология. – 2018. – №3. – С.64–78.
3. Океанов А.Е., Моисеев П.И., Левин Л.Ф., Евмененко А.А. Статистика онкологических заболеваний в Республике Беларусь (2008–2017) / Под ред. О.Г. Суконко. – Минск, 2018. – 286 с.
4. Океанов А.Е., Моисеев П.И., Евмененко А.А., Левин Л.Ф. 25 лет против рака. Успехи и проблемы противораковой борьбы в Беларуси за 1990–2014 годы / Под ред. О.Г. Суконко. – Минск, 2016. – 415 с.
5. Асланиди И.П., Шавладзе З.Н., Деревянко Е.П., Екаева И.В., Шурупова И.В., Мухортова О.В. // Мед. радиология и радиационная безопасность. – 2009. – №54 (5). – С.62–74.
6. Алгоритмы диагностики и лечения злокачественных новообразований: клинический протокол: в 2 т.: утв. Постановлением Министерства здравоохранения Республики Беларусь №60 от 06.07.2018 г. / Под ред. Суконко О.Г., Красного С.А. – Минск, 2019. – Т.2. – 308 с.
7. Демешко П.Д., Суконко О.Г., Леусик Е.А., Красный С.А., Поляков С.Л. // Здравоохранение. – 2015. – №5. – С.4–7.
8. Летягин А.Ю., Автаева М.В., Тулупов А.А., Савелов А.А. // Мед. визуализация. – 2005. – №46 (5). – С.4–7.
Медицинские новости. – 2020. – №12. – С. 19-22.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.