Внимание! Статья адресована врачам-специалистам
Mokhort T.V.
Belarusian State Medical University, Minsk
Insulin preparations – 100 years of discovery and success by
Резюме. Открытие инсулина и начало его использования в 1921–1922 годах совершили переворот в лечении сахарного диабета, обеспечив пациентам возможность полноценно жить с этим заболеванием. В статье приводятся исторические факты открытия инсулина и дальнейшие этапы эволюции инсулинотерапии от момента выделения животного инсулина до создания аналогов его 2-го поколения. Наряду с эволюцией препаратов рассматриваются изменения в методах доставки инсулина. Также уделяется внимание современным подходам к инсулинотерапии в Республике Беларусь. На примере аналога инсулина гларгин 300 МЕ/мл анализируется особенности использования его в клинической практике.
Ключевые слова: сахарный диабет, инсулин, 100-летие, аналоги инсулина.
Медицинские новости. – 2021. – №6. – С. 5–12.
Summary. The discovery of insulin and the beginning of its use in 1921–1922 made a revolution in the treatment of diabetes, providing patients with the opportunity to fully live with this disease. The article presents the historical facts of the discovery of insulin and the further stages of the evolution of insulin therapy from the moment of isolation of animal insulin to the creation of analogues of insulin of the 2nd generation. Along with the evolution of the insulin preparation, changes in the methods of insulin delivery are considered, and attention is also paid to modern approaches to insulin therapy in the Republic of Belarus. On the example of the insulin analog Glargine 300 IU/ml, the features of its use in clinical practice are analyzed.
Keywords: diabetes mellitus, insulin, 100th anniversary, insulin analogs.
Meditsinskie novosti. – 2021. – N6. – P. 5–12.
Инсулин – единственный глюкозо-снижающий препарат, не имеющий абсолютных противопоказаний к применению и лимита дозы, что определяет возможности его использования в различных клинических ситуациях независимо от этиологии сахарного диабета (СД).
Открытие препаратов инсулина
История создания препаратов инсулина берет начало в 1869 году, когда в Берлине студент медицинского факультета Пауль Лангерганс, изучая с помощью нового микроскопа строение поджелудочной железы (ПЖ), обнаружил новые клетки, образующие группы, получившие впоследствии название островков Лангерганса (рис. 1). Однако назначение этих клеток в то время оставалось непонятным. В 1889 году немецкий физиолог Оскар Минковский удалил ПЖ у собаки и вызвал экспериментальный диабет, диагностированный самым простым методом: на сладкую мочу летели мухи. Это позволило связать СД и повреждение ПЖ. Но только благодаря работам русского ученого Л.В. Соболева в 1900 г. было доказано наличие в ПЖ секрета, способного после перевязки протоков ПЖ и атрофии железистой ткани предупреждать развитие СД (см. рис. 1). Он предложил использовать железу новорожденных животных для выделения вещества с противодиабетическим действием, но не довел свои исследования до финального результата, то есть не получил экстракт с гормональной активностью.

Следующий этап развития знаний об инсулине связан с Фредериком Грантом Бантингом, который изучал хирургию, получил степень бакалавра медицины, во время Первой мировой войны служил в Канадской медицинской службе во Франции. После окончания войны в 1919 году он вернулся в Канаду, некоторое время работал в Лондоне, городе провинции Онтарио, но заинтересовался СД и пришел к выводу, что заболевание может быть следствием недостатка пептидного гормона – инсулина, секретируемого в островках Лангерганса, и предположил, что он может быть использован для лечения СД. Идею экстракции инсулина из ПЖ Ф. Бантинг изложил профессору физиологии Торонтского университета Джону Маклеоду, который позволил ему пользоваться лабораторией для экспериментальных работ вместе со студентом- ассистентом Чарлзом Бестом. В декабре 1921 года Ф. Бантингу и Ч. Бесту удалось выделить инсулин из ПЖ собаки и испытать его на подопытном животном. После этого Дж. Маклеод привлек к работе блестящего биохимика, Джеймса Коллипа, который разработал эффективный метод очистки инсулина (рис. 2). 11 января 1922 года, после множества успешных испытаний на собаках, 14-летнему Леонарду Томпсону была сделана первая в истории инъекция инсулина. Эта первая попытка применения инсулина оказалась неудачной: из-за недостаточной очистки у пациента развилась аллергическая реакция. Поэтому вторая доза инсулина, введенная 23 января, прошла дополнительную очистку, в результате чего не только не обнаружено явных побочных реакций, но и была купирована гипергликемия (рис. 3). За это открытие, позволившее продлить жизнь пациентам с СД, Дж. Маклеод и Ф. Бантинг в 1923 году удостоены Нобелевской премии по физиологии и медицине. Ф. Бантинг был возмущен, что его помощник Ч. Бест не представлен к награде, и свою часть премии торжественно разделил с Бестом, а Дж. Маклеод – с Дж. Коллипом [1, 2]. В 1923 году начато производство инсулина.
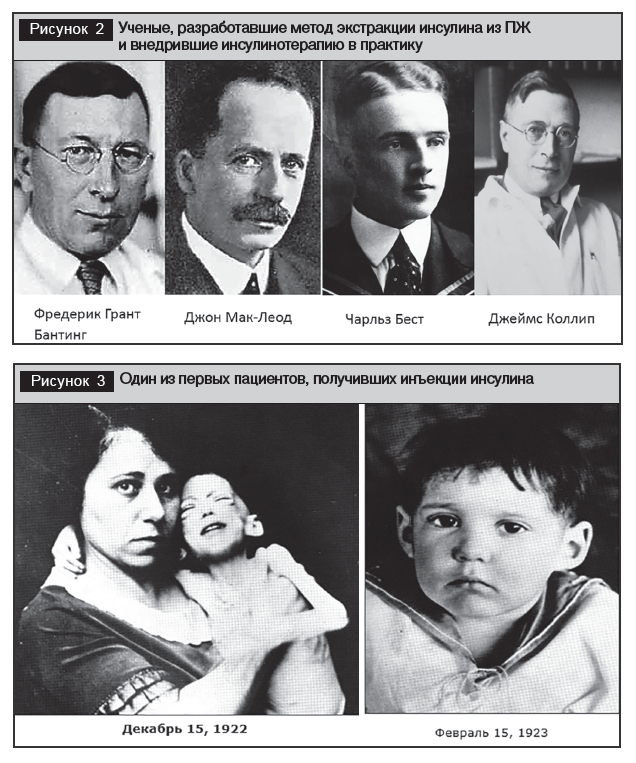
Интересно, что практически в это же время, в 1923 году, была разработана методика экстракции инсулина из ПЖ в Харьковском органотерапевтическом институте (ныне – Харьковский институт проблем эндокринной патологии им. В.Я. Данилевского). В 1927 году разработана технология производства инсулина и налажен его промышленный выпуск (Г.Л. Ейнгорн).
Изучение и совершенствование препаратов инсулина
Работы в области исследований инсулина продолжались:
– в 1926 году Дж. Абель и В. Дю-Виньо получили инсулин в кристаллическом виде;
– в 1939 году инсулин впервые одоб-рен Food and Drug Administration;
– в результате исследований по созданию инсулина продленного действия разработан протамин-цинк-инсулин (инсулин был соединен с белком спермы одного из видов форели – протамином) и в 1946 году Гансом Христианом Хагедорном создан инсулин НПХ (NPH – Neutral Protamine Hagedorn), который используется до настоящего времени;
– в 1958 году Фредерик Сенгер установил амикислотную последовательность в молекуле инсулина (удостоен Нобелевской премии) (рис. 4, 5);
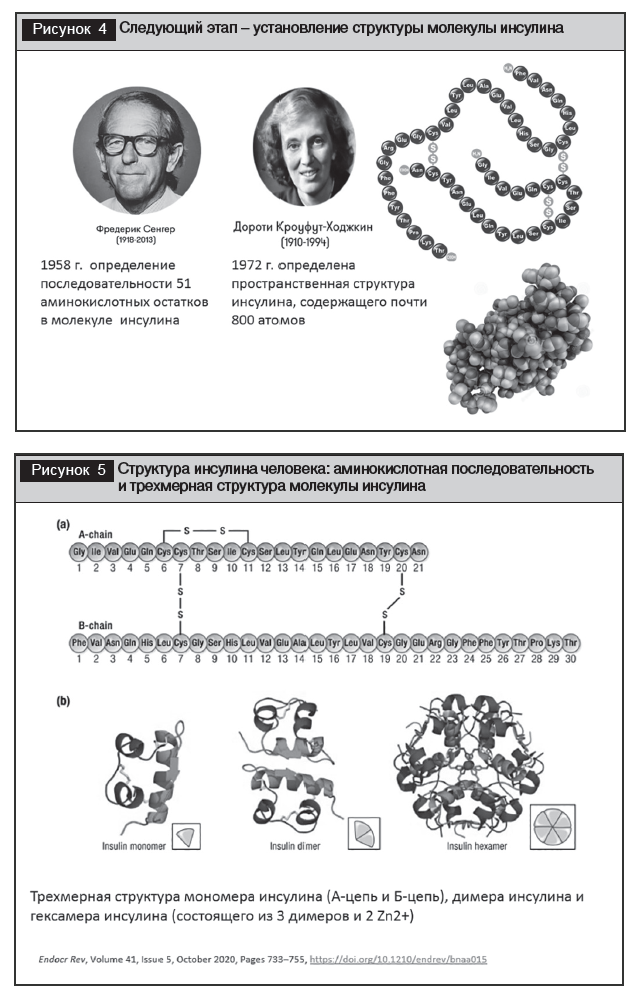
– в 1972 году Дороти Кроуфут-Ходж-кин определила пространственную структуру инсулина, содержащего почти 800 атомов (см. рис. 4, 5);
– в 1963 году в лаборатории Рейнско-Вестфальского технического университета в Германии (Гельмут Цан) и практически одновременно в Питтсбургском университете (Панайотис Катсоянис) получен первый искусственно-синтезированный инсулин;
– в 1978 году синтезирован генно-инженерный инсулин человека (Артур Ригс и Кэйити Итакура) на основе технологии использования рекомбинантной ДНК и внедрения ее в геном кишечной палочки E. сoli, а позже с этой целью начато использование пекарских дрожжей [3–6].
Разработки, касающиеся оптимизации препаратов инсулина, были направлены в первую очередь на уменьшение количества инъекций инсулина (пролонгированные инсулины), создание инсулина человека (исключение ежедневного парентерального введения животного белка). Кроме того, при абсолютном дефиците инсулина при инсулинотерапии должен быть обеспечен максимально физиологический профиль инсулинемии, обеспечивающий целевые показатели гликемии без гипогликемических эпизодов. Хронология развития инсулина с приблизительными историческими датами представлена на рисунке 6.
Терапевтическое обучение и контроль гликемии
С момента доступности инсулинотерапииDiabetes Control and Complication Trial (1983–1993) и United Kingdom Prospective Diabetes Study (1977–1997)), изменивших подходы к лечению и подтвердивших значимость поддержания уровня глюкозы в крови и НbА1с, что замедляет возникновение хронических осложнений диабета. известный американский специалист по СД Эллиот Джослин первым в медицинской практике поставил вопрос о необходимости обучения пациентов с СД самоконтролю в домашних условиях, указав на необходимость ежедневной самооценки состояния углеводного обмена (рис. 7). Его высказывание: «Нехватка обучения так же опасна, как нехватка инсулина» – остается актуальным до настоящего времени. Вначале самоконтроль осуществлялся путем многократной оценки глюкозурии перед каждой инъекцией, а в 1940 году под руководством Э. Джослина была разработана первая система мониторинга уровня глюкозы в крови перед едой, которая явилась предшественником современных глюкометров – незаменимых в управлении СД устройств, которые широко используются с 1970–1980 годов. В результате изменились цели в лечении СД и была определена необходимость поддержания близко нормальных уровней гликемии, что привело к повышению рисков развития гипогликемий. Практически в это же время бельгийский врач Жан Пирарт на основании наблюдения за 4000 пациентов с СД доказал связь между хорошим контролем глюкозы и предотвращением осложнений. Еще одним поворотным годом в лечении СД стал 1976-й, когда американские ученые обнаружили возможность соединения глюкозы и гемоглобина, то есть образование гликированного гемоглобина (НbА1с), который является интегральным показателем компенсации СД. Появление инструментов эффективного мониторинга СД предопределило проведение крупномасштабных исследований (
Новый этап разработки препаратов инсулина: аналоги
Создание генно-инженерного инсулина человека позволило улучшить качество очистки инсулина (отсутствуют белковые примеси (1?10-6)) с достижением более 99% степени чистоты, что снизило иммуногенность и улучшило его переносимость. Кроме того, генно-инженерный инсулин позволяет избежать опасности поступления прионов в отличие от использования препаратов животного происхождения. В то же время использование генно-инженерного инсулина человека не решило ряд проблем, возникающих в клинической практике инсулинотерапии.
1. Медленное начало действия, что диктует необходимость введения за 30–40 минут до еды. Это обусловлено фармакокинетическими отличиями: инсулин из подкожного депо, где он находится в виде гексамеров, постепенно диссоциирует до мономеров, способных поступать в кровь через микрососудистый эндотелий, что отличается от физиологического пути поступления инсулина из ПЖ в портальную систему печени (см. рис. 5) [6].
2. Длительность действия инсулина короткого действия до 6–8 часов и максимум действия через 2–4 часа детерминирует необходимость перекусов для предотвращения развития гипогликемий.
3. Наличие «пиков» действия инсулина и вариабельность его воздействия изо дня в день, особенно пролонгированного инсулина НПХ (максимум действия между 2 и 8 часами, продолжительность действия – 18–20 часов), в сочетании с повышенным риском развития поздней гипогликемии.
4. Необходимость 2-кратного вве-дения пролонгированного инсулина в течение суток [7, 8].
Таким образом, были созданы предпосылки для создания аналогов инсулина – препаратов, в которых время действия инсулина модифицировано, они более удобны в использовании для пациента, дают возможность добиться баланса между достижением целевой гликемии и минимизацией риска развития гипогликемий.При создании аналогов инсулина короткого действия было важно максимально сократить период полувыведения, что приблизило бы их фармакодинамику к таковой нативного инсулина, инактивация которого происходит через 4–5 минут после поступления в портальную систему. При разработке аналогов инсулина пролонгированного действия целью было создание беспиковых аналогов, способных постепенно и равномерно всасываться из подкожного депо, что минимизирует риск гипогликемий и количество инъекций [9]. В результате модификации структуры инсулина разработаны аналоги инсулина:
1) ультракороткого действия посредством внесения изменений в В-цепь:
– в 28–29-м положении лизин и пролин заменены местами (лизпро – Humalog);
– в 28-м положении пролин заменили на аспарагин (аспарт – Novorapid);
– в 3-м положении аспарагин заменен на лизин, а в 29-м – лизин заменен на глутамин (глулизин – Apidra);
2) беспиковые, пролонгированные:
– проведена замена аспарагина в 21-м положении А-цепи на глицин и добавлены 2 молекулы аргинина в С-конец В-цепи в положении 31 и 32. Изменения привели к смещению изоэлектрической точки молекулы с рН 5,4 до 6,7, следовательно, уменьшилась растворимость препарата при физиологических значениях нейтральной среды подкожной клетчатки (гларгин – Lantus);
– присоединение миристиновой кислоты в положении В29 привело к высокой степени самоассоциации молекул в дигексамеры и обратимой связываемостью с альбумином, что замедляет системную абсорбцию из мест инъекции (детемир – Levemir).
На этом прогресс в инновационных разработках не закончился – появились аналоги инсулина 2-го поколения, включающие:
– аналоги инсулина более быстрого действия, созданные при добавлении модификаторов всасывания и стабильности (Фаст аспарт – инсулин аспарт с добавлением никотинамида и L-аргинина (Fiasp) и лизпро ультракороткого действия с добавлением цитрата натрия и трепостибила (Lyumjev);
– аналоги сверхдлительного действия:
– деглютек – рекомбинантный ацилированный DesB30 инсулин человека, к которому в положении LysB29 через ?-L-глутаминовую кислоту (линкер) присоединен остаток гексадекандиновой жирной кислоты. Это способствует формированию гексамеров и дигексамеров, медленно диссоциирующихся за счет диффузии молекул цинка при подкожном введении (длительность действия – >42 часа, но рекомендуется для ежедневного использования (Tresiba));
– гларгин с концентрацией 300 МЕ/мл, длительность действия которого увеличивается за счет уменьшения объема подкожного депо и поверхности всасывания (длительность действия – до 36 часов (Tоujeo));
– икодек, в котором связывание инсулина с альбумином осуществлено посредством гидрофильного линкера, обеспечивающего обратимое связывание (в 10 раз более сильное, чем в инсулине детемир) и модификации молекулы с помощью рекомбинантной РНК-технологии: в белке проведены три аминокислотные замены (A14E, B16H и B25H) для снижения ферментативной деградации (длительность действия – до 196 часов).
На рисунке 8 представлены графики, иллюстрирующие время действия инсулина, используемого в реальной клинической практике.
Желание оптимизировать количество инъекций привело к созданию комбинированных препаратов инсулина или его аналогов различной длительности действия (премиксов) и инсулина с инкретином, например, деглутека и лираглутида (Сультофай, ИДегЛира, Xultophy, IDegLira), гларгина и ликсисенатида (Соликва, Soliqua).
Будущее препаратов инсулина
На протяжении многих лет ведутся работы по созданию инсулина для перо-рального использования, но до настоящего времени не получено признанного лекарственного средства. Инсулин для орального приема может представлять собой молекулу инсулина, устойчивую к воздействию пищеварительных ферментов и попадающую из желудочно-кишечного тракта в кровь в неизменном виде, или инсулин в форме микропузырьков, усеянных микроскопическими иголками, которые дают возможность фиксироваться к стенке органов пищеварения и всасываться в кровоток. Одобрен для использования ингаляционный препарат инсулина Afrezza (рис. 9), применение которого лимитировано при наличии патологии легких и существенно превышает стоимость препаратов инсулина для подкожного введения.
Технический прогресс в области биологии и медицины, ускоряющийся с каждым десятилетием, позволяет надеяться на реализацию разработок по созданию пластырей инсулина и «Smart», или «умного», инсулина, который представляет собой систему автоматической доставки инсулина в кровь. Основа этой системы – синтетический полимер с остатками бороновой кислоты, проницаемость которого меняется в зависимости от уровня глюкозы в среде, то есть система обеспечивает выделение инсулина в кровь в зависимости от уровня гликемии.
Эволюция инсулинотерапии не исключает восстановление независимости от инсулина, возможностей использования органной трансплантации ПЖ (в том числе в комплексе с почкой) в сочетании с иммуносупрессией и клеточной трансплантацией (культуры островковых клеток и плюрипотентных стволовых клеток, позволяющих получить практически неограниченный запас человеческих островковоподобных кластеров путем направленной дифференцировки) [10].
Отличия оригинальных препаратов инсулина и биосимиляров
Все современные препараты инсулина производятся с использованием биотехнологий и методов генной инженерии. В отличие от химического синтеза препаратов процесс создания биоинженерных более чувствителен к технологическим деталям. Лекарственные средства, получаемые посредством химического синтеза, имеют сравнительно простую химическую структуру и способ производства, поэтому воспроизведенные копии (генерические препараты) считаются идентичными оригинальному препарату. Воспроизведение точной копии биоинженерных препаратов, в том числе инсулинов, представляет собой гораздо более сложную задачу, и, хотя истечение срока патентной защиты оригинального инсулина позволяет создание его «копии», то есть биосимиляра (англ. biological drug – биологический препарат и similar – похожий), отличия могут быть существенными. Это различие важно понимать, потому что следствием отличия структуры биосимиляра от структуры оригинального лекарственного средства является необходимость проведения полного цикла клинических испытаний, включая оценку фармакокинетики (не менее одного однодозового перекрестного исследования с подкожным введением, предпочтительно у пациентов с СД 1-го типа), фармакодинамики (тесты, демонстрирующие эквивалентность с основным препаратом в двойных слепых перекрестных исследованиях с использованием эугликемического гиперинсулинемического клэмпа, отражающих соотношение «время – эффект», с предоставлением данных о скорости инфузии глюкозы и концентрации инсулина, а также обоснованием выбора популяции), эффективности биосимиляра и оригинального инсулина (по уровню HbА1c) и иммуногенности инсулина (продолжительность исследования – не менее 6 месяцев) [11–13]. Биосимиляры рекомбинантного инсулина человека и его аналогов с определенными ограничениями используются в клинической практике в мире и Республике Беларусь.
Инсулинотерапия: что важно?
Понадобилось много десятилетий и усилия сотен и тысяч специалистов в области физиологии, биохимии, генетики, эндокринологии, чтобы сделать инсулинотерапию доступной, максимально удобной и безопасной. Инсулин прошел путь от плохо очищенных экстрактов ПЖ животных до чистых и точно контролируемых препаратов, которые можно назначать и вводить с высокой точностью и предсказуемостью действия. Модификации рецептуры инсулина и самой молекулы инсулина позволили приблизиться к естественному эндогенному инсулиновому ответу.
Понимание путей разработки различных инсулинов поможет клиницистам в удовлетворении потребностей их пациентов. Важно осознавать, что наряду с препаратами инсулина для поддержания гликемии в целевом диапазоне принципиально необходимы средства его доставки, способы мониторинга гликемии и терапевтическое обучение пациентов.
Средства доставки инсулина с момента его создания также претерпели изменения от использования многоразовых, затем одноразовых шприцев и шприц-ручек до использования помп, которые вводят инсулин по заранее запрограммированным индивидуальным настройкам (рис. 10).

Инновации в контроле гликемии включают использование систем постоянного мониторинга гликемии, в том числе в режиме реального времени [14, 15]. Интегрирование помпы и системы мониторинга гликемии (Closed Loop) позволяет эффективно управлять диабетом.
Определяющим в эффективности лечения СД является терапевтическое обучение. Именно обучение позволяет пациенту достичь соответствия колебаний гликемии, обусловленных различными факторами (пища, физические нагрузки, стрессы), уровням инсулинемии.
В 1948 году по инициативе Эллиота Джослина была учреждена специальная медаль, которая первоначально вручалась людям, прожившим с диабетом 25 лет и более, в знак признания их достижений в борьбе с болезнью (см. рис. 7). В Республике Беларусь в настоящее время 2 пациентки имеют награду за жизнь с СД 50 лет – медаль Джослина. Эволюция качества инсулинотерапии и лечения СД привела к увеличению срока жизни с СД и появлению джослиновских медалистов с длительностью болезни 50, 75 и даже 80 лет.
Инсулинотерапия в Республике Беларусь
При понимании общемировой эволюции в инсулинотерапии важно оценивать изменения, происходящие в Республике Беларусь. В течение 2020 года был утвержден приказ Министерства здравоохранения РБ №417 от 10.04.2020 «Об обеспечении пациентов с сахарным диабетом лекарственными средствами инсулина», в котором определены концепция обеспечения лекарственными средствами инсулина пациентов с СД на период 2020–2025 годы, порядок назначения на бесплатной основе лекарственных средств инсулина пациентам с СД (показания, критерии эффективности и безопасности, порядок оценки непереносимости, неэффективности препаратов инсулина).
Указанная концепция предусматривает поэтапное расширение применения аналогов инсулина и переход на его использование в картриджной форме. В результате внедрения концепции к 2025 году прогнозируемое количество пациентов с СД на инсулинотерапии составит 91 600 человек, из них 81 000 будет получать инсулин в картриджах для использования в шприц-ручках, что не только облегчает жизнь пациента, но и гарантирует точное дозирование. Также планируется, что 10 600 больных будут получать аналоги инсулина. Последовательные этапы реализации концепции предусматривают перевод:
– на аналоги инсулина всех детей с СД 1-го типа в 2020 году; этап 2 – 2021 год;
– на картриджную форму генно-инженерных инсулинов человека пациентов с СД 1-го типа молодого возраста (до 45 лет) в 2021 году;
– на картриджную форму генно-инженерных инсулинов человека всех пациентов с СД 1-го типа в 2022 году;
– на картриджную форму генно-инженерных инсулинов человека всех пациентов трудоспособного возраста и работающих пенсионеров с СД 2-го типа в 2023 году;
– на картриджную форму генно-инженерных инсулинов человека всех оставшихся пациентов с СД в 2025 году.
Согласно данному приказу, аналогами инсулина на бесплатной основе обеспечиваются следующие категории пациентов:
– дети с СД (до 18 лет);
– учащиеся высших и средних учебных заведений;
– получавшие аналоги инсулина в возрасте до 18 лет;
– использующие помповую инсулинотерапию;
– с СД 1-го типа с выраженными стадия-ми хронических осложнений заболевания;
– с СД и тяжелой сопутствующей патологией: перенесшие инфаркт миокарда, или острые нарушения мозгового кровообращения, или после интервенционных хирургических вмешательств на сердце и сосудах, получающие базис-болюсную инсулинотерапию;
– имеющие злокачественное новообразование, значимо ухудшающее общее состояние (оценки 2–4 по шкале ECOG или ≤50% по шкале Карновского);
– после трансплантации органов.
Расширение показаний предусмотрено с 01.01.2025, когда аналогами инсулина будут обеспечены все пациенты с СД 1-го типа молодого возраста (до 45 лет).
Второй важный документ, приказ Министерства здравоохранения РБ «О совершенствовании системы обучения пациентов с сахарным диабетом» №47 от 23.01.2020, который предполагает оптимизацию организации обучения пациентов с СД, направленную на прогрессивное изменение представлений больного о заболевании и его лечении, ведущее к изменению поведения и истинному умению управлять лечением диабета в активном союзе с врачом. То есть итогом терапевтического обучения должно явиться поддержание компенсации СД с учетом индивидуализированных целей, направленной на предупреждение развития и прогрессии хронических осложнений, а также на увеличение продолжительности и качества жизни.
Особенности применения аналогов инсулина
Понимание целесообразности использования аналогов инсулина основано на сложностях достижения целевых уровней гликемии в течение суток длительное время. Традиционно в практике врачи ориентируются на уровень гликированного гемоглобина (НbA1c). Но важно понимать, что нет полной корреляции между уровнями НbA1c и гликемии [16]. Это является следствием ежедневной вариабельности гликемии, ложноотрицательных показателей НbA1c при наличии гипогликемий, постгипогликемической гипергликемией и другими факторами.
Вариант выхода из этой ситуации – использование систем мониторирования гликемии, обеспечивающих возможность постоянного контроля гликемии и проведения коррекционных мероприятий (изменение дозировок инсулина, режима физической активности или питания) [17].
Второй путь решения – оптимизация инсулинотерапии в реальной клинической практике с использованием аналогов инсулина, которые имеют оптимальный фармакокинетический профиль, обеспечивают снижение риска гипогликемических эпизодов и способствуют улучшению качества жизни. Из всего многообразия аналогов инсулина в настоящее время в Республике Беларусь используются на бесплатной основе аналоги инсулина ультракороткого действия – аспарт и глулизин, продленного действия – детемир и гларгин с концентрацией инсулина 100 МЕ/мл. С 2021 года будет доступен для льготного обеспечения также гларгин 300 МЕ/мл. В настоящее время гларгин с концентрацией 300 МЕ/мл, что обеспечивает ему несколько отличные свойства, доступен в аптечной сети.
В результате увеличения концентрации инсулина в 1 мл гларгин-300 приобрел измененный фармакокинетический профиль с более длительным и плавным эффектом по сравнению с гларгином 100 МЕ/мл, что обусловлено уменьшением площади поверхности депо препарата, меньшим объемом преципитата гларгина-300 и более медленным и постепенным поступлением в кровоток по сравнению с гларгином-100 [18, 19].
Говоря о преимуществах аналогов инсулина, необходимо подчеркнуть, что одним из факторов, оказывающих влияние на достижение компенсации, является боязнь нового эпизода гипогликемии. Этот психологический фактор может привести к снижению приверженности к лечению и ухудшению гликемического контроля, так как снижается готовность пациента к большей интенсификации терапии, ухудшается приверженность к правильному питанию, нарушается режим дозирования инсулина [20]. Авторы выявили, что лица, ранее перенесшие эпизоды гипогликемии, стремятся к достижению более высокого уровня глюкозы в ночное время из-за страха ночной гипогликемии, что влечет за собой недостижение компенсации [21].
Вариабельность гликемии
Результаты исследований свидетельствуют о том, что высокая вариабельность гликемии является фактором риска развития периферической нейропатии у пациентов с СД 1-го типа [22].
Нами 10 лет назад был проведен анализ вариабельности тощаковой (ночной) гликемии у пациентов с СД 1-го типа в зависимости от вида базальной инсулинотерапии: генно-инженерный инсулин человека средней продолжительности действия (НПХ) против аналога инсулина продленного действия (гларгин) [23]. Для оценки вариабельности тощаковой гликемии, в том числе межсуточной, наряду с стандартными показателями использовали коэффициент вариации, межквартильный диапазон, суточную лабильность гликемии, рассчитанную с использованием n-часового интервала времени и среднюю амплитуду колебаний гликемии, также рассчитывался индекс риска развития гипогликемии за 24 часа. В результате было доказано, что использование гларгин 100 МЕ/мл приводит к значительному снижению показателей суточной вариабельности тощаковой (ночной) гликемии, минимизирует риск развития гипогликемических реакций и обеспечивает больший резерв в повышении дозы для достижения целевых значений компенсации диабета по сравнению с пролонгированными инсулинами НПХ [23].
Гларгин 300 МЕ/мл: анализ клинических данных
Очевидно, что использование препаратов инсулина, обеспечивающих стабильный контроль гликемии, снижение риска гипогликемических эпизодов и улучшение качества жизни, в реальной клинической практике имеют принципиальное значение для пациентов с СД 1-го и 2-го типа. Единственный аналог пролонгированного действия, доступный в Республике Беларусь – гларгин 300 МЕ/мл (Туджео), – продемонстрировал соответствие перечисленным требованиям.
При анализе данных по использованию гларгина 300 МЕ/мл при СД 1-го типа, проведенные рандомизированные клинические исследования, исследования в реальной клинической практике и анализ данных регистров свидетельствуют о достижении более стабильных профилей гликемии с минимальной вариабельностью в течение дня в сравнении с инсулином гларгин 100 МЕ/мл и деглудек [24, 25].
Несмотря на современные возможности использования таблетированных лекарственных средств и агонистов рецепторов глюкагон-подобного пептида, в лечении наиболее распространенной формы СД – 2-го типа – инсулинотерапия является широко используемой опцией. В течение многих лет аксиомой диабетологии является облигатная необходимость инициации инсулинотерапии в случаях, если у пациента наблюдаются признаки продолжающегося катаболизма (потеря массы тела), присутствуют симптомы гипергликемии, или когда уровни НbA1с >10% или глюкозы в крови ≥16,7 ммоль/л у пациента с впервые выявленным СД 2-го типа. При этом указывается на возможности использования современных глюкозо-снижающих препаратов в комбинированной терапии, что зачастую лимитировано их стоимостью и отсутствием льготирования в Республике Беларусь. Невозможность выбора глюкозоснижающих средств в добавление к метформину и производным сульфонилмочевины в реальной клинической практике, а также лимитированный эффект пероральных сахароснижающих препаратов (ПССП) в снижении уровня НbA1с обусловливает целесообразность использования инсулинотерапии при недостижении целевого уровня НbA1с (для большинства пациентов – <7%) в течение 3 месяцев. Также инсулинотерапия должна быть использована при наличии противопоказаний для назначения других глюкозоснижающих средств, так как инсулин является единственным препаратом, не имеющим абсолютных противопоказаний и лимита дозы.
При СД 2-го типа рекомендуется инициация инсулинотерапии с использования базального инсулина перед сном, что обеспечивает предупреждение утренней гипергликемии. Для этой цели используются пролонгированные инсулины, включая аналоги.
Альтернативой является использование инсулина гларгин 300 МЕ/мл, который имеет преимущества перед гларгином 100 МЕ/мл, обеспечивая более ровные и пролонгированные фармакокинетический и фармакодинамический профили [26].
В реальной клинической практике преимущества пролонгированных аналогов инсулина первого поколения перед инсулином НПХ по влиянию на частоту гипогликемических событий не вызывают сомнений, однако необходим анализ доказательства преимуществ инсулина гларгин 300 МЕ/мл. По результатам программы прямых сравнительных клинических исследований EDITION, которая состояла из 3 исследований, включающих пациентов с СД 2-го типа (EDITION-1 – лица с недостаточно контролируемым СД 2-го типа при использовании базального, прандиального инсулина в комбинации с ПССП; EDITION-2 – пациенты, которым назначали ранее базальный инсулин в комбинации с ПССП; EDITION-3 – больные, принимавшие ПССП, инсулинотерапия назначалась им впервые), были получены доказательства преимуществ инсулина гларгин 300 МЕ/мл [27–29].
По результатам мета-анализа этих исследований сделано заключение, что при достижении равноценного гликемического контроля (по уровню НbА1с и тощаковой гликемии) у пациентов, получавших гларгин 300 МЕ/мл:
– была ниже частота подтвержденной (≤3,9 ммоль/л) или тяжелой гипогликемии в ночное (относительное различие – 31%) и в любое время (относительное различие – 14%);
– было ниже кумулятивное число подтвержденных (<3,9 ммоль/л) или тяжелых гипогликемических событий в любой время суток и ночных гипогликемий;
– прибавка в весе была низкой (<1 кг) в обеих группах с меньшим увеличением при использовании гларгина 300 (средняя разница – 0,28 кг (95% ДИ -0,55–-0,01); р=0,039) [26].
Аналогичные результаты получены в рандомизированном прямом сравнительном исследовании BRIGHT у пациентов с СД 2-го типа, не получавших предшествующей инсулинотерапии, в котором проводилось сравнение использования гларгина 300 МЕ/мл и деглудек 100 МЕ/мл в течение 24 недель [30]. В этом исследовании в группе гларгина выявлено снижение:
– доли пациентов с ≥1 эпизодом гипогликемии в течение первых 12 недель лечения (период титрования дозы);
– на 23% частоты подтвержденных (≤3,9 ммоль/л) и на 43% – тяжелых гипогликемий (≤3,0 ммоль/л) в течение суток;
– на 26% доли пациентов с ≥1 эпизодом (≤3,9 ммоль/л) и на 37% – тяжелых гипогликемий (≤3,0 ммоль/л);
– суммарной частоты ночных подтвержденных и тяжелых гипогликемий – на 35% [30].
Как указано выше, важным аспектом оценки препарата инсулина является вариабельность его действия в течение суток, оказывающая влияние на достижение cтабильной компенсации. При использовании клэмп-метода коэффициент вариабельности инсулина гларгин 300 МЕ/мл был существенно ниже, чем для НПХ и гларгина 100 МЕ/мл [31].
Лечение СД у пожилых
По мере того, как человек с диабетом стареет, может потребоваться упрощение, переключение или деэскалация терапевтического режима в зависимости от сохранности функций пациента и уровня HbA1c. Рекомендуется рассмотреть деинтенсификацию терапии, которая может вызвать гипогликемию, включая использование производных сульфонилмочевины и инсулинов короткого действия [32].
В Республике Беларусь старение населения идет более быстрыми темпами, чем в мире в целом. По данным национального регистра СД, среди общего количества пациентов с СД 2-го более 23% составляют лица 75 лет, что определяет значимость выбора безопасного метода инсулинотерапии для этой категории пациентов. При выборе глюкозоснижающей терапии у пожилых должны быть оценены способность к автономному функционированию; комплаентность с учетом когнитивного потенциала, зрительных и моторных функций; скорость клубочковой фильтрации, так как ее снижение приводит к увеличению периода полувыведения инсулина и уменьшению потребности в инсулине, что диктует необходимость регулярного контроля гликемии. Использование гларгина 300 МЕ/мл является альтернативной возможностью для лечения пожилых пациентов, обеспечивающей снижение риска ночной гипогликемии по сравнению с гларгином-100 при равнозначной эффективности [33, 34]. Также имеются доказательства безопасности использования гларгина 300 МЕ/мл у лиц со снижением скорости клубочковой фильтрации: в субанализе исследования BRIGHT renal продемонстрировано более выраженное снижение HbA1c (-0,43%, 95% ДИ -0,74–-0,12), чем у пациентов, получавших деглюдек со сходными с показателями по встречаемости и частоте эпизодов гипогликемии, что у пациентов с нарушением функции почек (СКФ <60 мл/мин/1,73 м2) [35].
Заключение
Эволюция использования инсулина в клинической практике – это история множества успешных открытий, которые направлены на оптимизацию помощи пациентам с СД. Акселерация научных исследований в области инсулинотерапии затрагивает разработки не только новых молекул-аналогов инсулина, но также путей доставки инсулина, способных облегчить бремя заболевания и привести к улучшению качества и увеличению продолжительности жизни пациентов с СД.
Л И Т Е Р А Т У Р А
1. Fralick M, Zinman B. // Diabetologia. – 2021. https://doi.org/10.1007/s00125-020-05371-6
2. Roth J., Qureshi S., Whitford I., et al. // Diabetes Metab. Res. Rev. – 2012. – Vol.28, N4. – P.293–304.
3. Rosenfeld L Insulin: discovery and controversy // Clin. Chem. – 2002. – Vol.48, N12. – P.2270–2288.
4. Sorli C., Heile M.K. // J. Multidiscip. Healthc. – 2014. – N7. – P.267–282.
5. Karamitsos D.T. // Diabetes Res. Clin. Pract. – 2011. – Vol.93, Suppl.1. – P2–8.
6. Hirsch I.B., Juneja R., Beals J.M., et al. // Endocrine Rev. – 2020. – N5. – P.733–755.
7. Bolli G.B. // Int. J. Clin. Pract. – 2002. – Suppl.129. – P.65–74.
8. Waugh N., Cummins E., Royle P., et al. // Health Technol. Assess. – 2010. – N14 (36). – P.241–248.
9. Rossetti P., Porcellati F., Fanelli C.G., et al. // Arch. Physiol. Biochem. – 2008. – Vol.114, N1. – P.3–10.
10. Melton D. // Diabetologia. – 2021. https://doi.org/10.1007/s00125-020-05367-2
11. Ampudia-Blasco F.J. // Am. J. Ther. – 2020. – Vol.27, N1. – e52–e61.
12. Yamada T., Kamata R., Ishinohachi K., et al. // Diabetes Obes. Metab. – 2018. – Vol.20, N7. – P.1787–1792.
13. 26 February 2015 EMEA/CHMP/BMWP/32775/2005_Rev. 1 Committee for Medicinal products for Human Use (CHMP) Guideline on non-clinical and clinical development of similar biological medicinal products containing recombinant human insulin and insulin analogues.
14. Shah R.B., Patel M., Maahs D.M., Shah V.N. // Int. J. Pharm. Investig. – 2016. – Vol.6, N1. – P.1–9.
15. Kesavadev J., Saboo D., Krishna M.B., Krishnan G. // Diabetes Ther. – 2020. – Vol.11, N6. – P.1251–1269.
16. Perlman J.E., Gooley T.A., McNulty B., et al. // Diabetes Technol. Ther. – 2021. – Vol.23, N4. – P.253–258.
17. Bergenstal R.M., Beck R.W., Close K.L. et al. // Diabetes Care. – 2018. – Vol.41, N11. – P.2275–2280.
18. Pandyarajan V., Weiss M.A. // Curr. Diab. Rep. – 2012. – N12. – P.697–704.
19. Becker R.H.A., Dahmen R., Bergmann K., et al. // Diabetes Care. – 2014. – Vol.38, N4. – P.637–643.
20. Ahrén B. // Vasc. Health Risk Manag. – 2013. – N9. – P.155–163.
21. Frier B.M. // Nat. Rev. Endocrinol. – 2014. – Vol.12, N10. – P.711–722.
22. Bragd J.U., Adamson L.B., Backlund P.E., et al. // Diabetes Metab. – 2008. – N34. – P.612–616.
23. Mashkova M., Mokhort T., Bylodid I. // Baltic Endocrinol. – 2012. – Vol.12, N6. – P.8–12.
24. Becker R.H., Dahmen R., Bergmann K., et al. // Diabetes Care. – 2015. – Vol.38, N4. – P.637–643.
25. Bailey T.S., Pettus J., Roussel R., et al. // Diabetes Metab. – 2018. – Vol.44, N1. – P.15–21.
26. Ritzel R., Roussel R., Bolli G.B., et al. // Diabetes Obes. Metab. – 2015. – Vol.17, N9. – P.859–867.
27. Riddle M.C., Bolli G.B., Ziemen M., et al. // Diabetes Care. – 2014. – Vol.37, N10. – P.2755–2762.
28. Yki-Jarvinen H., Bergenstal R., Ziemen M., et al. // Diabetes Care. – 2014. – Vol.37. – P.3235–3243.
29. Bolli G.B., Riddle M.C., Bergenstal R. M., et al. // Diabetes Obes. Metab. – 2015. – N17. – P.386–394.
30. Rosenstock J., Cheng A., Ritzel R., et al. // Diabetes Care. – 2018. – Vol.41. – P.2147–2154.
31. Owens D.R., Traylor L., Dain M.P., Landgraf W. // Diabetes Res. Clin. Pract. – 2014. – Vol.106, N2. – P.264–274.
32. Strain W.D., Down S., Brown P., et al. // Diabetes. Diabetes Ther. – 2021. doi: 10.1007/s13300-021-01035-9
33. Cheng A.Y.Y. // Can. Diabetes. – 2011. – Vol.24, N1. – P.3–9.
34. Zinman B., Philis-Tsimikas A., Cariou B., et al. // Diabetes Care. – 2012. – Vol.35, N12. – P.2464–2471.
35. Berard L., Bonnemaire M., Mical M., Edelman S. // Diabetes Obes. Metab. – 2018. – Vol.20, N2. – P.301–308.
Медицинские новости. – 2021. – №6. – С. 5-12.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.