Внимание! Статья адресована врачам-специалистам
Trisvetova E.L.
Belarusian State Medical University, Minsk
Losartan in the treatment of patients with cardiovascular comorbidity
Резюме. Сердечно-сосудистые заболевания и их осложнения часто встречаются в комбинации, обусловливая трудности в выборе лекарственных средств. Наиболее часто у коморбидных пациентов выявляют артериальную гипертензию в комбинации с хронической сердечной недостаточностью, хронической болезнью почек, метаболическими нарушениями, включающими сахарный диабет 2-го типа. Развитие гипертрофии миокарда и ремоделирование предрасполагает к возникновению аритмий сердца, внезапной сердечной смерти, поражение сосудистой стенки – к формированию аневризм, разрывов сосудов, прогрессированию атеросклероза. Препарат, выбранный для антигипертензивной терапии, оказывает влияние на течение и прогрессирование других заболеваний. В классе антигипертензивных препаратов блокатор рецепторов ангиотензина II лозартан относится к наиболее изученным и применяется при хронической сердечной недостаточности, хронической болезни почек, метаболических нарушениях для замедления прогрессирования патологических изменений и улучшения прогноза жизни пациентов.
Ключевые слова: сердечно-сосудистые заболевания, коморбидные пациенты, лечение, лозартан.
Медицинские новости. – 2021. – №10. – С. 33–38.
Summary. Cardiovascular diseases and their complications often occur in combination, making the choice of drugs difficult. Most often, in comorbid patients, arterial hypertension is detected in combination with chronic heart failure, chronic kidney disease, metabolic disorders, including type 2 diabetes mellitus. The development of myocardial hypertrophy and remodeling predispose to the occurrence of cardiac arrhythmias, sudden cardiac death, damage to the vascular wall to the formation of aneurysms, vascular ruptures, and the progression of atherosclerosis. The drug chosen for antihypertensive therapy influences the course and progression of other diseases. In the class of antihypertensive drugs, the angiotensin II receptor blocker losartan is one of the most studied and is used in chronic heart failure, chronic kidney disease, metabolic disorders to slow the progression of pathological changes and improve the prognosis of patients’ life.
Keywords: cardiovascular diseases, comorbid patients, treatment, losartan.
Meditsinskie novosti. – 2021. – N10. – P. 33–38.
В большинстве экономически развитых стран у взрослого населения в структуре неинфекционной патологии основное место среди причин потери трудоспособности и прежде-временной смерти занимают сердечно-сосудистые заболевания. К основным причинам смерти относятся осложнения, развивающиеся при артериальной гипертензии (АГ), ишемической болезни сердца (ИБС), хронической сердечной недостаточности. Наличие двух и более сердечно-сосудистых заболеваний и патологических состояний у одного человека рассматривается как сердечно-сосудистая коморбидность [1]. Развитие нескольких сердечно-сосудистых заболеваний и их осложнений у одного пациента обусловливает трудности в выборе лекарственных препаратов, увеличивает риск возникновения полипрагмазии и неблагоприятного прогноза жизни [2].
По данным Российских регистров сердечно-сосудистых заболеваний, в амбулаторной практике сердечно-сосудистую коморбидность определяют в 78% случаев обращений, доля лиц с АГ среди них составляет более 90% [3]. Вместе с тем, недостаточный контроль уровня артериального давления (АД) остается актуальной проблемой. Так, по данным США, 45,5% пациентов с АГ, получающих антигипертензивную терапию, не достигают целевого уровня АД (менее 140/90 мм рт. ст.), в России в 78,5% случаев леченных пациентов с АГ контроль АД остается неэффективным [4, 5]. В связи с этим немаловажное значение для лечения комбинации заболеваний и предупреждения осложнений имеет выбор антигипертензивного препарата, одного из пяти основных классов рекомендованных для лечения АГ: ингибиторы АПФ, блокаторы рецепторов ангиотензина II (БРА), блокаторы медленных кальциевых каналов, ?-адреноблокаторы, диуретики. Участие ренин-ангиотензин-альдостероновой системы (РААС) в развитии АГ, как одной из основных систем, регулирующих функциональное состояние сердца и сосудов, определяющая роль в гомеостазе сердечно-сосудистой системы и развитии сердечно-сосудистых заболеваний обусловливает первоочередное применение классов ингибиторов АПФ и БРА. Лозартан – селективный непептидный антагонист рецепторов ангиотензина II, применяют в лечении многих сердечно-сосудистых заболеваний, включая АГ.
Механизмы действия и фармакологические свойства лозартана
После приема per os лозартан подвергается в печени метаболизму с участием изофермента цитохрома P450 и преобразуется в активный метаболит – производное гидроксилированной карбоновой кислоты EXP3174, который в 10–20 раз мощнее и имеет более продолжительное действие, чем лозартан [6]. Метаболит EXP3174 является селективным антагонистом АТ1-рецепторов ангиотензина II, блокирует усиление активности индуцированных ангиотензином II ангиотензиногена и ренина, обусловливающих вазоконстрикцию, снижение почечного кровотока, повышение синтеза эндотелина-1, пролиферацию гладкомышечных клеток сосудов, гипертрофию миокарда и индуцирование аритмий, усиление высвобождения адреналина, стимуляцию высвобождения вазопрессина, альдостерона, ингибитора активатора плазминогена-1 [7].
Второй метаболит EXP3179 не блокирует АТ1-рецепторы, но подавляет экспрессию эндотелиальной циклооксигеназы COX-2, тем самым оказывая противовоспалительное действие. Метаболит EXP3179 блокирует также ICAM-1 и синтез COX-зависимого тромбоксана А2, опосредованно активирует PPAR-? (peroxisome proliferator-activated receptor-?) – центрального регулятора метаболизма инсулина и глюкозы, повышающего чувствительность тканей к инсулину, что инициирует антитромботическое и противодиабетическое действие лозартана [8] (рисунок).
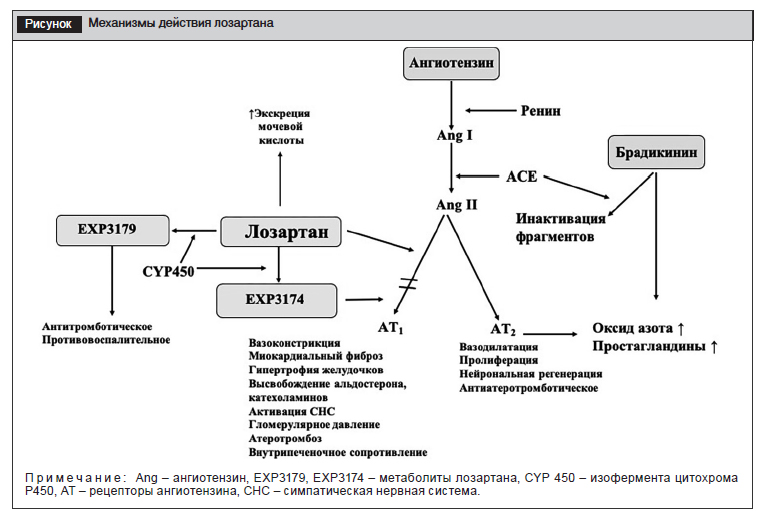
Лозартан является высокоселективным препаратом, избирательно блокирующим АТ1-рецепторы и, возможно, оказывающим стимулирующее действие на АТ2-рецепторы. Блокада РААС системного кровотока лозартаном, сопровождающаяся краткосрочным эффектом, дополняется блокадой тканевой или локальной РААС различных органов (интерстициальной и внутриклеточной в сердце, почках, головном мозге, кровеносных сосудах), обусловливающей долговременные эффекты и органопротекцию [9, 10]. Большинство физиологических эффектов ангиотензина II, в том числе неблагоприятных (артериальная вазоконстрикция, секреция альдостерона корой надпочечников, вазопрессина, эндотелина-1, высвобождение ренина, пролиферация гладкомышечных клеток сосудов, гипертрофия кардиомиоцитов), опосредуется АТ1-рецепторами [10].
Физиологическая роль рецепторов АТ2 обусловлена наибольшей экспрессией в клетках сердца, сосудов, надпочечников, почек, репродуктивных органов. Установлено участие АТ2-рецепторов в регуляции программированной гибели клеток, процессах пролиферации, дифференцировки клеток [7]. Усиление активности АТ2-рецепторов под влиянием лозартана сопровождается вазодилатацией, увеличением диуреза и натрийуреза, предупреждением пролиферации фибробластов, пролиферации и миграции эндотелиальных, гладкомышечных и мезангеальных клеток. Стимуляция АТ2-рецепторов предупреждает гипертрофию кардиомиоцитов, стимулирует апоптоз клеток, способствует высвобождению в стенках сосудов оксида азота, простациклина, эндотелиального фактора гиперполяризации [10]. В исследованиях показано, что повышение активности АТ2-рецепторов при инсульте обусловливает нейропротективный эффект, проявляющийся в уменьшении зоны поражения головного мозга, улучшении восстановления когнитивной функции, за счет улучшения кровотока и уменьшения окислительного стресса, не зависящих от снижения АД [11].
Таким образом, при многих заболеваниях сердечно-сосудистой системы и их комбинации фармакологические свойства лозартана, реализованные в клинической практике, способствуют эффективному лечению коморбидных пациентов.
Артериальная гипертензия
Согласно результатам исследований и разработанным на их основании рекомендациям, БРА, так же, как и ингибиторы АПФ, являются препаратами выбора для лечения АГ – основного фактора риска развития сердечно-сосудистых заболеваний. Установлено, что при повышении уровня АД на 20/10 мм рт. ст. выше 115/70 мм рт. ст. удваивается риск возникновения сердечно-сосудистых осложнений [12]. Результаты многочисленных плацебо-контролируемых исследований показали, что эффективное лечение АГ связано со снижением риска развития сердечно-сосудистых событий.
В одном из первых двойных слепых многоцентровых рандомизированных исследований LIFE (Losartan Intervention For Endpoint reduction in hypertension), продолжавшемся в течение 5 лет, получены доказательства эффективности и безопасности лозартана. В исследовании участвовали более 9000 пациентов в возрасте 55–80 лет (средний возраст – 66,9 года) с АГ, ранее леченной или нелеченной, и признаками гипертрофии левого желудочка, выявленными по стандартной электрокардиограмме (ЭКГ). Среди исследованных преобладали женщины (54,1%), у большинства определяли повышенную массу тела, сахарный диабет 2-го типа. Пациентов рандомизировали на две группы, одна из которых получала лозартан, вторая – ?-адреноблокатор атенолол.
На фоне лечения лозартаном в течение 4,8 года в средней дозе 82 мг/сутки или атенолола 79 мг/сутки отметили сопоставимое снижение АД и хорошую переносимость БРА. Результаты исследования показали, что лозартан при длительном применении снижает риск возникновения сердечно-сосудистых осложнений на 13%, новых случаев сахарного диабета – на 25%, по сравнению с результатами группы, получавшей атенолол. Выраженное протективное действие лозартана отмечено у пациентов с АГ и сахарным диабетом, у которых комбинированный риск развития сердечно-сосудистых осложнений снизился на 24%, общая смертность – на 39% [13].
Исследование LIFE продемонстрировало преимущество лозартана по сравнению с атенололом в профилактике инсульта, фибрилляции предсердий, снижении уровня мочевой кислоты в сыворотке крови, предупреждении развития впервые диагностированного сахарного диабета. На фоне лечения лозартаном отмечали снижение АД и уменьшение его вариабельности в краткосрочном и долгосрочном периодах лечения.
Ремоделирование сердца и
предотвращение развития фиброза
Влияние лозартана на сердце проявлялось замедлением прогрессирования поражения или уменьшением ремоделирования левого желудочка. Известно, что гипертрофия кардиомиоцитов и интерстициальное ремоделирование, обусловливающие гиперплазию и трансформацию фибробластов, а также ремоделирование внеклеточного матрикса приводят к гипертрофии желудочков. В экспериментальных исследованиях доказано ингибирующее влияние лозартана на гипертрофию миоцитов, вызванную ангиотензином II в условиях перегрузки давлением, объемом, ишемии миокарда и при сахарном диабете [15]. Действие лозартана на гипертрофию кардиомиоцитов объясняют также блокированием рецепторов АТ1 посредством паракринного механизма [16]. Установлено, что на фоне лозартана наблюдается снижение выделения эндотелина-1, интерлейкина-6 из миофибробластов, индуцирующих гипертрофию кардиомиоцитов [17]. Лозартан, блокируя рецепторы ангиотензина I, уменьшает патологические изменения в миокарде в виде снижения синтеза белков внеклеточного матрикса (фибронектин, коллаген I, III типов, ламинин, интегрин), а также нарушение соотношения между матричными металлопротеиназами и тканевыми ингибиторами, оказывает антифибротическое действие [18, 19]. Известно, что трансформирующий фактор роста ? (TGF -?) является медиатором профибротических сигналов и раннее влияние на его сигнальные пути лозартаном приводит к уменьшению фиброза независимо от снижения АД [20, 21]. Таким образом, лозартан действует на тканевую внутрисердечную РААС, уменьшая степень выраженности гипертрофии миокарда и фиброза левого желудочка.
Известно, что независимо от других факторов риска гипертрофия левого желудочка в 2–4 раза повышает риск развития неблагоприятных сердечно-сосудистых событий [22, 23]. В клинической практике доказан положительный эффект лозартана на степень выраженности гипертрофии и фиброза левого желудочка, что особенно важно для предупреждения возникновения электрической нестабильности миокарда и аритмий, внезапной сердечной смерти, инсульта, сердечной недостаточности и ишемии/некроза миокарда.
По мнению R.B. Devereux и соавт., пятилетнее наблюдение за пациентами с АГ и гипертрофией левого желудочка, получавшими лозартан или лозартан в комбинации с гидрохлортиазидом, показало большее снижение индекса массы миокарда левого желудочка по результатам ЭКГ и эхокардиографического исследования, обратное ремоделирование миокарда с меньшим увеличением внутреннего диаметра левого желудочка по сравнению с пациентами, получавшими атенолол [22].
C. Moroni и соавт. выполнили трехлетнее наблюдение с анализом результатов эхокардиографического исследования за пациентами с АГ и гипертрофией левого желудочка, получавших лозартан 100 мг/сутки [23]. В течение 8 лет до включения в исследование пациенты получали другие антигипертензивные препараты без эффективного снижения массы миокарда [23]. Через 6 месяцев лечения лозартаном отметили достоверное снижение среднего значения индекса массы миокарда, на протяжении трехлетнего наблюдения – прогрессивное снижение показателя. К концу третьего года лечения отметили достоверное снижение индекса массы миокарда левого желудочка (125,3±18 против 170,5±22,3 кг/м2 исходно; p<0,001) и улучшение диастолической функции левого желудочка.
В группе пациентов, не получавших лозартан, несмотря на одинаковое снижение АД (140/90 мм рт. ст.), значимого снижения показателя индекса массы миокарда и улучшения диастолической функции левого желудочка не наблюдали.
В исследовании EDEN (The Effect of Losartan plus Hydrochlortiazide Combination on Therapy on Left Ventricular Diastolic Function in Patient with Hypertension) при применении лозартана в комбинации с гидрохлортиазидом в течение 24 недель отметили улучшение показателей диастолической функции левого желудочка, динамика которых подтверждалась снижением уровня мозгового натрийуретического пептида – маркера сердечной недостаточности [24]. Результаты исследования показали, что на фоне лечения достоверно уменьшается показатель объема левого предсердия, увеличение которого влияет на частоту развития фибрилляции предсердий.
Таким образом, в исследовании получены доказательства влияния лозартана на тканевую РААС, отмечено уменьшение выраженности гипертрофии и диастолической дисфункции левого желудочка, уменьшение объема левого предсердия независимо от гемодинамических эффектов.
В пилотном исследовании оценили влияние комбинации лозартана (100 мг/сутки) с необходимым лечением другими препаратами в течение года на изменение степени фиброза и массы миокарда левого желудочка пациентов с необструктивной гипертрофической кардиомиопатией по результатам магнитно-резонансной томографии [19]. По окончании срока наблюдения выявили количественное снижение фиброза в группе лозартана (-23±45%; р<0,03) и массы миокарда (-5 [-11–0,9] %), по сравнению с группой не получавших лозартан (5 [-4–+21] %). Результаты исследования подтвердили возможность блокатора рецепторов ангиотензина II лозартана уменьшать развитие фиброза миокарда.
В другом исследовании у пациентов с АГ, получавших в течение года лозартан, оценивали связь содержания коллагена в миокарде с жесткостью миокарда левого желудочка [25]. Сравнительные результаты эндомиокардиальной биоп-сии межжелудочковой перегородки с количественной оценкой объемной фракции коллагена и эхокардиографического исследования с определением замедления ранней волны митрального наполнения демонстрировали способность лозартана замедлять развитие фиброза и снижать жесткость миокарда у пациентов при АГ.
Хроническая сердечная
недостаточность
Подавления гиперактивности нейрогуморальных систем – РААС и симпатического отдела вегетативной нервной системы, при хронической сердечной недостаточности достигают, применяя ингибиторы АПФ, в случае непереносимости которых и/или наличия противопоказаний, заменяют на БРА. Лозартан, помимо блокирования эффектов ангиотензина II, опосредованных рецепторами АТ1 надпочечников и сосудов, взаимодействует с пресинаптическими рецепторами норадренергических нейронов, препятствуя высвобождению норадреналина в пресинаптическую щель [7]. В результате взаимодействия уменьшается системная вазоконстрикция, снижается общее периферическое сосудистое сопротивление, развиваются натрий- и диуретические эффекты.
В новых Рекомендациях по диагностике и лечению хронической сердечной недостаточности Европейского общества кардиологов (ESC), опубликованных в августе 2021 года, БРА сохраняют те же позиции, что ранее, их применяют в случае непереносимости ингибиторов АПФ в лечении пациентов со сниженной (<40%) фракцией выброса левого желудочка (класс I уровень доказательности В).
В случае умеренно сниженной (41–49%) фракции выброса левого желудочка БРА рекомендуют для уменьшения частоты госпитализаций по поводу обострения хронической сердечной недостаточности или смерти (класс IIb уровень доказательности С). При хронической сердечной недостаточности с сохраненной (≥50%) фракцией выброса левого желудочка, выявляемой часто в пожилом возрасте у женщин, леченных в связи с имеющимися заболеваниями сердечно-сосудистой системы, рекомендаций по применению конкретных классов препаратов не разработано. Лечебную тактику в этом случае выбирають зависимости от этиологии заболеваний и их комбинаций, особенностей течения и наличия осложнений [26].
В мета-анализе 6 рандомизированных двойных слепых клинических исследований, включавших около 2000 пациентов с хронической сердечной недостаточностью с систолической дисфункцией левого желудочка (фракция выброса 23–31%), получавших лозартан (25–50 мг/сутки), доказано снижение смертности по сравнению с применением плацебо (1,8% против 4,7%; р=0,014) [27]. Исследователи отметили на фоне применения лозартана улучшение клинических симптомов и снижение частоты госпитализаций по поводу сердечной недостаточности.
Дальнейшие исследования показали, что эффект лозартана при хронической сердечной недостаточности зависит от применяемой дозы препарата. H. Svanström и соавт. на основании изучения датского регистра за 1998–2008 годы, включающего около 5000 пациентов старше 45 лет, находившихся впервые на лечении в стационарах по поводу хронической сердечной недостаточности, отметил дозозависимый эффект лозартана. Применение 100 мг/сутки лозартана у лиц с хронической сердечной недостаточностью по сравнению с меньшей дозой препарата сопровож-далось достоверным снижением общей смертности [28].
С целью изучения связи между дозой БРА и клиническими исходами в двойном слепом рандомизированном исследовании сравнили эффективность лечения низкими (50 мг/сутки) и высокими (150 мг/сутки) дозами БРА пациентов с хронической сердечной недостаточностью [29, 30]. В исследовании участвовали пациенты из 30 стран с хронической сердечной недостаточностью II–IV функциональных классов и фракцией выброса <40% с непереносимостью ингибиторов АПФ. При 4,7-летнем наблюдении отметили большую эффективность лозартана в дозе 150 мг/сутки в отношении снижения уровня смертности или частоты госпитализации пациентов с хронической сердечной недостаточностью [29]. Результаты исследования свидетельствовали о необходимости титрации дозы лозартана для достижения целей лечения пациентов с хронической сердечной недостаточностью.
Хроническая болезнь почек
Дисфункция почек при АГ появляется в связи с поражением почечных клубочков из-за повышения активности РААС и сопровождается развитием нефропатии и хронической почечной недостаточности. Признаки хронической болезни почек определяют в 1/3 случаев хронической сердечной недостаточности, снижение функции почек при наличии сердечно-сосудистой патологии – в 26% [31].
К причинам развития хронической болезни почек относится повышение активности тканевой РААС, в том числе локально в почках. Ангиотензин II вызывает эндотелиальную дисфункцию путем сложного взаимодействия, включающего в себя повышенную активность NADPH-оксидазы и производство супер-оксидов, дисфункцию эндотелиальной синтазы оксида азота и инактивацию киназ, регулируемых внеклеточными сигналами. Вследствие этого возникает вазоконстрикция в эфферентных артериолах почек, обусловливающая повышение внутриклубочкового давления и протеинурию. Помимо того, ангио-тензин II индуцирует пролиферацию и миграцию гладкомышечных клеток сосудов. Таким образом, ингибирование активности РААС относится к основной цели защиты органа при хронической болезни почек.
Применение лозартана обусловливает антигипертензивное, антипротеинурическое действие, отсроченные негемодинамические эффекты, в результате снижения почечной экспрессии TGF -? и других цитокинов, антиатерогенные эффекты в результате снижения уровня циркулирующих молекул адгезии. БРА обеспечивают ренопротективный эффект вследствие полной и селективной блокады РААС при сохранении функции АТ2-рецепторов, оказывающих дополнительное органопротективное действие [7]. Установлено, что блокаторы РААС более эффективны в снижении альбуминурии, чем другие антигипертензивные препараты, и показаны пациентам с АГ при наличии микроальбуминурии или явнои? протеинурии. Органопротективное влияние лозартана способствует предупреждению возникновения и прогрессирования дисфункции почек при АГ и сахарном диабете.
В рандомизированном исследовании RENAAL (Reduction of Endpoints in NIDDM with the AII Antagonist Losartan) участвовали 1513 пациентов с АГ, сахарным диабетом 2-го типа и хронической болезнью почек [32]. В результате применения комбинации лозартана (71% пациентов принимали 100 мг/сутки) с проводимой антигипертензивной терапией снизился риск удвоения уровня сывороточного креатинина на 25% (р=0,006), вероятность развития терминальной почечной недостаточности на 28% (р=0,002). К тому же у пациентов, получавших лозартан, на 35% уменьшилась степень выраженности протеинурии. Степень снижения АД не различалась с результатами группы контроля, получавших антигипертензивную терапию без лозартана, и не влияла на нефропротективный эффект. Исследователи отметили уменьшение оксидативного стресса и улучшение эндотелиальной функции в группе пациентов с сахарным диабетом 2-го типа, получавших лозартан.
В другом рандомизированном слепом исследовании ROAD (Renoprotection of Optimal Antiproteinuric Doses) в течение 3,7 года оценивали влияние стандартной и высокой дозы лозартана на функцию почек у пациентов (в возрасте 18–70 лет) с хронической болезнью почек. Пациенты до включения в исследование в течение не менее 6 лет не получали ингибиторы АПФ или БРА. Критериями включения считали уровень креатинина в сыворотке крови от 133 до 442 мкмоль/л и клиренс креатинина от 20 до 70 мл/мин. К причинам развития хронической болезни почек относилась инфекция мочевыводящих путей или хроническая сердечная недостаточность III или IV функционального класса (NYHA).
Применение лозартана в дозе 100 мг/сутки позволило снизить протеинурию у 57%, в дозе 150 мг/сутки – у 14%, 200 мг – у 11% пациентов. Средняя доза лозартана составила 117,7 мг/сутки. Титрация дозы лозартана по сравнению с обычными дозами, применяемыми при АГ, позволила снизить риск первичной конечной точки – время до удвоения сывороточного креатина, развитие терминальной почечной недостаточности или смерть, при сопоставимом с группой контроля снижении АД [33].
Результаты наблюдений свидетельствовали о замедлении прогрессирования хронической почечной недостаточности под влиянием лозартана при наличии или отсутствии сахарного диабета. Снижение протеинурии, замедление снижения клиренса креатинина и развития терминальной почечной недостаточности, наблюдаемые в группе с титрованием дозы лозартана, свидетельствуют о долгосрочной защите почек при выбранной стратегии.
Метаболический синдром
Тесная связь сердечно-сосудистых заболеваний, дисфункции почек и метаболических нарушений доказана во многих исследованиях. К патогенетическим механизмам развития комбинации поражения сердечно-сосудистой системы и почек при метаболическом синдроме относится инсулинорезистентность и гиперинсулинемия, повышение активности РААС и симпатического отдела вегетативной нервной системы, гиперурикемия, стойкая эндотелиальная дисфункция, обусловливающая вазоконстрикцию и тромбогенез [34]. Свойства лозартана снижать уровень мочевой кислоты в сыворотке крови, уменьшать инсулинорезистентность тканей обосновывают выбор препарата при метаболических нарушениях.
В исследовании LIFE доказано снижение риска развития новых случаев сахарного диабета 2-го типа в группе пациентов, получавших лозартан [13]. Свойства БРА стимулировать рецепторы PPAR-? клеток жировой, мышечной ткани и гепатоцитов обусловливает положительные изменения липидограммы: снижение уровня общего холестерина, триглицеридов, холестерина липопротеидов низкой плотности, повышение уровня липопротеидов высокой плотности [35].
Уменьшение реабсорбции мочевой кислоты в проксимальных канальцах способствует гиперурикемическому эффекту лозартана. Это свойство препарата приводит к увеличению экскреции мочевой кислоты и снижению ее уровня в сыворотке крови, не меняющееся в случае комбинации с диуретиками, которые вызывают повышение ее концентрации [6].
Заключение
Повышение активности тканевой РААС в сердце, сосудах, почках и других органах играет решающую роль в развитии коморбидности при многих сердечно-сосудистых заболеваниях и их осложнениях. Лозартан является одним из препаратов, ингибирующих РААС, обеспечивающих своими фармакологическими свойствами профилактику и лечение многих сердечно-сосудистых заболеваний. Селективная блокада АТ1-рецепторов лозартаном способствует снижению АД, предупреждению и регрессу гипертрофии и ремоделирования миокарда, предотвращает развитие фиброза в миокарде и почках. Лозартан предупреждает сосудистое ремоделирование, улучшая функцию эндотелия, и проявляет противовоспалительные и антитромботические свойства, препятствуя прогрессированию атеротромбоза.
На фармацевтическом рынке Респуб-лики Беларусь востребованы различные дозы препаратов лозартана «Сентор» и фиксированная комбинация лозартана с гидрохлортиазидом «Ко-Сентор» (ОАО «Гедеон Рихтер», Венгрия), эффективных и безопасных лекарственных средств. Показаниями к назначению препаратов являются артериальная гипертензия, хроническая сердечная недостаточность со сниженной фракцией выброса левого желудочка, хроническая болезнь почек, снижение риска инсульта при артериальной гипертензии в сочетании с гипертрофией левого желудочка. Эффективность Сентора и Ко-Сентора доказана при органных нарушениях и функциональных расстройствах, вызванных ими, обусловленных сердечно-сосудистыми заболеваниями: гипертрофия, фиброз миокарда, пароксизмальная фибрилляция предсердий, микроальбуминурия и протеинурия, диабетическая нефропатия, гиперурикемия и подагра с АГ, снижение цереброваскулярного кровотока и когнитивные нарушения.
Химическая структура лозартана обеспечивает уникальные фармакологические и фармакокинетические особенности препарата, безопасность долгосрочного использования и эффективное применение в разных клинических ситуациях у коморбидных пациентов с сердечно-сосудистыми заболеваниями.
Л И Т Е Р А Т У Р А
1. Budekke J., Bots M.L., van Dis I., et al. Comorbidity in patients with cardiovascular disease in primary care: a cohort study with routine healthcare data // Br. J. Gen. Pract. – 2019. – Vol.69, N683. – e398-e406. doi: 10.3399/bjgp19X702725
2. Barnett K., Mercer S.W., Norbury M., et al. Epidemiology of multimorbidity and implications for health care, research, and medical education: a cross-sectional study // Lancet. – 2012. – Vol.380, N9836. – P.37–43. doi:10.1016/S0140-6736(12)60240-2
3. Андреенко Е.Ю., Лукьянов М.М., Якушин С.С. и др. Ранняя кардиоваскулярная мультиморбидность в амбулаторнои? и госпитальной практике: возрастные характеристики и медикаментозное лечение пациентов (данные регистров РЕКВАЗА и РЕКВАЗА-КЛИНИКА) // Кардиоваскулярная терапия и профилактика. – 2020. – Vol.19, N5. – P.2672. doi:10.15829/1728–8800–2020–2672
4. Wolf-Maier K., Cooper R.S., Kramer H., et al. Hypertension Treatment and Control in Five European Countries, Canada, and the United States // Hypertension. – 2004. – Vol.43, N1. – P.10–17. doi:10.1161/01.HYP.0000103630.72812.10
5. Остроумова О.Д., Бондарец О.В., Копченов И.И. и др. От выбора антигипертензивного препарата – к выбору фиксированных комбинации? антигипертензивных препаратов: смена парадигм // Системные гипертензии. – 2015. – №12(4). – С.23–29.
6. Sica D.A., Gehr T.W., Ghosh S. Clinical pharmacokinetics of losartan // Clin. Pharmacokinet. – 2005. – Vol.44, N8. – P.797–814. doi:10.2165/00003088-200544080-00003
7. Ramasubbi K., Mann D.L., Deswal A. Anti-angiotensin therapy: new perspectives // Cardiol. Clin. – 2007. – Vol.25, N4. – P.573–580. doi:10.1016/j.ccl.2007.09.003
8. Rossi G.P. Losartan Metabolite EXP3179. An AT1-Receptor-Independent Treatment Strategy for Patients with the Metabolic Syndrome? // Hypertension. – 2009. – Vol.54, N4. – P.710–712. doi:10.1161/HYPERTENSIONAHA.109.138883
9. Iwanami J., Mogi M., Iwai M., et al. Inhibition of the renin-angiotensin system and target organ protection // Hypertension Research. – 2009. – Vol.32, N4. – P.229–237.
10. De Casparo M., Catt K.J., Inagami T., et al. international union of pharmacology. XXIII. The angiotensin II receptors // Pharmacol. Rev. – 2000. – Vol.52, N3. – P.415–472.
11. Wright J.V., Harding J.W.Brain renin-angiotensin – A new look at an old system // Progress Neurobiology. – 2011. – Vol.95, N1. – P.49–67. doi:10.1016/jpneurobio.2011.07001
12. Lewington S., Clarke R., Qizilbash N., et al. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies // Lancet. – 2002. – Vol.360. – P.1903–1913. doi: 10.1016/S0140-6736(02)11911-8
13. Dahlöf B., Devereux R.D., Kjeldsen S.E., et al. Cardiovascular morbidity and mortality in the Losartan Intervention for Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol // Lancet. – 2002. – Vol.359. – P.995–1003.
14. Serneri G.G., Boddi M., Cecioni I., et al. Cardiac angiotensin II formation in the clinical course of heart failure and its relationship with left ventricular function // Circ. Res. – 2001. – Vol.88, N9. – P.961–968. doi:10.1161/hh0901.089882
15. Makino M., Sugano M., Otsuka S., et al. Molecular mechanism of angiotensin II type I and type II receptors in cardiac hypertrophy of spontaneously hypertensive rats // Hypertension. – 1997. – Vol.30, N4. – P.796–802. doi: 10.1161/01.hyp.30.4.796
16. Everett A.D., Tufro-McReddie A., Fisher A., et al. Angiotensin receptor regulates cardiac hypertrophy and transforming growth factor-beta 1 expression // Hypertension. – 1994. – Vol.23, N5. – P.587–592. doi: 10.1161/01.hyp.23.5.587
17. Gray M.O., Long C.S., Kalinyak J.E., et al. Angiotensin II stimulates cardiac myocyte hypertrophy via paracrine release of TGF-beta 1 and endothelin-1 from fibroblasts // Cardiovasc. Res. – 1998. – Vol.40, N2. – P.352–363. doi:10.1016/s0008-6363(98)00121-7
18. Dostal D.E. Regulation of cardiac collagen: angiotensin and cross-talk with local growth factors // Hypertension. – 2001. – Vol.37, N3. – P.841–844. doi:10.1161/01.hyp.37.3.841
19. Shimada Y.J., Passeri J.J., Baggish A.L., et al. Effects of Losartan on Left Ventricular Hypertrophy and Fibrosis in Patients With Nonobstructive Hypertrophic Cardiomyopathy // J. Am. Coll. Cardiol. Heart Fail. – 2013. – Vol.6, N1. – P.480–487. doi:10.1016/j.jchf.2013.09.001
20. Cho N., Razipour S.E., VcCain M.L. Featured Article: TGF-?1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts // Exp. Biol. Med. – 2018. – Vol.243, N7. – P.601–612. doi:10.1177/1535370218761628
21. Bikkina M., Levy D., Evans J.C., et al. Left ventricular mass and the risk of stroke in an elderly cohort: the Framingham study // JAMA. – 1994. – Vol.272. – P.33–36.
22. Devereux R.B., Dahlöf B., Gerdts E., et al. Regression of Hypertensive Left Ventricular Hypertrophy by Losartan Compared With Atenolol // Circulation. – 2004. – Vol.110. – P.1456–1462. doi:10.1161/01.CIR.0000141573.44737.5A
23. Moroni C., Tolone S., Lopreiato F., et al. Effects of losartan on left ventricular mass: a three-year follow-up in elderly hypertensives with myocardial hypertrophy despite successful conventional antihypertensive treatment // Eur. Rev. Med. Pharmacol. Sci. – 2017. – Vol.21, N6. – P.1323–1328.
24. Little W.C., Zile M.R., Klein A., et al. Effect of losartan and hydrochlorothiazide on exercise tolerance in exertional hypertension and left ventricular diastolic dysfunction // Am. J. Cardiol. – 2006. – Vol.98, N3. – P.383–385. doi:10.1016/j.amjcard.2006.01.106
25. Diez J., Querejeta R., Lopez B., et al. Losartan-dependent regression of myocardial fibrosis is associated with reduction of left ventricular chamber stiffness in hypertensive patients // Circulation. – 2002. – Vol.105, N21. – P.2512–2517.
26. McDonagh T.M., Metra M., Adamo M., et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure // European Heart Journal. – 2021. – Vol.42, N36. – P.3599–3726. doi:10.1093/eurheartj/ehab368
27. Sharma D., Buyse M., Pitt B., et al. Meta-analysis of observed mortality data from all controlled, double-blind multiple-dose studies of losartan in heart failure // Am. J. Cardiol. – 2000. – Vol.85, N2. – P.187–192. doi:10.1016/S0002-9149(99)00646-3
28. Svanström H., Pasternak B., Hviid A. Association of treatment with losartan vs candesartan and mortality among patients with heart failure // JAMA. – 2012. – Vol.307, N14. – P.1506–1512. doi:10.1001/jama.2012.452
29. Konstam M.A., Neaton J.D., Dickstein K., et al. Effects of high-dose versus low-dose losartan on clinical outcomes in patients with heart failure (HEAAL study): a randomised, double-blind trial // Lancet. – 2009. – Vol.374(9704). – P.1840–1848. doi:1016/S0140-6736(09)61913-9
30. Pitt B., Poole-Wilson P., Segal R., et al. Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomized trial – the Losartan Heart Failure Survival Study ELITE II // Lancet. – 2000. – Vol.355. – P.1582–1587.
31. Смирнов А.В., Добронравов В.А., Каюков И.Г. и др. Эпидемиология и социально-экономические аспекты хроническои? болезни почек // Нефрология. – 2006. – №10 (1). – С.7–13. doi:10.24884/1561-6274-2006-10-1-7-13
32. Shahinfar S., Lyle P.A., Zhang Z., et al. Losartan: lessons learned from the RENAAL study // Expert Opin. Pharmacother. – 2006. – Vol.7, N5. – P.623–630. doi:10.1517/14656566.7.5.623
33. Hou F.F., Zhang D.X.X., Chen P.Y., et al. Renoprotection of Optimal Antiproteinuric Doses (ROAD) Study: A Randomized Controlled Study of Benazepril and Losartan in Chronic Renal Insufficiency // JASN. – 2007. – Vol.18, N6. – P.1889–1898. doi:10.1681/ASN.2006121372
34. Wilson P.W.F., D’Agostino R.B.D., Parise H., et al. Metabolic syndrome as a precursor of cardiovascular disease and type 2 diabetes mellitus // Circulation. – 2005. – Vol.112, N20. – P.3066–3072. doi:10.1161/CIRCULATIONAHA.105.539528
35. Xu F., Mao C., Hu Y., et al. Cardiovascular Effects of Losartan and Its Relevant Clinical Application // Curr. Med. Chem. –2009. – Vol.16, N29. – P.3841–3857. doi:10.2174/09298670989178046
Медицинские новости. – 2021. – №10. – С. 33-38.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.