Внимание! Статья адресована врачам-специалистам
Sadirova Sh.S.
Research Institute of Virology, Tashkent, Uzbekistan
Diagnostic value of rapid testing for HBV and HCV on the results of the screening of residents of Tashkent city
Резюме. По данным ВОЗ, ежегодно почти 700 000 человек умирают от неблагоприятных исходов хронического гепатита С и около 1 млн человек – от исходов хронического гепатита В. При этом менее 30% инфицированных вирусами гепатита В и С знают о своем заболевании, что побудило ВОЗ разработать Глобальную стратегию по вирусным гепатитам. Полученные нами результаты по изучению диагностической чувствительности и специфичности экспресс-тестов на HBsAg и анти-HCV показало, что они обладают достаточной чувствительностью – 100% и специфичностью – 94,2% и 93,2% соответственно, высокой прогностической ценностью отрицательного результата – 100%, что позволяет использовать их для скрининг-диагностики парентеральных гепатитов.
Ключевые слова: вирусный гепатит В, вирусный гепатит С, скрининг, диагностическая эффективность экспресс-тестирования.
Медицинские новости. – 2021. – №12. – С. 83–87.
Summary. According to WHO data, almost 700 000 people die annually from adverse outcomes of HCV and about 1 million people die from HВV outcomes. While less than 30% of those infected with HBV and HCV are aware of their disease, which prompted WHO to develop a Global Strategy for Viral Hepatitis. The results obtained by us on the study of the diagnostic sensitivity and specificity of rapid tests for HBsAg and anti-HCV showed that they have sufficient sensitivity of 100% and specificity of 94.2% and 93.2%, respectively, and a high negative prognostic value of a result at 100%, which allows them to be used for screening diagnostics of parenteral hepatitis.
Keywords: HBV, HCV, screening, diagnostic effectiveness of rapid testing.
Meditsinskie novosti. – 2021. – N12. – P. 83–87.
В структуре инфекционной патологии вирусные гепатиты составляют 16–30%, а по частоте поражения населения уступают лишь гриппу и острым респираторным вирусным инфекциям [6]. По данным разных авторов, более 2 млрд человек в мире инфицированы вирусом гепатита В (ВГВ), у более 400 млн из них – хронический гепатит В (ХГВ); 130–250 млн человек инфицированы вирусом гепатита С (ВГС), у 175 млн из них – хронический гепатит С (ХГС) [9]. По данным ВОЗ, ежегодно почти 700 000 человек умирают от неблагоприятных исходов ХГС и около 1 млн человек – от исходов ХГВ [18]. В 2015 году смертность от ХГВ составила 887 000, в 2017 – 786 000, в целом смертность от ХГВ стоит на 10-м месте среди всех причин смерти (глобальный отчет ВОЗ по вирусным гепатитам, 2017) [18]. В России смертность от исходов ХГС увеличилась за 20 лет XXI века в 5 раз (с 0,02 случаев на 100 тыс. населения в 1999 году до 0,1 случая на 100 тыс. населения в 2017 году) [5]. Повсеместное распространение инфекции и неравномерное территориальное распределение заболеваемости, скрытое течение инфекционного процесса и высокая частота его хронизации, а также активное вовлечение в эпидемический процесс лиц репродуктивного и трудоспособного возраста определяют высокую социально-экономическую значимость парентеральных гепатитов ХГВ и ХГС [9]. По данным на 2015 год, только 9% инфицированных ВГВ и 20% инфицированных ВГС знали о своем заболевании [16]. В 2020 году за счет улучшения целенаправленной диагностики 30% людей, инфицированных ВГВ и ВГС, узнали свой статус [13]. ВОЗ планирует, чтобы к 2030 году эта цифра достигла 90% [10], но для этого необходимо внед-рение скрининг-программ по выявлению и лечению ВГВ и ВГС на государственном уровне, при поддержке Международных организаций и достаточном финансировании [3, 17].
Цель исследования – оценить диагностическую эффективность экспресс-тестирования при скрининге парентеральных гепатитов среди населения Ташкента в рамках запущенного в 2019 году в Республике Узбекистан пилотного проекта UHEP (Uzbekistan Hepatitis Еlimination Program).
Материалы и методы
Фундаментом работы послужили результаты анкетирования и обследования 61 665 жителей Ташкента (42 216 женщин и 19 449 мужчин), которые дали свое согласие на участие в исследовании. Распределение пациентов по полу выявило преобладание женщин (в 2,2 раза больше), средний возраст респондентов составил 39,7 года (95% ДИ 39,2–40,2), то есть преобладали лица женского пола молодого трудоспособного возраста. Скрининг респондентов проводился на базе Научно-исследовательского института вирусологии, а также в 13 поликлиниках Ташкента. Исследование выполнено при финансовой поддержке Center for Disease Analysis Foundation (США), скрининг-обследование респондентов было бесплатным (проведение экспресс-тестов).
Для скрининга маркера гепатита В использован экспресс-тест «AlereDetermineHBsAg 2» (AbbotDiagnostics, USA). У пациентов с положительными результатами экспресс-тестов на HBsAg проводился экспресс-тест на ВИЧ с использованием тест-систем «HIVTestCard (WB/S/Psandwich)» (InTecProductsInc. Limited, HongKong). Скрининг на маркер гепатита С выполняли экспресс-тестом на анти-HCV «HCVTestCard (WB/S/P)» (InTecProductsInc. Limited, HongKong). Подтверждающий тест на анти-HCV проведен методом иммунохемилюминесцентного анализа (ИХЛА), также выполнена качественная полимеразная цепная реакция (ПЦР) для выявления РНК ВГС и количественный ПЦР для ДНК ВГВ в режиме реального времени на анализаторе Rotor-GeneQ (QIAGEN). Подтверждающий тест на ВГС методом ИХЛА проведен путем определения HCV-cor-Ag на анализаторе ARCHITECTi2000SR (Abbot, USA) реагентами ARCHITECTHCV Ag (AbbottLaboratories, США).
Результаты и обсуждение
Как показали наши исследования, маркированных по HBsAg, определенному по экспресс-тесту, было 2718 человек. Из них слепой выборкой отобрано 248 пациентов, у которых проведен подтверждающий тест методом ПЦР (табл. 1).
Таблица 1. Оценка диагностической эффективности экспресс-теста на HBsAg
|
Результат
|
Экспресс-тест HBsAg
|
Подтверждающий тест на ВГВ ПЦР-качественно
|
|
Истинно-положительный (а), n
|
244
|
244
|
|
Ложноотрицательный (с), n
|
0
|
0
|
|
Ложноположительный (в), n
|
4
|
0
|
|
Истинно-отрицательный (д), n
|
68
|
72
|
|
Диагностическая эффективность, %
|
98,7
|
100
|
|
Чувствительность, %
|
100
|
100
|
|
Специфичность, %
|
94,2
|
100
|
|
ПЦПР
|
98,4
|
100
|
|
ПЦОР
|
100
|
100
|
Методом построения характеристических кривых была установлена диагностическая чувствительность и специфичность скрининг-теста на HBsAg в диагностике ВГВ (рис. 1).
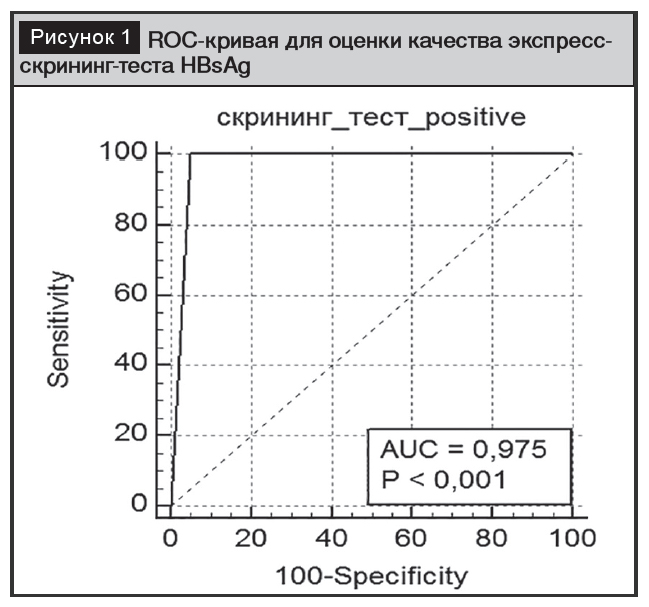
Площадь под характеристической кривой AUC составила 0,975 (95% ДИ 0,937–0,993), что характеризует тест как «отличный», с чувствительностью 100% и со специфичностью 94,2% при индексе Joden =0,95. Чувствительность, оцененная в 100%, указывает на то, что все 100% истинно инфицированных ВГВ будут обнаружены и ни один случай не будет упущен. Специфичность, оцененная в 94,2%, указывает на то, что в 5,8% случаев при использовании данного теста возможны ложноположительные результаты. Отметим, что при скрининге особенно важно не получить ложноотрицательные результаты, а ложноположительные при дальнейшем исследовании могут быть исключены из когорты инфицированных [2, 8].
Результаты ROC-анализа доказали пригодность скрининг-теста на HBsAg, так как он показал 100% чувствительность, что указывает на высокую прогностическую ценность отрицательного результата.
Нами проведено отдельное определение прогностической ценности положительного результата (ПЦПР) и прогностической ценности отрицательного результата (ПЦОР) для экспресс-теста на HBsAg для общей популяции в целом, а также в разрезе пола и для различных возрастных групп (табл. 2), поскольку прогностическая ценность сильно зависит от распространенности заболевания, то есть от когорты обследуемых лиц. При этом тест с высокой ПЦПР эффективен при обследовании когорты больных (при высокой распространенности болезни), а при обследовании-скрининге среди условно здоровых более полезен тест с высокой ПЦОР [7, 11].
Таблица 2. ПЦПР для различных возрастных групп с учетом распространенности ВГВ
|
Показатель
|
Распространенность, %
|
ПЦПР, %
|
|
В целом для ВГВ
|
4,77
|
47,2
|
|
Для мужчин
|
6,7
|
56,2
|
|
Для женщин
|
3,25
|
37,5
|
|
20–24 года
|
2,97
|
35,3
|
|
25–29 лет
|
4,06
|
43,0
|
|
30–34 года
|
5,86
|
52,6
|
|
35–39 лет
|
7,79
|
60,1
|
|
40–44 года
|
6,66
|
56,0
|
|
45–49 лет
|
4,39
|
45,1
|
|
50–54 года
|
3,25
|
37,5
|
|
55–59 лет
|
2,99
|
35,5
|
|
60–64 года
|
2,03
|
27,0
|
|
65–69 лет
|
1,69
|
23,5
|
|
70–74 года
|
1,71
|
23,7
|
|
75–79 лет
|
0,6
|
9,7
|
|
80–84 года
|
1,06
|
16,1
|
|
85–89 лет
|
3,45
|
39,0
|
В нашей работе распространенность ВГВ составила 4,77%, у мужчин – 6,7%, у женщин – 3,25%. Для рассчета мы использовали формулу:
ПЦПР=(Ч?РЗ)/[(Ч?РЗ)+(1-С)?(1-РЗ)],
где Ч – чувствительность, РЗ – распространенность заболевания, С – специ-фичность теста [4]. Наши результаты показывают, что из 100 случаев ВГВ в 47 случаях при дополнительном обследовании будет подтверждено наличие HBsAg. Тем не менее прогностическое значение отрицательного результата теста будет равно 100%, а это означает, что ни одного случая наличия HBsAg упущено не будет. Как видно из таблицы 2, прогностическая ценность положительного результата экспресс теста на HBsAg с поправкой на распространенность ВГВ выше у мужчин относительно женщин, а в разрезе возраста она была наибольшая у лиц в возрасте 35–44 лет, что дает основания для эффективного применения экспресс теста на ВГВ в первую очередь у данных пациентов.
Более того, мы рассчитали отношение правдоподобия (ОП), которое обобщает информацию о чувствительности и специфичности теста. ОП – это отношение вероятности данного результата теста у больных лиц к вероятности того же результата теста у здоровых, так как обследуемая популяция имеет важное значение. ОППР – отношение правдоподобия положительного результата, а ОПОР – отношение правдоподобия отрицательного результата. Использовали формулу:
ОППР=Ч/1-С, ОПОР=Ч/С [2].
Расшифровка: значения ОППР более 10 или ОПОР менее 0,1 позволяют вынести окончательное диагностическое решение.
Согласно нашим расчетам, для экспресс-теста на HBsAg ОППР=179, ОПОР=1,06. Это означает, что вероятность получить отрицательный результат у здоровых отличается от таковой у больных в 1,06 раза, то есть практически не отличается. Это указывает на то, что отрицательный результат теста имеет одинаковую прогностическую ценность как в когорте условно здоровых, так и среди инфицированных ВГВ; вероятность наличия болезни у пациента практически неизменна по результатам использования данного теста. Высокий ОППР=17,9 означает, что при наличии положительного результата в когорте больных вероятность болезни у них в 17,9 раза выше, чем при тестировании здоровых. Это значит, что тест может быть успешно и с более высокой эффективностью применен у лиц из групп высокого риска по ВГВ (наркоманы, заключенные тюрем, представители секс-меньшинств).
До сих пор нет четкого представления о том, какой должна быть скрининг-диагностика ВГВ – одноэтапной или двухэтапной с подтверждающим тестом. В стандарте «ThePublicHealthEnglandUKStandard» указано, что подтверждающий тест на HBsAg, проведенный на ином оборудовании с использованием нейтрализующих подтверждающих антител к HBsAg, рекомендуется, но не обязателен [11, 12]. В «NationalTestingPolicyforHepatitis B» (Австралия) указано, что подтверждающий тест на HBsAg может быть проведен, но также обязательно определение анти-HBcore- и анти-HBs-антител, что позволит судить о наличии хронического носительства и иммунизации соответственно [14, 15]. А. Fanetal (2014) рекомендуют трехэтапную модель с определением HBsAg, HBeAg и HBV-ДНК для диагностики ВГВ-инфекции. Требования к экспресс-тестам на HBsAg, используемым для скрининга, таковы: тест должен обладать клинической чувствительностью не менее 90% (95% ДИ 89–91) и клинической специфичностью – 100% (95% ДИ 99–100) [19], то есть обладать высокой прогностической ценностью отрицательного результата. Это обусловлено тем, что чувствительный тест редко «пропускает» пациентов, имеющих заболевание, а специфичный тест не дает ложноположительных результатов.
Наше исследование показало, что использование экспресс-теста на HBsAg обладает 100% чувствительностью и 94,2% специфичностью, высокой прогностической ценностью отрицательного результата – 100%, что позволяет рекомендовать его для скрининг-обследования в рамках реализации программы элиминации вирусных гепатитов.
Первичный скрининг на ВГС принято начинать с определения анти-HCV, а в случае положительного результата – проводить дальнейшее обследование, применяя подтверждающие тесты (иммуноблоттинг с вирусными белками), а также определение ПЦР-методом вирусной нагрузки РНК-HCV [20]. В нашей работе подтверждающий тест на наличие ХГС был выполнен 2 способами: ИХЛА определение HCV-cor-Ag и ПЦР-качественно. ПЦР-качественный тест выполнен 47 пациентам с положительным результатом на анти-HCV и 94 респондентам с отрицательным тестом на анти-HCV. Также определена вирусная нагрузка свободным HCV-corAg методом ИХЛА. Изучение диагностической значимости экспресс скрининг теста на анти-HCV методом построения характеристических кривых показало, что он также является надежным. Случайной выборкой было отобрано 272 пациента с положительным экспресс-тестом на анти-HCV. Также случайным образом выбраны 94 респондента с отрицательным результатом на анти-HCV. При проведении ИХЛА с определением свободного HCV-cor-Ag у 272 анти-HCV-маркированных респондентов он был выявлен у 264 (97,1%), оказался отрицательным у 8 (2,94%) пациентов. В группе респондентов с отрицательным экспресс-тестом на анти-HCV ИХЛА-определение HCV-cor-Ag дало отрицательный результат во всех случаях. Исходя из этих данных, можно полагать, что использованный для скрининга в нашем исследовании экспресс-тест на анти-HCVобладал 100% чувствительностью и 93,2% специфичностью, так как площадь под ROC-кривой составила 0,966 (95% ДИ 0,921–0,989), а это характеризует тест как «отличный» (рис. 2).
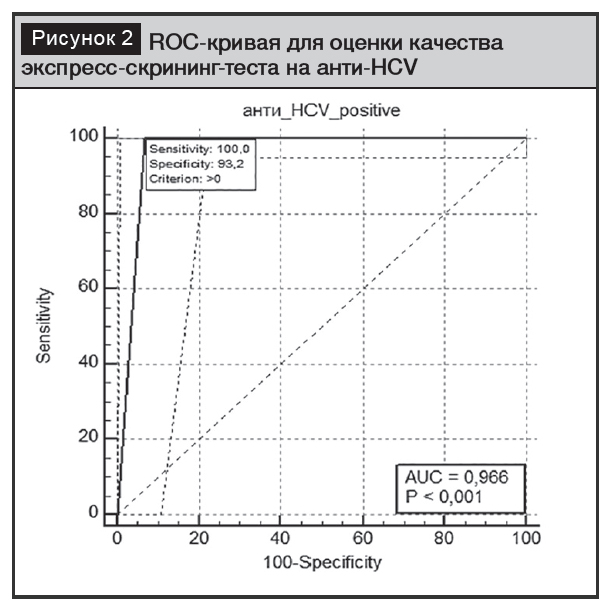
Сравнительная оценка диагностической чувствительности и специфичности различных способов тестирования на наличие НCV-инфекции показало, что, относительно золотого стандарта – метода ПЦР, наибольшей диагностической эффективностью обладает способ определения свободного антигена к ВГС (100%), а экспресс-тест на анти-HCV дает ложноположительные результаты в 6,8% случаев (табл. 3). Относительно теста для первичного скрининга это допустимо, так как при отсутствии инфицирования заболевание может быть исключено подтверждающим тестом.
Таблица 3. Сравнительная оценка диагностической эффективности экспресс- теста на анти-HCV
|
Результат
|
Экспресс-тест на анти-HCV
|
Подтверждающий тест на ВГС ИХЛА HCV-cor-Ag
|
Подтверждающий тест на ВГС – ПЦР качественный
|
|
Истинно-положительный (а), n
|
264
|
272
|
47
|
|
Ложноотрицательный (с), n
|
0
|
0
|
0
|
|
Ложноположительный (в), n
|
8
|
0
|
0
|
|
Истинно-отрицательный (д), n
|
94
|
94
|
94
|
|
Диагностическая эффективность, %
|
97,8
|
100
|
100
|
|
Чувствительность, %
|
100
|
100
|
100
|
|
Специфичность, %
|
93,2
|
100
|
100
|
|
ПЦПР
|
97,1
|
100
|
100
|
|
ПЦОР
|
100
|
100
|
100
|
Кроме того, мы рассчитали ПЦПР и ПЦОР с поправкой на распространенность заболевания, которая в целом для ВГС составила 3,9%, у мужчин – 4,4%, у женщин – 3,2% (табл. 4).
Таблица 4. ПЦПР для различных возрастных групп с учетом распространенности ВГС
|
Показатель
|
Распространенность, %
|
ПЦПР, %
|
|
В целом для ВГВ
|
3,9
|
37,4
|
|
Для мужчин
|
4,4
|
40,4
|
|
Для женщин
|
3,2
|
32,7
|
|
20–24 года
|
1,16
|
14,7
|
|
25–29 лет
|
1,47
|
18,0
|
|
30–34 года
|
2,00
|
23,1
|
|
35–39 лет
|
3,08
|
31,8
|
|
40–44 года
|
4,46
|
40,7
|
|
45–49 лет
|
5,14
|
44,3
|
|
50–54 года
|
5,41
|
45,7
|
|
55–59 лет
|
5,43
|
45,8
|
|
60–64 года
|
6,18
|
49,2
|
|
65–69 лет
|
6,96
|
52,4
|
|
70–74 года
|
6,40
|
50,1
|
|
75–79 лет
|
5,58
|
46,5
|
|
80–84 года
|
5,28
|
45,0
|
|
85–89 лет
|
5,17
|
44,5
|
|
90–94 года
|
6,67
|
51,2
|
Расчет отношения правдоподобия показал, что при использовании теста на анти-HCV ОППР составил 14,7, а ОПОР – 1,1, что указывает на высокую эффективность применения теста в когорте группы риска (у них шанс получить положительный результат в 14,7 раза выше, чем среди общей популяции), а также среди условно здоровых, поскольку вероятность получить ложноотрицательный результат одинакова как у больных, так и у здоровых.
Таким образом, полученные нами результаты по изучению диагностической чувствительности и специфичности экспресс-тестов на HBsAg и анти-HCV показало, что они обладают достаточной чувствительностью – 100% и специфичностью – 94,2% и 93,2% соответственно, высокой прогностической ценностью отрицательного результата – 100%, что позволяет использовать их для скрининг-диагностики парентеральных гепатитов.
Выводы:
1. Использование экспресс-теста на HBsAg «AlereDetermineHBsAg 2» (AbbottDiagnostics, USA) обладает 100% чувствительностью и 94,2% специфичностью, высокой прогностической ценностью отрицательного результата – 100%, диагностической эффективностью 98,7%, что позволяет рекомендовать его для скрининг-обследования в рамках реализации программы элиминации вирусных гепатитов.
2. Отношение правдоподобия для экспресс-теста на HBsAg «AlereDetermineHBsAg 2» (AbbottDiagnostics, USA) составляет для положительного результата 17,9, для отрицательного – 1,06, что указывает на равную вероятность отрицательного результата в популяциях с различной распространенностью заболевания и в 17,9 раза более высокую вероятность положительного результата в когорте с высокой распространенностью заболевания, что доказывает высокую диагностическую эффективность теста как при общем скрининге, так и у лиц из групп высокого риска.
3. Использованный для скрининга экспресс-тест на анти-HCV «HCVTestCard (WB/S/P)», (INTECPRODUCTSInc. Limited, HongKong) обладал 100% чувствительностью и 93,2% специфичностью, поскольку площадь под ROC-кривой составила 0,966 (95% ДИ 0,921–0,989), а это характеризует тест как «отличный».
4. Чувствительность и специфичность ИХЛА-метода определения HCV-coreAg сравнима с таковыми у ПЦР, составляя 100%.
5. При использовании теста на анти-HCV «HCVTestCard (WB/S/P)» (INTECPRODUCTSInc. Limited, HongKong) ОППР составил 14,7, а ОПОР – 1,1, что показывает высокую эффективность применения теста в когорте группы риска (у них шанс получить положительный результат в 14,7 раза выше, чем среди общей популяции), а также среди условно здоровых, поскольку вероятность получить ложноотрицательный результат одинакова как у больных, так и у здоровых.
Л И Т Е Р А Т У Р А
1. Ивашкин В.Т., Ющук Н.Д. Рекомендации по диагностике и лечению взрослых больных гепатитом В. – М., 2014. – 67 с.
2. Кишкун А.А. Руководство по лабораторным методам диагностики. – М.,2007. – 360 c.
3. Кравченко Н., Майстат Л., Головин С., Никелсен Т., Алиев А. Гепатиты В и С в странах Восточной Европы и Центральной Азии: эпидемия и ответные меры // Отчеты Альянса общественного здоровья. – 2019.
4. Маршал В.Дж. Клиническая биохимия (3-е издание). – СПб., 1999. – 367 с.
5. Пименов Н.Н., Комарова С.В., Карандашова И.В. и др. // Инфекционные болезни. – 2018. – Т.16, №3. – С.37–45.
6. Ющук Н.Д., Климова Е.А., Знойко О.О. и др. // Рос. журнал гастроэнтерологии, гепатологии, колопроктологии. – 2010. – №6. – С.4–60.
7. Altman D.G., Bland J.M. // BMJ. – 1994. – Vol.309 (6947). – P.102. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2540558/pdf/bmj00448-0038a.pdf
8. Burtis A., et al. Tietz Textbook of clinical chemistry, 4th ed AACC, 2008.
9. Centers for Disease Control and Prevention. Viral hepatitis surveillance. – United States, 2017. Atlanta: US Department of Health and Human Services, Centers for Disease Control and Prevention. – 2019. – Available at: https://www.cdc.gov/hepatitis/statistics/2017surveillance/index.htm
10. Assembly WHOS-NWH. Draft Global health sector strategies viral hepatitis 2016–2021: WHO; 2016
11. Centres for Disease Control and Prevention. Interpretation of Hepatitis-Bserologictestresults. – Available at: https://www.cdc.gov/HEPATITIS/HBV/PDFs/SerologicChartv8
12. EASL 2017 clinical practice guidelines on the management of hepatitis B virus infection // J. Hepatol. – 2017. – Vol.67. – P.370–398.
13. Feld J.J., Ward J.W. // Hepatol. Commun. – 2021. – N5 (6). – P.911–922. doi: 10.1002/hep4.1731
14. Fu-Yu Wu, Yu-Wun Liao, Jia-Feng Wu, et al. // Pediatrics Neonatol. – 2016. – Vol.57. – P.219–224.
15. Krajden M., McNabb G., Petric M. // Can. J. Infect. Dis. Med. Microbiol. – 2005. – Vol.16 N2. – P.65–72.
16. Razavi-Shearer D., Gamkrelidze I., Nguyen M.H., et al. // Lancet Gastroenterol. Hepatol. – 2018. – N3 (6). – P.383–403.
17. Rick Dunn; Erkin Musabaev, Homie Razavi, et al. // MMWR. – 2020. – Vol.69, N34. – P.1161–1165.
18. World Health Organization. World Hepatitis Report. – Geneva, 2017. Available at: https://apps.who.int/iris/bitstream/handle/10665/255016/9789241565455-eng.pdf;jsessionid=10847CB8AB36884692B8BEBBD0D54EB5?sequence=1,accessedAug17,2020.
19. World Health Organization. WHO Guidelines on Hepatitis B and C Testing. – 2017. Available at: https://www.who.int/hepatitis/publications/guidelines-hepatitis-c-b-testing/en/.
20. Zhang W., Aryan M., Qian S., Cabrera R., Liu X. // Gastroenterol. Res. – 2021. – Vol.14, N3. – P.139–156. doi: 10.14740/gr1405
Медицинские новости. – 2021. – №12. – С. 83-87.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.