Внимание! Статья адресована врачам-специалистам
Koroleva А.А.1, Krasnovitskaya E.G.2, Zhuravkov Y.L.3
1Belarusian Medical Academy for Post-Graduate Education, Minsk
2Republican Scientific and Practical Centre of Pulmonology and Tuberculosis, Minsk, Belarus
3Belarusian State Medical University, Minsk
Treatment of arterial hypertension, are all resources involved?
Резюме. Ежегодно от сердечно-сосудистых заболеваний умирает больше людей, чем от любой другой причины. Артериальная гипертензия – серьезное заболевание, которое значительно увеличивает риск развития сердечных, мозговых, почечных и других заболеваний. Традиционно в лечении пациентов с артериальной гипертензией используются блокаторы кальциевых каналов и b-адреноблокаторы. В обзоре рассмотрены особенности двух представителей этих классов – лерканидипина и небиволола.
Ключевые слова: артериальная гипертензия, лерканидипин, небиволол.
Медицинские новости. – 2022. – №1. – С. 57–60.
Summary. More people die each year from cardiovascular diseases than from any other cause. Arterial hypertension is a serious medical condition that increases the risk of heart, brain, kidney and other diseases. Traditionally, calcium channel blockers andb-blockers are used in the treatment of hypertensive patients. The review considers the features of two representatives of these classes – lercanidipine and nebivоlol.
Keywords: arterial hypertension, lercanidipine, nebivоlol.
Meditsinskie novosti. – 2022. – N1. – P. 57–60.
Актуальность проблемы артериальной гипертензии (АГ) обусловлена не только широким распространением заболевания, но и тем, что повышение давления является важнейшим фактором риска поражения сердца, сосудов головного мозга и почек. В августе 2021 года в журнале «Lancet» были опубликованы данные комплексного анализа глобальной динамики распространенности АГ, приведены оценки ее лечения и контроля. С 1990 года количество пациентов с АГ в мире удвоилось и составляет 1,28 млрд человек. Наша республика вошла в десятку стран с самыми высокими показателями распространенности заболевания среди мужчин в 2019 году. Хотя диагностика достаточно проста и не требует дорогостоящего оборудования, 41% женщин и 51% мужчин из обследованных людей не знали о наличии у них АГ. В ходе исследования было показано, что более половины пациентов не принимали антигипертензивные препараты. Не может не вызывать беспокойство тот факт, что благодаря приему лекарств АГ контролировалась только у 23% женщин и 18% мужчин. В то же время за последние 30 лет количество инсультов увеличилось на 70%, что привело к росту смертности в 2 раза.
В реальной клинической практике достичь целевых цифр артериального давления (АД) не всегда просто, особенно у коморбидных пациентов. Для базовой терапии АГ используются 5 классов антигипертензивных препаратов: ингибиторы АПФ, сартаны, блокаторы медленных кальциевых каналов (БКК), диуретики и ?-адреноблокаторы.
БКК представляют собой гетерогенный класс, включающий 2 большие подгруппы дигидропиридиновые и недигидропиридиновые БКК. Обе подгруппы имеют схожий механизм действия: они ингибируют ток кальция в вольтаж-зависимых кальциевых каналах L-типа в гладкомышечных клетках сосудов. Более низкая внутриклеточная концентрация ионов кальция вызывает вазодилатацию, снижение общего периферического сосудистого сопротивления и, как следствие, АД. Преимущество дигидропиридиновых БКК в высокой сосудистой селективности приводит к отсутствию таких фармакологических эффектов на уровне миокарда, как отрицательная инотропная и хронотропная активность [2]. По данным мета-анализов клинических исследований, дигидропиридиновые БКК снижают риск развития неблагоприятных сердечно-сосудистых событий, таких как инсульты (-21%), ишемическая болезнь сердца (-18%) и сердечная недостаточность (-28%) у пациентов независимо от значений АД до лечения [3–5]. Они будут предпочтительны у лиц, перенесших инсульт, со стабильной стенокардией, гипертрофией левого желудочка, пожилых пациентов, с заболеваниями почек и периферических сосудов. Только дигидропиридиновые БКК не имеют абсолютных противопоказаний, то есть их можно назначать практически любому пациенту с АГ.
В пределах одного класса препараты могут отличаться особыми свойствами, которые делают их назначение более предпочтительным. Среди дигидропиридиновых БКК выделяется препарат 3 поколения лерканидипина гидрохлорид. Уникальность препарата обусловлена высокой липофильностью, которая обеспечивает быстрое и легкое проникновение и накопление в фосфолипидном бислое гладкомышечных клеток сосудов. Препарат прочно связывается с рецепторами кальциевых каналов и оказывает плавное и длительное антигипертензивное действие. Фиксация лерканидипина к липидному бислою мембраны гладкомышечных клеток сосудистой стенки обеспечивает длительную блокаду трансмембранных кальциевых каналов. Длительность действия его зависит не от нахождения в плазме, как у амлодипина, а от концентрации внутри клеточной мембраны и длительности связывания с рецептором внутри кальциевого канала. В результате, у лерканидипина в отличие от других дигидропиридиновых БКК относительно короткий период полувыведения (после однократного приема 10–20 мг – 8–10,5 часов), обеспечивающий безопасность препарата, и 24-часовой период антигипертензивного действия [6].
Благодаря высокой тканевой селективности, лерканидипин практически не влияет на сократимость, возбудимость и проводимость миокарда в отличие от других представителей этой группы. В исследованиях in vitro индекс вазоселективности у лерканидипина – 730:1, амлодипина – 95:1, у фелодипина – 6:1. Оказывая выраженное влияние на сосуды, лерканидипин лишен отрицательного инотропного действия. При его назначении не развиваются признаки симпатической гиперактивации в ответ на периферическую вазодилатацию в отличие от других дигидропиридиновых БКК. При одинаковом снижении АД, концентрация норадреналина в плазме не изменялась при назначении лерканидипина (10–20 мг/сутки), но повышалась при использовании нифедипина замедленного высвобождения [7].
Увеличивая биодоступность оксида азота, лерканидипин вызывает эндотелий-зависимую вазодилатацию у пациентов с АГ [8]. Показаны эффекты препарата по снижению уровня C-реактивного белка, E - и P-селектина, липопротеина-a?и молекул внутриклеточной адгезии, участвующих в атеротромбозе [9]. У пациентов с АГ и сахарным диабетом при назначении лерканидипина наблюдалось снижение ХС-ЛПНП [10]. Эти эффекты, наряду со снижением АД, имеют большое клиническое значение и находят подтверждение в исследованиях. Показано, что назначение лерканидипина приводит к регрессу структурных изменений микрососудов при атеротромбозе [11].
Почки являются органом-мишенью при АГ, поэтому нейропротективным свойствам любого препарата уделяется пристальное внимание. Действие лерканидипина на почки отличается от других дигидропиридиновых БКК. Стандартные БКК, такие как нифедипин и амлодипин, как правило, влияют только на приводящую почечную артериолу, но не на отводящую. Соответственно на фоне их применения повышается внутриклубочковое давление, что может нивелировать положительное влияние от снижения уровня АД. Лерканидипин, расширяет как афферентную, так и эфферентную артериолы почечного клубочка, не приводя к повышению внутриклубочкового давления. Считается, что эта способность обусловлена ингибированием как L-типа (прегломерулярный), так и T-типа (постгломерулярный) кальциевых каналов на почечном уровне. Кроме того, лерканидипин подавляет интерстициальный фиброз канальцев, что приводит к уменьшению микроальбуминурии у крыс со спонтанной гипертензией [12]. Таким образом, нефропротективное действие лерканидипина многогранно и зависит не только от снижения АД. Хочется отметить, что также практически равноценное выведение лерканидипина через ЖКТ и почки.
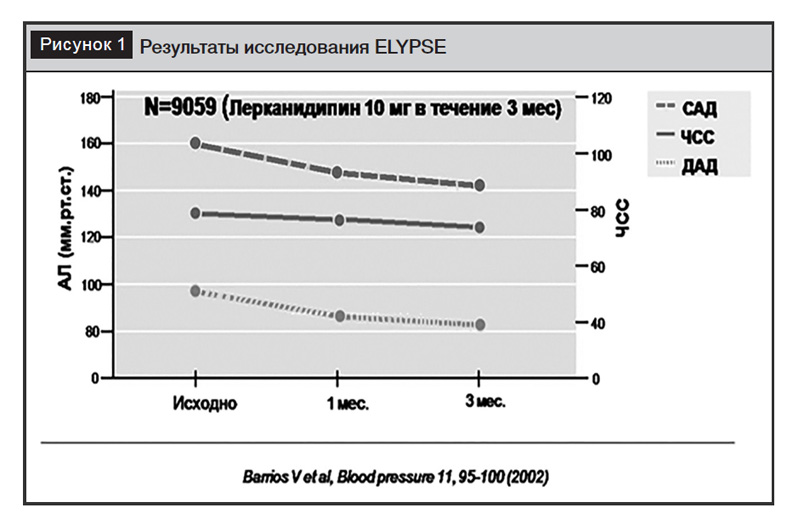
Терапевтическая эффективность лерканидипина (10–20 мг/день) оценивалась в двойных слепых рандомизированных сравнительных исследованиях и в крупных наблюдательных исследованиях (ELYPSE, ZANYCONTROL, ZANYTEN и др.) у пациентов с АГ I–III степени, в том числе с сопутствующим сахарным диабетом, заболеванием почек или факторами риска сердечно-сосудистых заболеваний, а также у пожилых людей. Через 4–6 недель систолическое АД снижалось в среднем на 19–26 мм рт. ст., диастолическое АД – на 13–15 мм рт. ст. без значимого влияния на ЧСС (рис. 1). При этом у 66% пациентов наблюдалось значимое снижение АД, а у 54% – достижение целевого АД после приема препарата в дозе 10 мг в сутки. При увеличении суточной дозы до 20 мг эти показатели возрастали до 86% и 63% соответственно [13]. Антигипертензивный эффект сохранялся в течение 24 часов со значительным снижением утреннего подъема АД и вариабельности АД. У пациентов с легкой и умеренной АГ или с изолированной систолической гипертензией лерканидипин значительно снижал центральное САД и пульсовое давление.
Всегда особый интерес вызывает эффективность терапии у пожилых лиц, так как это уязвимая группа пациентов с коморбидным фоном и большой частотой возникновения осложнений. Антигипертензивная эффективность лерканидипина у пожилых пациентов оценивалась как в трех крупных многоцентровых двойных слепых рандомизированных исследованиях и др. В исследовании COHORT [14] лерканидипин сравнивался с амлодипином и лацидипином у пациентов с АГ, средний возраст которых составлял 69–70 лет. Через 6 месяцев АД значительно снизилось на фоне приема лерканидипина (-29,6/-14,5 мм рт. ст.), амлодипина и лацидипина, без достоверных различий между препаратами. В исследовании ELLE (средний возраст – 73 года) лерканидипин и нифедипин модифицированного высвобождения снижали ДАД в большей степени, чем лацидипин [15]. В исследовании AGATE изучали антигипертензивную активность лерканидипина у пациентов в возрасте <65 и ≥65 лет, были получены сходные результаты в обеих группах [16]. Этот результат подтвержден в большом обзоре клинической практики [17]. Это исследование продемонстрировало сопоставимые изменения АД (САД/ДАД -26/-14 мм рт. ст. и -24/-14 мм рт. ст.) у женщин и мужчин соответственно. В целом частота ответа составила 72% при дозе 10 мг, а 29% пациентов нуждались в дозе 20 мг для достижения контроля АД. Можно сделать вывод, что терапевтическая активность лерканидипина не зависит от возраста или пола. Это открытие имеет важное терапевтическое значение, если учесть, что большинство пациентов с АГ старше 65 лет и добиться контроля АД у пожилых женщин труднее, чем у пожилых мужчин.
У пациентов с изолированной систолической гипертензией после 8 недель лечения количество ответчиков было достоверно выше при применении лерканидипина при сравнении с лацидипином (65% против 50%, р=0,04) [18].
Исследование LERZAMIG [19], проведенное у пациентов с ожирением или избыточной массой тела, показало хорошую антигипертензивную эффективность лерканидипина в этой группе высокого риска, при этом 42% пациентов нуждались в дозе 20 мг в сутки.
В многоцентровом наблюдательном открытом исследовании LAURA в реальных условиях оценивалась эффективность лерканидипина у пациентов с АГ и множественными факторами риска сердечно-сосудистых заболеваний (дислипидемия, курение, семейный анамнез сердечно-сосудистых заболеваний). После 6 месяцев терапии лерканидипином АД снизилось на 18,5/13,8 мм рт. ст. у пациентов с низким риском и на 23/15,2 мм рт. ст. – со средним риском, 24,4/16,1 мм рт. ст. – с высоким риском на 27,4/17,4 мм рт. ст. – с очень высоким риском. Уровень контроля АД был достигнут у 55% пациентов, получавших 10 мг в день лерканидипина, и у 82% пациентов, получавших 20 мг в день [20]. Таким образом, был получен значительный антигипертензивный эффект при всех уровнях риска сердечно-сосудистых заболеваний, более очевидный у пациентов из группы самого высокого риска.
Применение лерканидипина у пациентов с АГ и сахарным диабетом 2-го типа показало не только хорошую эффективность (после титрования дозы лерканидипина до 20 мг в сутки число ответчиков достигло 95%), но и отсутствие влияния на гомеостаз глюкозы [21].
Представляется предпочтительным использование лерканидипина у пациентов с патологией почек. В то время как амлодипин оказывает нефропротективное действие только в комбинации с ингибиторами АПФ или сартанами, лерканидипин, благодаря своим гемодинамическим эффектам, защищает почки и в режиме монотерапии. В исследовании DIAL оценивалась эффективность монотерапии лерканидипином по сравнению с рамиприлом у пациентов с АГ I–II степени с сахарным диабетом 2-го типа и стойкой микроальбуминурией. При сходной антигипертензивной активности снижение микроальбуминурии более чем на 50% было достигнуто у 34,2% пациентов в группе лерканидипина и 22,2% пациентов, получавших рамиприл [22]. Лерканидипин и ингибиторы АПФ/сартаны обладают синергичным эффектом в отношении альбуминурии. В исследовании REDLEVEL (REnalDisease: LErcanidipineValuableEffectonurinaryalbuminLoses) применение лерканидипина в комбинации с эналаприлом приводило к уменьшению альбуминурии в отличие от группы, получавшей комбинацию эналаприла с амлодипином [23].
Лерканидипин по сравнению с другими БКК оказывает более выраженное влияние на регресс гипертрофии левого желудочка [24].
В реальной практике приверженность пациентов к терапии обусловлена не только эффективностью препаратов, но и переносимостью. Нежелательные эффекты при приеме дигидропиридиновых БКК связаны с системной вазодилатацией и включают отек лодыжек, головокружение, головную боль, приливы крови к лицу, сердцебиение и головокружение. Лерканидипин, как правило, хорошо переносится, частота возникновения нежелательных эффектов сравнима с плацебо, а отказ от препарата из-за непереносимости бывает крайне редко (1–2%) [25]. Лерканидипин реже вызывает отек лодыжек по сравнению с нифедипином или амлодипином: 2,4% в группе лерканидипина и 6–29% при применении других дигидропиридиновых БКК. Таким образом, наличие у лерканидипина дополнительных свойств (кардиопротективное, нефропротективное, антиатеросклеротическое, противовоспалительное действие и улучшение функции эндотелия, высокая антиоксидантная активность), метаболическая нейтральность и хороший профиль безопасности превращают его практически в идеальный антигипертензивный препарат.
АГ является одним из важнейших факторов риска развития ишемической болезни сердца (ИБС). У одного пациента часто встречается сочетание ИБС (ее различных форм – стенокардии, инфаркта миокарда, аритмии) и АГ. Эти пациенты имеют самый высокий риск развития сердечно-сосудистых осложнений и смертности. В патогенезе как АГ, так и ИБС ключевое значение принадлежит эндотелиальной дисфункции. Эндотелий сосудов регулирует местные процессы воспаления, гемостаза, тромболизиса и тонуса. Одним из факторов, который вырабатывается в эндотелии и принимает участие в регуляции АД, является оксид азота – NO, наиболее мощный из всех известных эндогенных вазодилататоров. Причем сосуды малого диаметра синтезируют больше NO, чем сосуды большего диаметра, и за счет этого NO регулирует АД, периферическое сопротивление и перераспределение кровотока [25]. Таким образом, коррекция эндотелиальной дисфункции является стратегической задачей в терапии АГ. С другой стороны, при наличии АГ и ИБС ?-адреноблокаторы (БАБ) предпочтительны в качестве начальной терапии. Согласно современным рекомендациям, БАБ – препараты первого ряда при наличии стенокардии, перенесенного инфаркта миокарда, тахиаритмии, сердечной недостаточности. У пациентов со стабильной стенокардией напряжения БАБ уменьшают частоту сердечных сокращений (ЧСС) и АД во время нагрузки, повышая тем самым порог ишемии. Кроме того, БАБ уменьшают постнагрузку и сократимость миокарда, что ведет к снижению потребности миокарда в кислороде.
Небиволол – высокоселективный антагонист ?1-адренорецепторов с уникальным фармакологическим профилем, который отличается от других препаратов этого класса. Это высокоселективный липофильный БАБ с вазодилатирующими свойствами без внутренней симпатомиметической активности и мембраностабилизирующих свойств.
Небиволол – рацемат, состоящий из двух энантиомеров: D- и L-небиволола. D-димер вызывает блокаду ?1-адренорецепторов, снижая АД, урежая ЧСС, а L-небиволол обеспечивает вазодилатирующее действие. Небиволол – единственный БАБ, способный стимулировать синтез NO эндотелием сосудов в результате агонизма к ?3-адренорецепторам. К функциям этих рецепторов в жировой ткани относят регуляцию липолиза и углеводного обмена. Именно со стимуляцией синтеза NO связывают дополнительные органопротективные свойства и небиволола и хорошую переносимость. Поэтому небиволол будет препаратом выбора из БАБ у пациентов с ХОБЛ, сахарным диабетом и эректильной дисфункцией. Дополнительным преимуществом препарата выступают центральные гемодинамические эффекты, так как они являются независимыми предикторами сердечно-сосудистой заболеваемости и смертности. Прием небиволола в дозе 5 мг приводит к достоверному снижению среднего и пульсового давления в аорте и индекса аугментации. Небиволол улучшает центральную гемодинамику и снижает жесткость артерий у пациентов с АГ при одинаковом снижении периферического АД [25].
Эффективность небиволола при АГ хорошо изучена и не вызывает сомнений. Небиволол в дозах 1,25–40 мг в день оценивался для лечения АГ как в качестве монотерапии, так и в комбинации с другими классами гипотензивных средств. В качестве монотерапии небиволол изучался в трех крупных плацебо-контролируемых исследованиях. Было продемонстрировано, что терапия небивололом приводит к снижению САД и ДАД в среднем на 12,3 мм рт. ст., ЧСС уменьшается на 12,8 уд/мин. Отмена небиволола не вызывает симптомов рикошетной АГ [28].
Для оценки эффективности, безопасности и переносимости небиволола провели объединенный анализ трех основных исследований (n=2016), также изучили эффективность препарата в зависимости от возраста и индекса массы тела (ИМТ) [29]. Объединенные данные продемонстрировали хороший эффект небиволола по сравнению с плацебо как на ДАД, так и на САД для всего рекомендуемого диапазона доз (5–40 мг/день). Эффективность препарата была значительно выше для всех доз небиволола ≥2,5 мг/день в группе без ожирения и ≥5 мг/день в группе с умеренным ожирением. В целом небиволол безопасен и хорошо переносится. Частота прекращения приема из-за нежелательных эффектов (все дозы) была низкой (2,6%) и сопоставима с наблюдаемой в группе плацебо (2,0%).
В ряде исследований сравнивали эффективность небиволола с другими БАБ, ингибиторами АПФ, сартанами и БКК. 364 пациента были рандомизированы в группы небиволола 5 мг/день, атенолола 50 мг/день или плацебо. Результаты показали, что оба БАБ по эффективности превосходили плацебо, но были сопоставимы друг с другом с точки зрения снижения ДАД и САД [30]. Небиволол в отличие от атенолола не ухудшал индекс аугментации. В 8-недельном перекрестном двойном слепом рандомизированном исследовании сопоставимое снижение ДАД и САД наблюдалось при приеме небиволола (2,5–10 мг/день) и лизиноприла (10–40 мг/день) [31]. В 12-недельном рандомизированном двойном слепом исследовании эффективность небиволола (5 мг/день) в отношении ДАД была выше по сравнению с лозартаном (-12 мм рт. ст. и -8 мм рт. ст. соответственно) [32]. При этом большему количеству пациентов, получавших лозартан, потребовалось дополнительное применение гидрохлортиазида (12,5 мг/день) для достижения контроля АД. В двух отдельных исследованиях эффективность небиволола была сопоставима с дигидропиридиновыми БКК нифедипином с замедленным высвобождением и амлодипином, но большему количеству пациентов потребовалось добавление гидрохлортиазида для достижения контроля АД в группе амлодипина [33].
Для большинства пациентов рекомендуется начинать лечение с дозы 5 мг в день, которую можно титровать до 40 мг в день с 2-недельными интервалами. Более низкая начальная доза 2,5 мг/день рекомендуется пациентам с умеренной печеночной и/или тяжелой почечной недостаточностью. Нежелателен прием небиволола пациентам с тяжелой печеночной недостаточностью, и он не изучался у пациентов, получающих диализ.
Применение высокоселективного БАБ небиволола при АГ в сочетании с сахарным диабетом патогенетически оправдано. Индукция небивололом NO обусловливает периферическую вазодилатацию и повышение утилизации глюкозы периферическими мышцами. В исследовании с участием пациентов с сахарным диабетом 2-го типа и АГ лечение небивололом не влияло на показатели углеводного обмена, при этом улучшились показатели липидного профиля [34].
На фармацевтическом рынке Республики Беларусь присутствует единственный препарат лерканидипина – ЛеркаНАН 10 мг, производство которого освоено на предприятии «АКАДЕМФАРМ». Очевидно, что более широкое применение лерканидипина будет способствовать не только увеличению числа пациентов, достигших целевых показателей АД, но и приводить к защите органов-мишеней. Неоспоримым преимуществом лерканидипина является метаболическая нейтральность и хорошая переносимость. Для пациентов высокого риска при необходимости приема БАБ – препарат выбора Небиволол-НАН.
Л И Т Е Р А Т У Р А
1. Worldwide trends in hypertension prevalence and progress in treatment and control from 1990 to 2019: a pooled analysis of 1201 population-representative studies with 104 million participants // Lancet. – 2021. – Vol.398.
2. Godfraind T. // J. Cardiovasc. Pharmacol. Ther. – 2014. – Vol.19. – P.501–515.
3. Law M.R., Morris J.K., Wald N.J. // BMJ. – 2009. – Vol.338. – b1665.
4. Costanzo P., Perrone-Filardi P., Petretta M., et al. // J. Hypertens. – 2009. – Vol.27. – P.1136–1151.
5. Wu L., Deng S.B., She Q. // J. Clin. Hypertens (Greenwich). – 2014. – Vol.16. – P.838–845.
6. Herbette L.G., Vecchiarelli M., Sartani A., Leonardi A. // Blood Press Suppl. – 1998. – Vol.2. – P.10–17.
7. Fogari R., Mugellini A., Zoppi A., et al. // Am. J. Hypertens. – 2003. – Vol.16. – P.596–569.
8. Taddei S., Virdis A., Ghiadoni L., et al. // Hypertension. – 2003. – Vol.41. – P.950–955.
9. Farah R., Khamisy-Farah R., Shurtz-Swirski R. // Int. Angiol. – 2013. – Vol.32. – P.85–93.
10. Rachmani R., Levi Z., Zadok B.S., Ravid M. // Clin. Pharmacol. Ther. – 2002. – Vol.72. – P.302–307.
11. De Ciuceis C., Salvetti M., Rossini C., et al. // J. Hypertens. – 2014. – Vol.32. – P.565–574.
12. Sabbatini M., Leonardi A., Testa R., Vitaioli L., Amenta F. // Hypertension. – 2000. – Vol.35. – P.775–779.
13. Borghi C. // Vasc. Health Risk Manag. – 2005. – Vol.1. – P.173–182.
14. Leonetti G., Magnani B., Pessina A.C., et al. // Am. J. Hypertens. – 2002. – Vol.15. – P.932–240.
15. Cherubini A., Fabris F., Ferrari E., et al. // Arch. Gerontol. Geriatr. 2003. – Vol.37. – P.203–212.
16. Poncelet P., Ribstein J., Goullard L., et al. // Ann. Cardiol. Angeiol (Paris). – 2004. – Vol.53. – P.123–130.
17. Burnier M., Gasser U.E. // Expert Opin. Pharmacother. – 2007. – Vol.8. – P.2215–2223.
18. Millar-Craig M., Shaffu B., Greenough A., Mitchell L., McDonald C. // J. Hum. Hypertens. – 2003. – Vol.17. – P.799–806.
19. Barrios V., Calderon A., Navarro A., Noya C., Herranz I., Prieto L. // J. Hypertens. – 2004. – Vol.22 (Suppl.2). – S258–259.
20. Barrios V., Escobar C., Navarro A., et al. // Int. J. Clin. Pract. – 2006. – Vol.60. – P.1364–1370.
21. Viviani G.L. // J. Cardiovasc. Pharmacol. – 2002. – Vol.40. – P.133–139.
22. Dalla Vestra M., Pozza G., Mosca A., et al. // Diabetes Nutr. Metab. – 2004. – Vol.17. – P.259–266.
23. Robles N.R., Calvo C., Sobrino J., et al. // Curr. Med. Res. Opin. – 2016. – Vol.32 (Suppl.2). – P.29–34.
24. Devereux R.B., Palmieri V., Sharpe N., et al. // Circulation. – 2001. – Vol.104, N11. – P.1248–1254.
25. Burnier M., Gasser U.E. // Expert Opin. Pharmacother. – 2007. – Vol.8. – P.2215–2223.
26. Михеева О.М., Комиссаренко И.А. // Системные гипертензии. – 2014. – Т.11, №3. – C.83–87.
27. Kampus P., Serg M., Kals J., et al. // Hypertension. – 2011. – Vol.57. – P.1122–1128.
28. Lewin A., Punzi H., Luo X., Stapff M. // Clin. Ther. – 2013. – Vol.35, N2. – P.142–152.
29. Manrique C/, Whaley-Connell A/, Sowers J.R. // J. Clin. Hypertens. – 2009. – Vol.11. – P.309–315.
30. Van Nueten L., Taylor F., Robert J. // J. Hum. Hypertens. – 1998. – Vol.12. – P.135–140.
31. Lacourcière Y., Lefebvre J., Poirier L., Archambault F., Arnott W. // Am. J. Ther. – 1994. – Vol.1. – P.74–80.
32. Van Bortel L., Bulpitt C., Fici F. // Am. J. Hypertens. – 2005. – Vol.18. – P.1060–1066.
33. Mazza A., Gil-Extremera B., Maldonato A., Toutouzas T., Pessina A.C. // Blood Press. – 2002. – Vol.11. – P.182–188.
34. Маколкин В.И. // РМЖ. – 2005. – №13 (11). – С.376.
Медицинские новости. – 2022. – №1. – С. 57-60.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.