Внимание! Статья адресована врачам-специалистам
AntanovichZh.V.
Belarusian Medical Academy of Postgraduate Education, Minsk
Microlides in modern clinical practice: what’s new?
Резюме. Макролиды широко используются в современной клинической практике, обладают высокой активностью в отношении ключевых внебольничных патогенов, включая атипичные микроорганизмы, характеризуются высокой биодоступностью при пероральном приеме, удобством приема (1–2 раза в сутки), отличным проникновением в ткани и благоприятным профилем безопасности. Уникальность современных макролидов (азитромицин, кларитромицин) заключается в наличии у них дополнительных неантимикробных эффектов (противовоспалительная и иммуномодулирующая активность). Ограничением к использованию макролидов может быть повсеместный рост устойчивости к ним Streptococcus pneumoniae и невысокая природная активность в отношении Haemophilus influenzae, поэтому следует учитывать данные о местной антибиотикорезистентности. Новым направлением в респираторной медицине является длительная терапия хронических бронхолегочных заболеваний низкими дозами макролидов, в основе которой лежит иммуномодулирующий механизм.
Ключевые слова: макролиды, эффекты, противовоспалительные и иммуномодулирующие свойства, показания, безопасность, длительная терапия низкими дозами.
Медицинскиеновости. – 2023. – №9. – С. 19–27.
Summary. Macrolides are widely used in modern clinical practice, have high activity against key community-acquired pathogens, including atypical microorganisms, are characterized by high oral bioavailability, ease of administration (1–2 times a day), excellent tissue penetration and a favorable safety profile. The uniqueness of modern macrolides (azithromycin, clarithromycin) lies in the presence of additional non-antimicrobial effects (anti-inflammatory and immunomodulatory activity). A limitation to the use of macrolides may be the widespread growth of Streptococcus pneumoniae resistance to them and the low natural activity against Haemophilus influenzae, so data on local antibiotic resistance should be taken into account. A new direction in respiratory medicine is long-term therapy of chronic bronchopulmonary diseases with low doses of macrolides, which is based on an immunomodulatory mechanism.
Keywords: macrolides, effects, anti-inflammatory and immunomodulatory properties, indications, safety, long-term low-dose therapy.
Meditsinskie novosti. – 2023. – N9. – P. 19–27.
Макролиды относятся к классу основных и наиболее часто используемых в современной клинической практике антибиотиков, обладают высокой активностью в отношении ключевых внебольничных патогенов, включая атипичные микроорганизмы, и хорошим профилем безопасности, являясь средствами первой линии при многих нозологиях.
В статье рассмотрены эффекты современных макролидов, определены ключевые нозологии и клинические ситуации, при которых назначение макролидов будет максимально полезно, представлена возможность ознакомиться с новым направлением в респираторной медицине – длительной терапией хронических бронхолегочных заболеваний низкими дозами макролидов.
Макролидные антибиотики, обычно называемые «макролидами», представляют собой семейство различных антибиотиков, продуцируемых грибами рода Streptomyces и некоторыми бактериями, такими как Arthrobacter spp. [1–3].
Макролиды принадлежат к семейству химических соединений, характеризующихся наличием макроциклического лактонного кольца из 12 и более элементов в сочетании с сахарами (кладиноза, дезозамин) [1–4].
Обычно лактонные кольца состоят из 14, 15 или 16 членов (рис. 1) [1–4].
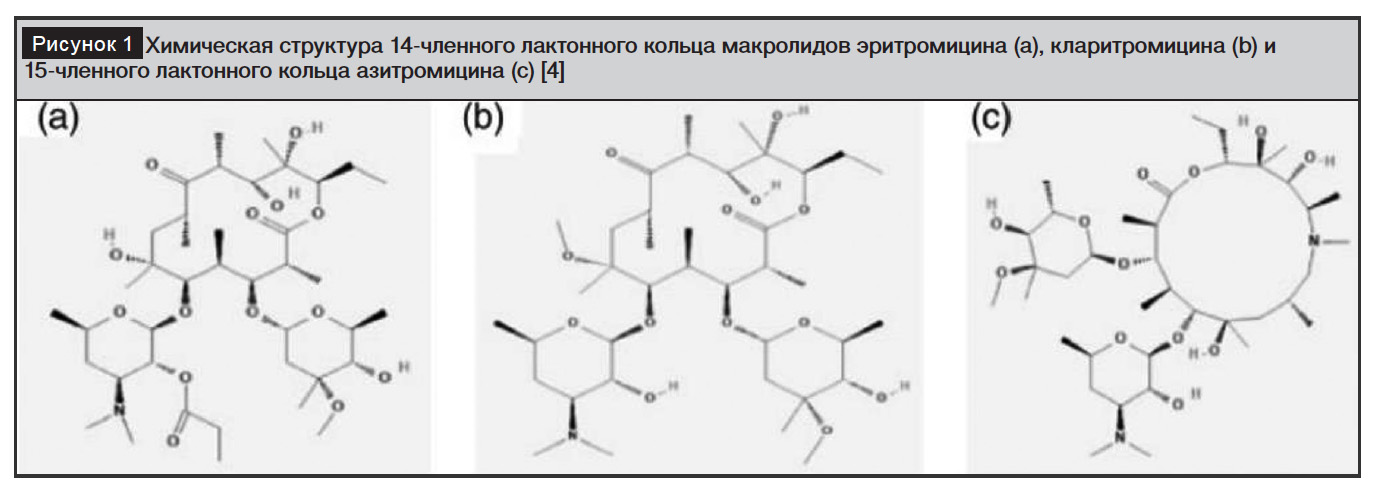
Первый представитель класса макролидов эритромицин вошел в клиническую практику в 50-х годах прошлого века [2, 3]. Его антимикробный спектр охватывает область действия пенициллинов, но распространяется и на атипичные бактерии [2, 3]. Ограничения его использования включают желудочно-кишечную непереносимость и короткий период полувыведения, что делает необходимым прием несколько раз в сутки [2, 3].
В 90-е годы XX века были синтезированы другие препараты этой группы с менее выраженными побочными эффектами, чем у эритромицина, более благоприятной фармакокинетикой и фармакодинамикой и расширенным спектром действия в отношении грамотрицательных бактерий [2, 3].
Другие макролиды с 14-членным кольцом включают кларитромицин, диритромицин, олеандомицин, рокситромицин; с 16-членным кольцом: джозамицин, мидекамицин, микамицин и спирамицин [2]. 15-членный кольцевой макролид азитромицин представляет собой азалид [2]. Отдельно стоят кетолиды с 14-членным кольцом, такие как телитромицин и цетромицин [2]. К группе макролидов относятся такролимус, выделенный из Streptomyces tsukubaensis, и сиролимус, выделенный из Streptomyces hygroscopicus (табл. 1) [2].
Таблица 1. Классификация макролидов по химической структуре [2]
|
Химическая структура
|
Представители
|
|
14-членные
|
Эритромицин, кларитромицин, диритромицин, олеандомицин, рокситромицин
|
|
15-членные (азалиды)
|
Азитромицин
|
|
16-членные
|
Джозамицин, мидекамицин, микамицин, спирамицин
|
|
14-членные (кетолиды)
|
Телитромицин, цетромицин
|
|
Макролиды не антибиотики
|
Такролимус (из Streptomyces tsukubaensis) – ингибитор кальциневрина, пимекролимус (производное аскомицина, из Streptomyces hygroscopicus) – ингибитор кальциневрина, сиролимус (из Streptomyces hygroscopicus) – ингибитор TOR-киназы, эверолимус (производное сиролимуса) – ингибитор TOR-киназы
|
Новым препаратом из группы макролидов является фидаксомицин, демонстрирующий минимальную системную абсорбцию, высокий уровень фекальной концентрации, длительный постантибиотический эффект и ограниченную активность против нормальной кишечной флоры, что обеспечивает его активный и селективный эффект в отношении инфекции Clostridiumdifficile[6–9].
По способу получения выделяют природные (эритромицин, олеандомицин, спирамицин, джозамицин, мидекамицин) и полусинтетические (кларитромицин, рокситромицин, азитромицин, мидекамицина ацетат) макролиды [10].
Механизм действия и эффекты макролидов
Механизм действия макролидов заключается в блокировании синтеза белка путем связывания с субъединицей 50S рибосомы бактерий [2, 3].
На современном этапе известно, что помимо антибактериальных свойств, макролиды обладают иммуномодулирующим действием, подавляя выработку провоспалительных цитокинов (фактор некроза опухоли альфа, интерлейкин (ИЛ)-1, ИЛ-6 и ИЛ-8), оказывая влияние на факторы транскрипции (NF -кB), а также костимулирующие молекулы (CD 80) и молекулы адгезии (ICAM) [2, 5, 11–13].
В последние годы растет интерес к иммуномодулирующим свойствам макролидов. Иммуномодулирующее действие наблюдается только при применении 14-(эритромицин, кларитромицин и рокситромицин) и 15-членных (азитромицин) макролидов [14, 15] и основано на снижении секреции и вязкости слизи в дыхательных путях (ДП) [16] и уменьшении накопления нейтрофилов в ДП за счет снижения экспрессии провоспалительных цитокинов и продукции молекул адгезии [5, 11–13] (рис. 2).
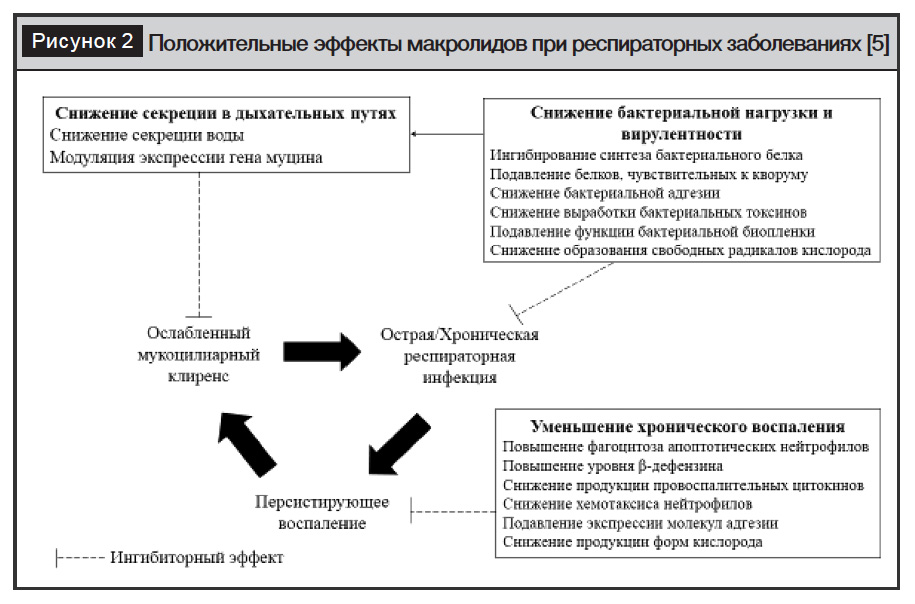
Макролиды ингибируют синтез бактериального белка, уменьшают адгезию бактерий и продукцию ими токсинов, подавляют функцию биопленки и уменьшают образование свободных радикалов кислорода, что приводит к снижению бактериальной нагрузки и вирулентности [2, 3, 5].
Макролиды могут модулировать экспрессию гена муцина и выработку белка муцина, а также подавляют белки, чувствительные к кворуму, что ведет к снижению секреции в ДП и улучшению мукоцилиарного клиренса [5, 16].
Наконец, макролидные антибиотики обладают рядом противовоспалительных и иммуномодулирующих свойств, тем самым ослабляя воспаление [5, 11–13].
Противовоспалительные и иммуномодулирующие свойства макролидов включают: снижение хемотаксиса и выживаемости нейтрофилов; подавление экспрессии молекул адгезии; усиление альвеолярно-макрофагального фагоцитоза апоптотических клеток; ингибирование факторов транскрипции, приводящее к снижению продукции провоспалительных цитокинов; повышение уровней бета-дефензина; снижение продукции форм кислорода; снижение количества и миграции Т-клеток; модуляцию функции дендритных клеток (см. рис. 2) [5, 11–13].
Таким образом, уникальность современных макролидов (азитромицин, кларитромицин) заключается в наличии у них дополнительных неантимикробных эффектов (противовоспалительная и иммуномодулирующая активность).
Учитывая высокую биодоступность макролидов при пероральном приеме, удобство приема (1–2 раза в сутки), отличное проникновение в ткани и эффективность против многих легочных патогенов (большинство грамположительных и некоторые грамотрицательные бактерии, микобактерии, хламидии, микоплазмы, легионеллы), они широко используются в качестве препаратов первой линии в терапии респираторных инфекций [2, 3, 5, 17–19], хотя есть опасения, что длительное применение макролидов может способствовать развитию устойчивости микроорганизмов к противомикробным препаратам [5, 20–26].
Одним из основных достоинств макролидов является их высокая природная активность в отношении атипичных микроорганизмов, таких как Mycoplasmapneumoniae, Chlamydophilapneumoniae и Legionella pneumophila [2, 3, 24].
Показания к назначению макролидов
В настоящее время макролиды применяются для лечения инфекций ДП, заболеваний, передающихся половым путем, некоторых инфекций кожи и мягких тканей, коклюша, а также инфекций, вызванных Helicobacter pylori и комплексом Mycobacterium avium, демонстрируя эффективность в лечении микобактериальных инфекций, особенно у пациентов, инфицированных ВИЧ (табл. 2) [27].
Таблица 2. Показания к назначению некоторых макролидов, одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) [27]
|
Показания
|
Азитромицин
|
Кларитромицин
|
Кларитромицин XL
|
Эритромицин
|
Фидаксомицин
|
|
Фарингит/тонзиллит, вызванный Streptococcus pyogenes
|
V*
|
V*
|
|
|
|
|
Инфекция Helicobacter pylori и язвенная болезнь двенадцатиперстной кишки ***
|
|
V
|
|
|
|
|
Острый верхнечелюстной синусит, вызванный Haemophilus influenzae, Moraxella catarrhalis или Streptococcus pneumoniae
|
V
|
V*
|
V
|
|
|
|
Острое бактериальное обострение хронического бронхита, вызванное Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis или Streptococcus pneumoniae
|
V**
|
V
|
V
|
|
|
|
Внебольничная пневмония, вызванная Haemophilus influenzae, Mycoplasma pneumoniae, Streptococcus pneumoniae или Chlamydophila pneumoniae
|
V#
|
V*
|
V##
|
|
|
|
Неосложненные инфекции кожи и кожных структур, вызванные Staphylococcus aureus или Streptococcus pyogenes
|
V###
|
V*
|
|
|
|
|
Диссеминированные микобактериальные инфекции, вызванные Mycobacterium avium или Mycobacterium intracellulare
|
V§
|
V*
|
|
|
|
|
Профилактика диссеминированного заболевания Mycobacterium avium complex у пациентов с поздней стадией ВИЧ-инфекции
|
V§§
|
V*
|
|
|
|
|
Острый средний отит, вызванный Haemophilus influenzae, Moraxella catarrhalis или Streptococcus pneumoniae у детей
|
V
|
V
|
|
|
|
|
Уретрит и цервицит, вызванные Chlamydia trachomatis или Neisseria gonorrhoeae
|
V
|
|
|
|
|
|
Язвенная болезнь половых органов у мужчин, вызванная Haemophilus ducreyi (шанкр)
|
V
|
|
|
|
|
|
Диарея, связанная с Clostridium difficile, у взрослых (>18 лет)
|
|
|
|
|
V
|
|
Негонококковый уретрит и цервицит, вызванные Chlamydia trachomatis
|
V §§§
|
|
|
|
|
|
Ревматическая лихорадка, профилактика у взрослых и детей
|
|
|
|
V
|
|
|
Хламидийная инфекция
|
|
|
|
V
|
|
|
Дифтерия, дополнение к антитоксину у взрослых и детей
|
|
|
|
V
|
|
|
Эритразма у взрослых и детей
|
|
|
|
V
|
|
|
Гонококковые воспалительные заболевания органов малого таза у женщин у взрослых и детей
|
|
|
|
V
|
|
|
Entamoeba histolytica-кишечная инфекционная болезнь у взрослых и детей
|
|
|
|
V
|
|
|
Инфекция кожи или подкожной клетчатки у взрослых и детей
|
|
|
|
V
|
|
|
Болезнь легионеров у взрослых и детей
|
|
|
|
V
|
|
|
Листериоз у взрослых и детей
|
|
|
|
V
|
|
|
Неонатальный хламидийный конъюнктивит у детей
|
|
|
|
V
|
|
|
Неонатальная хламидийная пневмония у детей
|
|
|
|
V
|
|
|
Негонококковый уретрит
|
|
|
|
V
|
|
|
Коклюш у взрослых и детей
|
|
|
|
V
|
|
|
Инфекции дыхательных путей у взрослых и детей
|
|
|
|
V
|
|
|
Сифилис у взрослых и детей
|
|
|
|
V
|
|
Примечания:
* Также показан детям; для кларитромицина внебольничная пневмония, вызванная Haemophilus influenzae, не одобрена у детей.
** Азитромицин не показан при Haemophilus parainfluenzae.
*** Таблетки в сочетании с амоксициллином и лансопразолом (или омепразолом) в качестве тройной терапии.
# Также показан детям. Не следует применять у пациентов с пневмонией, которым не подходит пероральная терапия из-за среднетяжелого или тяжелого течения заболевания или наличия факторов риска, таких как любой из следующих: муковисцидоз, нозокомиальные инфекции, известная или подозреваемая бактериемия, требующая госпитализации, пожилые или ослабленные пациенты или наличие тяжелых сопутствующих заболеваний, которые могут поставить под угрозу способность реагировать на болезнь, включая иммунодефицит или функциональную асплению.
## Также одобрен при Haemophilus parainfluenzae и Moraxella catarrhalis.
### Также одобрен для Streptococcus agalactiae.
§ таблетки 600 мг в сочетании с этамбутолом.
§§ 1200 мг, принимаемый отдельно или в сочетании с рифабутином.
§§§ Доза один грамм.
Клинические исследования
Объединенный анализ исследований по лечению инфекций нижних ДП, включая острый бронхит и пневмонию, не выявил существенной разницы между азитромицином и амоксициллином или амоксициллин/клавуланатом [28].
Сетевой мета-анализ 48 исследований по относительной эффективности и безопасности различных антибиотиков при лечении бронхита не обнаружил различий в эффективности между макролидами и бета-лактамами или хинолонами [29].
Прямые исследования по оценке лечения фарингита и пневмонии, как правило, не показывают существенных различий между разными макролидами в клиническом и бактериологическом ответе [30–32].
Мета-анализ 14 исследований, посвященных схемам лечения комплекса Mycobacteriumavium(МАК), показал, что схемы, содержащие макролиды, имеют показатель успеха лечения 60% [33]. Ранее кларитромицин показал эффективность по сравнению с плацебо в профилактике развития диссеминированной МАК-инфекции у пациентов с ВИЧ [34].
В открытом исследовании азитромицин продемонстрировал эффективность при лечении коклюша с частотой эрадикации до 100% [35]. Исследование, непосредственно сравнивающее азитромицин, кларитромицин и эритромицин при лечении коклюша, установило 100% уровень эрадикации для всех препаратов через 2 недели лечения [36]. Другие исследования, сравнивающие макролиды при лечении коклюша, дают аналогичные результаты [37, 38].
В одном из исследований сравнивался клинический ответ на препараты кларитромицина немедленного и пролонгированного действия при лечении множества заболеваний, включая фарингит, пневмонию, а также инфекции кожи и ее структур, и не были продемонстрированы существенные различия [39].
В исследованиях, посвященных лечению тяжелой внебольничной пневмонии (ВП), было показано, что добавление макролида к бета-лактамному антибиотику приводило к значительному снижению смертности [40–45]. Системный обзор и мета-анализ установили, что при тяжелой ВП комбинация бета-лактама с макролидом была более эффективной в снижении общей смертности и продолжительности пребывания в стационаре по сравнению с комбинацией бета -лактама с респираторным фторхинолоном (РФХ) [45]. Поскольку помимо антибиотического действия макролиды обладают противовоспалительной и иммуномодулирующей активностью, вероятно, они способны оказывать эффект даже в условиях устойчивости к макролидам [41].
Кокрейновский обзор не выявил четкой разницы между азитромицином и доксициклином при лечении воспалительных заболеваний органов малого таза. Анализ чувствительности, включавший одно исследование с низким риском систематической ошибки, показал, что азитромицин превосходит доксициклин при воспалительных заболеваниях органов малого таза легкой и средней степени тяжести [46].
Кокрейновский обзор 14 РКИ оценивал безопасность и эффективность лечения антибиотиками генитальных инфекций, вызванных Chlamydia trachomatis, и обнаружил более высокий уровень микробиологической неудачи у мужчин, получивших однократную дозу азитромицина, по сравнению с доксициклином один или два раза в день в течение 7 дней (ОР 2,45; 95% ДИ 1,36–4,41); влияние обоих режимов лечения на клиническую неудачу было неопределенным (ОР 0,94; 95% ДИ 0,43–2,05) [47]. Результаты микробиологической неудачи при применении азитромицина по сравнению с доксициклином у женщин были неопределенными (ОР 1,71; 95% ДИ 0,48–6,16), и ни в одном исследовании не оценивалась клиническая неудача. Азитромицин ассоциировался с меньшим количеством побочных эффектов по сравнению с доксициклином как у мужчин, так и у женщин (ОР 0,83; 95% ДИ 0,71–0,98) [47].
В клинических исследованиях было показано, что фидаксомицин не уступает ванкомицину при лечении диареи, вызванной Clostridiumdifficile, демонстрируя значительно более низкие показатели рецидивов и более высокие показатели излечения [6–8].
Мета-анализ лечения антибиотиками диареи, вызванной Clostridiumdifficile, выявил статистически значимое превосходство фидаксомицина над ванкомицином в достижении симптомного излечения при объединении результатов двух исследований [48]. Дополнительный мета-анализ лечения рецидивирующей Clostridiumdifficile инфекции обнаружил, что фидаксомицин превосходил ванкомицин и метронидазол в достижении устойчивого симптомного излечения [49].
Предварительные данные позволяют предположить, что фидаксомицин может оказаться эффективнее, чем метронидазол или ванкомицин для лечения устойчивых штаммов Clostridiumdifficile, и уменьшать количество рецидивов инфекции. Ранее в руководствах этот препарат упоминался как вариант лечения тяжелых случаев диареи, вызванной Clostridiumdifficile. Более поздние рекомендации предлагают использовать фидаксомицин или ванкомицин в качестве начальной терапии диареи, вызванной Clostridiumdifficile, а также при рецидивирующей диарее [9].
Клинические испытания доказали эффективность макролидов при различных инфекциях, однако чрезмерное использование антибиотиков, привело к устойчивости многих бактерий к макролидам, а также к другим антибиотикам [20–23].
Ограничениями к использованию макролидов могут являться повсеместный рост устойчивости к ним Streptococcuspneumoniae, невысокая природная активность в отношении Haemophilusinfluenzae и практически полное отсутствие таковой в отношении энтеробактерий [22–25].
Выбор средств для лечения различных инфекций основан на местных особенностях чувствительности [5, 25].
Клинические руководства
Согласно клиническим руководствам азитромицин и кларитромицин рекомендуются в качестве препаратов первой линии для лечения ВП, коклюша, обострений хронического бронхита (ХБ) и хронической обструктивной болезни легких (ХОБЛ), профилактики МАК у детей и лечения МАК у детей и взрослых [18, 19, 50–63].
И азитромицин, и кларитромицин ранее также применялись для профилактики МАК у взрослых, однако недавнее обновление рекомендаций больше не рекомендует первичную профилактику диссеминированной МАК-инфекции у пациентов с ВИЧ, которые немедленно начинают антиретровирусную терапию. У пациентов, которым проводится профилактика, считается, что азитромицин и кларитромицин по-прежнему являются предпочтительными препаратами [54].
Кларитромицин также включен в состав комбинированной терапии для эрадикации инфекции Helicobacterpylori [55].
Кроме этого, макролиды рекомендуются в качестве терапии первой линии при некоторых инфекциях, передающихся половым путем, таких как шанкр, уретрит, цервицит, хламидиоз, некоторых инфекциях кожи и мягких тканей, таких как импетиго (хотя некоторые штаммы Staphylococcusaureus и Streptococcuspyogenes могут быть устойчивыми), болезни кошачьих царапин и бациллярном ангиоматозе [56, 57].
Внебольничная пневмония
В руководстве по ВП Американского торакального общества и Американского общества по инфекционным болезням, опубликованном в 2019 году, пациентам с нетяжелой ВП без сопутствующих заболеваний, не принимавшим за последние 3 месяца антимикробные препараты (АМП) ≥2 дней и не имеющим других факторов риска (ФР) инфицирования редкими и/или полирезистентными возбудителями (ПРВ), в качестве препаратов первой линии рекомендуется назначение амоксициллина или доксициллина, или макролида (если локальный уровень резистентности пневмококка к макролидам менее 25%) [18]. Данные подходы соответствуют белорусским клиническим протоколам лечения и рекомендациям, в которых препаратами первой линии указаны амоксициллин или макролиды (азитромицин, кларитромицин) [58, 59]. Однако, согласно российским клиническим рекомендациям по ВП у взрослых 2021 года, антибиотиком выбора у пациентов этой группы является амоксициллин, альтернатива – макролиды [60]. Назначение макролидов в качестве препаратов первой линии в Российской Федерации не рекомендуется ввиду возможной неэффективности лечения из-за роста устойчивости к ним Streptococcus pneumoniae [60, 61]. Макролиды в качестве стартовой терапии ВП могут применяться при невозможности использовать аминопенициллины (индивидуальная непереносимость, аллергические реакции немедленного типа на бета-лактамы в анамнезе), а также при наличии клинических или эпидемиологических данных, указывающих на то, что ВП вызвана атипичными возбудителями (Mycoplasma pneumoniae или Chlamydophila pneumoniae) [60]. Согласно российским клиническим рекомендациям по ВП 2021 года, несмотря на определенную роль Mycoplasma pneumoniae и Chlamydophila pneumoniae в этиологии ВП, рутинное назначение комбинации бета-лактамного антибиотика и макролида в амбулаторной практике не показано, так как в настоящее время нет доказательных данных, что такая комбинация улучшает исходы лечения, повышая риск нежелательных лекарственных реакций и приводя к росту антибиотикорезистентности [60].
В руководстве по ВП Американского торакального общества и Американского общества по инфекционным болезням 2019 года у пациентов с нетяжелой ВП и сопутствующими заболеваниями (ХОБЛ, сахарный диабет, хроническая сердечная недостаточность, хроническая болезнь почек, цирроз печени, алкоголизм, наркомания, истощение) и/или принимавших за последние 3 месяца АМП ≥2 дней и/или имеющих другие факторы риска инфицирования редкими и/или ПРВ, в качестве антибиотиков выбора указываются ингибиторозащищенные аминопенициллины или цефалоспорины II–IIIпоколений в комбинации с макролидом или доксициклином, а в качестве альтернативы – РФХ [18]. Эти данные соответствуют белорусским рекомендациям, в которых первой линией терапии пациентов этой группы является комбинация ингибиторозащищенного аминопенициллина и макролида (азитромицин, кларитромицин) [59]. В то время как, согласно российским клиническим рекомендациям по ВП у взрослых 2021 года, антибиотиками выбора для пациентов этой группы являются ингибиторозащищенные аминопенициллины, альтернативой – РФХ [60].
При тяжелой ВП во всех руководствах комбинация ?-лактамного антибиотика с макролидом обозначена как терапия первой линии, в качестве альтернативы указана комбинация бета-лактамного антибиотика с РФХ [18, 58, 59, 60].
Хронический бронхит и ХОБЛ
Самая частая причина обострений ХБ и ХОБЛ – респираторные инфекции. Наиболее распространенными возбудителями при обострениях ХБ и ХОБЛ являются: Haemophilusinfluenzae, Streptococcuspneumoniae, Moraxella catarrhalis и Pseudomonas aeruginosa (у пациентов с GOLD 3 и 4) [19, 51].
Согласно глобальной инициативе по ХОБЛ 2023 года (GOLD 2023), выбор антибиотика при обострении ХОБЛ должен основываться на данных о местной бактериальной резистентности [19]. Пациентам с частыми обострениями, тяжелой обструкцией ДПи/или обострениями, требующими механической вентиляции легких, следует провести посев мокроты или других материалов из легких [19].
Показания для антибактериальной терапии (АБТ) при обострении ХОБЛ [19, 51]:
– присутствие 3-х кардинальных симптомов – усиление одышки, увеличение объема и гнойности мокроты;
– наличие 2-х из 3-х указанных симптомов в случае, если увеличение гнойности мокроты является одним из симптомов;
– пациенту требуется ИВЛ (инвазивная или неинвазивная).
В качестве начальной эмпирической терапии при обострении ХОБЛ назначаются амоксициллин/клавуланат или макролид или тетрациклин, а у отдельных пациентов – РФХ[19, 51].
При обострении ХОБЛ предполагаемый спектр наиболее вероятных возбудителей и выбор эмпирической АБТ зависит от степени тяжести заболевания и наличия факторов риска (табл. 3) [51].
Таблица 3. Наиболее вероятные возбудители обострений с учетом тяжести течения ХОБЛ [51]
|
Тяжесть течения ХОБЛ
|
ОФВ1
|
Наиболее частые микроорганизмы
|
Выбор антибактериальных
препаратов
|
|
ХОБЛ легкого и среднетяжелого течения, без факторов риска*
|
> 50%
|
Haemophilus influenzae,
Moraxella catarrhalis,
Streptococcus pneumoniae,
Chlamydophila pneumoniae,
Mycoplasma pneumoniae
|
Амоксициллин,
макролиды (азитромицин,
кларитромицин),
цефалоспорины III поколения
|
|
ХОБЛ легкого и среднетяжелого течения, c факторами риска*
|
> 50%
|
Haemophilus influenzae,
Moraxella catarrhalis,
Пенициллин-резистентный
Streptococcus pneumoniae
|
Амоксициллин/ клавуланат,
респираторные фторхинолоны
|
|
ХОБЛ тяжелого течения
|
30–50%
|
Haemophilus influenzae,
Moraxella catarrhalis,
Пенициллин-резистентный
Streptococcus pneumoniae,
Энтеробактерии грамотрицательные
|
|
|
ХОБЛ крайне тяжелого течения
|
<30%
|
Haemophilus influenzae,
Пенициллин-резистентный
Streptococcus pneumoniae,
Энтеробактерии грамотрицательные, Pseudomonas aeruginosa**
|
Ципрофлоксацин и другие препараты с антисинегнойной активностью
|
Примечания: * – факторы риска неблагоприятного исхода терапии: возраст ≥65 лет, сопутствующие сердечно-сосудистые заболевания, частые обострения (≥2 в год); ** – предикторы инфекции Pseudomonas aeruginosa: частые курсы антибиотиков (>4 за год); ОФВ1 (объем форсированного выдоха за 1-ю секунду) <30%; выделение Pseudomonas aeruginosa в предыдущие обострения, колонизация Pseudomonas aeruginosa; частые курсы системных глюкокортикостероидов (>10 мг преднизолона в последние 2 недели); бронхоэктазы.
Макролиды отличаются отсутствием перекрестной аллергии с бета-лактамными антибиотиками и часто используются при аллергии на пенициллины [2, 3, 24, 56, 57].
На современном этапе макролиды рекомендуются при анафилаксии на бета-лактамы в качестве альтернативного лечения фарингита и острого тонзиллита, вызванного стрептококком группы А [24, 62–65], острого среднего отита и острого риносинусита, так как обладают ограниченной эффективностью против Haemophilusinfluenzae и Streptococcuspneumoniae из-за повышенной к ним устойчивости [22–24, 63, 66].
Фидаксомицин рекомендован в последних руководствах по лечению Clostridiumdifficile в качестве начальной терапии, альтернативной ванкомицину, при диарее, вызванной Clostridiumdifficile, а также при рецидивирующей инфекции [9]. Более ранние рекомендации предполагают его назначение для терапии тяжелых рецидивирующих случаев из-за ограниченности данных [67].
Длительная терапия респираторных заболеваний низкими дозами макролидов
Новым направлением в респираторной медицине является длительная терапия хронических бронхолегочных заболеваний низкими дозами макролидов.
Признание иммуномодулирующих свойств препаратов этой группы привело к исследованию потенциальной пользы длительного применения низких доз макролидов при ряде хронических воспалительных заболеваний ДП, включая ХОБЛ, бронхиальную астму, муковисцидоз, бронхоэктазы, облитерирующий бронхиолит, диффузный панбронхит [19, 26, 68–71]. При таком использовании считается, что эффект реализуется через механизмы, отличные от прямого антибактериального, и обычно этот механизм описывается как иммуномодулирующий [5, 26].
Недавние исследования показали, что регулярное применение макролидных антибиотиков может снизить частоту обострений ХОБЛ [72, 73]. Так, прием азитромицина (250 мг/день или 500 мг три раза в неделю) или эритромицина (250 мг два раза в день) в течение одного года у пациентов, склонных к обострениям, снижал риск развития обострений по сравнению с обычным лечением [74–76]. Применение азитромицина было связано с увеличением частоты бактериальной резистентности, удлинением интервала QT корригированного (QTк) и нарушением слуха [76]. Последующий анализ показал меньшую пользу у активных курильщиков [77].
Возможность длительной терапии макролидами (6–12 месяцев) может быть рассмотрена для уменьшения частоты обострений у пациентов с более чем тремя обострениями ХОБЛ за год, требующими назначения стероидной терапии, и, по крайней мере, с одним обострением, требующим госпитализации [26].
Потенциальные эффекты макролидов при ХОБЛ представлены в таблице 4 [78]. Если побочные эффекты со стороны ЖКТ возникают на дозе азитромицина 500 мг трижды в неделю, можно рассмотреть возможность снижения дозы азитромицина до 250 мг трижды в неделю, при условии, что терапия макролидами принесла клиническую пользу [26].
Таблица 4. Потенциальные эффекты макролидов при ХОБЛ [78]
|
Действие макролидов
|
Предполагаемый механизм действия при ХОБЛ
|
|
Антимикробное действие
|
Прямое антимикробное действие против бактерий, обычно связанных с обострениями ХОБЛ (Haemophilus influenzae, Moraxella cataralis, Streptococcus pneumoniae,
Chlamydia pneumoniae и Mycoplasma pneumoniae).
Непрямое антимикробное действие через ингибирование чувствительности кворума бактерий
|
|
Уменьшение воспаления дыхательных путей
|
Снижают экспрессию молекул адгезии эпителиальными и эндотелиальными
клетками (ICAM-1, V-CAM-1).
Модулируют высвобождение провоспалительных цитокинов (ИЛ-1, ИЛ-6, ИЛ-8, ФНО-a).
Ингибируют сигнальные пути (транскрипционные факторы AP-1 и NK-kB).
Влияют на экспрессию и активность Toll-подобных рецепторов
|
|
Продукция слизи
|
Ингибируют индуцированную бактериями продукцию MUC5AC
Снижают секрецию белка и экспрессию мРНК MUC5AC.
Ингибируют секрецию хлоридов
|
|
Врожденный иммунитет
|
Макрофаги: усиливают фагоцитоз и дифференцировку моноцитов-макрофагов и снижают выработку металлопротеиназ.
Нейтрофилы: снижают хемотаксический ответ, эластолитическую активность и накопление в тканях.
Ингибируют образование супероксид-анионов.
Повышают активность супероксиддисмутазы
|
|
Адаптивный иммунитет
|
Лимфоциты: ингибируют выработку провоспалительных цитокинов и повышают апоптоз.
Дендритные клетки: модулируют выработку провоспалительных цитокинов
|
|
Прокинетики в желудочно-кишечном тракте
|
Уменьшают желудочно-пищеводный рефлюкс и микроаспирацию, приводящую к воспалению дыхательных путей
|
Примечание: ХОБЛ – хроническая обструктивная болезнь легких, ИЛ – интерлейкин, ФНО-a – фактор некроза опухоли a, AP-1 – активирующий белок-1, NK-kB – ядерный фактор каппа-би.
Сегодня нет данных, подтверждающих эффективность или безопасность постоянного лечения азитромицином для предотвращения обострений ХОБЛ после одного года лечения [19].
Длительное лечение макролидами (6–12 месяцев) может уменьшить частоту обострений у пациентов с бронхоэктазами с высокой частотой обострений (3 и более в год) [26, 69]. Для снижения частоты обострений назначают азитромицин 500 мг три раза в неделю, азитромицин 250 мг в день и этилсукцинат эритромицина 400 мг два раза в день. Можно использовать начальную дозу азитромицина 250 мг три раза в неделю для минимизации риска побочных эффектов с последующим ее титрованием в соответствии с клиническим ответом [26].
У пациентов с тяжелой бронхиальной астмой без признаков стойкого воспаления 2 типа рекомендуется рассмотреть дополнительную возможность длительного назначения низких доз азитромицина (на 6–12 месяцев) для снижения частоты обострений у взрослых с сохраняющимися симптомами, несмотря на высокие дозы ингаляционных стероидов (>800 мкг/день), и как минимум одним обострением за год, требующим назначения пероральных стероидов [26, 68, 79, 80].
Если при применении более высокой дозы азитромицина (500 мг трижды в неделю) возникают побочные эффекты со стороны ЖКТ, доза может быть снижена до 250 мг трижды в неделю [26].
Низкие дозы азитромицина (250 мг трижды в неделю) могут быть рассмотрены, чтобы предотвратить возникновение синдрома облитерирующего бронхиолита (СОБ) после трансплантации легких. Низкие дозы азитромицина (250 мг через день в течение пробного периода 3 месяца) могут быть также рассмотрены для лечения СОБ, возникающего у реципиентов трансплантата легких [26].
Длительная терапия макролидами назначается врачом-специалистом. Перед началом лечения рекомендуется проверить мокроту на наличие атипичных микобактерий, функциональные пробы печени и ЭКГ на предмет удлинения интервала QTк (QTк>450 мс для мужчин и >470 мс для женщин считается противопоказанием для терапии макролидами). ЭКГ и функциональные пробы печени необходимо повторить через месяц лечения, а затем контролировать каждые 6 месяцев. Пациенты должны быть проинформированы о потенциальных побочных эффектах, включая желудочно-кишечные расстройства, нарушения слуха и равновесия, сердечные эффекты и микробиологическую резистентность [26].
Безопасность макролидов
Многочисленные клинические исследования и многолетний опыт использования указывают на то, что макролиды являются одним из наиболее безопасных классов антибиотиков [10, 79–81].
Нежелательные лекарственные реакции (НЛР) при применении макролидов в большинстве случаев носят функциональный характер, являются обратимыми и проходят после завершения курса лечения [10, 79–81].
НЛР со стороны желудочно-кишечного тракта (ЖКТ) включают тошноту, рвоту, боль в животе, изменение вкуса, диспепсию и жидкий стул, возможно развитие холестатического гепатита [10, 79, 82–84].
14-членные макролиды (особенно эритромицин) оказывают стимулирующее действие на моторику ЖКТ, что может приводить к диспепсическим расстройствам, тогда как у 15- и 16-членных препаратов этот эффект менее выражен [85]. Современные макролиды, такие как азитромицин и кларитромицин, отличаются меньшим прокинетическим эффектом и лучшей переносимостью со стороны ЖКТ [10, 86].
За исключением фидаксомицина, все препараты этого класса могут вызывать повреждение печени [84]. При появлении признаков и симптомов прием препарата следует немедленно прекратить. Макролиды не следует применять у пациентов, сообщающих о повышенной чувствительности или нарушениях функции печени при предыдущем применении [84].
В клинических исследованиях пациенты также сообщали о транзиторной потере слуха, головной боли и нервно-психических расстройствах, аллергических и кожных реакциях [81, 87].
Однако аллергические реакции при приеме макролидов наблюдаются очень редко, этот класс антибиотиков считается наименее анафилактогенным [10, 88, 89]. Ранее было показано, что азитромицин вызывает аллергические реакции реже, чем другие макролиды (кларитромицин, эритромицин) [89].
Со стороны сердечно-сосудистой системы стоит отметить удлинение интервала QT и развитие фатальных аритмий, например, желудочковой тахикардии типа пируэт (torsade de pointes) [90, 91]. Макролиды не следует применять у пациентов с врожденным удлинением интервала QTк или у пациентов с проаритмическими состояниями [91].
Риск удлинения интервалаQT и развития аритмий при приеме азитромицина ниже, чем при приеме других макролидов (кларитромицин, эритромицин) [92].
Крупное многоцентровое рандомизированное контролируемое исследование с оценкой влияния двухнедельного курса кларитромицина на пациентов со стабильной ишемической болезнью сердца, которые наблюдались в течение трех лет, показало значительное увеличение смертности от сердечно-сосудистых заболеваний, связанное с применением кларитромицина [93]. 10-летнее наблюдение после первоначального исследования показало, что прием кларитромицина ассоциировался с повышенным риском смертности от всех причин и цереброваскулярных заболеваний [94].
Риски и преимущества лечения кларитромицином следует взвешивать у пациентов с предполагаемым или подтвержденным заболеванием коронарных артерий [93, 94].
Макролиды действуют на систему цитохрома (CYP) P450, следовательно, может произойти множество лекарственных взаимодействий. Некоторые взаимодействия включают статины, пимозид, колхицин, ингибиторы протеазы и блокаторы кальциевых каналов, поэтому следует соблюдать осторожность при добавлении макролида в схему лечения коморбидного пациента [95].
Азитромицин не влияет на CYP3A4 и отличается низким риском лекарственных взаимодействий и низкой гепатотоксичностью, тогда как кларитромицин и эритромицин являются сильными ингибиторами CYP3A4 [96].
Азитромицин и эритромицин относятся к категории B при беременности (нет данных о риске для человека, но остается отдаленная вероятность; исследования репродукции на животных не продемонстрировали риска для плода; не существует адекватных и контролируемых исследований у беременных). Азитромицин не противопоказан во время беременности, в период лактации может назначаться с осторожностью [24, 97].
Кларитромицин не рекомендуется применять беременным женщинам (исследования репродукции на животных показали неблагоприятное влияние на плод; текущие данные о людях недостаточны, чтобы информировать о рисках) [24, 97]. Кларитромицин в период лактации также не рекомендуется (проникает в грудное молоко в высоких концентрациях) [24, 97].
В изменениях в маркировке безопасности для фидаксомицина в соответствии с требованиями FDA по беременности и родам говорится, что в период лактации данные о людях ограничены для информирования о любом риске, связанном с приемом лекарств; однако исследования репродукции на животных не выявили доказательств вреда для плода.
Изменения в маркировке безопасности для эритромицина включают меры предосторожности, поскольку в обсервационных исследованиях были описаны сердечно-сосудистые пороки развития плода, которые произошли на фоне применения препаратов эритромицина на ранних сроках беременности [24].
В целом, макролиды отличаются благоприятным профилем безопасности.
Сегодня наиболее распространенные НЛР, наблюдаемые при приеме макролидов, связаны с ЖКТ и носят функциональный характер.
Несмотря на низкий риск развития аллергических реакций при приеме макролидов, у пациентов с отягощенным аллергологическим анамнезом следует отдать предпочтение препарату азитромицина, в составе которого не содержатся красители, которые могут вызывать аллергические реакции. Таким препаратом азитромицина является Зитмак (Nobel, Турция).
Заключение
Макролиды широко используются в современной клинической практике, обладают высокой активностью в отношении ключевых внебольничных патогенов, включая атипичные микроорганизмы, характеризуются высокой биодоступностью при пероральном приеме, удобством приема (1–2 раза в сутки), отличным проникновением в ткани и благоприятным профилем безопасности.
Уникальность современных макролидов (азитромицин, кларитромицин) заключается в наличии у них дополнительных неантимикробных эффектов (противовоспалительная и иммуномодулирующая активность).
Ограничением к использованию макролидов может быть повсеместный рост устойчивости к ним Streptococcuspneumoniae и невысокая природная активность в отношении Haemophilusinfluenzae, поэтому при выборе антибиотика следует учитывать данные о местной антибиотикорезистентности.
Новым направлением в респираторной медицине является длительная терапия хронических бронхолегочных заболеваний низкими дозами макролидов, в основе которой лежит иммуномодулирующий механизм (азитромицин 250–500 мг три раза в неделю в течение 6–12 месяцев).
Л И Т Е Р А Т У Р А
1. Mazzei T, Mini E, Novelli A., et al. // J Antimicrob Chemother. – 1993. – Vol.31. – P.1–9.
2. Kwiatkowska B., Maslinska M. // Mediators of Inflammation. – 2012, Article ID 636157, 7 pages doi:10.1155/2012/636157
3. Dinos G.P. // British Journal of Pharmacology. – 2017. – Vol.174. – P.2967–2983. doi:10.1111/bph.13936
4. National Center for Biotechnology Information, база данных PubChem: www.pubchem.ncbi.nlm.nih. gov, дата доступа 30.05.2023.
5. Spagnolo P., Fabbri L.M., Bush A. // Eur Respir J. – 2013. – Vol.42. – P.239–251. doi: 10.1183/09031936.00136712
6. Cornely O.A., Crook D.W., Esposito R., et al. // Lancet Infect Dis. – 2012. – Vol.12, N4. – P.281–289.
7. Crook D.W., Walker A.S., Kean Y., et al. // Clin Infect Dis. – 2012. – Vol.55, Suppl.2. – S93–S103. doi: 10.1093/cid/cis499.
8. Louie T.J., Miller M.A., Mullane K.M., et al. // N Engl J Med. – 2011. – Vol.364. – P.422–431.
9. McDonald LC, Gerding DN, Johnson S., et al. // Clin Infect Dis. – 2018. – Vol.66, N7. – P.987–994. doi: 10.1093/cid/ciy149
10. Синопальников А.И., Андреева И.В., Стецюк О.У. // Клиническая медицина. – 2012. – №3. – С.23–30.
11. Takizawa H., Desaki M., Ohtoshi T., et al. // Am J Respir Crit Care Med. – 1997. – Vol.156. – P.266–271.
12. Desaki M., Okazaki H., Sunazuka T., et al. // Antimicrob Agents Chemother. – 2004. – Vol.48. – P.1581–1585.
13. Kusano S., Kadota J., Kohno S., et al. // Respiration. – 1995. – Vol.62. – P.217–222.
14. Rubin B.K. // Am J Med. – 2004. – Vol.117, Suppl.9A. – P.2–4.
15. Kanoh S., Rubin B.K. // Clinical Microbiology Reviews. – 2010. – Vol.23, N3. – P.590–615.
16. Tamaoki J., Takeyama K., Tagaya E., et al. // Antimicrob Agents Chemother. – 1995. – Vol.39. – P.1688–1690.
17. Bearden D.T., Rodvold K.A. // Infect Med. – 1999. – Vol.16. – P.480–484.
18. Metlay J.P., et al. // Am J Respir Crit Care Med. – 2019. – Vol.200, №7. – e45–e67.
19. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease (2023 report) [Electronic resource]. – 194 p. – Mode of access: http://www.goldcopd.org. – Date of access: 1.06.2023.
20. Centers for Disease Control and Prevention. Antibiotic/Antimicrobial Resistance (AR/AMR). 2020. [Electronic resource]. – Mode of access: https://www. cdc.gov/drugresistance/index.html. – Date of access: 31.05.2023.
21. World Health Organization. Antibiotic Resistance. 2020. [Electronic resource]. – Mode of access: https://www.who.int/news-room/fact-sheets/detail/ antibiotic-resistance. – Date of access: 31.05.2023.
22. Иванчик Н.В. [и др.] // Клин. микробиол. антимикроб. химиотер. – 2019. – №4. – С.317–323.
23. Иванчик Н.В. [и др.] // Клин. микробиол. антимикроб. химиотер. – 2019. – Т.21, №3. – С.230–237.
24. Стратегия и тактика рационального применения антимикробных средств в амбулаторной практике: Евразийские клинические рекомендации / под ред. С.В. Яковлева [и др.]. – М., 2016. – 144 с.
25. Рекомендации МАКМАХ «Определение чувствительности микроорганизмов к антимикробным препаратам (2021)». Режим доступа: https://www.antibiotic.ru/minzdrav/category/clinical-recommendations. – Дата доступа: 29.05.2023.
26. Smith D., Ingrid D.R., Louise A.C., et al. // Thorax. – 2020. – Vol.0. – P.1–35. doi:10.1136/thoraxjnl-2019-213929
27. Drugs@FDA 2019, Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations 2019
28. Laopaiboon M., Panpanich R., Swa Mya K. // Cochrane Library. – 2015. – Issue 3. http://www.thecochranelibrary.com. – Date of access: 31.05.2023.
29. Wang J., Xu H., Liu P., et al. // Int J Chron Obstruct Pulmon Dis. – 2017. – Vol.12. – P.2391–2405.
30. Venuta A., Laudizi L., Beverelli A., et al. // J Int Med Res. – 1998. – Vol.26. – P.152–158.
31. Drehobl M., De Salvo M., Lewis D., et al. // Chest. – 2005. – Vol.128, N4. – P.2230–2238.
32. O’Doherty B., Muller O., et al. // Eur J Clin Microbiol Infect Dis. – 1998. – Vol.17. – P.828–833.
33. Kwak N., Park J., Kim E., et al. // Clin Infect Dis. – 2017. – Vol.3. doi: 10.1093/cid/cix517
34. Pierce M., Crampton S., Henry D., et al. // N Engl J Med. – 1996. – Vol.335, N6. – P.384–391.
35. Pichichero M., Hoeger W., Casey // J. Pediatri Infect Dis J. – 2003. – Vol.22, N9. – P.847–849.
36. Aoyama T., Sunakawa K., Iwata S., et al. // Journal of Pediatrics. – 1996. – Vol.129, N5. – P.761–764.
37. Langley J., Halperin S., Boucher F., et al. // Pediatrics. – 2004. – Vol.114, N1. – e96–e101.
38. Lebel M., Mehra S. // Pediatr Infect Dis. – 2001. – Vol.20. – P.1149–1154.
39. Block S. // Clin Pediatr. – 2006. – Vol.45. – P.641–648.
40. Ceccato Adrian, Cilloniz C., Martin-Loeches I., et al. // CHEST. – 2019. – Vol.155, N4. – Vol.795 – P.804.
41. Anderson R., Feldman C. // Int. J. Mol. Sci. – 2023. – Vol.24. – 11038. https://doi.org/10.3390/ ijms241311038
42. König R., Cao X., Oswald M., et al. // Eur Respir J. – 2019. – Vol.54. – 1900824 [https://doi.org/10.1183/13993003.00824-2019].
43. Chowers M., Gerassy-Vainberg S., Cohen-Poradosu R., et al. // Clinical Infectious Diseases. – 2022. – Vol.75. – P.2219–2224.
44. Kyprianou M., Dakou K., Aktar A., et al. // Int J Antimicrob Agents. – 2023. – Vol.2. – P.106942. doi: 10.1016/j.ijantimicag.2023.106942
45. Lee J.H., Kim H. J., Kim Y.H. // J Korean Med Sci. – 2017. – Vol.32. – P.77–84.
46. Savaris R.F., Fuhrich D.G., Duarte R.V., et al. // Cochrane Library 2017, Issue 4. http://www.thecochranelibrary.com. – Date of access: 31.05.2023.
47. Páez-Canro C., Alzate J.P., González L.M., et al. // Cochrane Database Syst Rev. – 2019. – Vol.1. – CD010871. doi: 10.1002/14651858.CD010871.pub2.
48. Nelson R.L., Suda K.J., Evans C.T. // Cochrane Database Syst Rev. – 2017. – Vol.3. – CD004610.
49. Beinortas T., Burr N.E., Wilcox M.H., et al. // Lancet Infect Dis. – 2018. – Vol.18, N9. – P.1035–1044. doi: 10.1016/S1473-3099(18)30285-8
50. Centers for disease control and prevention. Pertussis (Whooping cough). Timing and antimicrobial choice, 2017.
51. Чучалин А.Г., Авдеев С.Н., Айсанов З.Р. [и др.] // Пульмонология. – 2022. – Vol.32, N3. – P.356–392. doi: 10.18093/0869-0189-2022-32-3-356-392
52. Panel on Opportunistic Infections in HIV-Exposed and HIV-Infected Children. Guidelines for the prevention and treatment of opportunistic infections among HIV-exposed and HIV-infected children: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, the HIV Medicine Association of the Infectious Diseases Society of America, the Pediatric Infectious Disease Society, and the American Academy of Pediatrics. Updated 2019[b] Feb 8. https://aidsinfo.nih.gov/contentfiles/lvguidelines/ oi_guidelines_pediatrics.pdf. Date of access: 1.06.2023.
53. Uthman M., Uthman O.A. Yahaya I. Cochrane Library 2013, Issue 4. http://www.thecochranelibrary.com. Date of access: 1.06.2023.
54. Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in HIV-infected adults and adolescents: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. Updated 2019[a] March 28. http://aidsinfo.nih.gov/contentfiles/lvguidelines/adult_oi.pdf. Date of access: 1.06.2023.
55. Chey W.D., Leontiadis G.I., Howden C.W., et al. // Am J Gastroenterol. – 2017. – Vol.112. – P.212–238.
56. Workowski K.A., Bolan G.A. // Recomm Rep. – 2015. – Vol.64, RR-03. – P.1–37.
57. Stevens D.L., Bisno A.L., Chambers H.F., et al. // Clin Infect Dis. – 2014. – Vol.18 [ePub]. – P.1–43.
58. Клинический протокол диагностики и лечения пневмонии: приложение 2 к приказу Министерства здравоохранения Республики Беларусь от 05.07.2012 г. №768.
59. Рекомендации (временные) об организации оказания медицинской помощи пациентам с инфекцией COVID-19: утв. приказом М-ва здравоохранения Республики Беларусь от 22.06.2022 г. №841.
60. Внебольничная пневмония у взрослых: клинические рекомендации МЗ РФ / Российское респираторное общество, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии, 2021. – 126 с.
61. Рекомендации МАКМАХ «Определение чувствительности микроорганизмов к антимикробным препаратам (2021). Режим доступа: https://www.antibiotic.ru/minzdrav/category/clinical-recommendations. – Дата доступа: 31.05.2023.
62. Shulman S.T., Bisno A.L., Clegg H.W., et al. // Clin Infect Dis. – 2012. – Vol.55, Т10. – e86–e102. doi: 10.1093/cid/cis629.
63. Short S., Bashir H., Marshall P., et al; Institute for Clinical Systems Improvement. Diagnosis and treatment of, respiratory illness in children and adults. https://www.icsi.org/wp-content/uploads/2019/01/RespIllness.pdf. Updated September 2017. – Date of access: 31.05.2023.
64. van Driel M.L., De Sutter A., Habraken H., et al. // Cochrane Library. – 2016, Issue 9. http://www.thecochranelibrary.com. – Date of access: 31.05.2023.
65. Клинический протокол «Диагностика и лечение пациентов с инфекционными и паразитарными заболеваниями»: МЗ РБ от 13.12.2018 г. №94.
66. Острый риносинусит: клинические рекомендации МЗ РФ (пересмотр 2021) / под ред. А.С. Лопатина, В.В. Шиленковой. – М., 2021. – 41 с.
67. Surawicz C.M., Brandt L.J., Binion D.G., et al. // Am J Gastroenterol. – 2013. – Vol.108. – P.478–498. http://d2j7fjepcxuj0a.cloudfront.net/wp-content/uploads/2013/04/ACG_Guideline_Cdifficile_April_2013.pdf. – Date of access: 28.05.2023.
68. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2023. Updated July 2023. [Electronic resource]. – 245 p. – Mode of access: www.ginasthma.org – Date of access: 1.06.2023.
69. Lee E., Sol I.S., Kim J.D., et al. // Scientific Reports. – 2021. – Vol.11. – P.24287. – doi.org/10.1038/s41598-021-03778-8
70. Mogayzel P.J., Naureckas E.T., Robinson K.A., et al. // Am J Respir Crit Care Med. – 2013. – Vol.187, №7. – P.680–689.
71. Lin X., Lu J., Yang M., et al. // Cochrane Database Syst Rev. – 2015. – Vol.1. – CD007716.
72. Herath S.C., Poole P. // Cochrane Database Syst Rev. – 2013. – Vol.11. – CD009764.
73. Ni W., Shao X., Cai X., et al. // PLoS One. – 2015. – Vol.10, Т3. – e0121257.
74. Seemungal T.A., Wilkinson T.M., Hurst J.R. // Am J Respir Crit Care Med. – 2008. – Vol.178, N11. – P.1139–1147.
75. Uzun S., Djamin R.S., Kluytmans J.A., et al. // Lancet Respir Med. – 2014. – Vol.2, N5. – P.361–368.
76. Albert R.K., Connett J., Bailey W.C., et al. // N Engl J Med. – 2011. – Vol.365, N8. – P.689–698.
77. Han M.K., Tayob N., Murray S., et al. // Am J Respir Crit Care Med. – 2014. – Vol.189, N12. – P.1503–1508.
78. Blasi F., Mantero M., Aliberti S. // Curr Opin Pharmacol. – 2012. – Vol.12. – P.293–299.
79. Gibson P.G., Yang I.A., Upham J.W., et al. // Lancet. – 2017. – Vol.390. – P.659–668.
80. Brusselle G.G., Vanderstichele C., Jordens P., et al. // Thorax. – 2013. – Vol.68. – P.322–329.
81. Alsowaida Y.S., Almulhima A.S., Oha M., et al. // International Journal of Pharmacy Practice. – 2021. – Vol.29. – P.21–28. doi:10.1111/ijpp.12670
82. Reiter J., Demirel N., Mendy A., et al. // Allergy. – 2013. – Vol.68. – P.1040–1049.
83. Fan L-C., Lu H-W., Wei P., et al. // BMC Infect Dis. – 2015. – Vol.15. – P.160.
84. Sundaram V., Björnsson E.S. // Hepatol Commun. – 2017. – Vol.1. – P.726–735.
85. Broad J., Sanger G.J. // Br J Pharmacol. – 2013. – Vol.168. – P.1859–1867.
86. Caron F., Bouaniche M., Delatour F., et al. // Antimicrob Agents Chemother. – 1996. – Vol.40. – P.1796–1800.
87. Ikeda A.K., Prince A.A., Chen J.X., et al. // Laryngoscope. – 2018. – Vol.128. – P.228–236.
88. Araújo L., Demoly P. // Curr. Pharm Des. – 2008. – Vol.14, N27. – P.2840–4862.
89. Demoly P., Benahmed S., Valembois M., et al. // Presse Med. – 2000. – Vol.29, N6. – P.321–326.
90. Albert R.K., Schuller J.L. // Am J Respir Crit Care Med. – 2014. – Vol.189. – P.1173–1180.
91. Lu Z.K., Yuan J., Li M., et al. // Expert Opin Drug Saf. – 2015. – Vol.14. – P.295–303.
92. Strle F., Maraspin V. // Wien. Klin. Wschr. – 2002. – Vol.114, N10–11. – P.396–399.
93. Jespersen C.M., Als-Nielsen B., Damgaard M., et al. // BMJ. – 2006. – Vol.332, N7532. – P.22–27.
94. Winkel P., Hilden J., Hansen J.F., et al. // Int J Cardiol. – 2015. – Vol.182. – P.459–465. doi:10.1016/j.ijcard.2015.01.020
95. Tatro D.S., ed. Drug Interactions Facts. St Louis: Facts and Comparisons, 1999.
96. Zhou Q., Yan X.F., Zhang Z.M., et al. // Wld J. Gastroenterol. – 2007. – Vol.13, N42. – P.5618–5628.
97. Клинический протокол «Медицинское наблюдение и оказание медицинской помощи женщинам в акушерстве и гинекологии»: Постановление Министерства здравоохранения Республики Беларусь от 19.02.2018 г. №17.
Медицинские новости. – 2023. – №9. – С. 19-27.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.