|

В. И. Вотяков, Н. П. Мишаева, Ю. А. Грачев, И. К. Зубович
Проблемы клинико-вирусологической диагностики, патогенеза и постэкспозиционной профилактики бешенства
Белорусский НИИ эпидемиологии и микробиологии, Антивирусная Ассоциация РБ
В 1994 г. исполнилось 110 лет со дня выступления во Французской Академии наук Л. Пастера о результатах иммунизации собак ослабленным ("фиксированным") вирусом бешенства. Иммунизация проводилась немедленно после заражения и предотвратила у животных развитие клинически выраженного заболевания. Этот метод иммунизации открыл перспективы спасения людей от болезни, известной человечеству более 4000 лет. Постэкспозиционное лечение вакциной и антирабическим иммуноглобулином в настоящее время проводится всем людям, укушенным бешеными животными.
Этиология и вирусологическая диагностика. Вирус бешенства принадлежит обширному семейству рабдовирусов. Оно включает три рода: везикуло-, планта- и лиссавирусов [3, 9, 28, 41]. Вирус бешенства входит в род лиссавирусов (рисунок).
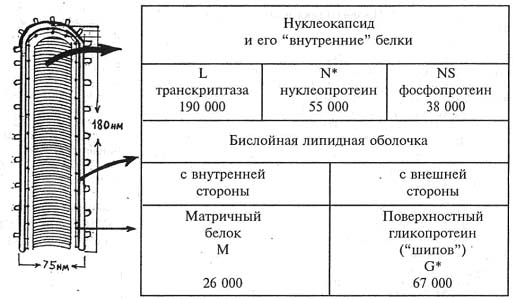
Схема строения вириона рабдовируса и расположение в нем белков. Цифрами представлены данные по молекулярному весу белков вируса бешенства; звездочкой обозначены наиболее хорошо изученные из них
По современным данным, вирус состоит из 5 белков: L, N, NS, М и G (рисунок). 3 белка — L, N, NS (внутренние) — входят в состав нуклеокапсида в виде комплекса с РНК. Белки L и NS обеспечивают транскрипцию и репликацию, NS играет конформационную роль. Белок М (матричный) примыкает к нуклеокапсиду, белок G расположен на поверхности вириона. Оба последних белка находятся в бислойной оболочке вируса. Понимание функций белков и их расположение в вирионе помогает понять репликацию вируса и патогенез болезни, а также определить подходы к лечению, созданию вакцин и диагностических препаратов.
Методы вирусологической диагностики и идентификации вируса бешенства основываются на изоляции вируса, типировании моно- и поликлональными антителами, выявлении антигена вируса или антител. Выявление антигена проводится методом флюоресцирующих антител (МФА) с изотиоционатом. Следует иметь в виду, что МФА чаще дает положительные результаты в финальных стадиях заболевания, и чувствительность его выше при исследовании биоптатов кожи. Для эпидемиологических исследований используется вариант ELISA (сорбентного метода с иммобилизованным ферментом), дающий быстрые ответы. Успешно выявляется антиген нуклеокапсида, но материал не должен быть фиксирован формалином. Обычно используются ткани головного мозга. В лабораториях, занимающихся молекулярной биологией, применяются реакция цепей полимеразы (РЦП), методы клонирования и определения последовательностей аминокислотных остатков в вирусных белках, что дает возможность характеризовать определенные участки генома вируса и способствовать успешной идентификации лиссавирусов.
Для изоляции и идентификации вируса используются моно- и поликлональные антитела, а также молекулярно-биологические методы.
Для выявления антител применяется реакция нейтрализации на мышах (РНМ) или тест быстрого ингибирования очагов флюоресценции (ТБИОФ). Для титрования уровня антител используется вариант ELISA.
Клиническая диагностика бешенства у человека. Диагноз бешенства ставится, как правило, на основе клинических данных.
Инкубационный период варьирует. В 84% случаев он находится в пределах 12—99 дней [18], но описаны случаи с 7-дневным инкубационным периодом и продолжительностью 2—3 и даже 18—20 лет.
В классическом виде заболевание включает три стадии — продромальную, возбуждение и паралитическую.
В продромальной стадии диагноз основывается на симптомах со стороны ЦНС в виде беспричинной тревоги и страха, депрессии. В месте укуса ощущается жжение, гиперчувствительность, боль. Продолжительность стадии — 1—3 дня.
Для стадии возбуждения (продолжительность — 2—3 дня) характерны различные фобии, являющиеся отражением резкой симпатикотонии: это гидро-, аэро-, акустико- и фотофобии, выражающиеся прежде всего мучительными спазмами мышц глотки и гортани с нарушением дыхания. Отмечаются зрительные и слуховые галлюцинации, слюнотечение.
Паралитическая стадия самая короткая (1 день). Ранние ее симптомы — отеки мышц, прежде всего дыхательных (выявляются перкуторно) и дельтовидных. В связи с поражением волосяных мешочков отмечается пилоэрекция ("гусиная кожа"). Вследствие выпадения деятельности коры большого мозга и подкорковых образований развиваются распространенные параличи. Смерть наступает от паралича дыхания и упадка сердечной деятельности.
В течении заболевания может отсутствовать продрома или стадия возбуждения и сразу развивается паралитическая. Причем она может быть выражена либо в виде бульбарной формы, или паралича Ландри, либо мозжечковой, или синдрома Гийена—Барре (острой полирадикулоневропатии с коротким течением). Распространение инфекционного процесса идет по типу энцефаломиелополирадикулоневрита [18]. Длительность заболевания может составлять один день, наблюдается и "спокойная" форма, особенно у детей и женщин.
В инкубации и продроме температура иногда повышается (на 5—8-й день после укуса). Особенно высокая температура наблюдается улиц, укушенных волками. Она держится от нескольких часов до двух дней. Повышение температуры может повторяться, что является плохим прогностическим признаком. Такие больные обычно быстро погибают. Как правило, температура повышается к концу заболевания. Параличи развиваются также при высокой температуре. Имеются случаи посмертного повышения температуры до 42—43° [18].
Таким образом, в свете имеющихся литературных данных острое бешенство у людей по клинической выраженности варьирует от классического 7-дневного типа до скоротечного однодневного паралитического бешенства или проявляющегося отдельными неврологическими синдромами типа Гийена—Барре.
Заболевание и в классическом виде, и в вариациях заканчивается летальным исходом. Описаны редкие, так называемые "абортивные" формы бешенства без летального исхода [17, 18, 22].
В связи с выздоровлением больных после "абортивного" бешенства выдвигается требование настойчивого интенсивного реанимационного лечения заболевших с использованием всех методов, в том числе и находящихся в стадии экспериментальной проработки.
Интересны данные А. П. Зинченко [11] по обследованию 329 пациентов с заболеваниями нервной системы на наличие вируснейтрализующих антител в отношении вируса из группы бешенства. У 71 больного (22%) были зарегистрированы антитела в титре 2 lg IN и более. В подавляющем большинстве случаев (98,2%) наблюдались разнообразные нейроинфекционные синдромы и лишь иногда (1,8%) встречались заболевания явно неинфекционной природы. В данном случае речь может идти о хронически протекающей рабической инфекции с нехарактерной для клиники бешенства симптоматикой либо о бессимптомном носительстве вируса бешенства с ослабленной вирулентностью.
Понимание широким кругом врачей многообразия клинической манифестации и возможности бессимптомного носительства вируса бешенства важно и потому, что в практике здравоохранения приходится встречаться с регистрацией бешенства, казалось бы, в совершенно неожиданных ситуациях — после пластических операций, при трансплантации органов и тканей, при обследовании инфекционных больных. Роговица, взятая от умершего больного с неясными неврологическими симптомами и пересаженная здоровому человеку, привела его к гибели от бешенства. Поэтому не рекомендуется использовать трансплантаты от лиц с неврологическими проявлениями [17].
Патогенез бешенства. Рассмотрим основной (нейрогенный) путь распространения вируса, его повреждающее действие на нервную систему и иммунологический ответ.
Известно, что на поверхности клеток нет специальных рецепторов для вирусов. Имеются лишь рецепторы, которые обеспечивают клетку жизненно важными продуктами — гормонами, питательными веществами, факторами роста и т.д. Эти рецепторы и используют вирусы для проникновения в клетку. Следует иметь в виду, что первичным местом пребывания вируса являются кожа, слизистые, мышцы, где он длительно (до 18 сут) сохраняется [1].
Контакт вируса с нервными образованиями происходит уже в воротах инфекции. Установлено, что ганглиозиды — физиологические рецепторы клетки для гормонов, интерферона и других биологических агентов — обладают рецепторными свойствами для рабдовирусов [38]. Рецепторами для вируса являются также ацетилхолиновые рецепторы клеток [15]. Поверхностный гликопротеид G вируса имеет участок "узнавания" в виде аминокислотного сегмента 151—238. Как установлено, он гомологичен змеиному яду и другим нейротоксинам [39]. Во взаимодействии не принимают участия ни сиаловые кислоты клеточных рецепторов, ни N-ацетил-нейраминовая кислота белка G, являющаяся концевым остатком гликозидной части белка [16]. Популяции нейронов вовлекаются избирательно в соответствии со степенью специфического аффинитета к рецептору вируса [15].
Распространение вируса осуществляется в основном в нервной системе [2]. Механизм движения вируса связан с внутриаксональным транспортом [40] или электромагнитными полями [24], возникающими в момент прохождения нервного импульса. Считается, что скорость движения вируса равна примерно 3 мм/ч. Направление движения вируса в начале болезни центростремительное — в ЦНС [15, 22], затем центробежное — во все нервные образования. Таким образом, во время болезни поражается вся нервная система. Во второй фазе заболевания не исключается дополнительное гематогенное распространение вируса [31].
Развитие заболевания бешенством ассоциируется со вторичной локализацией вируса [35].
В результате комплексного функционирования всех белков вируса наступают наиболее драматические деструктивные процессы в нейронах. По морфологическим данным, разрушение нейронов подтверждается прежде всего вакуолизацией цитоплазмы и деструкцией ядер, демиелинизацией и распадом осевых цилиндров. Указанные изменения отмечаются во всех отделах ЦНС. Особенно сильное разрушение нейронов наблюдается в зрительном бугре, подбугорной области, в черном веществе и ядрах черепных нервов, а также в среднем мозге, базальных ганглиях и в мосту мозга. Максимальные изменения имеют место в продолговатом мозге. Наряду с разрушением нейронов отмечается полнокровность, отечность, кровоизлияния и острые воспалительные процессы. Известно, что тельца Бабеша—Негри (ацидофильные включения с базофильными гранулами) в цитоплазме являются патогномоничными для бешенства. Считается, что разного рода тельца или включения при вирусных инфекциях (Бабеша—Негри, Пашена, Гварниери и т.д.) — это либо скопления вирионов в цитоплазме или ядрах (нередко имеющие кристаллоподобную структуру), либо своеобразные "фабрики", где синтезируется вирус, либо скопления компонентов вируса или продуктов деградации клеток. Большей частью включения представляют собой "вирусные фабрики", т. е. очаги, в которых происходят транскрипция и репликация вирусных геномов, а также сборка вирусных частиц [2, 22]. Поэтому представляет интерес тот факт, что в нейронах наряду с деструктивными признаками находят по несколько таких телец. Максимальное количество телец обнаруживают в гиппокампе (аммоновом роге — возвышении на медиальной стенке нижнего рога бокового желудочка), а также в слое пирамидных клеток коры большого мозга, слое грушевидных нейронов мозжечка, крупных нейронах базальных ганглиев и нейронах спинного мозга, правда, в меньших количествах.
Поскольку вирус уже в инкубационном периоде проникает в ЦНС, в частности в продолговатый мозг, то становится очевидным, что в период клинической манифестации многие повреждения уже произошли.
Привлекает внимание определенное несоответствие в патологических проявлениях, связанных с поражением ЦНС и иммунной системы при бешенстве, в местах репродукции вируса и в отдалении от них. Если говорить о местах репродукции вируса по локализации телец Бабеша—Негри и патологии нейронов, то достоверно установлено, что патология нейронов в ЦНС выражена в широких границах и поражает даже белое вещество, т.е. наблюдается в отдалении от мест репродукции вируса. Однако, несмотря на репродукцию вируса в ЦНС, в ней не отмечается массивных необратимых очаговых поражений, как, например, при герпетическом энцефалите, что подтверждается отсутствием остаточных неврологических явлений у больных, выздоровевших от "абортивного" (нелетального) бешенства. В то же время при бешенстве наблюдается клиническое течение по типу тяжелого энцефаломиелорадикулоневрита с расстройством интеграционной деятельности ЦНС и летальным исходом. Смерть наступает от остановки дыхания не вследствие паралича дыхательного центра по причине его деструкции, а из-за паралича дыхательных мышц и мышц глотки и гортани. Указанные несоответствия в экспрессии патологии в местах репродукции вируса и в отдаленных местах можно объяснить чрезвычайно высоким вирусным токсикозом. Известно, что вирусы не имеют токсинов, их токсическое действие проявляется через накопление токсических вирусных продуктов — белков, липо- и гликопротеидов. Токсические продукты, связанные с накоплением вируса, — по-видимому, решающий фактор развития скоротечного разлитого и фатального процесса.
Мерами предупреждения фатального развития патологии являются ограничение репродукции вируса как продуцента токсических субстанций и сбалансирование компенсаторных и иммунологических реакций. В этих условиях ЦНС и иммунная система смогли бы выполнять свои жизненно важные функции.
Постэкспозиционная иммунизация как метод формирования компенсаторного звена патогенеза. Давно известно, что у выздоровевших от бешенства животных наблюдаются высокие титры вируснейтрализующих антител (ВН-антитела), а у погибших ВН-антитела или вовсе не регистрируются, или регистрируются в очень низких титрах [6, 15]. Исходя из этого можно предположить, что при остром и быстром развитии патологического процесса при бешенстве иммунологический ответ организма, с одной стороны, не успевает сформироваться, а с другой — в связи с большими дозами вируса в организме и значительным токсическим воздействием на нее иммунная система не в состоянии осуществить иммуногенез и защитить организм от инфекции. Данные работы [15] о заражении животных малыми дозами вируса, вызывающими гибель некоторых из них, свидетельствуют, что у выздоровевших малые дозы достаточны для пролиферации антигенно специфических клонов и защиты животных, хотя у них в ЦНС длительное время обнаруживается вирус.
Изучение патогенеза бешенства показывает, что возможность летального исхода зависит от трех основных условий: 1) большой стартовой дозы вируса, попавшей в организм и подавляющей сбалансированное функционирование иммунной системы и ЦНС; 2) проникновения вируса в месте с высоким аффинитетом популяции нейронов к рецептору вируса; 3) короткого инкубационного периода.
Выздоровление, напротив, определяется защитными иммунологическими реакциями. Для оптимального их проявления необходимы прямо противоположные условия: 1) небольшие стартовые дозы "дикого" вируса, достаточные лишь для пролиферации антигенспецифичес-ких клонов лимфоидных клеток; 2) место проникновения вируса с низким аффинитетом нейронов; 3) длительный инкубационный период.
В результате широкого внедрения постэкспозиционной вакцинации развитие патологического процесса, вызываемого "диким" вирусом, в инкубационном периоде и при манифестации клиники, как правило, совмещается с процессом иммуногенеза, определяемого вакциной. Это диктует необходимость изучения патогенеза в данных условиях. Известно, что иммуногенез в сжатые сроки осуществляется в случае интенсивного "многоточечного" введения в дельтовидные мышцы высокоантигенной вакцины. Подъем клеточного иммунитета начинается уже через 6 ч, а образование антител — через 5 дней. Эта схема получила название "3—1" (три прививки по одной дозе в обе дельтовидные мышцы с одной ревакцинацией на 7-й день).
Применение в начале вакцинации, состоящей из двух доз, по одной дозе в каждую дельтовидную мышцу приводит к увеличению периода вакцинации до 12 дней (схема "2—1—1"). В настоящее время используются и более длительные (пятикратные) схемы иммунизации при введении вакцины в дельтовидные мышцы.
Если в свое время данные об отсутствии антител у погибших от бешенства животных и высокий уровень антител у выздоровевших служили доказательством целесообразности применения антирабического иммуноглобулина при постэкспозиционной вакцинации, то при вакцинации, вызывающей раннюю выработку антител, введение иммуноглобулина, по-видимому, нецелесообразно, так как наблюдается подавление образования антител в течение двух недель. Этот вопрос требует дальнейшего изучения.
Чтобы добиться выработки иммунитета при постэкспозиционной вакцинации в краткие сроки, необходимо:
1) применять высокоочищенные и высокоантигенные вакцины;
2) использовать для внутримышечного введения вакцины лучшую нервно-рецепторную зону — дельтовидные мышцы;
3) "многоточечное" введение двух или трех доз вакцины в начале вакцинации (0-й день).
Соблюдение этих условий приводит к значительному сокращению периода выработки иммунитета и предотвращению манифестации клиники.
Необходимость применения высокоочищенных вакцин у прививающихся, естественно, ставит вопрос об исключении использования вакцин из нервной ткани, так как они содержат энцефалитогенные субстанции.
Современные схемы постэкспозиционной активной и пассивной иммунизации. Становление современных схем активной иммунизации основывалось на эволюции знаний в области усовершенствования вакцины, практики ее применения и изучения патогенеза. Длительное время вакцина изготавливалась из нервной ткани, которая содержала энцефалитогенные субстанции — базальный белок миелина, ганглиозидные и фосфолипидные субстанции (вакцины типа Semple и Ферми). Эти субстанции вызывали неврологические осложнения типа тяжелых энцефаломиелитов, нередко с летальным исходом [28, 30, 32, 33, 36]. Кроме того, вакцины содержали много балластных веществ, обладали тромбокиназной активностью и при внутримышечном введении повышался риск шоковых осложнений в результате попадания вакцины в просвет кровеносных сосудов, т. е. образования тромбов и эмболии. Внутрикожное введение такого рода вакцин вызывало местные некрозы кожи (поскольку вакцины содержали фенол).
Самым безопасным со времен Пастера считалось введение вакцины в подкожную клетчатку живота (5—6 см от средней линии на уровне или чуть ниже пупка с попеременной сменой стороны введения) при исключении попадания иглы в кровеносный сосуд или, в крайнем случае, в межлопаточную область.
Усовершенствование вакцин из нервной ткани шло по пути снижения энцефалитогенных субстанций и фенола и применения средств, уменьшающих риск неврологических реакций, например дексаметазона. Однако его использование вызывает значительное снижение образования вируснейтрализующих антител и приводит к необходимости двухкратного увеличения иммунизирующей дозы.
Серьезным успехом в снижении содержания энцефалитогенных субстанций было изготовление вакцин из нервной ткани новорожденных мышей (в возрасте не более одного дня) центрифугированием ткани головного мозга при 17 000 об/мин в течение 10 мин. Такого рода вакцины не содержали миелина, и неврологические осложнения наблюдались значительно реже.
Шагом вперед было создание высокоочищенной вакцины, приготовленной из утиных эмбрионов с инактивированием фиксированного вируса пропилактоном. Вакцина не вызывала тяжелых осложнений, лишь изредка после введения бустерных доз регистрировались слабовыраженные реакции, сходные с сывороточной болезнью либо с крапивницей.
Крупным достижением стала разработка методов изготовления вакцин на культурах клеток. Используются первичные клетки почек хомяков, собак, фибробласты утиного эмбриона, линии диплоидных клеток человека, обезьян-резусов и перевиваемые клетки Vero.
В последнее время обращено внимание на возможность изготовления вакцин для людей на клетках почек хомяков-сосунков (линия 21) в связи с высоким выходом вируса на этих клетках, что исключает необходимость его концентрации в процессе производства вакцины [17].
Культуральные убитые вакцины, содержащие в одной дозе 2,5 ME, являются безопасными и высокоиммуногенными. Они не содержат не только энцефалитогенных субстанций, но и живого вируса, каких-либо остаточных количеств пропилактона и других веществ, например антибиотиков и т.д.
Высокоочищенные культуральные вакцины позволили использовать наиболее оптимальные нервно-рецепторные зоны для введения вакцины. В настоящее время наилучшей зоной считаются дельтовидные мышцы [25, 27, 29, 36], непригодной — ягодичные, поскольку при иммунизации в эту зону плохо или вовсе не образуются вируснейтрализующие антитела. В крайнем случае вакцина вводится в передние мышцы бедра, например у маленьких детей. При необходимости экономии вакцины используют схемы внутрикожной иммунизации, так как в этом случае ее расходуется в несколько раз меньше.
Кроме уже упомянутых схем иммунизации "3—1" (с недельным интервалом) и "2—1—1" (соответственно на 0—7-й и 12-й дни) наиболее распространенной является схема из пяти прививок по одной дозе, причем первые две — через 3 дня, а две последующие — с недельным интервалом. Последняя (пятая) прививка проводится на 30-й день (ревакцинация). Выбор схем основан на оценке длительности инкубационного периода.
Считается, что при бешенстве инкубационный период достаточно длительный. Короткий инкубационный период наблюдается при укусах дикими плотоядными животными, особенно волками, в область лица, головы, пальцев рук и чаще у детей. Если предполагается короткий инкубационный период, естественно, следует остановиться на более интенсивных схемах иммунизации.
Раньше считалось, что для эффективности вакцинации (при использовании старых вакцин, по-видимому, менее антигенных по сравнению с современными) необходимо, чтобы инкубационный период был не короче 45 дней. Это обстоятельство потребовало введения терминов "редуцированная" и "общая смертность". Редуцированная смертность может быть вызвана заболеванием, зарегистрированным после 30-го дня от начала вакцинации, т.е. по окончании полного курса прививок. Если же заболевания развивались во время курса прививок, то для оценки эффективности вакцинации они не учитывались. Эти случаи связаны, с одной стороны, с коротким инкубационным периодом, когда иммунитет не успевает выработаться из-за недостатка времени, а с другой — с нарушениями при проведении прививок (неполный и беспорядочный курс, несоблюдение режима лечения, употребление алкоголя, охлаждение, перенапряжение), т.е. с отсутствием необходимых условий для выработки иммунитета.
В общую смертность, таким образом, входят все летальные случаи, связанные, с одной стороны, с отсутствием требуемых условий для формирования иммунитета, а с другой — с качеством самой вакцины [10, 22]. Дифференцирование показателей редуцированной и общей смертности позволило установить связь между недостаточной эффективностью вакцины и значительной заражающей дозой вируса, обширностью раны и местом ее расположения, видами плотоядных животных, которые наносили укусы. Например, при волчьих укусах вакцина чаще оказывалась неэффективной.
Наряду с активной иммунизацией был всесторонне проработан вопрос о дополнительном введении в ранний период антител, когда в ответ на иммунизацию вакциной организм еще не сформировал своих собственных. В настоящее время оптимальным является сочетанное применение активной и пассивной иммунизации. Антирабический иммуноглобулин вводится однократно в самом начале лечения (человеческий — 20 МЕ/кг, лошадиный — 40 МЕ/кг) после обработки раны, причем как можно большая часть указанной дозы инфильтруется вокруг раны, если это позволяет ее анатомическая локализация, а оставшаяся часть вводится внутримышечно в ягодичную область, которая в этом случае предпочтительна, так как образуется меньше антител против глобулина. Несмотря на то что в настоящее время иммуноглобулин лошадиного происхождения является высокоочищенным, не исключаются анафилактические реакции. Поэтому необходима предварительная кожная проба. При схемах активной иммунизации, дающих раннее образование антител, некоторые исследователи считают ненужным применение иммуноглобулина, хотя в большинстве случаев он не используется лишь из-за противопоказаний. В связи с тем что введение антирабического иммуноглобулина при вакцинации иногда задерживает выработку собственных антител, часть исследователей считает, что целесообразность применения иммуноглобулина определяется успешностью предотвращения заболевания в первые 45—50 дней после заражения. Интерферирующее действие пассивно введенных антител на выработку иммунитета в отдаленный период может быть скорректировано курсом вакцинации [22].
Постэкспозиционная антивирусная химиопрофилактика. Ряд исследователей, признавая все достоинства метода постэкспозиционной иммунизации, отмечает такой его недостаток, как отсутствие возможности подавления репликативного цикла вируса внутри клеток, поскольку факторы иммунитета не проникают в них и не преодолевают гематоэнцефалического барьера. В случаях массивного поступления вируса в клетки это может быть фатальным для пострадавшего, например при многочисленных и тяжелых волчьих укусах.
Следует иметь в виду, что у большинства людей, подвергающихся постэкспозиционной иммунизации, часть вируса все же проникает внутрь клеток, в том числе нейронов. В этом случае умеренная внутриклеточная репродукция вируса находится, по-видимому, на уровне компенсируемых возможностей организма, но она, естественно, наносит ему определенный вред. Компенсации можно помочь внутриклеточной ингибицией вируса с помощью антивирусных химиотерапевтических средств. Кроме того, не всегда удается немедленно начать постэкспозиционную иммунизацию, например при позднем обращении пострадавших за помощью, или снизить количество поступившего вируса путем обработки раны с применением детергентов, дезинфектантов и антирабического иммуноглобулина, если она расположена вблизи жизненно важных органов. Особенно острое положение создается тогда, когда укушенные боятся прививок и поэтому отказываются от них.
В последние десятилетия антивирусные свойства выявлены у соединений фурана, малеинового ангидрида, витурида, бактериальной РНКазы и т. д., зарегистрированные лишь в случае введения их в место заражения вирусом [8], у производных адамантана, у арабинозил-цитозина, 8-азагуанидина, имурана, метотрексата, 6-азауридина, 6-азацитидина, йоддезоксиуридина, актиномицина D, гетерополианионов [26, 37], виразола, гетероциклических аминооксикетонов, кислород- и азотсодержащих гетероциклинов [5, 23], а также у PICK Са, индуцирующего интерферон [34].
Белорусскими исследователями [4, 12, 13, 19, 21] впервые установлены антивирусные свойства у двух известных антибиотиков — линкомицина и рифампицина и у лечебных препаратов — резерпина и АТФ [14]. Исследования проведены на белых мышах массой 7—8 г. Мышей инфицировали внутримышечно 1—100 ЛД50 штаммом фиксированного вируса "Москва" с титром 5,3 lg ЛД50/ 0,03 мл. Указанные препараты вводили по двум схемам — лечебной и лечебно-профилактической. По первой схеме антибиотик вводили через 30—60 мин после инфицирования в течение 3—4 дней. По второй схеме инъекции начинали за 24 ч до инфицирования, а затем продолжали в течение 2—3 сут после заражения мышей вирусом (общее время лечения составляло 3—4 дня). Препараты вводились внутримышечно или перорально (внутрижелудочно) один раз в сутки. При пероральном применении использовали иглу с оливой. Препараты в оптимальных дозах защищали животных в пределах 37,5— 87,5% (табл. 1). При заражении их 10 ЛД50 вируса защита была максимальной при лечебно-профилактической схеме применения препаратов. В опыте контролировали вирус в мозге. Во всех случаях отмечено снижение титра вируса в мозге на 1,5—3,3 lg ЛД50 или отсутствие вирусного антигена по МФА. Одновременно изучалось вирулицидное действие in vitro. Оно зарегистрировано у линкомицина и рифампицина. Отметим, что под влиянием приведенных в таблице ингибиторов вируса бешенства средняя продолжительность жизни (СПЖ) увеличилась в 1,5—2,6 раза.
Таблица 1. Защитное действие препаратов при рабической инфекции белых мышей, зараженных 10 ЛД50 фиксированного вируса бешенства и получавших препараты по лечебной (А) и лечебно-профилактической (Б) схемам (внутримышечно)
|
|
Оптимальная доза препарата, мг/кг
|
|
Выживаемость животных в опыте, %
|
Увеличение СПЖ (во сколько раз)
|
Подавление вируса в мозге, lg ЛД50
|
Вирулицидное действие, lg ЛД50
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* В МФА антиген вируса бешенства в мозге выживших подопытных животных не обнаруживался, в то время как в контроле он выявлялся регулярно.
Увеличение заражающей дозы вируса до 100 ЛД50 приводило к уменьшению эффективности рифампицина с 70,1 до 33,3—50% при 100%-ной гибели животных в контроле. С уменьшением инфицирующей дозы до 1—5 ЛД50 выживали все животные, получавшие рифампицин. Чем раньше вводился рифампицин, тем выше был эффект: достаточно было 2—3 инъекций препарата один раз в сутки, чтобы обеспечить 50—70% защиту.
При внутрижелудочном введении 70 мг/кг препарата один раз в сутки в течение 3—4 дней выживаемость животных, зараженных 10 ЛД50 вируса бешенства, была выше по сравнению с контролем на 50%, при инфицирующей дозе 1 ЛД50 выживали все подопытные животные.
Механизм антивирусного действия рифампицина не изучен. Вероятно, он влияет на внутриклеточный вирус и на зрелые вирионы. Установлено, что обработка 10%-ной вирусной суспензии рифампицином (500 мкг на 1 мл суспензии) снижает его инфекционный титр на 1,5 — 2,5 lg ЛД50/0,03 мл по сравнению с контролем.
Препаратами, заслуживающими серьезного внимания, являются резерпин и АТФ. При введении резерпина животным, инфицированным 8—10 ЛД50 вируса, наблюдалось увеличение их выживаемости на 40,0—83,4% по сравнению с контролем в зависимости от дозы и схемы введения препарата (Р < 0,01—0,001). Протективный эффект отмечался при назначении резерпина как по лечебно-профилактической, так и по лечебной схеме.
Резерпин оказывал ингибирующее действие и при пероральном применении. Выживаемость животных при введении резерпина в дозе 0,01 мг/кг по лечебной схеме увеличивалась по сравнению с контролем на 40% (Р < 0,01). Химиотерапевтический индекс препарата составил более 100.
Изучены ингибирующие свойства резерпина в отношении уличного штамма вируса бешенства на кроликах. Препарат, введенный в дозах 0,01—0,05 мг/кг, полностью защищал от гибели инфицированных животных. Необходимо отметить, что высокая степень защиты наблюдалась при применении резерпина как парентерально, так и перорально, а также в случае использования короткой схемы лечения (через 10 мин, 24 и 48 ч после инфицирования). Все 15 кроликов, зараженных вирусом и получивших резерпин, выжили. В контроле из трех кроликов, зараженных 10%-ной вирусной суспензией, один погиб с клинической картиной бешенства на 16-й, второй — на 21-й день после заражения, третий кролик выжил.
После завершения опыта все кролики были исследованы на наличие вирусного антигена в мозге. С помощью иммунофлюоресцентного метода установлено, что в отпечатках мозга кроликов, зараженных уличным вирусом бешенства и леченных резерпином, вирусный антиген отсутствовал, в то время как в мозге контрольных животных он выявлялся регулярно.
В эксперименте на белых мышах, зараженных фиксированным вирусом бешенства, показано, что выживаемость животных, получавших АТФ в фармакопейных дозах, достигала 75,0—87,5% по сравнению с контролем, а СПЖ увеличивалась в 1,7—2,3 раза. Вирусологическим исследованием мозга инфицированных животных, получавших препарат, установлено, что содержание вируса в нем снижалось до уровня, не определяемого методом биопробы, в то время как в контроле титры вируса достигали 2,3—3,3 lg ЛД50/0,03 мл.
В наших исследованиях линкомицин оказался менее эффективным по сравнению с рифампицином, резерпином и АТФ. Однако этот препарат заслуживает внимания в связи с тем, что он действует на микробы газовой гангрены и столбняка, и если возникнет угроза этих заболеваний у людей, покусанных бешеными животными, то линкомицин может дать эффект.
В целом лечебно-профилактическая схема оказалась более эффективной. Внедрение препаратов из этой схемы может планироваться при бешенстве лишь как постэкспозиционная антивирусная химиопрофилактика. Уже давно в решениях Комитета экспертов ВОЗ по бешенству высказывалось мнение, что осуществляющееся постэкспозиционное лечение бешенства особенно благоприятно в случае раннего применения антивирусных препаратов [42].
Нами получены данные, доказывающие отсутствие отрицательного влияния рифампицина на образование вируснейтрализующих антител при иммунизации животных инактивированной культуральной антирабической вакциной. Иммунизация проводилась на фоне присутствия в организме рифампицина в течение всего периода вакцинации. Препарат вводился за сутки до начала вакцинации в дозе 250 мкг. Эта доза эффективна в отношении вируса и подавляет его репродукцию в мозге инфицированных животных. Поскольку рифампицин быстро всасывается и присутствует в крови в течение примерно 12 ч, подопытным животным через сутки была сделана первая прививка, а через час после нее вновь введен рифампицин в указанной дозе и т.д. Такое чередование введений рифампицина и вакцины, по нашему мнению, достаточно для тесного их взаимодействия в организме, чтобы выявить возможное отрицательное влияние рифампицина на образование антител в ранний период вакцинации. Рифампицин не подавлял синтез вируснейтрализующих антител: и в опыте, и в контроле титры антител были одинаковы — 1,75 lg IN.
В другом опыте мы изучали воздействие рифампицина на формирование защитного иммунитета (схема иммунизации из двух прививок по Грибенча и Баринскому [7]). Так же, как и в предыдущем опыте, введения рифампицина и вакцины чередовались. Однозначно показано отсутствие отрицательного влияния рифампицина на вакцинальный процесс. Более того, можно предположить, что совместное применение вакцины и рифампицина улучшает процесс вакцинации, так как в этом случае при введении животным разрешающей дозы вируса 4—5 ЛД50 наблюдалось увеличение процента их выживаемости (до 100%) и СПЖ в 1,5 раза по сравнению с иммунизацией одной вакциной.
Приведенные данные позволили сделать вывод, что совместное применение вакцины и рифампицина в постэкспозиционный период весьма целесообразно. Оно не только не мешает процессу иммуногенеза, но может даже способствовать его развитию, создавая условия для подавления вируса, уменьшения вирусного токсикоза и увеличения инкубационного периода.
Изучали влияние рифампицина на репродукцию вируса в мозге. На 5-е сутки после заражения белых мышей 10 ЛД50 вируса под действием рифампицина титр вируса в мозге был ниже на 2,5 lg ЛД50 по сравнению с контролем. У выздоровевших мышей вирус в мозге не обнаружен, в то время как у погибших (контроль) содержание вируса составляло 5,8 lg ЛД50. Таким образом, рифампицин в указанной дозе может снижать накопление вируса в мозге с 5,8 до 2,5 и даже 0,0 lg ЛД50.
Мы полагаем, что подавление рифампицином репродукции вируса и вызываемой им патологии нормализует жизнедеятельность организма, оптимизирует условия проявления иммунного ответа.
На первых этапах внедрения рифампицина в постэкспозиционный период необходимо было проверить, влияет ли он на пассивную иммунизацию, так как в систему постэкспозиционного лечения обязательно входит антирабический иммуноглобулин. Было установлено (табл. 2), что рифампицин не оказывал отрицательного воздействия на защитные свойства иммуноглобулина при совместном их применении при разрешающем заражении 5—7 ЛД50 вируса (100%-ная защита). В опыте с разрешающим заражением дозой 100 ЛД50 вируса доказана, напротив, положительная роль рифампицина, так как наблюдается значительно более высокая выживаемость животных по сравнению с применением одного антирабического иммуноглобулина (соответственно 83,4 и 33,3%).
Таблица 2. Результаты совместного применения антирабического иммуноглобулина и рифампицина
|
Группы мышей, обработанные препаратами (п=48)
|
Доза препарата (суточная)
|
Выживаемость мышей после разрешающего заражения вирусом, %
|
|
5-7 ЛД50
|
100 ЛД50
|
|
Гамма-глобулин
|
|
|
33,3
|
|
Контроль
|
|
|
0,0
|
|
Гамма-глобулин + рифампицин
|
64МЕ+250 мкг на мышь
|
|
83,4
|
|
Контроль
|
—
|
0,0
|
0,0
|
Подводя итоги, можно заключить, что имеются все основания для клинического изучения рифампицина в комплексе с вакцинно-сывороточными препаратами, применяющимися в настоящее время в постэкспозиционный период.
Использование рифампицина в комплексе с вакциной и антирабическим иммуноглобулином мы расцениваем как первый этап внедрения антивирусных химиопрепаратов. Естественно, все другие антирабические химиопрепараты — линкомицин, резерпин, АТФ — требуют такой же экспериментальной проработки и представления материалов в Фармкомитет РБ для последующего клинического изучения.
Есть достаточные основания приступить ко второму этапу внедрения рифампицина. Речь идет о замене антирабического иммуноглобулина антивирусными химиопрепаратами в системе постэкспозиционных лечебных мероприятий. Рифампицин успешно подавляет репродукцию вируса в мозге экспериментальных животных. Его защитный эффект не уступает иммуноглобулину и проявляется даже при высоких разрешающих дозах вируса (10-100 ЛД50).
Проведенное сравнительное изучение эффективности АТФ и антирабического гамма-глобулина на белых мышах, зараженных летальной дозой вируса бешенства, также показало, что АТФ не уступал специфическому гамма-глобулину при применении препарата на ранних стадиях инфицирования животных и превосходил его при использовании на более поздних сроках. Так, если АТФ вводили зараженным животным через 1,5, 24 и 48 ч, выживаемость их составляла соответственно 75, 50 и 33%. При введении антирабического гамма-глобулина в эти же сроки защитный эффект составил соответственно 80,25 и 0%.
Кроме того, что химиопрепараты, в частности рифампицин, обладают высокой антивирусной активностью, у них не имеется таких отрицательных свойств, как интерференция в отношении образования собственных антител при иммунизации вакциной и анафилактические реакции (гетерологичный иммуноглобулин). Внедрение рифампицина в систему постэкспозиционного лечения бешенства может сделать вакцинацию более успешной, так как этот препарат увеличивает инкубационный период, а подавление репликации вируса и связанного с этим вирусного токсикоза приводит к нормализации патологических нарушений, способствует созданию более оптимальных условий для развития иммуногенеза в постэкспозиционный период.
На основании уже имеющихся данных в будущем может быть поставлен вопрос о полной замене постэкспозиционной активной иммунизации повторными циклами постэкспозиционной химиопрофилактики либо их сочетанием с заключительной активной иммунизацией в более поздний период.
Разумеется, для осуществления всех указанных уровней внедрения постэкспозиционной химиопрофилактики требуется дальнейшее накопление экспериментальных и клинических материалов, и не только по отдельным наиболее эффективным антивирусным монопрепаратам. Важное направление исследований — создание комплексного химиотерапевтического препарата из антивирусных химических соединений с различным механизмом действия на репликативный цикл вируса.
Первый опыт применения рифампицина в постэкспозиционном лечении людей. На основании изложенных данных было высказано обоснованное предположение о возможности применения указанных препаратов в качестве этиотропных антивирусных средств в комплексной терапии бешенства (наряду с вакцинацией) в инкубационном периоде с целью подавления репродукции вируса на ранних этапах развития инфекции.
По инициативе М. Р. Нехая [20] рифампицин был применен как дополнительное средство лечения бешенства в постэкспозиционный период. Непосредственным поводом для назначения препарата были случаи, имевшие место в 1975—1991 гг., когда 9 человек, покусанных дикими животными, несмотря на полный курс вакцинации (25 прививок) и антирабического гамма-глобулина, погибли от гидрофобии (табл.3). Если у лиц, сильно покусанных волками, с большими травмами, летальный исход можно было связать с большой дозой вируса, введенной в организм, то при укусах средней тяжести и легких укусах (лисы, собаки, кошки) летальный исход, по-видимому, объясняется повышенной вирулентностью "диких" штаммов вируса, циркулирующего не только среди диких, но и среди домашних животных.
Таблица 3. Комплексное постэкспозиционное лечение рифампицином на фоне активно-пассивной иммунизации лиц, покусанных бешеными животными, с лабораторно подтвержденным диагнозом
|
Постэкспозиционные — меры
|
Количество покусанных
|
Степень укуса
|
Клиническая экспрессия бешенства
|
|
Всего
|
Из них
|
|
Антивирусная химиотерапия рифампицином с активной и пассивной иммунизацией
|
|
|
|
|
|
|
|
|
|
|
1— тяжело, 1— средней тяжести
|
|
Активная и пассивная иммунизация без рифампицина
|
|
|
|
Гидрофобия с летальным исходом
|
|
|
|
|
|
|
|
|
В работе [20] показано, что при применении рифампицина в комплексе с активной и пассивной иммунизацией во всех случаях предупреждена экспрессия клиники бешенства у покусанных людей в период активной эпизоотии бешенства у диких животных. Все 12 покусанных и леченных рифампицином в постэкспозиционном периоде выздоровели. Особого внимания заслуживают 9 случаев выздоровления после тяжелых волчьих укусов. Применение рифампицина в комплексном постэкспозиционном лечении бешенства не вызывало никаких побочных явлений.
На основании представленных материалов можно прийти к выводу, что впервые за много лет поиска антивирусных химиотерапевтических средств в нашем распоряжении имеется ряд химиопрепаратов, высокоэффективных при экспериментальном исследовании, — линкомицин, рифампицин, резерпин и АТФ. Два первых препарата находятся в стадии клинического изучения. На линкомицин, рифампицин и резерпин имеется разрешение Фармкомитета на клиническое испытание, а рифампицин уже начал применяться в медицинской практике в наиболее тяжелых случаях, когда жизни пострадавших угрожает опасность. Результаты наших экспериментальных и клинических исследований дают все основания предполагать, что постэкспозиционное применение антивирусных препаратов в комплексе с антирабической пассивной и активной иммунизацией — это наиболее оправданный путь начала внедрения антивирусной химиотерапии в практику здравоохранения.
Необходимы специальные исследования различных способов введения препаратов — не только перорального, но и парентерального (внутривенно, внутримышечно), а также изучение методов обработки раны антивирусными препаратами. Это тем более оправдано, что бешенство — и нейровирусная, и раневая инфекция. Нужно иметь в виду, что линкомицин активен в отношении грамположительных бактерий и стафилококков, столбнячной палочки и других анаэробов (газовой гангрены), рифампицин — еще и в отношении грамположительных бактерий и микобактерий туберкулеза, а в больших дозах — и грамотрицательных бактерий. Оба препарата активно воздействуют на стафилококки, устойчивые к пенициллину и другим антибиотикам. Отметим также, что линкомицин проникает в костную ткань и даже через гематоэнцефалический барьер, хотя и не очень активно, но более выражено в случаях поражения ЦНС (менингит).
Таким образом, нами подробно изучен защитный эффект выявленных ингибиторов. Ограниченное количество исследований проведено при изучении антивирусных свойств in vitro (вирулицидное действие) и in vivo (подавление вируса в мозге). В настоящее время стоит задача изучения механизма молекулярно-биологического влияния предлагаемых препаратов на репликативный цикл вируса. Можно предположить, что он окажется у разных препаратов неодинаковым, так как все они относятся к различным классам химических соединений. Уже в ближайшее время можно приступить к изучению сочетанного влияния различных комбинаций этих, препаратов для выяснения синергидного действия и повышения их антивирусной эффективности и создания целевого химиотерапевтического антирабического препарата.
Исследования по сочетанному действию препаратов необходимы и для выявления наилучшего нейрофизиологического и сердечно-сосудистого эффекта, так как резерпин обладает седативным и сосудистым действием, а АТФ улучшает процессы обмена и облегчает проведение возбуждения в вегетативных ганглиях и передачу возбуждения с блуждающего нерва на сердце. При бешенстве все эти вопросы чрезвычайно важны в связи с резким возбуждением ЦНС, расстройством синаптической передачи импульсов и сердечно-сосудистой системы.
Перспективы улучшения медицинской помощи населению Республики Беларусь в постэкспозиционной профилактике бешенства. Ю.П.Буланов (РЦГЭ) собрал хорошо документированные сведения о 138 случаях гидрофобии, зарегистрированных в Беларуси за последние 48 лет. Из них 63,8% (88 случаев) относятся к первому послевоенному десятилетию (1949—1958). В следующие два десятилетия наблюдалось снижение заболеваемости гидрофобией в 3,4 и 5,1 раза соответственно по сравнению с максимумом (18,8 и 12,3%), а затем с 1979 по 1996 г. регистрировалось по 3—4 случая гидрофобии за десятилетие.
Таким образом, органами здравоохранения была проделана значительная работа по борьбе с бешенством, прежде всего по налаживанию лабораторной диагностики и снабжению населения антирабической вакциной. В БелНИИЭМ была организована вирусологическая лаборатория, которая в 1955—1965 гг. выделила от умерших больных 16 штаммов уличного вируса. Организован отдел по производству антирабической вакцины типа Ферми, который удовлетворил потребности республики. В настоящее время Беларусь снабжается культуральной вакциной из России.
Обеспечено взаимодействие с ветеринарной и коммунальной службами республики по ограничению циркуляции вируса бешенства среди собак и диких животных, так как, по приведенным Ю. П. Булановым данным, 61,6% (85 случаев) связано с укусами собак, а 20,2% (28 случаев) — с укусами диких животных (преимущественно лис и волков).
Диагностика бешенства основывается, как правило, на оценке клинических и эпидемиологических данных. Эта задача очень трудна и чревата ошибками. Вирусологические методы прижизненной диагностики в учреждениях здравоохранения до сих пор не применяются. Если и проводится лабораторная диагностика, то лишь после смерти больного на основании морфологического исследования гиппокампа и при наличии телец Негри. Предстоит значительная работа по налаживанию в республике прижизненной диагностики с помощью таких методов, как исследование отпечатков роговиц и соскобов кожи с задней части шеи на наличие антигена, устанавливаемого МФА. Изоляция вируса от больных, изучение природы выделенных штаммов и установление серотипа не производится, поскольку это требует более сложных молекулярно-биологических исследований (РЦП, молекулярных зондов).
Последние исследования нужны не только для постановки окончательного диагноза у больных бешенством, но и для рациональной организации постэкспозиционного лечения зараженных вирусом лиц при укусах бешеными животными, так как первое требование к антирабическим прививкам — антигенное соответствие вакцин и циркулирующих штаммов вируса бешенства. Помимо этого, необходима их высокая антигенность и иммуногенность и введение в наиболее адекватные нервно-рецепторные зоны (дельтовидные мышцы). Сочетание этих условий позволяет применять короткие схемы иммунизации ("3—1", или "2—1—1", или 5-кратную прививку). Для этого в республике пока нет условий, хотя уже применяются культуральные вакцины и исключены энцефалитогенные вакцины из нервной ткани. Однако используемые культуральные вакцины требуют длительных и многократных прививок (до 25 инъекций), что, по-видимому, связано с недостаточной их антигенностью (менее 2,5 ME) или отсутствием данных об эффективности применяющихся вакцин при коротких схемах иммунизации. В этих условиях целесообразен переход на улучшенные вакцины, выпускаемые, например, во Франции (фирма "Пастер-Мерье"). В данном случае немаловажное значение имеют экономические возможности республики, поскольку хорошо зарекомендовавшие себя вакцины стоят в несколько раз дороже. В то же время следует иметь в виду, что если количество прививок уменьшится в 5 раз, а контингента для прививок будут отбираться более строго, то экономические трудности не будут основным препятствием для внедрения современных высокоантигенных очищенных вакцин. О том, что резерв в уменьшении числа прививающихся в Беларуси имеется, свидетельствуют данные о резких различиях в количестве прививающихся в разных областях республики (40—70% — в Гродненской и 7—12% — в Гомельской). Чтобы снизить стоимость прививок, можно практиковать и внутрикожное введение вакцины, при котором расход вакцины сокращается в 10 раз при сохранении эффективности схемы иммунизации, но это требует хорошо подготовленных кадров.
Важный этап — проведение исследований по периодическому контролю за соответствием показателей вакцины при ее практическом применении, проверка уровня антител у прививающихся, для чего нужны тесты на антителообразование, такие как РНМ, ТБИОФ и др. Подобные исследования будут основанием для приобретения органами здравоохранения наиболее качественных вакцин. Для этого потребуется не только фиксированный вирус Challenge Virus Standart (CVS-27), но и все остальные, поскольку различные вакцины готовятся на основе разных штаммов фиксированного вируса. При использовании культуральных методов для диагностических и контрольных исследований нужны и хорошо зарекомендовавшие себя линии клеток, в первую очередь клетки мышиной нейробластомы Na С 1.300.
Необходимо налаживание комплексной работы с ветеринарными и коммунальными учреждениями по вирусологическому изучению циркулирующих штаммов в диких резервуарах (лисицы, енотовидные собаки) и резервуаре бешенства в населенных пунктах (собаки), их идентификация и серотипирование, в том числе с помощью Центра ВОЗ по бешенству. Эти данные в сочетании с результатами по изучению штаммов вируса бешенства от людей помогут создать научно обоснованную систему использования наиболее адекватных вакцин.
Для достижения международного уровня борьбы с бешенством потребуются значительные усилия: организация системы рабических диагностических центров, способных удовлетворить запросы лечебной сети, создание Национального лабораторного Центра ВОЗ при БелНИИЭМ, который будет иметь всю необходимую информацию от экспертного комитета ВОЗ по бешенству и работать в непосредственном контакте с этой организацией.
Следует не только внедрить в практику здравоохранения монопрепараты с антирабическими свойствами, но и создать комплексные антивирусные препараты на основе ингибиторов вируса бешенства с разным механизмом действия. Это потребует развития молекулярно-биологических исследований и тесного контакта с заводами-изготовителями монопрепаратов с антивирусным эффектом, а также совместной научно-исследовательской деятельности с работниками антирабической службы на основе обязательного и систематического финансирования. При этом следует учитывать, что бешенство — смертельное заболевание, а наличие резервуаров вируса этой инфекции в природе является постоянной угрозой для любого жителя республики.
Для лечения манифестного клинического бешенства необходимы комплексные исследования рабиологов и нейробиологов, иммунологов и специалистов по молекулярной биологии для дальнейшего изучения патогенеза этого заболевания.
- Ботвинник А. Д., Никифорова Т. А. // Вопр. вирусологии. – 1986.–Т.731, № 4. – С.504–506.
- Букринская А. Г., Жданов В. М. Молекулярные основы патогенности вирусов.– М.: Медицина, 1991.– 253 с.
- Быковский А. Ф., Ершов Ф. И., Кармышева В. Я. и др. Атлас вирусов. – М.: Медицина, 1975.– 259 с.
- Вотяков В.И., Титов Л.П., Мишаева Н.П. и др. // М-лы междунар. науч. конф., посвящ. 5-летию образования Гомельского ГМИ. – Гомель, 1995.– С. 244–245.
- Галицкая Н. Н, Шашенько А. С, Давыденко П. В. Антивирусные вещества: Сб. м-лов.– Мн., 1984.– С. 62–63.
- Грибенча С. В., Баринский И. Ф. // Вопр. вирусологии. – 1982.– № 5. – С. 580–589.
- Грибенча С. В., Баринский И. Ф. // Вопр. вирусологии.– 1987.– № 4.–С. 489–492.
- Грибенча С. В., Баринский И. Ф. // Идеи Пастера в борьбе с инфекциями: Междунар. симпоз., посвящ. году Пастера. СПб., 6-10 июня 1995 г. – С. 127.
- Жданов В. М. Эволюция вирусов.– М.: Медицина, 1990.– 373 с.
- Зибицкер Д., Ковалев Н. Бешенство и его профилактика.– Мн., 1968.– 195 с.
- Зинченко А. П. Рассеянный склероз и энцефаломиелит.– Л.: Медицина, 1973.– 295 с.
- Зубович И. К., Вотяков В. И., Мишаева Н. П. // Антибиотики и химиотерапия – 1989 – Т. 34, № 2 – С. 123–125.
- Зубович И. К., Мишаева Н. П., Вотяков В. И. // Антибиотики и химиотерапия.– 1991.– Т. 36, № 10.– С. 31–33.
- Зубович И. К., Мишаева Н. П., Вотяков В. И. и др. // Вопр. вирусологии.– 1993.– № 2. – С. 81–83.
- Зуев В. А. Медленные вирусные инфекции человека и животных.– М.: Медицина, 1988.– 251 с.
- Каверин Н В. // Общая и частная вирусология/ Под ред. В. М. Жданова, С. Я. Гайдамович. – М., 1982. – Т. 2. – С.220– 239.
- Комитет экспертов ВОЗ по бешенству. 8-й докл.– Женева, 1994.
- Маргулис М. С. Инфекционные заболевания нервной системы. Т. 5. Руководство по неврологии. Раздел "Бешенство".– М.; Л.: Медгиз, 1940.– С. 401–433.
- Мишаева Н. П., Вотяков В. И., Андреева О.Т. и др. // Вопр. вирусологии. – 1991.– № 3.– С. 256–258.
- Нехай М. Р. // М-лы междунар. науч. конф., посвящ. 5-летию образования Гомельского ГМИ.– Гомель, 1995 – С. 256–257.
- Самойлова Т. И., Мишаева Н. П., Зубович И. К. и др. // Химиотерапия и химиопрофилактика вирусных инфекций. Особо опасные и медленные инфекции.– Мн., 1985.– С. 75.
- Селимов М. А. Бешенство.– М.: Медицина, 1978 – 335 с.
- Шашихина М. Н., Станишевский Л. С, Андреева О. Т. и др. // Перспективы научной разработки противовирусных веществ.– Мн., 1978.–С. 50–52.
- Annal N. // Med.Hypotheses. – 1984.– V.14.– P. 207–212.
- Aoki F. Y., Rubin M. E., Fast M. V. // Biologicals.– 1992.–V.20. – P. 283–287.
- Bussereau F., Picard M., Blancou I. // Acta Virol.–1988.– V.32, N 1. – P. 33–49.
- Chavanet P., Sureau P., Waldner–Combernoux A. et al. // La Presse Medicale.–1989.– V.18, N 16.– P. 813–815.
- Classification and Nomenclature of viruses // Intervirol.– 1982.–V.17, N 1–2.
- Gardner H., Schaffner W. // New Engl. J. Med.– 1993.–V.328, N 17.– P. 1252–1258.
- Granicki Ol., Dorant–Wilczek Z., Glowacka J. et al. // Pol. tyg. lek.– 1986.– V. 41, N 3.–P.78–80.
- Gribencha S. V., Barinsky I. F. //Acta Virol.– 1982.– V.26, N 4.– P.301–305.
- Hemachudna Т., Griffin D. E., Giffels J. J. et al. // New Engl. J. Med.– 1987.– V. 316.– P. 369–374.
- Hemachudna Т., Griffin D. E., Johnson R. T. et al. // Neuro–logy.–1988.– V.38, N 1.– P.42–44.
- Lin H. X., Contier C, Saron M. F. // Arch. Virol.– 1993.–V.131.–P. 307–319.
- Morgunov I.N. // Zoonosis control: Cell, of Teaching AIDS for Intern. Training Course.– Moscow, 1982.– V. 2.– P. 34–38.
- Rotivel Y., Sureau P. // Infect, et immunol.–1994.– V. 1, N 4.–P. 147–153.
- Sodja M. I. // Acta Virol.– 1986.– V.30, N 1.– P. 63–68.
- Superti F., Seganti L., Ruggeri F. M. et al. // J. Gen. Viroi. – 1987.– V. 68.– P. 387–399.
- Suzuki M., Mori M., Sakagami Y. et al. // Science.– 1984.– V. 226.– P. 89–92.
- Tsiang H. // J. Neuropath. Exp. Neurol. – 1979. – V. 38.–P. 286–296.
- Warrell D.A., Warrell M.J. // Hunter’s Tropical Medicine. 7th ed.– WB, Saunders, Philadelphia, 1991.– P. 219–227.
- WHO (1980). Report of consultation on rabies prevention and control. Lyon, France, 10–12.3.1980.
Медицинские новости. – 1997. – № 2. – С. 12-22.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Содержание »
Архив »
|
|