Незлокачественные стенозы пищевода (СП) в зависимости от их вида лечатся или бужированием, или баллонными дилатациями. При отсутствии эффекта применяют хирургические методы. Для этого разработаны различные способы эндоскопических вмешательств [5]: инъекции кортикостероидов в стенозированную часть пищевода, рассечение рубцов. Хирургические методы лечения обычно заключаются в резекции стенозированного сегмента и реконструкции с помощью обходной вставки. Однако роль хирургического лечения все еще обсуждается [8]. Радикальная хирургия сопровождается осложнениями и высокой смертностью [2, 6, 9]. От гастростомии пациенты часто отказываются, так как у них нормальный аппетит и акт глотания не нарушен. Пластика желудочным стеблем стала методом выбора замещения пищевода после его резекции при атрезии пищевода с большим диастазом между сегментами, а также при протяженных пептических, ожоговых или врожденных стенозах пищевода [2, 4, 5]. В качестве обходной вставки могут использоваться желудок, тощая, подвздошная и толстая кишка. Пластика пищевода толстой кишкой рассматривается как «метод последней надежды» и ассоциируется с высоким риском осложнений и смертности. По данным зарубежной литературы, смертность при подобных операциях составляет от 9 до 15 % [6, 9]. Кроме того, в детском возрасте особенно важны функциональные результаты, такие как глотание и рост. В этих случаях необходима терапевтическая альтернатива — стентирование пищевода. Применяемые в настоящее время металлические стенты (покрытые или частично покрытые) могут находиться в просвете пищевода от 3 недель до 13 месяцев (у взрослых). В 50% случаев при их извлечении возникают значительные технические проблемы, связанные с тем, что на месте стояния стента отмечается значительная гипертрофическая реакция слизистой. Таким образом, существует значительный риск перфорации пищевода [3, 7].
Двое наших пациентов — мальчики 5 лет, получившие ожог щелочью различной давности, к концу 2006 г. исчерпали возможности консервативного лечения. В процессе терапии им было проведено более 40 баллонных дилатаций. У обоих в анамнезе была перфорация пищевода с медиастинитом и плевритом. Вследствие многочисленных наркозов у больных развилось токсическое поражение печени и железодефицитная анемия. Учитывая безуспешность консервативных методов лечения, оба пациента были кандидатами на эзофагоколонопластику. В ноябре 2006 г. для их лечения была предпринята «терапия отчаяния». Под рентгеновским контролем установлены биодеградабельные стенты из polydioxanone производства фирмы ELLA-CS, Ltd (Чешская Республика), не требующие извлечения.
Синтетические и естественные материалы, используемые для увеличения или замещения любой ткани, органа или функции организма, называют биоматериалами. Они используются в виде суставных протезов, наполнителей дефектов кости, пластин для фиксации переломов, сосудистых протезов, клапанов сердца, контактных линз, хрусталиков, а также в стоматологии. Синтетические полимеры молочной и гликолевой кислот подвергаются биологическому распаду. Именно это свойство нашло применение в медицинской промышленности. С 60-х годов прошлого столетия стали пименяться рассасывающиеся хирургические нити, а в последующем появились биодеградабельные трехмерные медицинские изделия.
Биологический распад полимеров происходит либо путем гидролиза, либо путем поверхностной эрозии. Гидролиз протекает в две фазы. В первой фазе образуются короткие, растворимые в воде фрагменты, сохраняющие физические свойства материала. Во второй фазе метаболизация фрагментов приводит к потере массы полимера, и образующиеся мономеры вовлекаются в цикл Кребса.
Свойства polydioxanone хорошо изучены. Его применяют для изготовления рассасывающихся хирургических нитей, а также формованных трехмерных медицинских изделий — винтов, булавок, фольги и пр. В живой ткани polydioxanone распадается путем гидролиза. Полностью резорбируется в течение 180—210 дней. Гидролитическая деградация polydioxanone зависит от pH. В кислой желудочной среде деградация ускоряется в 5 раз. Процесс деградации (динамика, нетоксичность продуктов распада), а также успешное клиническое использование, безопасность и биологическая совместимость позволили применять этот материал для производства стентов. Кроме того, чешской компанией ELLA-CS, Ltd разработана и внедрена технология, создающая у polydioxanone «память формы».
Биодеградабельные стенты из polydioxanone оказывают терапевтическое действие в течение длительного периода и ремоделируют сужение [1]. Благодаря биологическому распаду материала, из которого изготавливается стент, не требуется удаление конструкции. Это преимущество устраняет риск, связанный с процедурой удаления. Данный метод лечения пока не нашел широкого применения в педиатрической практике.
Представляем промежуточные результаты применения биодеградабельных стентов для лечения послеожоговых стенозов пищевода у детей, а также использования современных цифровых рентгенодиагностических систем для контроля состояния стентированного пищевода.
В 2006 г. в Центре детской хирургии проходили лечение 12 детей с послеожоговыми стенозами пищевода, в том числе 10 детей — после ожога щелочью. Протяженность стриктур после ожога щелочью составляла более 2 см, просвет пищевода в зоне сужения был деформирован и имел диаметр менее 5 мм. Локализовались они в средней и нижней трети грудного отдела пищевода.
Саморасширяющийся биодеградабельный стент сплетен из цельного моноволокна polydioxanone. Стент окрашен в фиолетовый цвет красителем, использующимся для окраски хирургических нитей. Содержание красителя составляет 0,07% веса материала. Стент имеет ацилиндрическую форму с расширяющимися концами, которые помечены рентгенконтрастными золотыми метками. Пищеводные стенты SX-ELLA могут быть различной длины и диаметра (рис. 1).
.jpg)
Рис. 1. Пищеводный биодеградабельный стент SX-ELLA (ELLA-CS, Ltd)
Поскольку polydioxanone имеет «память формы», стент упаковывается отдельно от системы доставки и загружается в нее вручную непосредственно перед процедурой стентирования. Система доставки состоит из трех коаксиально размещенных пластмассовых цилиндров и имеет длину 750 мм.
Один из пациентов, К., получил ожог щелочью в 2005 г. Лечился в Центре детской хирургии. До момента постановки стента ему было проведено 40 дилатаций стриктуры пищевода. Во время одной из них, в сентябре 2006 г., произошла перфорация пищевода, развился медиастинит, плеврит. Для устранения проявлений фибринозно-выпотного плеврита выполнен торакоскопический плевродез и дренирование плевральной полости. К ноябрю 2006 г. у К. имелась кольцевидная стриктура в верхней трети пищевода и в средней трети, на уровне Th4—Th6 (рис. 2).
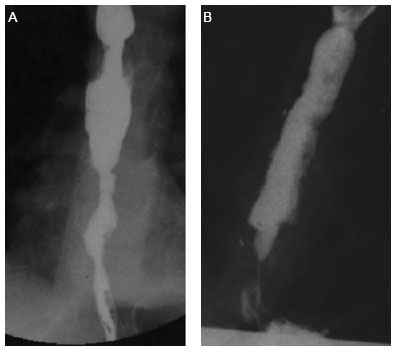
Рис. 2. Эзофагограммы пациента К., 5 лет: А — перед стентированием; В — на 8-й неделе после постановки стента
У другого пациента, А., получившего ожог щелочью в 2003 г., в 2005 г. развился критический стеноз пищевода, и для кормления и бужирования ему была наложена гастростома. В июне 2006 г. при извлечении инородного тела, обтурирующего просвет пищевода, произошла перфорация, также вызвавшая медиастинит и плеврит. Выполнялось дренирование плевральной полости. До ноября 2006 г. К. перенес 40 баллонных дилатаций. Перед постановкой стента у него имелся стеноз в средней трети пищевода, в проекции Th3—Th7 (рис. 3).
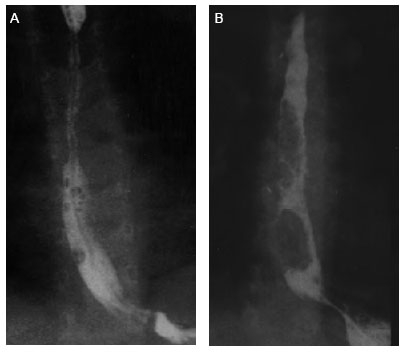
Рис. 3. Эзофагограммы пациента А., 5 лет: А — перед стентированием; В — на 8-й неделе после постановки стента
В ноябре 2006 г. обоим пациентам под рентгеновским контролем были установлены биодеградабельные стенты SX-ELLA из polydioxanone. Подобный способ лечения требует динамического наблюдения. Необходимо оценивать стабильность стояния стента, состояние стенок пищевода, диаметр его просвета, следить за изменениями, происходящими в процессе лечения. Применение эндоскопии пищевода крайне опасно из-за высокого риска перфорации. Рентгенологический метод в данном случае является методикой выбора. На следующие сутки после постановки стента и через каждые 14 дней в течение 3 месяцев и 1 раз в месяц в течение полугода проводилось рентгенологическое исследование пищевода на цифровой рентгенодиагностической системе Easy-diagnost (Philips). Эта система оснащена рентгеновской трубкой с сеткой «Grid controlled Fluoroscopy», которая полностью устраняет бесполезное нарастающее и затухающее излучение, возникающее при обычной импульсной рентгеноскопии. Имеющееся «педиатрическое приложение» направлено на следующие базовые технические параметры:
1. Уровень полученной пациентом дозы значительно уменьшается, а подходящие значения напряжения выбираются в соответствии с европейскими стандартами.
2. Входная доза усилителя изображения уменьшается на 50 %.
3. Длительность импульса уменьшается до значения, соответствующего обследуемому объекту, и составляет от 2 до 10 мс.
4. Автоматическое управление уровнем дозы по изменению плотности объекта может производиться только в сторону уменьшения дозы.
5. Общий диапазон импульсного тока переключается на соответствующие педиатрии пары значений.
Запись необходимого изображения производится параллельно с нормальной рентгеноскопией без дополнительной лучевой экспозиции. Выбор кадра для сохранения на пленке позволяет проводить динамические исследования, не требующие дополнительных затрат времени или дополнительного оборудования.
В результате лечения с помощью стента удалось удерживать физиологическим просвет пищевода на месте протяженной стриктуры в течение более 3 месяцев, избавив детей от необходимости дилатации каждые 2 недели.
В течение времени стояния стента у пациентов не отмечалось дисфагии, болевых и каких-либо других признаков болезни. Для лечения гастроэзофагеального рефлюкса применялся Nexium — ингибитор протонной помпы последнего поколения.
Таким образом, применение биодеградабельных стентов SX-ELLA из polydioxanone (ELLA-CS, Ltd, Чешская Республика) может заменить систематические баллонные дилатации при лечении протяженных рубцовых стенозов пищевода после ожога щелочью.
Стентирование стриктур пищевода может быть одним из этапов лечения у детей.
Рентгеноскопия пищевода является методикой выбора для контроля состояния стентированного пищевода. Использование современных цифровых рентгенодиагностических систем, работающих в импульсном режиме и оснащенных «педиатрическими приложениями» (типа Еasy Diagnost), позволяет это сделать наиболее безопасно и с минимальной лучевой нагрузкой.
Цифровые технологии, применяемые в подобного рода аппаратах, позволяют сократить время исследования, получить необходимую дополнительную информацию, создавать архив изображений.
1. Лазюк И.И., Бычкова О.В., Volenec K. и др. // Современные цифровые технологии в лучевой диагностике: м-лы республ. науч.-практ. конф./ под ред. А.Н. Михайлова. — Минск: БелМАПО, 2007.
2. Beggs F. D., Salama F. D., Knowles K.R. // J. Royal Coll. Surg. Edinb. – 1995. – Vol. 40, N 5. – P. 305—307.
3. Fiorini A., Fleischer D., Valero J. et al. // Gastrointest. Endosc. – 2000. – Vol. 52, N 2. – P. 259—262.
4. Gupta N.M., Goenka M.K., Behera A. et al. // Brit. J. Surg. – 1997. – Vol. 84, N 2. – P. 262—264.
5. Mamazza J., Schlachta C.M., Poulin E.C. // Gastrointest. Endosc. Clin. North Amer. — 1998. – Vol. 8, N 2. – P. 399—413.
6. Renzulli P., Joeris A., Strobel O. et al. // Langenbecks Arch. Surg. – 2004. – Vol. 389, N 2. – P. 128—133.
7. Repici A., Conio M., De Angelis C. et al. // Gastrointest. Endosc. – 2004. – Vol. 60, N 4. – P. 513—519.
8. Thomas M.O. // Niger. Postgrad. Med. J. – 2004. – Vol. 11, N 3. — P. 215—217.
9. Yararbai O., Osmanodlu H., Kaplan H. et al. // Hepatogastroenterology. – 1998. – Vol. 45, N 19. – P. 59—64.
Медицинские новости. – 2008. – №4. – С. 66-68.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.