Внимание! Статья адресована врачам-специалистам
Компартмент-синдром (КС) — клинический симптомокомплекс, который может возникать в различных органах и сегментах тела вследствие широкого спектра причин. КС скелетной мускулатуры при отсутствии лечения может приводить к повреждениям в виде контрактуры Фолькмана, потере конечности и даже смерти пациента.
Наиболее часто (до 40% случаев) компартмент–синдром наблюдается при переломах голени, далее следуют КС, вызванный мягкотканными повреждениями без костной травмы (23%), и КС при переломах предплечья (18%). Встречаемость КС при закрытых переломах голени составляет от 1 до 29%, при открытых переломах – от 1 до 10%. При многооскольчатых переломах риск возникновения КС выше [2].
Исторический обзор
Первыми основополагающими работами по изучению компартмент–синдрома считаются труды Фолькмана, который в 1881 г. опубликовал статью «Ишемические мышечные парезы и контрактуры». Он указывал, что возникающие в результате наложения слишком плотной повязки параличи и контрактуры обусловлены массивным повреждением сократительной мускулатуры и реактивными изменениями окружающих тканей.
Murphy (1914) считал пусковым моментом в развитии контрактур увеличение внутримышечного давления и полагал, что оперативное лечение путем фасциотомии показано до возникновения контрактур. Brooks (1922) доказал роль фасции в повышении мышечного давления. С помощью ранней фасциотомии ему удалось снизить частоту возникновения контрактур. Он объяснял развитие контрактур нарушениями венозного оттока и образованием геморрагического и серозного экстравазата, приводящих к опуханию тканей и увеличению давления на нервы и прочие структуры.
Термин «компартмент-синдром» был введен в 1963 г. von Reszel et al. В конце 70-х годов F. Matsen [5] выявил синергичное влияние артериальной гипотонии и повышенного субфасциального давления на развитие КС. Примерно к этому времени были разработаны стандартизированные оперативные вмешательства на голени в виде унилатеральной парафибулярной декомпрессии [5] и билатеральной декомпрессии [6].
В 1980 г. F. Matsen [5] дал следующее определение компартмент–синдрома: «КС – это состояние, при котором увеличение давления в каком-либо ограниченном пространстве нарушает циркуляцию и функцию тканей этого пространства». Хотя данное определение было весьма широким, авторы фокусировались в основном на скелетной мускулатуре. Позднее характеристики КС были применены на другие органы и ткани (внутрисуставной КС при повышении давления в тазобедренном суставе интракапсулярной гематомой при переломах шейки бедра, интракраниальный КС при увеличении интракраниального давления, глаукома при нарушении оттока из камеры глаза).
С помощью микрозондов, первоначально применявшихся для измерения внутричерепного давления, открылась возможность постоянного измерения внутримышечного давления (Becker et al., 1987).
Этиологические факторы КС скелетной мускулатуры:
1. Уменьшение объема мышечного ложа извне:
• компрессия: мягкие и гипсовые повязки, пневматические шины, кровоостанавливающий жгут, позиционное сдавление при интоксикации;
• вытяжение при переломах, дистракция сегмента;
• циркулярные ожоги и отморожения III степени;
• ушивание дефектов фасции;
• укладка пациента на операционном столе (поднятие конечности и (или) компрессия в течение длительного периода времени.
2. Увеличение объема содержимого мышечного ложа:
• кровотечение;
• инфузионная терапия
• внутрикостная инфузия, внутривенная инфузия под давлением
• артроскопия;
• отек из-за увеличения проницаемости капилляров
• ишемическое реперфузионное повреждение.
Патофизиология
Нормальное давление в мышечном ложе составляет в среднем 10—12 мм рт. ст. (от 4 до 21 мм рт. ст.). Перфузионное давление в мышце, представляющее собой разницу между средним артериальным давлением и давлением в мышечном ложе, должно быть не менее 70—80 мм рт. ст.
Теория артерио-венозного градиента (а.-в. градиент). Так как имеются четкие указания на роль вазоспастического компонента в развитии компартмент–синдрома и локальный кровоток страдает в значительной степени, теория артерио-венозного градиента является весьма важной, так как она четко разъясняет механизмы перфузионных нарушений. Согласно этой теории, местный кровоток зависит от отношения артерио-венозного градиента (Рарт. – Рвен.) к местному сосудистому сопротивлению (R). При этом местное сосудистое сопротивление зависит от вязкости крови, длины и общего поперечника сосудов. Согласно математическим подсчетам, изменение поперечника сосудов четырехкратно воздействует на местный кровоток.
Венозная система более подвержена компрессии, поэтому при повышении тканевого давления повышается венозное давление, снижая, таким образом, а.-в. градиент и местный кровоток. В определенной мере местный кровоток может поддерживаться путем снижения сосудистого сопротивления, однако при превышении местных компенсаторных возможностей местный кровоток понижается критически, что вызывает метаболический дефицит и может способствовать развитию КС.
Рассечение повязки, как и фасциотомия, снижает тканевое, а следовательно, и венозное давление и тем самым улучшает региональный кровоток. Аналогично действует и минимальное поднятие конечности (например, голени в аппарате внешней фиксации) от поверхности кровати, устраняя тем самым давление снизу. Однако не следует сильно поднимать конечность, так как это ведет к снижению артериального притока и дальнейшему уменьшению а.-в. градиента.
При нестабильности общей гемодинамики (политравма, шок) низкое системное артериальное давление также приводит к снижению местного а.-в. градиента. Кровопотеря вызывает сгущение крови и увеличение локального сопротивления – факторы, которые усиливаются при повреждении клеток эндотелия и увеличении проницаемости капилляров [3].
Микроциркуляторный обмен жидкостью, белками и синдром проницаемости капилляров. Starling (1896) установил, что перемещение жидкостей между плазмой и тканями зависит от дифферента гидростатических давлений и протеино–осмотических сил между этими средами. Дифферент гидростатического давления представляет собой разницу между давлением в капиллярах и гидростатическим тканевым давлением. Осмотическая сила, действующая в капиллярах, представлена дифферентом осмотического давления протеинов плазмы и протеинов тканей, она противостоит гидростатическому давлению и способствует наполнению капилляров. Согласно гипотезе Starling, данные процессы постоянно уравновешены, т.е. потеря протеинов плазмы и жидкостей в капиллярах с нормальной проницаемостью невелика. Однако если стенка капилляров повреждается, протеины плазмы устремляются в ткани, что приводит к значительному увеличению осмотического давления тканей и к отеку даже при низком давлении в капиллярах [3].
В последние десятилетия шло интенсивное изучение клеточных и субклеточных реакций на ишемию, были открыты важные дополнительные факторы, такие как нестабильность гемодинамики. Выяснилось, что в патогенезе компартмент–синдрома помимо ишемии и повышения давления не последнюю роль играют также реперфузионно-ишемические повреждения и иммунологические реакции. Большое влияние на развитие теории патогенеза КС оказали новые знания о синдроме повышенной проницаемости капилляров и формировании «третьего пространства» (или «функционально мертвого пространства»), которое приводит к нарушениям диффузионных процессов.
Диагностика
Так как компартмент–синдром может возникать не только сразу после травмы, но и спустя несколько дней после нее, для своевременного выявления этого состояния необходимо динамическое наблюдение. Если пациент в сознании, диагноз устанавливается клинически (таблица). Инструментальные методы исследования важны в сомнительных случаях для проведения дифференциальной диагностики, а также при бессознательном состоянии пациента.
Таблица. Клиническая диагностика компартмент–синдрома и артериальной ишемии
|
Компартмент-синдром – 6Р
|
Артериальная ишемия – 4Р
|
|
Pain (боль)
Paresthesia (парестезия)
Paresis (парез)
Pain with stretch (боль при натяжении)
Pulses intact (пульс интактен)
Pink skin colour (синюшность кожи)
|
Pain (боль)
Pallor (бледность)
Paralysis (паралич)
Pulselessness (отсутствие пульса)
|
Так как в большинстве мышечных футляров проходят нервы с чувствительными волокнами, первым признаком ишемии нерва являются парестезии в зоне его чувствительной иннервации. По мере увеличения ишемии парестезии сменяются гипестезиями. По локализации дизестезии можно определить, какое мышечное ложе повреждено.
На голени в переднем мышечном ложе находится глубокий малоберцовый нерв, зона чувствительной иннервации которого соответствует первому межпальцевому промежутку стопы. Через латеральный отсек проходит поверхностный малоберцовый нерв (чувствительность тыла стопы). Дизестезия подошвенной поверхности стопы указывает на вовлечение n.tibialis posterior — глубокое мышечное ложе голени. Оценка поверхностного заднего футляра может производиться по чувствительности наружного края стопы — зоны иннервации n.suralis.
В отличие от дизестезий, парезы и параличи являются поздними признаками, которые требуют неотложного лечения. Интактность артериального пульса на стопе не исключает диагноза КС.
Измерение субфасциального давления. Преимущества измерения субфасциального давления заключаются в его достоверности и возможности продолжительного контроля эффективности терапии. Критический уровень абсолютного давления мышечного ложа точно не определен. Он колеблется, по разным оценкам, от 30 до 50 мм рт. ст.
Whitesides (1975) предположил, что уровень давления в мышце, который может вызывать ишемические расстройства, зависит от перфузионного давления. Разница между диастолическим и внутримышечным давлением (DР) менее 30 мм рт. ст. является показанием к оперативному лечению. Измерение субфасциального давления важно также для своевременного выявления «возвратного» КС, возникающего при закрытии кожных дефектов спустя несколько дней после фасциотомии.
Для лучшего понимания клинической картины и выполнения лечебных мероприятий выделяют угрожающий и манифестный КС.
Об угрожающем КС говорят, когда пациент испытывает сверлящие боли, усиливающиеся при натяжении мышц, имеются неврологические расстройства в виде парестезий и парезов. Различие между диастолическим АД и давлением внутри мышечного ложа более 20 мм рт.ст.
Манифестный КС характеризуется полной выраженностью неврологических проявлений (плегия, анестезия) и различием давлений менее 20 мм рт.ст.
Дифференциальная диагностика при компартмент–синдроме производится с артериальной ишемией, флеботромбозом, повреждениями нервов и инфекционными процессами.
Принципы лечения
Так как в первые часы и дни после травмы, операции, особенно при нестабильности системного кровотока, возникает посттравматический отек, при подозрении на развитие КС необходимо рассечение всех циркулярных повязок (не только гипсовых, но и бинтовых). Аналогичным образом а.-в. градиент повышается при легком поднятии конечности с поверхности кровати (но не выше уровня сердца). Поскольку недостаток ОЦК вызывает увеличение вязкости крови и увеличивает сосудистое сопротивление, важно адекватное восполнение ОЦК [6].
Хирургическая техника
При развитии признаков манифестного компартмент–синдрома показано хирургическое лечение.
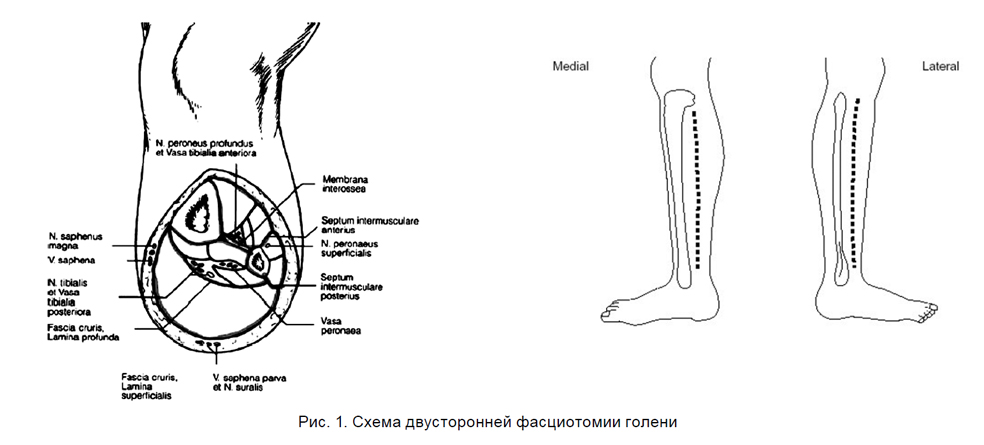
Четыре мышечных ложа голени могут быть вскрыты либо через билатеральные разрезы, либо с помощью парафибулярной фасциотомии (ФТ). Парафибулярный доступ был разработан F. Matsen в 1978 г. Позднее S. Mubarak и C. Owen [6] рекомендовали применение двух разрезов, их метод обеспечивал более безопасный доступ ко всем четырем отсекам с четкой визуализацией всех поверхностных и глубоких образований голени. Этот метод остается методом выбора при травматическом КС голени.
При парафибулярной декомпрессии кожа рассекается над малоберцовой костью на всем протяжении, находящаяся в разрезе фасция наружной группы мышц также рассекается. Передняя мышечная группа достижима при отведении кожного лоскута кпереди. Поверхностная задняя группа мышц достигается путем препарирования в дорзальном направлении и высвобождается. После отделения наружной группы мышц от их дорзальной фасции малоберцовые мышцы отводятся кпереди, а трехглавая мышца голени кзади. Тем самым для фасциотомии выделяется фасция между малоберцовой костью и глубоким листком фасции голени. При дистальных повреждениях особенно важно рассечь lig. transversum [5].
При двустороннем доступе для освобождения вентрального и латерального отсеков выполняется кожный разрез на 2 см кпереди от малоберцовой кости в проксимальной или средней трети голени. Фасции обеих мышечных групп рассекаются поперечно для выделения передней межмышечной перегородки. При этом следует щадить поверхностный малоберцовый нерв, находящийся кзади от межмышечной перегородки. Для декомпрессии обеих мышечных групп используются раскрытые бранши длинных ножниц или фасциотом, которые продвигаются (в том числе подкожно) в направлении надколенника проксимально и большого пальца дистально, для латерального отсека – в пределах диафиза малоберцовой кости.
Для декомпрессии поверхностного и глубокого задних футляров кожа рассекается на 2 см дорзальнее заднего края большеберцовой кости в дистальной трети голени. V. saphena magna и n. saphenus отводятся вентрально. При поперечном рассечении фасции идентифицируется межмышечная перегородка между двумя группами. После декомпрессии поверхностной группы мышц следует найти сухожилие m. flexor digitorum longus и выполнить декомпрессию глубокого мышечного ложа, которое не покрыто трехглавой мышцей только в нижней трети голени. Преимуществом двусторонней декомпрессии является также возможность ее выполнения под местной анестезией [4, 6].
Для сокращения длительности ишемии и степени реперфузионных повреждений оперативное вмешательство проводится обычно без кровоостанавливающего жгута. Фасциотомия выполняется путем продольного и поперечного рассечения. Решающим критерием при иссечении нежизнеспособной мышечной ткани является правило 4К: здоровая мышца контрагирует при покалывании, имеет нормальную консистенцию, красно-коричневый цвет и капиллярное кровотечение при надрезе [3]. Однако при сомнениях в жизнеспособности мышечной ткани рекомендуется избегать излишнего иссечения.
Манифестный КС требует рассечения кожи по всей длине выполняемой фасциотомии. В сравнительном исследовании подкожной и открытой фасциотомии Jensen и Sandermann (1987) выявили бóльшую эффективность последней: 5 из 39 случаев выполнения подкожной фасциотомии требовали ревизии и открытой ФТ из-за сохраняющихся признаков повышения мышечного давления. В то же время у всех пациентов с открытой ФТ была достигнута удовлетворительная декомпрессия.
Длина кожного разреза, необходимого для проведения фасциотомии, оценивалась в работах S. Mubarak et al. [6]. Средняя длина разреза у их пациентов составляла 15 см, сам по себе разрез кожи уже снижал внутримышечное давление на 5—9 мм рт.ст.
При наличии перелома рекомендуется одновременное выполнение стабилизирующих вмешательств на костях. По возможности следует сразу осуществлять окончательный остеосинтез, однако, если это невозможно ввиду тяжелого состояния больного, временная стабилизация с помощью стержневого внешнего фиксатора позволяет обеспечить необходимую прочность фиксации [4].
Для предотвращения рецидива компартмент–синдрома фасция и кожа на всем протяжении разреза должны оставаться незашитыми. Рана закрывается влажной стерильной повязкой либо синтетическими материалами. При необходимости выполняется вторичная хирургическая обработка с целью иссечения демаркированных нежизнеспособных мышц. В последние годы за рубежом стали популярными вакуумные изолирующие повязки, позволяющие избегать вторичного инфицирования раны. Даже если при угрожающем КС производится профилактическая фасциотомия полузакрыто через небольшие разрезы кожи, первичный шов кожной раны показан лишь при отсутствии натяжения кожных краев [4].
Динамическое закрытие раны с помощью дерматотракции следует начинать после уменьшения отека на 5—8–е сутки, а иногда еще на 2—3 суток позже. Нередко для закрытия ран используется свободная пластика расщепленным кожным лоскутом.
Осложнения фасциотомии изучал Fitzgerald (2000): в когорте из 60 пациентов наиболее частыми были расстройства чувствительности у краев раны и сохраняющаяся отечность конечности. Другие авторы отмечали возникновение инфекционных осложнений со стороны мягких тканей, остеомиелит, необходимость ампутации, а также снижение силы мышц голени.
Дополнительное лечение
Гипербарическая оксигенация (ГБО) позволяет уменьшить отек и некроз мышечной ткани. Механизм ее действия заключается в увеличении потребления кислорода и вазоконстрикции артериол, что снижает давление в капиллярах и транссудацию. Применение ГБО показано лишь как дополнение к фасциотомии либо в тех случаях, когда немедленное оперативное лечение невозможно [7].
Маннитол – гиперосмотический диуретик, действует как поглотитель свободных радикалов и устраняет отечность. Данные об эффективности маннитола при лечении компартмент–синдрома противоречивы, но препарат может использоваться как дополнение к оперативному лечению.
К л и н и ч е с к и й п р и м е р. Пациент В., 56 лет, был доставлен в приемное отделение РНПЦ травматологии и ортопедии через 1 час после травмы: находясь на заднем сиденье троллейбуса, внезапно ощутил сильный удар по задней поверхности голени (взорвалось колесо). При осмотре: резкая напряженная отечность голени, синюшность кожных покровов и нарастающий отек стопы. За время выполнения рентгенограмм появились нарушения чувствительности стопы в виде парестезий. На снимках: оскольчатый перелом проксимального отдела большеберцовой кости со смещением, смещенный перелом обеих лодыжек левой голени.
В операционной выполнена открытая билатеральная фасциотомия голени, произведено наложение стержневого аппарата на левое бедро-голень, открытая репозиция и остеосинтез перелома лодыжек. Кожные разрезы ушивались лишь в проекции металлоконструкций в зонах, где не было сильного натяжения кожи. В верхней и средней третях голени ушивание раны не выполнялось из-за резкого отека мускулатуры. Наложен непрерывный шов монофильной нитью по типу «шнуровки» без затягивания, рана закрыта влажными салфетками.
По мере спадания отека на 5-е сутки после операции начали этапное затягивание нити, что позволило в течение 3 дней практически полностью свести края раны и наложить вторичный шов (рис. 2).

Еще через 7 суток выполнен окончательный остеосинтез проксимального отдела большеберцовой кости и демонтирован аппарат внешней фиксации. Заживление послеоперационных ран без особенностей. Пациент возобновил полную нагрузку на ногу через 4 месяца после травмы. Спустя 1 год металлоконструкции удалены. Ходит с незначительной хромотой, отмечает отечность конечности после нагрузок, движения стопой ограничены на 10о в каждом направлении. Работает по специальности.
Таким образом, результатом компартмент–синдрома при отсутствии лечения является рубцовое перерождение мышц, которое приводит к тяжелой фиброзной контрактуре и нейропатии всех нервных стволов, проходящих в мышечном ложе. Восстановление нормальной функции сегмента становится невозможным.
Основа ранней диагностики КС конечностей — клиническая настороженность в отношении развития этого серьезного осложнения. Диагностическое правило 6Р (см. таблицу) позволяет установить диагноз, если пациент в сознании. При бессознательном состоянии больного диагностика КС затруднена и требует применения инструментальных методов.
Необходимо раннее (до 6 часов с момента возникновения КС) экстренное хирургическое лечение – декомпрессия всех мышечных футляров поврежденного сегмента в сочетании со стабилизацией костных повреждений. Из-за быстрого развития необратимых изменений в мышечной и нервной тканях срок выполнения вмешательства критически важен. При переломах костей голени и развитии компартмент–синдрома методом выбора является выполнение широкой двусторонней фасциотомии.
Л И Т Е Р А Т У Р А
1. Blick S.S., Brumback R.J., Poka A. et al. // J. Bone Joint Surg. —1986. – Vol. 68-A. – P. 1348.
2. Court-Brown C.M., Christie J., McQueen M.M. // J. Bone Joint Surg. —1990. – Vol. 72-B. – P. 605—611.
3. Echtermeyer V., Horst P. // Unfallchirurg. —1997. – Bd 100. – S. 924—937.
4. Kostler W., Strohm P.C., Sudkamp N.P. // Injury. — 2004. – Vol.35. – P. 1221—1227.
5. Matsen F.A., Winquist R.A., Krugmire R.B. Jr. // J. Bone Joint Surg. (Amer.). — 1980. —Vol. 62. —P. 286—291.
6. Mubarak S.J., Owen C.A., Hargens A.R. et al. // J. Bone Joint Surg. —1978. – Vol. 60-A. – P. 1091—1095.
7. Tiwari A., Haq A.I., Myint F. // Brit. J. Surg. — 2002. —Vol. 89 (4). – P. 397—412.
Медицинские новости. – 2008. – №7. – С. 20-24.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.