Сердечно-сосудистые заболевания (ССЗ) являются ведущей причиной смертности в мире, приводя к 17,5 млн смертей в год. 7,6 млн человек ежегодно умирают от инфаркта, 5,7 млн — от инсульта. По предварительным прогнозам, общее количество смертей от ССЗ к 2020 г. составит около 25 млн. К этому же году сердечно-сосудистые заболевания прогнозируются как ведущая причина утраты трудоспособности. В связи с этим продолжается поиск новых лекарственных средств с целью снижения заболеваемости и смертности от ССЗ.
В 90-е годы XX в. появилась новая группа фармакологических препаратов, действие которых основано на торможении активности ренин-ангиотензин-альдостероновой системы (РААС) на уровне ангиотензиновых рецепторов I типа для ангиотензина II. Эти препараты получили название блокаторы ангиотензиновых рецепторов I типа (БРА), или антагонисты рецепторов ангиотензина II (АРА).
В настоящее время продолжается изучение места БРА в лечении сердечно-сосудистой патологии. Класс БРА пополняется новыми представителями (табл. 1).
Таблица 1. Классификация блокаторов ангиотензина II
|
Лекарственное средство
|
Химическая группа
|
Фармакологическая активность
|
Характер связи с рецептором
|
Сродство к рецепторам АТ I
|
|
Валсартан
|
Негетероциклический
|
+
|
Неконкурентная
|
2,4
|
|
Ирбесартан
|
Бифенилтетразол
|
+
|
Неконкурентная
|
1,2—4,1
|
|
Кандесартан
|
Бифенилтетразол
|
Пролекарство (CV 11974)
|
Неконкурентная
|
0,7—7,4
|
|
Лозартан
|
Бифенилтетразол
|
Пролекарство (Е3174)
|
Неконкурентная
|
19 (3,7)
|
|
Телмисартан
|
Небифенилтетразол
|
+
|
Неконкурентная
|
1,2
|
|
Эпросартан
|
Небифенилтетразол
|
+
|
Конкурентная
|
1,5
|
По механизму действия БРА напоминают ингибиторы ангиотензинпревращающего фермента (ИАПФ), которые подавляют АПФ, участвующий в превращении неактивного ангиотензина (АТ) I в АТ II, являющийся мощным вазоконстриктором и обладающий рядом других эффектов. За последние годы проведено несколько исследований, целью которых был поиск ответов на следующие вопросы:
• насколько БРА эффективнее ИАПФ в лечении сердечно-сосудистой патологии;
• является ли комбинация ИАПФ и БРА более эффективной при лечении сердечно-сосудистой патологии, чем ИАПФ или БРА.
Результаты последних исследований позволяют однозначно утверждать: прогрессирование сердечно-сосудистых заболеваний связано с нарастанием активности РААС. Хроническая гиперактивация РААС проявляется увеличением содержания в крови и тканях ее главного эффекторного пептида – ангиотензина II. К числу основных физиологических эффектов ангиотензина II относятся вазоконстрикция, усиление синтеза и секреции альдостерона, задержка натрия и воды, повышение тонуса симпатической нервной системы, усиление высвобождения вазопрессина, эндотелина-1 и норадреналина, стимуляция роста кардиомиоцитов и клеток соединительной ткани в миокарде, пролиферации гладкомышечных клеток и фибробластов в сосудистой стенке, а также мезангиальных клеток в почечных клубочках. Повреждающее воздействие ангиотензина II на органы-мишени выражается в развитии гипертрофии миокарда и миокардиофиброза, прогрессировании атеросклероза, повышении внутриклубочкового давления с последующим развитием нефросклероза, патологической цереброваскулярной реконструкции. Эффекты ангиотензина II и других эффекторных пептидов РААС опосредуются специфическими ангиотензиновыми рецепторами. Ангиотензин II воздействует главным образом на рецепторы 1-го и 2-го типов (АТ1 и АТ2). Большинство связанных с активацией РААС функциональных и структурных изменений в сердце, сосудах и почках обусловлено влиянием ангиотензина II на АТ1-рецепторы. Снижение активности РААС может быть обеспечено либо подавлением синтеза ангиотензина II, либо блокадой АТ1-рецепторов. В клинических условиях для решения этой задачи применяют ИАПФ или БРА. Каждый из этих способов воздействия на РААС имеет свои достоинства и недостатки. Известно, что АПФ контролирует образование лишь 15—20% ангиотензина II. Образование АТII может осуществляться помимо основного пути, в котором ключевую роль играет АПФ, другими способами, в которых участвуют химазы, катепсин G, тканевой активатор плазминогена, тонин и т.д. Альтернативное, независимое от АПФ образование АТII происходит главным образом в тканях. В связи с этим при лечении ИАПФ снижение активности АТII в крови не исключает отсутствия выраженных изменений его содержания в тканях. Именно активность тканевого АТII определяет степень его повреждающего действия на органы-мишени. Длительная терапия ИАПФ сопровождается гиперренинемией и усилением образования ангиотензина I, конкурирующего с лекарственными препаратами этого класса за связывание с АПФ, а также активацией альтернативных путей превращения АТI в АТII. Вместе с тем блокада АПФ (кининазы II) не только обеспечивает уменьшение образования АТII, но и препятствует превращению брадикинина в неактивные пептиды. Воздействуя на клетки эндотелия, брадикинин стимулирует выработку оксида азота, простациклина и эндотелиального фактора гиперполяризации, которые обладают вазодилатирующими, антиагрегантными и антипролиферативными свойствами. Торможение деградации брадикинина играет важную роль в восстановлении нейрогормонального баланса при повышении активности РААС.
БРА блокируют АТ1-рецепторы и ослабляют эффекты АТII вне зависимости от путей его образования. Вместе с тем одним из следствий блокады АТ1-рецепторов является реактивное усиление образования АТII и других эффекторных пептидов РААС. В условиях блокады АТ1-рецепторов эффекторные пептиды РААС вызывают дополнительную стимуляцию других видов АТ1-рецепторов. Некоторые эффекты стимуляции АТ2-рецепторов противоположны эффектам стимуляции АТ1-рецепторов. Так, воздействие ангиотензина II на АТ2-рецепторы вызывает вазодилатацию, натрийурез, торможение гипертрофии кардиомиоцитов и пролиферации фибробластов в миокарде, а также пролиферации и миграции эндотелиальных, гладкомышечных и мезангиальных клеток. Одним из эффектов стимуляции АТ2-рецепторов является активация кининогена, что способствует образованию брадикинина в сосудистой стенке, а следовательно, усилению высвобождения оксида азота, простациклина и эндотелиального фактора гиперполяризации. Таким образом, благоприятные фармакологические эффекты складываются из прямого блокирующего влияния на АТ1-рецепторы и косвенного стимулирующего воздействия на АТ2-рецепторы (рис. 1).
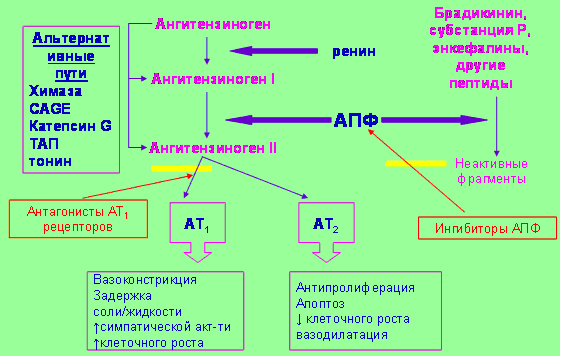
Рис. 1. Точки воздействия ИАПФ и АРА
Преимущество БРА перед ИАПФ заключается в том, что они обеспечивают более полную и селективную блокаду РААС. Кроме того, БРА способствуют реализации защитных эффектов ангиотензина II за счет усиления его воздействия на АТ2-рецепторы и не оказывают непосредственного влияния на калликреин-кининовую систему, с активацией которой связаны основные побочные эффекты ИАПФ — сухой кашель и ангионевротический отек. С другой стороны, предотвращение распада брадикинина не только повышает риск развития побочных эффектов ИАПФ, но и является важным компонентом их органопротективного действия.
Показания к применению ИАПФ и БРА идентичны. Оба класса лекарственных препаратов обеспечивают снижение АД у больных артериальной гипертензией (АГ), замедление прогрессирования хронической сердечной недостаточности (ХСН) и защиту органов-мишеней. В связи с этим у врача нередко возникает проблема выбора: какому классу лекарственных препаратов, подавляющих активность РААС, следует отдать предпочтение в той или иной клинической ситуации? Однозначного ответа на этот вопрос сегодня нет. Активно обсуждается возможность совместного применения ИАПФ и БРА для лечения ССЗ, но единого мнения о преимуществах и ограничениях этой комбинации нет. В клинической практике ИАПФ используются значительно чаще, чем БРА, так как препараты этого класса лучше изучены, более знакомы врачам и более доступны пациентам. Основанием для применения БРА, согласно требованиям рекомендаций экспертов по лечению ХСН и АГ, до настоящего времени была лишь индивидуальная непереносимость ИАПФ. Между тем полученные в последнее время данные о влиянии препаратов этих классов на течение сердечно-сосудистых заболеваний позволяют более четко определить клинические задачи, для решения которых применение БРА или комбинации ИАПФ и БРА может быть предпочтительно.
В последние годы проведено большое количество исследований, посвященных изучению эффективности БРА (рис. 2)

Рис. 2. Клинические исследования с использованием блокаторов рецепторов АТ II
Метаанализ результатов исследований антигипертензивного эффекта различных БРА (лозартана, валсартана, ирбесартана и кандесартана) показал, что на фоне постоянной терапии через 24 часа после приема препарата наибольшее снижение АД отмечается у больных, получающих кандесартан. Сравнительная оценка выраженности гипотензивного эффекта выявила достоверную разницу между кандесартаном и валсартаном [3]. В исследовании К. Fridman et al. показано, что у больных АГ применение кандесартана в дозе 16 мг/сут обеспечивает более выраженный гипотензивный эффект, чем прием лозартана и валсартана в дозе 50 и 80 мг/сут соответственно. Подъем АД, усиление секреции альдостерона и другие негативные эффекты вводимого внутривенно ангиотензина II на фоне терапии кандесартаном выражены достоверно слабее, чем на фоне приема лозартана и валсартана. Авторы пришли к выводу о том, что кандесартан более эффективно блокирует AT1-рецепторы, чем другие БРА [4]. В исследовании CARLOS сравнивался гипотензивный эффект комбинаций кандесартана с гидрохлортиазидом (16 и 12,5 мг соответственно) и лозартана с гидрохлортиазидом (50 и 12,5 мг соответственно) у больных АГ через 24 и 48 часов после приема препаратов на фоне предшествующих 6 недель терапии этими комбинациями. У больных, принимавших кандесартан, снижение АД было достоверно более выраженным, чем у использовавших лозартан [5].
Цель исследования ELITE II заключалась в сопоставлении результатов лечения лиц пожилого возраста, страдающих ХСН II–IV функционального класса, лозартаном и каптоприлом. Частота смерти от всех причин, а также внезапной смерти с успешной реанимацией у пациентов сравниваемых групп была одинаковой. При анализе выживаемости в подгруппах отмечено недостоверное преимущество каптоприла, которое достигало уровня статистической значимости у больных, получавших b-адреноблокаторы и спиронолактон, а также в подгруппе пациентов с фракцией выброса левого желудочка более 32%. Преимущество лозартана заключалось в меньшей частоте побочных эффектов [9]. По данным исследования OPTIMAAL, лечение каптоприлом и лозартаном одинаково влияет на риск смерти больных с ХСН вследствие перенесенного инфаркта миокарда [2]. В исследовании VALIANT показано, что каптоприл и валсартан не различаются по влиянию на прогноз больных, перенесших инфаркт миокарда, осложненный ХСН [7]. Результаты исследования RESOLVD продемонстрировали, что у больных ХСН эналаприл и кандесартан в равной степени замедляют процесс патологического ремоделирования левого желудочка, снижают уровень мозгового натрийуретического пептида и альдостерона в крови [6].
К вопросу о том, какому классу лекарственных препаратов – ИАПФ или БРА – принадлежит приоритет в той или иной клинической ситуации, следует добавить еще один: в каких клинических ситуациях целесообразно их сочетанное применение? Теоретически комбинация ИАПФ и БРА выглядит весьма привлекательно: подавление АПФ позволяет уменьшить образование ангиотензина II и усилить положительные эффекты брадикинина, а блокада AT1-рецепторов – свести к минимуму возможность реализации негативных эффектов ангиотензина II, образующегося не АПФ-зависимыми путями, и направить его действие на AT2-рецепторы.
Добавлять ИАПФ к терапии БРА нецелесообразно, поскольку последние способствуют полному и избирательному снижению активности РААС. При этом ИАПФ подавляют вызываемое БРА реактивное повышение синтеза АТ II и вследствие этого ослабляют косвенную стимуляцию рецепторов АТ II 2-го типа, которая считается одним из основных механизмов антигипертензивного действия БРА. Сторонники применения этой комбинации ссылаются на то, что, во-первых, только ИАПФ не могут обеспечить полной блокады РААС, в то время как дополнительное применение БРА позволяет более значимо снизить ее активность. Во-вторых, фармакологические эффекты ИАПФ опосредуются не только влиянием на РААС, но и торможением деградации брадикинина. В-третьих, вызываемое ИАПФ торможение образования АТ II способствует повышенному превращению АТ I в АТ III и IV, которое особенно усиливается в условиях реактивного подъема уровня АТ I, вызываемого БРА.
Опыт применения данной комбинации ограничен, первые результаты весьма неоднозначны. Однако именно комбинация ИАПФ с БРА может оказаться полезной и даже незаменимой при лечении высокорениновых форм АГ.
Эффективность комбинации ИАПФ и БРА была доказана в нескольких исследованиях. В двойном слепом проспективном исследовании CALM (CAndesartan and Lisinopril Microalbuminuria study) участвовали 199 пациентов с АГ и сахарным диабетом типа 2 (СД 2). Сравнивалась антигипертензивная эффективность монотерапии БРА кандесартаном в дозе 16 мг/сут, ИАПФ лизиноприлом в дозе 20 мг/сут и их комбинации. Средний срок наблюдения составил 24 недели. При применении комбинированного лечения отмечено достоверно большее снижение артериального давления (АД), чем при монотерапии каждым препаратом.
Клинические результаты двухуровневой блокады РААС у больных с ХСН оказались менее впечатляющими, чем ожидалось. В исследовании VALIANT сравнивали влияние терапии валсартаном, каптоприлом и их комбинацией на прогноз больных, перенесших инфаркт миокарда, осложненный в остром периоде сердечной недостаточностью. По влиянию на общую смертность, а также комбинированный критерий оценки, включавший сердечно-сосудистую смертность, частоту развития инфаркта миокарда и прогрессирования ХСН, сочетанное использование валсартана и каптоприла оказалось не более эффективным, чем их применение по отдельности, но сопровождалось увеличением частоты побочных явлений [7]. Результаты исследования RESOLVD показали, что у больных с ХСН сочетанное применение эналаприла и кандесартана по сравнению с их раздельным использованием сопровождается достоверным усилением гипотензивного эффекта и тормозящего влияния терапии на прирост конечно-диастолического объема левого желудочка, но незначительно повышает риск смерти [6]. В исследовании Val-HeFT добавление валсартана к комбинированной терапии больных с ХСН, включавшей эналаприл, не оказывало влияния на выживаемость, но приводило к достоверному снижению риска госпитализации. Результаты этого исследования вызвали некоторую настороженность в отношении применения комбинации нейрогуморальных модуляторов с целью предотвращения прогрессирования ХСН, так как анализ данных, которые были получены в подгруппах больных, показал, что сочетание ИАПФ, БРА и b-адреноблокаторов оказывает негативное влияние на прогноз [1].
Более обнадеживающие результаты применения БРА в составе комплексной фармакотерапии больных с ХСН получены в программе CHARM [8]. Терапия кандесартаном (дозу титровали до 32 мг/сут) сопровождалась едва не достигшим статистической значимости снижением общей смертности на 9% (p=0,055), достоверным снижением смертности от сердечно-сосудистых причин на 12%, частоты госпитализаций в связи с ХСН на 21% и частоты первичной конечной точки (смерть от сердечно-сосудистых причин или госпитализация в связи с ХСН) на 16%. Применение кандесартана у больных с фракцией выброса левого желудочка менее 40% и непереносимостью ИАПФ (исследование CHARM-Alternative) позволило достоверно снизить частоту первичной конечной точки на 23%. Сочетанное использование кандесартана и ИАПФ у больных с низкой фракцией выброса левого желудочка, по данным исследования CHARM-Added, сопровождалось достоверным снижением частоты первичной конечной точки на 15% и частоты смертельных исходов от сердечно-сосудистых причин на 16%. В исследовании CHARM-Preserved у больных с сохраненной фракцией выброса левого желудочка частота первичной конечной точки на фоне лечения кандесартаном снижалась недостоверно на 11%, но даже в этом исследовании (равно как и в двух других) терапия кандесартаном приводила к статистически значимому сокращению числа госпитализаций в связи с прогрессированием ХСН [10].
Программа CHARM позволила получить доказательства позитивного влияния кандесартана на прогноз больных с ХСН вне зависимости от наличия или отсутствия систолической дисфункции левого желудочка, а также пола, возраста больных и сопутствующей терапии.
Для определения места комбинации БРА и ИАПФ в лечении больных высокого сердечно-сосудистого риска было проведено исследование ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial). Результаты этого испытания, включавшего 25620 пациентов и длившегося 5,5 года, были представлены 31 марта 2008 г. на 57-й ежегодной научной сессии Американского кардиологического колледжа.
Основная цель, которую вначале поставили перед собой исследователи, заключалась в том, чтобы оценить, будет ли ежедневный прием 80 мг телмисартана по крайней мере таким же эффективным, как ежедневный прием 10 мг рамиприла, в снижении главной конечной точки, включающей кардиоваскулярную смерть, инфаркт миокарда, инсульт и госпитализацию по поводу сердечной недостаточности. Вторая часть исследования посвящена вопросу, будет ли комбинация телмисартана и рамиприла лучше применения одного рамиприла в снижении этих конечных точек.
Все понимали, что с теоретической точки зрения такая комбинация является уникальной возможностью блокады неблагоприятных патофизиологических эффектов прогрессирования сосудистых поражений. Так родилась идея разделить исследование на несколько частей.
Третья часть исследования, получившая название ONTARGET/TRANSCEND, посвящена использованию БРА у пациентов, которые по разным причинам не переносят ингибиторы АПФ. Телмисартан сравнивался с плацебо, поскольку на сегодняшний день не доказана эффективность другого БРА или другой группы препаратов.
Результаты этого испытания четко показали, что телмисартан так же эффективен, как и рамиприл, в снижении главной конечной точки (р<0,003) и столь же эффективен в снижении дополнительных конечных точек, как в исследовании НОРЕ (p<0,001), при сохранении более 90% преимуществ применения рамиприла у пациентов с высоким кардиоваскулярным риском. Как и ожидалось, переносимость телмисартана была значительно лучше в связи с меньшим количеством таких побочных эффектов, как кашель и ангионевротический отек. Одним из основных доказательств исследования является то, что БРА телмисартан не увеличивает риск развития ИМ у пациентов высокого риска, а снижает его.
Таким образом, на сегодняшний день доказана возможность использования телмисартана с той же целью, что и рамиприла. Это очень важно для клинической практики.
Не обошлось и без неожиданностей. Для исследователей стал сюрпризом тот факт, что комбинация ингибитора АПФ и БРА не дала дополнительных положительных преимуществ, как это было показано в экспериментальных исследованиях. Кроме того, в ряде случаев получен негативный эффект в отношении функции почек, что сделало необходимым проведение ретро-спективного анализа полученных данных с целью оценки функции почек у больных, у которых наблюдалось ухудшение состояния при применении комбинированной терапии.
В исследовании ONTARGET показана возможность профилактики развития новых эпизодов сахарного диабета или нарушения толерантности к глюкозе на фоне лечения телмисартаном. Однако если в исследовании НОРЕ с рамиприлом было продемонстрировано достоверное уменьшение количества новых клинически значимых случаев СД, то в ONTARGET этот эффект не столь достоверен, а позитивный клинический результат в плане уменьшения толерантности к глюкозе получен преимущественно у пациентов, уже имевших такое нарушение.
Поскольку мы говорим о конкретном исследовании, необходимо отметить, что в его основе лежит современная базисная терапия. В ходе ONTARGET вероятность развития сосудистых осложнений предполагала использование антитромбоцитарных препаратов; у больных с высоким уровнем холестерина липо-протеидов низкой плотности применялись статины; пациенты с ишемической болезнью сердца получали бета-адреноблокаторы. Все эти группы лекарственных средств являются жизненно важной терапией для кардиологического больного. Но при этом следует помнить, что в реальной клинической практике доказанный эффект одного или двух препаратов нельзя переносить на эффект класса. Исследование ONTARGET показало, что сегодня имеются четкие доказательства в отношении длительного профилактического эффекта единственного из всей группы БРА препарата – телмисартана.
Исследования по изучению эффективности БРА, проведенные в последние годы, нашли отражение в положениях экспертов в ряде рекомендаций. Так, в Рекомендациях ЕОАГ/ЕОК 2007 г. отмечено: «Комбинации ИАПФ и БРА изучаются в исследованиях, которые проводятся в настоящее время. Хотя препараты этой группы могут перекрывать действие друг друга на различных уровнях и обладают одинаковым механизмом действия, тем не менее их комбинация более значимо снижает АД и обладает более выраженным антипротеинурическим эффектом, чем каждый компонент у пациентов с диабетической и недиабетической нефропатией. Эта комбинация приводила к улучшению выживаемости при ХСН. Тем не менее, остается неясным, могут ли преимущества этой комбинации быть повторены простым повышением дозы каждого компонента в качестве монотерапии.
Показания для назначения БРА:
• Хроническая сердечная недостаточность
• Перенесенный инфаркт миокарда
• Диабетическая нефропатия
• Гипертрофия левого желудочка
• Фибрилляция предсердий
• Метаболический синдром
• Кашель при приеме ИАПФ.
Позиция БРА в фармакотерапии сердечно-сосудистых заболеваний окончательно не определена. Естественно, препараты этого класса могут выступать как альтернатива ИАПФ в случаях их индивидуальной непереносимости. Но основным направлением клинического применения БРА, по-видимому, станет органопротекция. Прежде всего следует отметить многообещающие результаты использования препаратов этого класса с целью предупреждения нарушений мозгового кровообращения и прогрессирования функциональной неполноценности почек. Перспективным представляется применение БРА для профилактики СД типа 2, особенно для лечения больных с метаболическим синдромом. Специальных клинических исследований заслуживает способность БРА предотвращать негативные следствия острой ишемии и реперфузии миокарда.
Несомненно, ИАПФ и БРА являются высокоэффективными лекарственными средствами, улучшающими прогноз больных с сердечно-сосудистыми заболеваниями. Очевидно, их эффективность обусловлена не столько антигипертензивным действием, сколько влиянием на другие, неизученные механизмы развития ССЗ. В связи с этим необходимы дальнейшие исследования механизмов действия БРА и более четкое определение показаний к их назначению.
Л И Т Е Р А Т У Р А
1. Cohn J.N., Tognoni G.A. // New Engl. J. Med. – 2001. – Vol. 345. – P. 1667–1675.
2. Dickstein K., Kjekshus J. // Lancet. – 2002. – Vol. 360. – Р. 752–760.
3. Elmfeldt D., Olofsson B., Meredith P. // Blood Pressure. – 2002. – Vol. 11. – Р. 293–301.
4. Fridman K.U.B., Elmfeldt D., Wysocki M. et al. // Blood Pressure. – 2002. – Vol. 11. – Р. 244–252.
5. Koenig W. // Clin. Drug Invest. — 2000. – Vol. 19. – Р. 239–246.
6. McKelvie R.S., Yusuf S., Pericak D. et al. // Circulation. — 1999. – Vol. 100. – Р. 1056–1064.
7. Pfeffer M.A., McMurray J.J., Velazquez E.J. et al. // New Engl. J. Med. – 2003. – Vol.349. – Р. 1893–1906.
8. Pfeffer M.F., Swedberg K., Granger C.B. et al. // Lancet. – 2003. – Vol. 362. – Р. 759–766.
9. Pitt B., Pool-Wilson P., Segal R. et al. // Lancet. – 2000. – Vol. 355. – Р. 1582–1587.
10. Schrader J., Luders S., Kulschewski A. et al. // Stroke. — 2003. – Vol. 34. – Р. 1699–1703.
Медицинские новости. – 2009. – №6. – С. 11-15.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.