Сердечно-сосудистые заболевания (ССЗ) являются основной причиной инвалидизации и смертности населения экономически развитых стран мира.
В России ежегодно умирает 1200-1300 тыс человек, причем 62 % погибают от ишемической болезни сердца (ИБС) и таких её осложнений, как инфаркт миокарда и хроническая сердечная недостаточность (ХСН). В 2002 году в России насчитывалось 8,1 млн человек с четкими признаками ХСН, из которых 3,4 млн имели терминальный, III – IV ФК заболевания. У 4/5 всех больных с ХСН это заболевание ассоциируется с артериальной гипертензией (АГ) и у 2/3 больных – с ИБС (1).По данным Euro Heart Survay Study (2001), среди основных причин развития ХСН 60% приходится на ИБС, 14 % - на клапанные пороки сердца и 11% - на дилатационную кардиомиопатию.
Сохраняющаяся тенденция к росту показателей смертности от ССЗ в России и Беларуси на фоне стойкой тенденции к снижению или стабилизации показателей смертности от ССЗ в странах Западной Европы еще больше увеличивают этот разрыв.
Важную роль в адаптации млекопитающих к условиям внешней среды играет симпатическая нервная система (СНС), которая выступает в качестве одного из главных регуляторов сердечно-сосудистых функций. Однако, постоянное повышение симпатического тонуса может приводить к неблагоприятным изменениям в сердечно-сосудистой системе, а также сопровождаться развитием тяжелых метаболических нарушений.
Анатомия и физиология СНС
Вегетативная нервная система является частью нервной системы и состоит из центральной и периферической частей. Центральную часть образуют сегментарно расположенные центры в спинном мозгу и вышестоящие центры в стволе головного мозга. В подбугорковой области продолговатого мозга находятся дыхательный и сосудодвигательный центры, а также центры ускорения и замедления сердечной деятельности, рвоты, кашля, терморегуляции, регуляции сахара в крови, липидного и водного обмена, половых функций и т.д. Все вегетативные функции координирует кора головного мозга.
Периферические вегетативные нервы прерываются на своем пути в вегетативных ганглиях, при этом преганглионарные волокна, берущие начало в центральной нервной системе (ЦНС), оканчиваются в одном из вегетативных ганглиев. Периферические вегетативные нервы делят на симпатические и парасимпатические. Симпатическая (адренергическая) и парасимпатическая (холинергическая) системы функционально дополняют друг друга. Для поддержания нормальной вегетативной функции организма абсолютно необходимо наличие обеих систем, при этом холинергическая система поддерживает процессы ассимиляции – накопления энергии, тогда как адренергическая система поддерживает процессы диссимиляции – освобождения энергии. Если организм находится в состоянии покоя и восстановления, преобладает холинергический тонус, если же организм работает, то преобладает тонус адренергический. Эфферентные волокна СНС развиваются в эмбриогенезе из нейрональных структур продолговатого мозга, так называемых вазомоторных центров (рис.1).
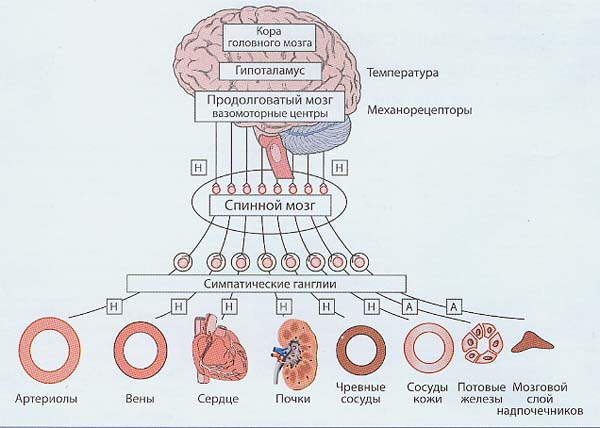
Рис. 1. Структура симпатической нервной системы (Wenzel R.R. et al., 2000): А- ацетилхолин (медиатор всех преганглионарных, а также постганглионарных волокон, иннервирующих потовые железы и мозговое вещество надпочечников); Н – норадреналин (медиатор постганглионарных волокон, за исключением иннервирующих потовые железы и мозговое вещество надпочечников)
Сигналы от ЦНС поступают к рабочим (эффекторным) органам через два последовательно расположенных нейрона, которые соединяются в ганглиях (узлах) на уровне спинного мозга. Миелинизированные аксоны преганглионарных нейронов СНС, расположенных в боковых рогах шейных и грудных сегментов спинного мозга, соединяются с постганглионарными нейронами в паравертебральных симпатических и превертебральных ганглиях. Медиатором преганглионарных нейронов является ацетилхолин, активизирующий никотиновые рецепторы (Н-холинорецепторы), а медиатором постганглионарных нейронов СНС, которые соединяются с рецепторами на эффекторных органах, является норадреналин.
Катехоламины – адреналин, норадреналин и допамин синтезируются и поступают в кровоток из мозгового слоя надпочечников. Симпатическая активация сопровождается вазоконстрикцией периферических сосудов вследствие активации α1- адренорецепторов на гладкомышечных клетках, тогда как эффекты СНС на сердце опосредованы ß1-адренорецепторами. Соотношение ß1/ß2-адренорецепторов в миокарде левого желудочка состовляет у здоровых лиц 80/20, в то время как у больных с выраженной ХСН – 60/40. α2 – Адренорецепторы играют второстепенную роль в симпатической регуляции сердечно-сосудистой системы. Вместе с тем, α2-адренорецепторы в сосудистом эндотелии моделируют адренергическую вазоконстрикцию (2).
СНС взаимодействует с ренин-ангиотензин-альдостероновой системой (РААС) и эндотелием сосудов. Ангиотензин II (АII) влияет на высвобождение и обратный захват норадреналина посредством связывания с пресинаптическими рецепторами постганглионарных волокон (3), а также стимулирует СНС, воздействуя на центральные механизмы регуляции (4). В тоже время стимуляция ß1-адренорецепторов юкстагломерулярного аппарата клубочков почек приводит к увеличению синтеза ренина и активации РААС, в результате чего повышается АД, а также происходит задержка натрия и воды в организме (5).
Как известно тромбоциты имеют ß1 – адренорецепторы, стимуляция которых может приводить к их агрегации и образованию тромба. Повышенная активность СНС участвует также в развитии и прогрессировании атеросклеротического процесса (6). В эксперименте показано, что адреналин и норадреналин вызывают атеросклероз даже при отсутствии повышения уровня АД и общего холестерина (7). Гиперактивность СНС играет ключевую роль в развитии метаболического синдрома, который характеризуется сочетанием высокого АД и нарушением метаболизма глюкозы и липидов (8,9).
Активация СНС и повышение частоты сердечных сокращений, как предикторы ССЗ и смертности
Главные эффекторы СНС – катехоламины играют существенную роль в развитии ССЗ и их осложнений. Гиперактивность СНС, сопровождающаяся увеличением частоты сердечных сокращений (ЧСС) и повышением уровня норадреналина в плазме крови, является важным фактором риска развития ССЗ, а также предиктором сердечно-сосудистой и общей смертности (10-12). С возрастом активность СНС увеличивается и это происходит независимо от наличия заболевания (13). Повышенная активность СНС играет существенную роль не только в возникновении ишемии миокарда вследствие рефлекторной тахикардии и коронарной вазоконстрикции, но и в развитии АГ, резистентности к инсулину, возрастании коронарного риска (14,15).
Исследования второй половины ХХ века выдвинули концепцию так называемых «факторов риска» и показали их прогностическое значение для таких казалось бы различных заболеваний, как ИБС, АГ, ХСН, цереброваскулярные болезни. Убедительно доказана связь этих заболеваний с дислипидемией, курением, ожирением центрального типа, сахарным диабетом. Однако в этом общепринятом перечне факторов риска отсутствует такой показатель, как ЧСС, который принимается во внимание только при развитии ХСН, тиреотоксикозе, шоке, врожденных и приобретенных пороках сердца, тахиаритмиях и др. Следовательно, о ЧСС вспоминают при наличии сердечно-сосудистой патологии, тогда как этот показатель никак не оценивается у здоровых лиц и у лиц, не предъявляющих каких-либо жалоб со стороны сердечно-сосудистой системы.
Хорошо известно, что мелкие животные имеют высокую ЧСС в покое и небольшую продолжительность жизни, а крупные животные, наоборот, обладают большей продолжительностью жизни при меньшей ЧСС. Высказывается мнение, что тотальное число сердечных сокращений составляет около 3 млрд, несмотря на различие в продолжительности жизни разных животных (16).Эти наблюдения в приложении к клинической практике позволяют предположить, что невысокая ЧСС в покое ассоциируется с увеличением продолжительности жизни, тогда как высокая ЧСС может сочетаться со снижением общей выживаемости лиц с уже имеющимися ССЗ.
Истинные патофизиологические механизмы влияния невысокой ЧСС на заболеваемость и продолжительность жизни не известны. Установлено, что ЧСС оказывает прямое влияние на скорость метаболических процессов и тесно связана с физической активностью (17). Выявлена зависимость между ЧСС и скоростью метаболизма, а также массой тела (18). Если ЧСС является ключевой детерминантой скорости метаболизма, то вполне логичным может выглядеть предположение о взаимосвязи ЧСС и ожидаемой продолжительности жизни среди животных (включая человека).
Клинические данные последних десятилетий продемонстрировали наличие существенной связи между ЧСС и смертностью у пациентов с ИБС и АГ, позволяющую предположить аналогичную тенденцию в популяции в целом (19). Прогностическое значение ЧСС было показано в крупных эпидемиологических исследованиях, в частности, в Фрамингемском и исследовании Goteborg, которые подтвердили взаимосвязь между риском внезапной смерти и стойким повышением ЧСС (20,21).
При изучении влияния уровня ЧСС в покое на общую и сердечно-сосудистую смертность при хронической ИБС в течение 15 лет наблюдения установлено, что пациенты с более высокой ЧСС имели достоверно больший уровень общей и сердечно-сосудистой смертности в сравнении с пациентами с низкой ЧСС. Показано, что уровень ЧСС в покое больше 80-85 в1мин не является нормальным (22). Выявлена тесная корреляционная связь между высокой ЧСС в покое и риском внезапной смерти не только у пациентов с ССЗ, но и у предположительно здоровых людей (23). В Парижском проспективном исследовании 5713 мужчин без признаков заболевания в возрасте 42-53 лет показано, что риск сердечной смертности при более высокой ЧСС был в 3,5 раза выше, чем при более низкой ЧСС (24).
Стратификация риска является крайне важной для оценки прогноза у пациентов с умеренным и высоким риском развития ССЗ, в связи с чем постоянно предпринимаются попытки интегрировать различные показатели в удобную для практического использования модель. Недавно Европейское сообщество кардиологов разработало шкалу SCORE, в которой в качестве факторов риска учитывается возраст, пол, курение, уровень систолического АД и общего холестерина. К сожалению, в шкалу SCORE даже в качестве вероятного фактора риска не был включен такой показатель, как ЧСС в покое (25).
Между тем, достоверно установлена предсказательная ценность ЧСС в отношении ССЗ в общей популяции, у больных, перенесших инфаркт миокарда или страдающих АГ, причем подобная связь не зависит от других факторов риска развития атеросклероза (26-28). Именно поэтому ЧСС, как фактор риска, включена в 2007 году в новые Европейские рекомендации по профилактике ССЗ в клинической практике наряду с такими традиционными факторами риска, как АГ и диабет (29). В настоящее время за целевое значение принимается ЧСС 55-60 в 1 мин и поэтому для улучшения прогноза пациентам с ЧСС, превышающей этот уровень, необходимо проводить пульсурежающую терапию. ЧСС является ключевым фактором, определяющим потребление миокардом кислорода (снижение ЧСС благоприятно повышает ишемический порог), а также время диастолического наполнения, что приводит к увеличению коронарного кровотока. ЧСС может быть важным фактором в патогенезе коронарного атеросклероза – в эксперименте подтверждено прямое противоатерогенное действие снижения ЧСС (30).
Высокая ЧСС в покое отражает повышенную активность СНС или сниженную вагусную активность, или оба эти нарушения. В эксперименте показано, что эти изменения вызывают снижение порога фибрилляции желудочков и могут приводить к повышению ССЗ и смертности (31). Более высокая ЧСС может указывать на плохое физическое развитие и плохое общее состояние здоровья. При низком уровне физического развития отмечается более высокая коронарная и сердечно-сосудистая смертность. ЧСС в покое, как правило, выше у людей со слабым физическим развитием и с плохим общим состоянием здоровья.
Все нейрогормональные системы, включая СНС, обладают двояким эффектом: защитным – функциональным, компенсаторным, адаптационным и разрушающим – пролиферативным, дезадаптационным, приводящим к срыву компенсации. Роль активации СНС при естественном течении ССЗ можно охарактеризовать как «хорошую» (компенсация), «плохую» (декомпенсация) и «фатальную» (смерть). «Хорошие» функциональные свойства позволяют поддерживать состояние компенсации, «плохие» - пролиферативные, наоборот, ведут к декомпенсации, а «фатальные» проявляются развитием фиброза, декомпенсации, желудочковых аритмий и летальным исходом.
Выявление факторов риска развития ССЗ и ХСН, современное понимание их патогенеза и естественного течения, использование более информативных методов оценки патоморфологических и патофизиологических нарушений сердца привели к формированию и введению понятия сердечно-сосудистого континуума (рис.2).
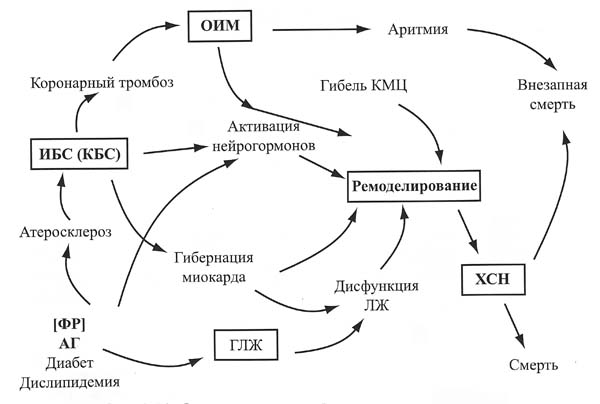
Рисунок 2. Схема сердечно-сосудистого континуума.
Сердечно-сосудистый континуум – единый механизм дерегуляции, включающий все патофизиологические процессы, приводящие от факторов риска к болезни, ремоделированию, дилатации левого желудочка, формированию ХСН и смерти. Суть феномена заключается в том, что такие факторы риска как АГ, сахарный диабет, дислипидемия, через гипертрофию и дилатацию левого желудочка, либо через развитие атеросклероза, ИБС, острого инфаркта миокарда приводят к гибели и гибернации кардиомиоцитов, активации тканевых и циркулирующих нейрогормонов и в результате к ремоделированию сердца и формированию ХСН (32). В свою очередь, ХСН приводит или к смерти от нарастающей декомпенсации, или через жизненно опасные тахи- и брадиаритмии к внезапной смерти таких тяжело больных. Важной особенностью сердечно-сосудистого континуума является то, что с определенного этапа поражения сердца прогрессирование ХСН происходит по общим закономерностям, практически не зависящим от этиологии заболевания.
В прогрессировании дисфункции и ремоделировании миокарда при ССЗ и ХСН значительная роль принадлежит повышению активности таких нейрогормональных систем, как СНС и РААС (рис.3).
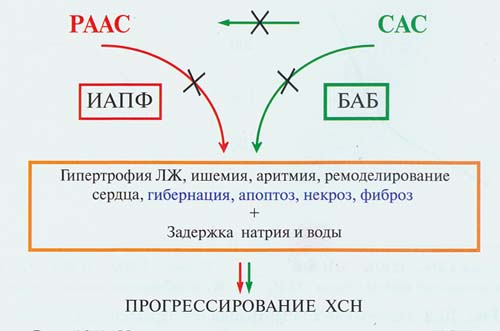
Рисунок 3. Нейрогормональная модель патогенеза ХСН, как исхода различных ССЗ (крестиками показаны возможные места блокады).
Так, постоянная активность СНС может привести к развитию гипертрофии левого желудочка, ишемии миокарда, тахи – и брадиаритмий, гибели кардиомиоцитов вследствие некроза и апоптоза, «засыпанию» или гибернации оставшихся в живых кардиомиоцитов, возникновению участков фиброза, а также вызвать нарушения метаболизма липидов и глюкозы. Кроме того, главный эффектор СНС- норадреналин способствует повышению активности
РААС. Учитывая то, что постоянная активация СНС и повышенная ЧСС являются предикторами ССЗ, общей и сердечно-сосудистой смертности, снижение этих патоморфологических и патофизиологических воздействий с помощью таких нейрогормональных модуляторов, как бета-адреноблокаторы (ББ), может иметь благоприятное прогностическое значение.
Клиническая фармакология бета – адреноблокаторов
ББ – неоднородная по своим фармакологическим эффектам группа лекарственных препаратов, единственным общим свойством которых является конкурентный антагонизм в отношении ß1- адренергических рецепторов.
Существует два класса - ß-адренорецепторов. Стимуляция ß1-рецепторов, расположенных в сердце, приводит к увеличению ЧСС, сократимости и улучшению АВ – проводимости. Блокада ß1-рецепторов уменьшает эти эффекты как при нагрузке или стрессе, так и в покое при повышении тонуса СНС. ß2-рецепторы распространены более широко, чем ß1- рецепторы. Активация этих рецепторов приводит к таким разнообразным эффектам, как бронходилатация, периферическая вазодилатация и липолиз. Многие побочные реакции ББ, в частности бронхоспазм, обусловлены блокадой ß2 – рецепторов. Различают ББ кардиоселективные (КС), вызывающие блокаду ß1 - адренорецепторов, и неселективные, блокирующие ß1 – и ß2 - адренорецепторы. ББ характеризуются также наличием или отсутствием внутренней симпатомиметической активности (ВСА), мембраностабилизирующей активности (МСА), вазодилатирующих свойств (ВДС), липофильности (табл.1).
Селективные β1-дреноблокаторы в той или иной степени блокируют β1 -адренорецепторы миокарда и мало влияют на β2 – адренорецепторы в бронхах и сосудах. Однако в более высоких дозах кардиоселективные ББ блокируют также и β2 – адренорецепторы и способны спровоцировать бронхоспазм. Поэтому при бронхиальной астме применение ББ не рекомендуется. Коррекция тахикардии у пациентов с бронхиальной астмой, получающих β– адреномиметики, является одной из актуальных проблем, особенно при сопутствующей ИБС. Селективность к β1 -адренорецептораму метопролола сукцината CR/ХL выше, чем у атенолола, в результате чего он достоверно меньше влияет на объем форсированного выдоха у больных бронхиальной астмой и при применении форматерола обеспечивает более полное восстановление бронхиальной проходимости. Селективность по отношению к β1 – адренорецепторам приобретает важное клиническое значение не только при бронхообструктивных заболеваниях легких, но и при использовании ББ у больных АГ с сопутствующими заболеваниями периферических сосудов (болезнь Рейно, перемежающаяся хромота). При использовании селективных β1 – адреноблокаторов β2 – адренорецепторы, оставаясь активными, реагируют на эндогенные катехоламины и экзогенные адреномиметики, что сопровождается вазодилатацией.
Таблица 1. Основные фармакологические свойства бета-адреноблокаторов
|
Препараты
|
КС
|
ВСА
|
МСА
|
ВДС
|
Липофильность
|
Дозы, мг/сут (кратность приема)
|
Выведение: печень/почки
|
|
Атенолол
Ацебутолол
Бетаксолол
Бисопролол
Карведилол
|
+2
+1
+2
+3
+1
|
0
+1
0
0
0
|
0
+1
+1
0
+2
|
0
0
0
0
+1
|
-1
+2
+3
+2
+3
|
25-100 (1-2)
200-800 (1-2)
10-20 (1)
2,5-10 (1)
25-50 (2)
|
10/90
60/40
85/15
50/50
100/0
|
|
Лабетолол
Метопролол*
Надолол
Небиволол
|
0
+2
0
+3
|
+1
0
0
0
|
0
0
0
|
+2
0
0
+1
|
+3
+3
-1
+2
|
200-800 (2-3)
50-200 (2-3)
40-160 (1)
2,5-10 (1)
|
100/0
100/0
0/100
60/40
|
|
Окспренолол
Пиндолол
Пропранолол*
Соталол
Тимолол
Целипролол
|
0
0
0
0
0
+1
|
+2
+2
0
0
0
+2
|
+1
+2
0
0
|
0
+1
0
0
0
+1
|
+3
+2
+3
-1
+3
+1
|
60-200 (2-3)
10-40 (2-3)
40-240 (2-3)
80-160 (1-2)
20-60 (2)
200-400 (1-2)
|
100/0
60/40
100/0
10/90
80/20
40/60
|
Примечание. * - существуют ретардные формы метопролола (беталок ZOK) и пропранолола (индерал LA), эффективные при приеме 1 раз в день.
Общепринятой классификации ББ не существует. Наиболее часто используется разделение ББ на группы в зависимости от наличия или отсутствия вазодилатирующих свойств и β1-адреноселективности.
ББ без вазодилатирующих свойств: неселективные (пропранолол, надолол, окспреналол, соталол, тимолол и др.); β1-селективные (атенолол, бетаксолол, бисопролол, метопролол идр.).
ББ с вазодилатирующими свойствами: неселективные (лабетолол, пиндолол, и др.); β1-селективные (каведилол, небиволол, целипролол и др.).
Можно выделить четыре основных механизма вазодилатации: выраженная ВСА в отношении β2-адренорецепторов сосудов, в частности, у пиндолола и целипролола; блокада α1 – и (или) α2 – адренорецепторов, как у карведилола и лабетолола; высвобождение из эндотелиальных клеток оксида азота, обладающего вазодилатирующими свойствами, как у небиволола; прямое сосудорасширяющее действие. У многих больных ССЗ общее периферическое сосудистое сопротивление (ОПСС) повышено и поэтому при прочих равных условиях для их длительной терапии более предпочтительным является назначение ББ с вазодилатирующими свойствами.
Некоторые ББ оказывают слабый агонистический эффект на бета-адренорецепторы, т.е. им свойственна внутренняя симпатомиметическая активность. Показано, что препараты с ВСА – окспреналол, пиндолол, практолол мало влияли на ЧСС и летальность у пациентов, перенесших острый инфаркт миокарда, в отличие от метопролола, пропранолола, атенолола и тимолола. Установлено, что буциндолол, обладающий свойствами частичного агониста, не изменял ЧСС и не оказывал существенного влияния на летальность при ХСН в отличие от метопролола, карведилола и бисопролола. Препараты с ВСА стимулируют бета-адренорецепторы артериол и т.о. препятствуют росту ОПСС, оказывают меньшее атерогенное воздействие, реже вызывают синдром отмены.
Мембраностабилизирующая активность ББ обусловлена блокадой натриевых каналов и свойственна лишь пропранололу и некоторым другим препаратам. Она не имеет клинического значения при назначении терапевтических доз этих препаратов и проявляется возникновением аритмий при интоксикации вследствие их передозировки.
В зависимости от растворимости в жирах и воде ББ разделяются на липофильные, гидрофильные и амфофильные.
До недавнего времени считалось, что от липофильных свойств ББ зависят лишь их фармакокинетические особенности. Так, липофильные ББ – метопролол, бетаксолол, пропранолол и др. быстро и почти полностью (более 90%) всасываются в желудочно-кишечном тракте (ЖКТ) и метаболизируются в печени (до 80-100%), что следует учитывать при их назначении пациентам с нарушенной функцией печени. Например, разовые дозы или кратность приема липофильных ББ необходимо уменьшить у пожилых больных, при циррозе печени или ХСН.
Гидрофильные ББ – атенолол, надолол, соталол и др. не полностью (30-70%) и неравномерно всасываются в ЖКТ, при этом они в незначительной степени (0-20%) метаболизируются в печени. Гидрофильные ББ экскретируются почками с мочой в неизменном виде (40-70%), либо в виде метаболитов. Поэтому при назначении гидрофильных ББ необходимо учитывать функцию почек. У пациентов с низкой скоростью клубочковой фильтрации (СКФ) – менее 30-50 мл/мин суточную дозу гидрофильных ББ следует уменьшить. С другой стороны, фармакокинетика гидрофильных ББ, в отличие от липофильных, не изменяется у злостных курильщиков и при совместном применении с барбитуратами, фенитоином, рифампицином. Эти препараты хуже проникают через гематоэцефалический барьер и поэтому они реже вызывают такие побочные эффекты со стороны ЦНС, как общая слабость, сонливость, бессонница, кошмарные сновидения, депрессия и т.п.
Жиро-водорастворимые (амфофильные) ББ, в частности бисопролол, имеют два пути выведения из организма. От 40 до 60% всосавшейся в ЖКТ дозы амфофильного препарата метаболизируется в печени, а остальная часть выводится почками в неизмененном виде. Сбалансированный клиренс бисопролола, целипролола, ацебутолола обуславливает большую их безопасность при лечении больных ССЗ с сопутствующими нарушениями функций печени и почек.
По-видимому лишь липофильные ББ обладают кардиопротективным действием. Установлено, что длительное применение липофильных ББ – бисопролола, метопролола, пропранолола, тимолола, а также карведилола и ацебутолола снижало смертность у больных, перенесших инфаркт миокарда, на 20-50%. С другой стороны, такие гидрофильные ББ, как атенолол и соталол, не оказывали существенного влияния на смертность больных, перенесших инфаркт миокарда.
Применение неселективных ББ в течение от 6 мес до 2 лет сопровождается повышением триглицеридов в диапазоне от 5 до 25% и снижением холестерин фракции липопротеинов высокой плотности (ЛПВП) в среднем на 13%. Влияние неселективных ББ на липидный профиль связывают с ингибированием липопротеинлипазы, так как β - адренорецепторы, снижающие активность липопротеинлипазы, оказываются без контррегуляции со стороны β2 – адренорецепторов, являющихся анатагонистами в отношении этой ферментной системы. Повышение триглицеридов и снижение ЛПВП не характерно для высокоселективных ББ, при этом имеются данные, что метопролол замедляет процесс атерогенеза.
Влияние ББ на обмен углеводов опосредуется через β2 – адренорецепторы, так как они регулируют секрецию инсулина и глюкагона в мускулатуре и синтез глюкозы в печени. Применение неселективных ББ при сахарном диабете 2 типа сопровождается гипергликемией, в то время как при переходе на кардиоселективные препараты эта реакция устраняется полностью. Установлено, что метопролол и бисопролол по влиянию на углеводный обмен при сахарном диабете 2 типа не отличается от плацебо. Тем не менее чувствительность к инсулину снижается при использовании всех ББ, причем под влиянием неселективных препаратов более существенно.
Основные побочные эффекты ББ: бронхоспазм, чувство усталости, депрессия, повышенная утомляемость, нарушение сна и неприятные сноведения, брадикардия и АВ-блокады, ухудшение липидного профиля. Приведенные нежелательные явления чаще наблюдаются при использовании неселективных ББ.
Противопоказания к назначению ББ: абсолютные – гипотензия с систолическим АД меньше 90 мм рт.ст., бронхиальная астма, хронические обструктивные болезни легких, АВ – блокада II – III степени; относительные – брадиаритмии, застойная СН, феномен Рейно.
Бета-блокаторы в лечении ССЗ
При назначении ББ с целью лечения ССЗ, селективная блокада β1 – адренорецепторов защищает сердце от гиперсимпатикотонии, что приводит к замедлению сердечного ритма, отрицательному инотропному эффекту и, как следствие этого, к снижению потребности миокарда в кислороде.
В РКИ 80-х годов прошлого века была доказана высокая эффективность ББ в лечении АГ и ИБС. В более поздних исследованиях установлено, что применение ББ вызывает значительное снижение смертности при ХСН. Это не только расширило показания для использования ББ при ССЗ, но и изменило взгляды на патогенез ХСН вообще. Последние исследования ХХI века открывают новые перспективы для использования ББ, в частности, их антиатеросклеротические эффекты представляют новую информацию о ключевом процессе сердечно – сосудистого континуума – атерогенезе.
В настоящее время в распоряжении врачей имеется широкий выбор препаратов этого класса, эффективность которых в лечении ССЗ имеет самый высокий уровень доказанности.
Острый инфаркт миокарда
Многочисленные РКИ (MIAMI, ISIS – 1, CAPRICORN, TIMI – II и др), а также метаанализы, включающие результаты клинических испытаний с десятками тысяч пациентов, показали, что применение ББ, начиная с первых суток заболевания, когда уровень катехоламинов в крови резко повышен, уменьшает риск возникновения аритмий, постинфарктной стенокардии, рецидивирующего инфаркта миокарда, разрыва миокарда и, как следствие этого, снижает летальность на 13% в первую неделю и на 25% в первые 2 дня за счет снижения частоты развития фибрилляции желудочков и тампонады сердца. Если же продолжить прием ББ после перенесенного инфаркта миокарда, то риск смерти в течение 2-х лет снижается на 40%.
Проведение сочетанной терапии тромболитиками и ББ в первые 3 часа от начала инфаркта миокарда уменьшало массу потенциального некроза более чем в 2 раза, снижало частоту крупноочагового инфаркта миокарда с 49 до 29% и застойной СН с 42 до 22%. Совместное назначение тканевого активатора плазминогена и метопролола (15 мг в/в) снижало частоту рецидивов нефатального инфаркта миокарда в 2 раза и нестабильной постинфарктной стенокардии на – 30% (GISSI II и GUSTO).
В современных клинических рекомендациях предполагают, что ББ оказывают благоприятное действие независимо от того, использовался ли тромболизис, аспирин и ингибиторы АПФ.
ББ без ВСА – метопролол, бисопролол, карведилол, пропранолол, атенолол оказались наиболее эффективны при сочетании инфаркта миокарда с АГ, частой экстрасистолией, ранней постинфарктной стенокардией и мелкоочаговом инфаркте миокарда. Рекомендовано в/в болюсное введение пропраналола 2-3 мг за минуту, затем по 1мг каждые 2 минуты до суммарной дозы 0,1 мг/кг с последующей поддерживающей суточной дозой 80-240 мг в 3-4 приема перорально; в/в введение метопролола (три болюса по 5 мг с интервалом в 5 мин), затем 50-200 мг/сут в 2 приема перорально; в/в атенолол (два болюса по 5 мг с интервалом в 5 мин), затем 50-100 мг/сут в 1-2 приема перорально. Бисопролол и карведилол назначаются перорально соответственно по 2,5 – 10 мг/сут в 1 прием и 6,25 – 25 мг/сут в 2 приема.
Положительное влияние на прогноз жизни больных, перенесших инфаркт миокарда, доказано при использовании пропранолола, метопролола, тимолола, ацебутолола и карведилола. Поэтому только эти ББ (тимолол и ацебутолол не зарегистрированы) рекомендуют назначать больным, перенесшим инфаркт миокарда. Напротив, при использовании альпренолола, атенолола, окспренолола и ксамотерола положительных результатов получить не удалось. Другие ББ в качестве препаратов, снижающих риск осложнений инфаркта миокарда, не применялись.
Основные противопоказания к назначению ББ – синусовая брадикардия, артериальная гипотензия с систолическим АД менее 100 мм рт.ст., нарушения АВ – проводимости, острая левожелудочковая недостаточность, бронхоспазм.
В соответствии с рекомендациями Европейского общества кардиологов и Американской ассоциации сердца в/в ведение ББ показано пациентам с тахикардией, гипертензией, рецидивирующим болевым синдромом, а пероральный прием рекомендован всем больным с наличием факторов риска с первых часов инфаркта миокарда и в дальнейшем длительно после перенесенного инфаркта миокарда (33).
Стабильная стенокардия напряжения
Практически все используемые в настоящее время ББ обладают отчетливым антиангинальным эффектом, однако их способность улучшать прогноз заболевания доказана лишь у больных, перенесших инфаркт миокарда. У больных с неосложненной ИБС способность ББ влиять на исходы заболевания доказана лишь в небольших РКИ. Поскольку ББ обладают отчетливым антиангинальным действием, их назначение становится необходимым всем больным с ИБС, не имеющим противопоказаний. На эффект ББ можно рассчитывать лишь в том случае, если при назначении достигается эффективная блокада бета-адренорецепторов. Для этого необходимо поддерживать ЧСС в покое в пределах 55-60 ударов в минуту. В рекомендациях по лечению хронической ИБС особо отмечается, что у больных с более выраженной стенокардией можно снижать ЧСС менее 50 в минуту при условии, что такая брадикардия не вызывает неприятных ощущений и не развивается блокада (34).
Артериальная гипертензия
ББ изначально создавались как антиангинальные препараты, однако после опубликования в 1964 году первого сообщения о применении пропранолола у пациентов с повышенным АД стало очевидным, что они эффективны при лечении не только стенокардии напряжения, но и АГ.
В ряде широкомасштабных РКИ (SHEP Cooperative Research Group, MRC Working Party, IPPPSH, HAPPHY, MARHY, STOP Hypertension) было показано, что применение ББ в качестве антигипертензивных препаратов (АГП) сопровождается снижением частоты сердечно-сосудистой летальности как у молодых, так и у пациентов старших возрастных групп. В международных экспертных рекомендациях ББ, наряду с диуретиками, отнесены к препаратам первой линии для лечения АГ (35).
В проведенных за последние годы мета – анализах, обобщающих данные РКИ по изучению эффективности различных АГП в лечении АГ, роль ББ получила разную оценку. По данным 29 РКИ (162341 больной), в которых сравнивалась эффективность различных АГП как с плацебо, так и между собой, было показано, что главным условием уменьшения риска сердечно-сосудистых осложнений является снижение уровня АД, а не выбор препарата. ББ ничем не отличались от других групп АГП как по влиянию на общую смертность, так и по риску развития сердечно-сосудистых осложнений, в том числе и мозгового инсульта (36). Однако в этом мета-анализе не проводилась оценка влияния препаратов на развитие новых случаев сахарного диабета. В результате анализа 13 РКИ (105951 больной) установлено, что ББ не отличаются от других АГП по влиянию на общую смертность и вероятность возникновения инфаркта миокарда, но уступают другим АГП во влиянии на риск мозгового инсульта, хотя существенно превосходят при этом плацебо (37). Анализ 22 РКИ у 143153 больных АГ без признаков сахарного диабета при включении в исследование показал, что ББ существенно уступают другим АГП и плацебо во влиянии на вероятность возникновения новых случаев сахарного диабета, однако превосходят при этом диуретики (38). При анализе 12 РКП у 112177 больных с АГ было показано, что ББ не уступают другим группам АГП, но и не превосходят их в способности предупреждать развитие СН (39). Еще раз был подтвержден известный вывод о том, что основным в лечении АГ является снижение АД как такового.
Несмотря на кажущуюся противоположность заключений различных мета-анализов, выводы из них представляются достаточно однозначными. Убедительно показано, что ББ так же положительно, как и другие АГП, влияют на показатели общей и сердечно-сосудистой смертности, а также не уступают другим АГП по влиянию на вероятность развития ИБС и таких ее осложнений, как инфаркт миокарда и ХСН. Вместе с тем, вполне очевидно, что ББ уступают другим АГП в способности предупреждать развитие новых случаев сахарного диабета. Менее ясен вопрос о роли ББ в предупреждении мозгового инсульта, особенно у пожилых больных.
В рекомендациях 2007 года по лечению АГ Европейского общества по артериальной гипертензии и Европейского общества кардиологов отмечается, что главным принципом терапии должно быть достижение так называемого целевого уровня АД и что все современные группы АГП при соблюдении этого условия одинаково влияют на исходы АГ (40).
В основе выбора конкретной группы АГП положены дополнительные показания и противопоказания к их назначению. Такими дополнительными показаниями к использованию ББ являются наличие ИБС, проявляющейся в виде стенокардии напряжения или перенесенного инфаркта миокарда, ХСН, различных тахиаритмий. В тоже время не рекомендуется использовать ББ в качестве препаратов первой линии у пациентов, склонных к развитию сахарного диабета, в частности, с наличием метаболического синдрома или значительно выраженных его компонентов. Следует отметить, что ни в одних рекомендациях ББ не считаются противопоказанными при наличии сахарного диабета, поскольку имеется ряд крупных РКИ, в которых препараты этой группы зарекомендовали себя с самой лучшей стороны при назначении таким больным (41,42).
Выбор конкретного препарата из класса ББ остается исключительно в ведении практического врача. В самом общем виде рекомендации отмечают лишь, что избранный препарат должен быть удобен для применения и поддерживать эффект в течение 24 часов, чтобы его можно было принимать 1 раз в день. Это такие препараты, как бисопролол, небиволол, бетаксолол. В Геттеборгском и Норвежском исследованиях, исследованиях MARHY, MRC, IPPPSH, BHAT с уровнем доказательности А показана эффективность метопролола в первичной профилактике сердечно-сосудистых осложнений при АГ, а также его антиаритмическое действие со снижением частоты внезапной смерти при сочетании АГ с ИБС. Новая лекарственная форма липофильного β1- адреноблокатора метопролола сукцината (CR/XL) обеспечивает стабильный гипотензивный эффект при однократном приеме в сутки.
Рекомендации отмечают также важность того, чтобы препарат обладал хорошей переносимостью. Из ББ наилучшей переносимостью обладают препараты с высокой селективностью действия в отношении β1 – адренорецепторов – бисопролол, небиволол, бетаксолол. В отношении возможного отрицательного влияния ББ и риска развития сахарного диабета в рекомендациях сделана оговорка, что это может не иметь отношения к препаратам с дополнительными вазодилатирующими свойствами – карведилолу и небивололу, однако этот вывод пока не подкреплен в РКИ.
В последних рекомендациях по лечению АГ расширен круг больных, которым сразу же должна назначаться комбинированная антигипертензивная терапия. Это пациенты со значительно повышенным АД (систолическим – более чем на 20 мм рт.ст. и диастолическим – более чем на 10 мм рт.ст.), а так же с незначительно повышенным АД, но имеющие высокий риск сердечно-сосудистых осложнений с множественными факторами риска, субклиническое поражение органов, ассоциированные клинические состояния, сахарный диабет, нарушение функции почек. Для ББ наиболее оптимальными являются их комбинации с дигидропиридиновыми антагонистами кальция. Комбинация ББ с тиазидными диуретиками успешно использовалась в ряде крупных РКИ, но она нежелательна для больных с повышенным риском развития сахарного диабета, в частности, при наличии метаболического синдрома.
Хроническая сердечная недостаточность
Развитие сердечной недостаточности сопровождается ранней гиперкатехоламинемией с прогрессивным увеличением норадренолина в крови. Доказана прямая связь риска смерти больных с ХСН в зависимости от концентрации норадреналина в плазме крови, повышенное содержание которого вызывает: увеличение пейсмекерной активности клеток миокарда, сопровождающееся неадекватным ростом ЧСС и возможным проаритмическим действием; гибель кардиомиоцитов вследсвие перезагрузки их кальцием; рост гипертрофии миокарда; увеличение оксидативного стресса, стимулирующего неадекватное усиление апоптоза; ухудшение гемодинамики с нарушением систолической и диастолической функции левого желудочка; снижение плотности и афинности бета-адренорецепторов; стимуляцию вазоконстрикторных, антидиуретических и вызывающих избыточную пролиферацию клеток нейрогормональных систем – РААС, эндотелин, вазопрессин и др. (43).
На протяжении более 20 лет единственным препятствием для включения ББ в число обязательных средств в лечении ХСН был их отрицательный инотропный эффект. Действительно, в ранней фазе ББ оказывают отрицательное инотропное действие и снижают сократимость миокарда и СВ. Опасения вызывают только первые 2-4 недели лечения ББ, когда может наблюдаться значительное снижение СВ. Однако это происходит в большей степени из-за уменьшения ЧСС, а не сократимости миокарда. Через 3 месяца терапии ФВ достоверено увеличивается по сравнению с исходным уровнем и в дальнейшем СВ неуклонно растет.
В исследованиях CIBIS II и MERIT – HF с кардиоселективными ББ бисопрололом и метопрололом сукцинатом замедленного высвобождения, а также в исследовании COPERNICUS с неселективным блокатором β– рецепторов и α1 – рецепторов карведилолом было показано, что назначение каждого из этих препаратов больным с ХСН приводило к снижению риска смерти на 34-35%. Кроме того, монотерапия с использованием этих препаратов достоверно уменьшала риск внезапной смерти от прогрессирующей ХСН и частоту госпитализаций. После завершения этих исследований стало очевидным, что метопролол сукцинат, бисопролол и карведилол являются одними из основных препаратов в лечении ХСН I – IV ФК, которые, при отсутствии противопоказаний, должны назначаться таким больным (44-46).
Бисопролол блокирует β1 – рецепторы в 19,6 раз сильнее, чем β2 – рецепторы, в связи с чем он вызывает меньше осложнений со стороны бронхов и может использоваться в лечении болезней органов кровообращения и дыхания. Благодаря высокой селективности бисопролол практически не ухудшает чувствительности периферических тканей к инсулину и может применяться у больных с сахарным диабетом, метаболическим синдромом и нарушенной толерантностью к глюкозе, а также у курящих пациентов и больных с сопутствующим облитерирующим атеросклерозом сосудов нижних конечностей.
Положительное влияние метопролола сукцината, бисопролола, карведилола на смертность больных с ХСН оказалось столь очевидным, что при отсутствии противопоказаний их назначение больным ХСН I - IV ФК, связанной с ишемической и неишемической кардиомиопатией, считается обязательным. Менее убедительные данные получены в отношении кардиоселективного ББ небиволола, не показавшего существенного снижения риска смерти, но продемонстрировавшего достоверное снижение суммы госпитализаций и смертей на 14% у больных с ХСН старше 70 лет (исследование SENIORS). Поэтому применение нибиволола пока является обоснованным у пациентов с ХСН старше 70 лет.
Другие ББ, включая атенолол, не показали способности улучшать прогноз больных ХСН. Назначение ББ при ХСН осуществляется обычно дополнительно к ИАПФ и мочегонным. Терапия ББ начинается с минимальной дозы с последующим ее увеличением не чаще 1 раза в 1-2 недели и доведением до целевых доз (табл.2).
Таблица 2. Схема титрации доз ББ у пациентов с ХСН.
|
Препараты
|
Недели лечения и дозы препаратов, мг
|
Целевая доза
|
|
1-я
|
3-я
|
5-7-я
|
9-11-я
|
11-15-я
|
|
Бисопролол
|
1,25
|
2,5
|
5
|
7,5
|
10
|
10
|
|
Карведилол
|
3,125
|
6,25
|
12,5
|
25
|
25
|
25
|
|
Метопролол
|
6,25
|
12,5
|
25
|
50
|
50
|
50-75
|
|
Небиволол
|
1,25
|
2,5
|
5
|
7,5
|
10
|
10
|
Примечание. Приведенная доза бисопролола и небиволола назначается 1 раз в день, а доза карведилола и метопролола 2 раза в день.
В начале терапии в процессе титрования ББ до целевой дозы могут развиться переходящие нарушения – гипотония, брадикардия, увеличение декомпенсации, что требует их своевременного выявления и коррекции. Рекомендуется придерживаться следующей тактики ведения и лечения больных: контроль за проявлениями ХСН, признаками застоя, уровнем АД, ЧСС; при нарастании симптомов ХСН в первую очередь необходимо увеличить дозу диуретиков и ИАПФ, а при неэффективности этой меры – снизить дозу ББ; при развитии гипотонии следует уменьшить дозу вазодилататоров и только при неэффективности этой меры показано временное уменьшение дозы ББ; при возникновении брадикардии необходимо снизить дозу или прекратить прием препаратов, урежающих ЧСС, а, в случае крайней необходимости временно снизить дозу ББ или отменить их полностью; по достижении стабильного состояния следует возобновить лечение и/или продолжить титрование ББ до целевой дозы. Если при нарастании декомпенсации пациент нуждается в инотропной поддержке, то средством выбора считаются ингибиторы фосфодиэстеразы, так как их гемодинамические эффекты не зависят от блокады бета – адренорецепторов.
В последнее время очень живо обсуждается вопрос о возможности применения ББ до назначения ИАПФ. Многоцентровое исследование CIBIS III показало одинаковую эффективность использования ББ бисопролола и ИАПФ эналаприла в начале лечения больных с ХСН в среднем возрасте 72 года. В дальнейшем все участники получали комбинированную терапию. Через один год после начала исследования в группе больных, получавших первично бисопролол, смертность была на 30% ниже, чем в группе больных, получавших монотерапию эналаприлом, при этом снижение риска смерти составило 12%.
В отношении использования ББ в лечении ХСН уместно привести слова известного российского кардиолога В.А. Алмазова: «… это препараты, применение которых, так же, как и гликозидов, при сердечной недостаточности требует большого врачебного опыта. Хотя мы живем теперь с Вами в эпоху доказательной медицины, лечение больного требует и врачебного мастерства».
Таким образом, ББ остаются одними из основных препаратов для лечения острого инфаркта миокарда и состояния после перенесенного инфаркта миокарда, нестабильной и стабильной стенокардии, АГ, ХСН, тахиаритмий, дилатационной и гипертрофической кардиомиопатии, расслоения аорты и других заболеваний.
Литература
1. Агеев Ф.Т., Даниелян М.О., Мареев В.Ю. и др. // Сердечная недостаточность. — 2004. — №5 (1). – C. 4—7.
2. Wenzel R.R., Bruck H., Sch Kfers R.F. et al. // Kidney Blood Press Res. — 1998. — Vol. 21. — Р. 336—398.
3. Hilgers K.F., Veelken R., Rupprecht G. et al. // Hypertension. — 1993. — Vol. 21. — Р. 322—328.
4. Kannan H., Nakamura T., Jin X.J. et al. // J. Auton Nerv. Syst. — 1991. — Vol. 34. — P. 201–210.
5. Weber F., Blodde O.E., Anlauf M., Bock K.O. // Clin. Exp.Hypertens. — 1983. — Vol. 5. — Р. 225—238.
6. Kaplan J.R., Pettersson K., Manuk S.B., Olsson G. // Circulation. — 1991. — Vol. 84. — P. 123—132.
7.Pauletto P., Scannapieco G., Pessina A.C. // Hypertension. — 1991. —Vol. 17 (Suppl. III). — P. 75—81.
8. Lonnroth P., Smith U. // Biochem. Biophys. Res. Commun. — 1983. — Vol. 112. — Р. 972—979.
9. Bonora E., Kiechl S., Oberhollenzer F. et al. // Diabetologia. — 2000. — Vol. 43. — P. 156—164.
10. Cohn J.N., Levine T.B., Olivari M.T. et al. // N. Engl. J. Med. — 1984. — Vol. 311. — Р. 819—823.
11.Leimbach W.N., Wallin B.G., Victor R.G. et al. // Circulation. — 1986. — Vol. 73. — P. 913—919.
12.Swedberg K., Eneroth P., Kjekshus J., Wilhelmsen L. // Circulation. — 1990. — Vol. 82. – P. 1730—1736.
13.Yamada Y., Miyajima E., Tochikubo O.et al. // Hypertension. — 1989. — Vol. 13. — P. 870—877.
14. Neri Serneri G.G., Boddi M., Arata L. et al. // Circulation. — 1993. — Vol. 87. — P. 1928—1937.
15. Julius S., Gudbrandsson T. // J. Cardiovas. Pharmacol. — 1992. — Vol. 8. — Р. 40—48.
16. Levine H.J. // J. Amer Coll Card. — 1997. — Vol. 30. — P. 1104—1108.
17.Boraso A. // Dialogues in Cardiovascular Medicine. — 2001. — Vol. 6. — P.19—24.
18. Schmidt–Nielsen K. Animal Phisiology: Adaptation and Environment. New York: Cambridge University Press. — 1975. — P. 133.
19. Singh B.N. // J.Cardiovasc. Pharmacol. Therap. — 2001. — Vol. 6. — P. 313—331.
20. Wilhelmsen L., Berlung G., Elmfeldt D. et al. // Eur. Heart J. — 1986. — Vol. 7. — P. 279—288.
21.Goldberg R.J., Larson M., Levy D. // Arch. Intern. Med. — 1996. — Vol. 156. — P. 505—510.
22. Diaz A., Bourassa M., Guertin M.C. et al. // Eur. Heart J. — 2005. — Vol. 26. — P. 867—874.
23.Jouven X., Empana J.P., Schwartz J. et al. // N. Engl. J. Med. — 2005. — Vol. 352. — P. 1951—1958.
24. Jouven X., Empana J.P., Sehwartz P.J. et al. // N. Engl. J. Med. — 2005. — Vol. 352. — P. 1951—1958.
25. Conroy R.M., Pyrorala K., Fitzgerald A.P. et al. // Eur. Heart J. — 2003. — Vol. 11. — P. 987—1003.
26. Menotti A., Mulder I., Nissinen A. et al. // J. Clin. Epidemiol. – 2001. – Vol. 54. – Р. 680–686.
27. Disegni E., Goldbourt U., Reicher – Reiss H. et.al. // J.Clin. Epidemiol. – 1995. – Vol. 48. – Р. 1197–1205.
28. Palatini P., Thijs L., Staessen J.A. et al. // Arch. Intern. Med. — 2002. — Vol. 162. — P. 2313—2321.
29. Evropean guidelines on cardiovascular disease prevention in clinical practice: executive summary Fourth Joint Task Force of the European Society of Cardiovascular Disease Prevention in Clinical Practice // Euro Heart J. On line, 28 August 2007.
30.Beere P., Glagov S., Zarins C. // Science. — 1984. — Vol. 226. — P. 180—182.
31. Siche J.P. // Ann Cardiol. Angeiol. — 1998. — Vol. 47. — P. 404—410.
32. БеленковЮ.Н., МареевВ.Ю., АгеевФ.Т. — М.: ГЭОТАР – Медиа, 2006. – 432 с.
33. ACC/AHA 2007 Focused Update of the 2004 Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction // Circulation. — 2008. —Vol. 117. — P. 296—329.
34. ACC/AHA/ACP-ACIM Guidelines for the management of patients chronic stable angina. A report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines // J. Am. Coll. Cardiol. — 2003. — Vol. 41. — P. 159—168.
35. European Sociery of Hypertension – European Sociery of Cardiology guidelmes for the management of arterial hypertension // J. Hypertension. — 2003. — Vol. 21. — P. 1011—1053.
36. Turnlull F. // Lancet. — 2003. — Vol. 362. — P. 1527—1535.
37. Lindholm L., Carlberg B., Samuelsson O. // Lancet. — 2005. — Vol. 366. — P. 1545—1553.
38. Elliott W., Meuer P. // Lancet. — 2007. — Vol. 369. — P. 201—207.
39. Bandgalore S., Wild D., Parkar S.et al. // J. Am. Coll. Cardiol. — 2008. — Vol. 52. — P. 1062—1072.
40. Mancia G., De Backer G., Dominiczak A. et al. // J. Hypertens. — 2007. — Vol. 25. — P. 1105—1187.
41. Efficaci of atenolol and captopril in reducing risk of macrovascular and microvasculur complications in type 2 diabets. UKPDS 39, UK Prospective Diabetes Study Group // BMJ. — 1998. — Vol. 317. — P. 713—720.
42.Messerli F., Bell D., Fonseca V. et al. // Am. J. Med. — 2007. — Vol. 120. — P. 610—615.
43. Романенко В.В., Романенко З.В. Хроническая сердечная недостаточность: от диагноза к лечению. — Минск, 2008. – 232 с.
44. Lechat P., Escolano S., Golmard J.L. et al. // Circulation. — 1997. — Vol. 96. — P. 2197—2205.
45. MERIT – HF Studi Group Effects of metoprolol CR/XL in chronic heart failure Metoprolol CR/XL Randomized International Trial in Congestive Heart Failure (MERIT – HF) // Lancet. — 1999. — Vol. 353. — P. 2001—2207.
46. Cleland J.G., Pennel D.J., Ray S.G.et al. // Lancet. — 2003. — Vol. 362. — P. 14—21.
Медицинские новости. – 2009. – №11. – С. 11-18.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.