Демографическая тенденция к увеличению продолжительности жизни и численности возрастной популяции наряду с развивающейся эпидемией сахарного диабета 2-го типа и ожирения во всем мире способствуют росту частоты гипогонадизма.
Эпидемиологические исследования (BaltimoreLongitudinalStudyofAging; NewMexicoAgingProcessStudy; MassachusettsMaleAgingStudy) продемонстрировали увеличение частоты развития гипогонадизма с возрастом. Содержание тестостерона у молодых здоровых мужчин варьирует в пределах 300 - 1050 нг/дл (10,4 - 36,4 нмоль/л). После 50 лет концентрация гормона снижается [13, 20, 27]. Динамика падения уровня тестостерона, по данным различных исследований, колеблется от 0,5 до 2% в год [12, 13, 20, 31, 36]. Согласно результатам BaltimoreLongitudinalStudyofAging, примерно 12, 20, 30 и 50% мужчин в возрасте 50, 60, 70 и 80 лет соответственно имеют андрогенный дефицит [27].
Концентрации сексгормон-связывающего глобулина (СГСГ) крови, лютеинизирующего (ЛГ) и фолликулостимулирующего гормонов, в отличие от таковых тестостерона, повышаются с возрастом [13, 20]. Уровень СГСГ у мужчин к 80 годам возрастает примерно в 2 раза по сравнению с возрастом 20 лет [30]. В MassachusettsMaleAgingStudy установлено повышение значений СГСГ на 1,2% ежегодно [12]. Нарастание концентрации СГСГ с возрастом и различия в способности женских и мужских гормонов связываться с ним создают условия для формирования эстрогенного фона [30].
Ожирение и сахарный диабет 2-го типа (СД 2-го типа) также ассоциируются со снижением циркулирующих уровней андрогенов. Старение популяции, неправильное питание, малоподвижный образ жизни, формирование висцерального ожирения способствуют росту частоты СД 2-го типа. Согласно данным InternationalDiabetesFederation, около 5% населения в возрасте 20-79 лет страдает СД, самая высокая частота - в США (7,9%) и Европе (7,8%) [14]. DhindsaS. еt al. диагностировали гипогонадизм у 33% мужчин с СД при среднем значении ИМТ 33,4 кг/м2 и уровне гликированного гемоглобина A1c - 8,4%, и практически у 58% пациентов с морбидным ожирением (ИМТ >40 кг/м2) и СД 2-го типа [10]. Андрогенный дефицит отмечается у 31,3% мужчин с СД 2-го типа без ожирения (нормальный ИМТ) [10], что свидетельствует о многофакторности формирования гипогонадизма на фоне инсулинорезистентности. Установлена обратная корреляционная взаимосвязь значений биодоступного, свободного и общего тестостерона в различных возрастных группах с уровнем препрандиального инсулина, а СГСГ и тестостерона - с уровнем препрандиальной гликемии [35]. Более низкие уровни общего тестостерона и дегидроэпиандростерона-сульфата отмечены у мужчин одного возраста с полным вариантом метаболического синдрома, включая СД 2-го типа [1].
Увеличение ИМТ на 1 кг/м2 сопровождается падением концентрации тестостерона крови на 10 нг/дл [13]. Причинные взаимосвязи между абдоминальным ожирением и снижением уровня андрогенов обсуждаются [36]. Повышение метаболического клиренса [30] и ароматизации андрогенов в жировой ткани, гиперпродукция провоспалительных цитокинов (TNFα, интерлейкин-1β), которые могут снижать секрецию лютеинизирующего гормона и гонадотропин-рилизинг гормона [40, 29], рассматриваются в качестве возможных механизмов формирования андрогенного дефицита при ожирении.
Возрастное снижение уровня андрогенов у мужчин, в отличие от характерного изменения гормонального фона у женщин в менопаузе, постепенное и сугубо индивидуальное. Возрастным мужской андрогенный дефицит можно назвать только после исключения влияния других хронических состояний, ассоциированных со старением. К ним относятся ожирение, СД 2-го типа [10] со снижением уровня тестостерона и/или повышением концентрации СГСГ, использование медикаментов для лечения хронических заболеваний, гипертироидизм с повышением продукции СГСГ, алкоголизм (употребление алкоголя >40г в день) [21] и/или алкогольная болезнь печени [30].
В диагностике мужского андрогенного дефицита, в том числе возрастного, существует ряд спорных вопросов. Прежде всего, это пороговый уровень тестостерона для верификации гипогонадизма, способ определения уровня гормонов, в частности общего тестостерона, и оптимальная фракция гормонов для выявления пациентов с гипогонадизмом (общий тестостерон, биодоступный тестостерон или свободный тестостерон).
Определяемые фракции тестостерона. У здоровых мужчин 1-3% общего количества тестостерона циркулируют в свободном состоянии, примерно 50-70% - связано с СГСГ и биологически неактивно, 20-30% легко связаны с альбумином. В тканях-мишенях биологическое действие оказывают свободный (несвязанный) тестостерон и связанный с альбумином. Эти фракции составляют так называемый биодоступный тестостерон.
Определение общего тестостерона крови не всегда отражает истинный андрогенный статус, особенно у пожилых мужчин. Например, уровень общего тестостерона может быть в пределах нормы при первичном нарушении тестикул или высоком уровне СГСГ тогда как значения биодоступного и свободного тестостерона снижены [2]. Согласно последним рекомендациям ВОЗ, исследование уровня свободного или биодоступного тестостерона обосновано, если концентрация общего тестостерона в сыворотке крови не является диагностической для гипогонадизма (низко-нормальные значения), особенно у мужчин с ожирением [16].
Стандартом для определения концентрации свободного тестостерона является метод равновесного диализа, однако значение показателя можно также установить математически [22]. Свободный андрогеновый индекс (рассчитанный по формуле: FAI = тестостерон (нмоль/л)/СГСГ (нмоль/л) х 100) имеет наиболее высокую степень корреляции с методом равновесного диализа [41].
Общепринятая нижняя граница нормы для уровня свободного тестостерона в диагностике гипогонадизма на сегодняшний день отсутствует, тем не менее концентрация свободного тестостерона крови ниже 225 пмоль/л (65 пг/мл) может быть отправной точкой для назначения заместительной терапии тестостероном [28, 37,38].
Уровень биодоступного тестостерона наиболее точно определяется методом преципитации с сульфатом аммония. Пороговое значение для биодоступного тестостерона зависит от методики определения и в настоящее время не используется в широкой практике [28].
Диагностический уровень тестостерона. По данным литературы, нормальное содержание общего тестостерона крови варьирует в широких пределах: от 300 до 1050 нг/дл (10,4 - 36,4 нмоль/л) [16,39]. Важным аргументом для использования значения общего тестостерона 300 нг/дл как диагностического для гипогонадизма является его функциональная корреляция с эректильной дисфункцией [24].
Другой вариант определения пороговой величины «низкий уровень» общего тестостерона - статистический: 2,5 стандартного отклонения ниже среднего значения нормального показателя для здорового мужчины. По данным MassachusettsMaleAgingStudy, нижняя граница для патологического снижения уровня общего тестостерона (отклонение на 2,5 сигмы от нормальных значений) составила 251 нг/дл (8,7 нмоль/л) - для здоровых мужчин в возрасте 40-49 лет, 216 нг/дл (7,5 нмоль/л) - в возрасте 50-59 лет, 196 нг/дл (6,8 нмоль/л) - в возрасте 60-69 лет и 156 нг/дл (5,4 нмоль/л) - в возрасте 70-79 лет [18]. Диагностические границы для свободного тестостерона крови в данных возрастных интервалах соответственно составили 5,3; 4,2; 3,7 и 2,2 нг/дл, для биодоступного тестостерона - 99,7; 79,8; 69,7 и 41,8 нг/дл.
По рекомендации эндокринологического сообщества в настоящее время заместительная терапия не назначается, если уровень общего тестостерона крови выше 350 нг/дл (12 нмоль/л), и заместительная терапия необходима, если уровень общего тестостерона крови ниже 230 нг/дл (8 нмоль/л). Если уровень общего тестостерона между 8 и 12 нмоль/л, проводится повторное исследование показателя с определением концентрации СГСГ для расчета свободного тестостерона или определение уровня свободного тестостерона крови методом равновесного диализа.
Продукция тестостерона имеет выраженный циркадный суточный ритм у молодых мужчин с максимальными значениями в утренние часы. По некоторым данным, пики концентрации с возрастом сглаживаются или вообще исчезают [6]. Более поздние исследования указывают на сохранение циркадного ритма продукции тестостерона у пожилых мужчин [11,25], поэтому пробы сыворотки крови для определения уровня общего тестостерона должны быть получены между 07.00 и 11.00 утра [11]. Если уровень тестостерона утром <300 нг/дл (10,4 нмоль/л), результат должен быть подтвержден повторными исследованиями с забором крови в то же время.
Методы определения уровня тестостерона. Методом выбора для определения уровня общего тестостерона крови является жидкостная последовательная хроматографическая масс-спектрометрия, однако эта методология не доступна в большинстве клиник.
Сравнительные исследования показали, что использование доступных коммерческих наборов для автоматических и полуавтоматических методов определения тестостерона способствует возникновению отличий в оценке эугонадных и гипогонадных уровней гормона [39]. Коэффициент вариаций значений между лабораториями, использующими одинаковые методы, может составлять от 5,1 до 22,7% [39].
Вариабельность значений общего тестостерона в зависимости от нормы каждой конкретной лаборатории обусловливает сложности в установлении пороговых значений для верификации мужского гипогонадизма.
Референсные значения показателя для заданного метода, предоставляемые во вкладышах производителем, являются только рекомендательными. Критерии отбора (исключения), возраст мужчин, а также время забора проб для установления референсных значений не сообщаются, а возможно, и не учитываются.
J. Taiebetal. сравнили концентрации тестостерона из 116 проб (50 мужчин, 55 женщин и 11 детей), полученные с помощью 10 различных коммерческих наборов и методом масс-спектрометрии [33]
Уровень тестостерона, определенный с помощью коммерческих наборов, был ниже по сравнению с методом масс-спектрометрии. Верхняя и нижняя границы нормы общего тестостерона различных наборов, рекомендуемые производителем, имели большое расхождение (рисунок).
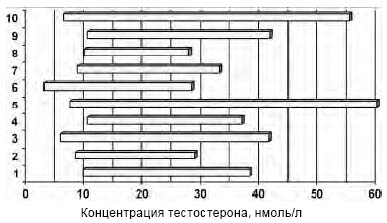
Рисунок. Вариации границ нормы производителей 10 различных коммерческих наборов для определения уровня общего тестостерона (адаптировано J. Taieb, 2003)
Самые низкие полученные значения общего тестостерона для мужчин составили 2-9 нмоль/л, самые высокие - 59-98 нмоль/л; средние значения для всех наборов 8 - 39,1 нмоль/л. Границы нормы для метода масс-спектрометрии: 10,4 - 32 нмоль/л. В восьми из десяти изученных коммерческих наборов производители сообщали нижнюю границу нормы для тестостерона менее рекомендованной 10,4 нмоль/л.
Для минимизации ошибок, связанных с оценкой результатов, необходимо установление в каждой локальной лаборатории собственных референсных значений для тестостерона [28, 33, 39].
Дифференциальная диагностика. Гипогонадизм (первичный и вторичный) может развиваться в любом возрасте. Факторы риска вторичного гипогонадизма у мужчин: хронические заболевания (диабет, хронические обструктивные заболевания дыхательных путей, артриты, заболевания почек и иммунодефицитные состояния), ожирение, метаболический синдром и гемохроматозы [5].
Диагноз гипогонадизм устанавливается на основании лабораторных данных и наличия признаков и симптомов, свидетельствующих о дефиците тестостерона [5, 23]. Наиболее характерный для андрогенного дефицита симптом - снижение либидо [34]. Другие проявления гипогонадизма: эректильная дисфункция, снижение мышечной массы и силы, повышение жировой массы, снижение минерал ной плотности кости и остеопороз, снижение энергии, депрессивное состояние, потеря смысла жизни, повышенная раздражительность, трудности с концентрацией внимания и другие когнитивные расстройства и/или приливы жара в случае острого начала. Ни одно из этих проявлений не является специфическим для андрогенного дефицита, но может стать поводом для обследования с целью выявления этого состояния [4, 15, 19, 42].
Низкий уровень тестостерона и наличие клинических признаков гипогонадизма не позволяют дифференцировать возрастной и вторичный гипогонадотропный гипогонадизм. В недавних исследованиях установлено, что снижение либидо встречается примерно у 54% мужчин с возрастным и у 67% с вторичным гипогонадизмом, эректильная дисфункция - у 58 и 53% соответственно; усталость - у 38 и 58%; депрессивное настроение - у 25 и 21%; остеопения или остеопороз - у 17 и 29% пациентов [8]. В таких случаях необходимо определение уровня лютеинизирующего гормона.
Согласно рекомендациям Американской Ассоциации клинических эндокринологов, крайне низкие уровни тестостерона крови (<150 нг/дл) требуют проведения визуализации гипофиза даже в отсутствие других симптомов [2]. Некоторые авторы рекомендуют ЯМР гипофиза наряду с определением тироксина, кортизола и пролактина, если есть подозрение на вторичный гипогонадизм [31].
Рекомендации Австралийского консессуса [9]:
• первичный (гипергонадотропный) гипогонадизм: уровень тестостерона крови <230 нг/дл (8 нмоль/л) с ЛГ более чем в 1,5 раза выше верхней границы нормы;
• вторичный (гипогонадотропный) гипогонадизм: уровень тестостерона крови <230 нг/дл (8 нмоль/л) без повышения ЛГ;
• нарушение клеток Лейдига: уровень тестостерона 230-432 нг/дл (8-15 нмоль/л) с ЛГ более чем в 1,5 раза выше верхней границы нормы;
• резистентность к андрогенам: уровень тестостерона крови T>864 нг/дл (31,5 нмоль/л) с ЛГ более чем в 1,5 раза выше верхней границы нормы.
Уровень пролактина определяют, если значения общего тестостерона ниже 5,2 нмоль/л (150 нг/дл) [7, 26] или есть подозрение на наличие вторичного гипогонадизма [3, 5, 37].
Установление собственных референсных значений для общего тестостерона в различных возрастных группах, соблюдение правил получения проб крови у пациентов, повторные исследования и использование дополнительных показателей (СГСГ свободный тестостерон), адекватная оценка неспецифических клинических проявлений способствуют более качественной верификации мужского андрогенного дефицита, в том числе и возрастного.
Л И Т Е Р А Т У Р А
1. Данилова Л.И., Мурашко Н.В. // Весц НАН Беларуси Сер. мед. навук. -2004. - №1.- С.10-14.
2. American Association of Clinical Endocrinologists medical guidelines for clinical practice for the evaluation and treatment of hypogonadism in adult male patients // Endocrinol. Pract. - 2002. - N 8. - P. 440-456.
3. Arauj A.B., Esch, G.R., Kupeiian V. et al. // J. Clin. Endocrinol. Metab.- 2007. - N 92. - P. 4241-4247.
4. Araujo A.B., O’Donnell A., Brambilla D. J.et al. // J. Clin. Endocrinol. Metab.- -2004. - N 89. - P. 5920-5926.
5. Bhasin S., Cunningham G. R, Hayes F J. et al. // J. Clin. Endocrinol. Metab. -2006. - N 91. - P. 1995-2010.
6. Bremner W.J., Vitiello M.V., Prinz P.N. // J. Clin. Endocrinol. Metab. - 1983. - N56. - P. 1278-1281.
7. Bunch T.J., Abraham D., Wang S., Meikle AW. // Aging. Male. - 2002. - N 5. -P.38-46.
8. Christ-Crain M., Meier C., Huber P.R. et al. // J. Clin. Endocrinol. Metab. - 2005.-N 90. - P. 1280-1286.
9. Conway A.J., Handelsman D.J., Lording D.W. et al. // Med. J. Austr. - 2000. - N 172. - P. 220-224.
10. Dhindsa S., Prabhakar S., SethiM. et al. // J. Clin. Endocrinol. Metab. -2004. - N 89. - P. 5462-5468.
11. Diver M.J., Imtiaz K.E., Ahmad A.M. // Clin. Endocrinol. - 2003. -N 58. - P.710-717
12. Feldman H.A., Goldstein I., Hatzichristou D.G.et al. // J. Urol. - 1994. - N 151. - P.54-61.
13. Harman S.M., MetterE.J., Tobin J.D. et al. // J. Clin. Endocrinol. Metab. - 2001. -N 86. - P. 724-731.
14. International Diabetes Federation. Diabetes prevalence. Available at http. // www. idf.org/home/index.cfm?node=264. Accessed Jan. 28, 2005.
15. Kelleher S., Conway A.J., Handelsman D.J. et al. // J. Clin. Endocrinol. Metab. -2004. - N 89, 3813-3817.
16. Larsen P.R., Kronenberg H.M., Melmed S., Polonsky K. Reference values. In. -P. William’s Textbook of Endocrinology. - 10 ed. - WB Saunders; P. Philadelphia, PA, 2002.
17. Lue TF, Giuliano F, MontorsiF. et al. // J. Sex. Med. - 2004. - N 1. - P. 6-23.
18. MohrB.A., GuayAT, O’DonnellA.B., McKinlay J.B. // Clin Endocrinol. - 2005. - N62. - P. 64-73.
19. Morales A., Spevack M., Emerson L. et al. // Aging. Male. - 2007. -N 10. - P.57-65.
20. Morley J.E., Kaiser FE., Perry III H.M. et al. // Metabolism. - 1997. -N 46. - P.410-413.
21. Muller M., den Tonkelaar I., Thijssen J.H. et al. // Eur. J. Endocrinol. - 2003. - N149. -P. 583-589.
22. Nanjee M.N., Wheeler M.J. // Ann. Clin. Biochem. -1985. -N 22.- P. 387-390.
23. Nieschlag E., Swerdloff R., Behre H.M. et al. // Eur. Urology. - 2005. - N 48. - P.1-4.
24. ParkK., Ku J.H., Kim S.W., Paick J.-S. // BJU Int. - 2005. -N 95. - P. 366-370.
25. Plymate S.R., Tenover J.S., Bremner W.J. // J. Andrology. - 1989. - N 10. -P.366-371.
26. Rhoden E.L., MorgentalerA. // N. Engl. J. Med. - 2004. -N 350. - P. 482-492.
27. Rhoden E. L., Estrada C., Levine L. et al.// J. Urology. - 2003. -N 170. - P.795-798.
28. Rosner W., Auchus R.J., Azziz R. et al. // J. Clin. Endocrinol. Metab. - 2007. - N92. - P. 405-413.
29. RussellS.H., Small C.J., Stanley S.A. // J. Neuroendocrinol. - 2001. - N 13. - P.296-301.
30. Selby C. // Ann. Clin. Biochem. - 1990. - N 27 (pt 6). - P. 532-541.
31. Snyder P.J. // J. Clin. Endocrinol. Metab. - 2001. - N 86. - P. 2369-2372.
32. Snyder P.J. // N. Engl. J. Med. - 2004. - N 350. - P. 440-442.
33. Taieb J., Mathian B., Millot Fet al. // Clin. Chem. - 2003. -N 49. - P. 1381-1395.
34. Travison T.G., Morley J.E., Araujo A.B. et al. // J. Clin. Endocrinol. Metab. - 2006. -N 91. - P. 2509-2513.
35. TsaiE.C., Matsumoto A.M., Fujimoto WY., Boyko E.J. // Diabetes Care. - 2004. -N 27. -P. 861-868.
36. Vermeulen A.// J. Clin. Endocrinol. Metab. - 2001. -N 86. - P. 2380-2390.
37. Vermeulen A. // J. Endocrinol. Investigation. - 2005. - N 28 (Suppl. 3). - P.28-31.
38. Vermeulen A., VerdonckL., Kaufman J.M. // J. Clin. Endocrinol. Metab. - 1999. -N 84. - P. 3666-3672.
39. Wang C.A., Catlin D.H., DemersL.M. et al. // J. Clin. Endocrinol. Metab. - 2004. -N 89. - P. 534-543.
40. Watanobe H., Hayakawa Y. // Endocrinology. - 2003. - N 144. - P. 48684875.
41. Wilke T.J., UtleyD.J. // Clin. Chem. - 1987. - N 33. - P. 1372-1375.
42. Zitzmann M., Faber S., Nieschlag E. // J. Clin. Endocrinol. Metab. - 2006. - N 91. - P. 4335-4343.
Медицинские новости. – 2009. – №16. – С. 17-20.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.