|

Ерш И.Р., Моргис
Я.С., Зайцев В.И., Романчук Э.В., Иодковская А.Э.
Антиишемический эффект ингибиторов АПФ и их роль в ремоделировании
сердца у больных, перенесших инфаркт миокарда
Гродненский государственный медицинский университет, Гродненская областная клиническая больница, Городская клиническая больница № 3, г. Гродно
Ингибиторы АПФ (иАПФ) успешно применяются в клинической практике с 70-х годов XX в. как гипотензивные препараты. В последующем они стали широко использоваться для лечения больных с хронической сердечной недостаточностью (ХСН) и в настоящее время считаются препаратами выбора у таких пациентов.
В последние годы убедительно подтверждена прогностическая значимость иАПФ, гемодинамические и негемодинамические эффекты которых в настоящее время являются предметом пристального внимания, однако до последнего времени не решен вопрос об антиишемическом эффекте этих препаратов [1, 5, 7].
Нами изучено воздействие тритаце (рамиприла, фирмы «Sanofi-Aventis, Франция) на постинфарктное ремоделирование левого желудочка, количество безболевых и болевых эпизодов ишемии миокарда, их среднюю и общую продолжительность, суммарную ишемию миокарда, а также амплитуду смещений сегмента ST у больных, перенесших острый крупноочаговый инфаркт миокарда (ИМ).
Материалы и методы
Обследованы 63 пациента (47 мужчин, 16 женщин), находившихся на стационарном лечении по поводу острого крупноочагового инфаркта миокарда; средний возраст которых составил 56±8,7 лет. Из исследования были исключены больные с мелкоочаговым и повторным ИМ. Все пациенты были разделены на 2 группы. Больные 1-й группы (основная; 32 человека: 24 мужчины, 8 женщин) наряду с традиционной терапией получали тритаце (рамиприл, фирмы «Sanоfi-Aventis», Франция) с 1-го дня неосложненного крупноочагового инфаркта миокарда в течение всего периода нахождения в стационаре и в течение года после выписки. Пациенты 2-й группы (контрольная; 31 человек: 23 мужчины, 8 женщин) получали обычную традиционную терапию, включающую антикоагулянты, антиагреганты, β-блокаторы и нитраты. Начальная доза рамиприла составила 2,5 мг/сут, которая постепенно увеличивалась в зависимости от уровня артериального давления (АД), динамики ЭКГ и состояния больного. Титрование дозы проводилось в течение всего госпитального периода и при выписке составляла в среднем 75–10 мг/сут.
Суточное мониторирование ЭКГ (СМЭКГ) проводили на аппарате «Кардиотехника-4000 АД» («Инкарт», Россия) в течение 24 ч на фоне отмены антиангинальных препаратов за сутки до исследования. Проводился анализ количества безболевых и болевых эпизодов ишемии миокарда, их средней и общей продолжительности, оценивали суммарную ишемию миокарда, а также определяли амплитуду смещений сегмента ST.
Эхокардиографическое исследование (ЭхоКГ) проводилось на аппарате «ALOKA-680» (Япония) по стандартной методике с использованием рекомендаций Американского эхокардиографического общества (1978 г.). Определялись следующие ЭхоКГ показатели: диаметр левого предсердия (ЛП), конечный диастолический (КДР) и конечный систолический (КСР) размеры левого желудочка (ЛЖ), толщина межжелудочковой перегородки (ТМЖП) и задней стенки ЛЖ (ТЗСЛЖ), размеры правого желудочка (ПЖ) в диастолу. Кроме того, по общепринятым методикам вычисляли конечный диастолический (КДО) и конечный систолический (КСО) объемы ЛЖ, ударный объем (УО), фракцию выброса (ФВ) ЛЖ в систолу. Индекс относительной толщины стенки (2 Н/Д) ЛЖ определяли следующим образом: (ТМЖП+ТЗСЛЖ)/КДРЛЖ. За повышение данного показателя принимали значение 0,45 и более. В то же время, признаком ассиметричной гипертрофии МЖП считалось отношение ТМЖП/ТЗСЛЖ > 1,5 [5]. Используя формулу R. Devereux и соавт. [13] определяли массу миокарда ЛЖ (ММЛЖ), за норму было принято значение 215 г, а за нормальное значение ИММЛЖ – цифры менее 130 г/м2 для мужчин и менее 110 г/м2 для женщин.
ЭхоКГ и СМЭКГ проводилось больным в 1-е сутки с момента развития острого инфаркта миокарда, повторные исследования проводились на 25-е сутки ИМ и через год наблюдения.
Статистический анализ проведен с помощью стандартных методов вариационной статистики с использованием программы Microsoft Excel по t-критерию Стьюдента.
Результаты и обсуждение
Динамика функционального класса (ФК) ХСН, повторных ИМ и летальности у больных, перенесших ОИМ представлена на рисунке.
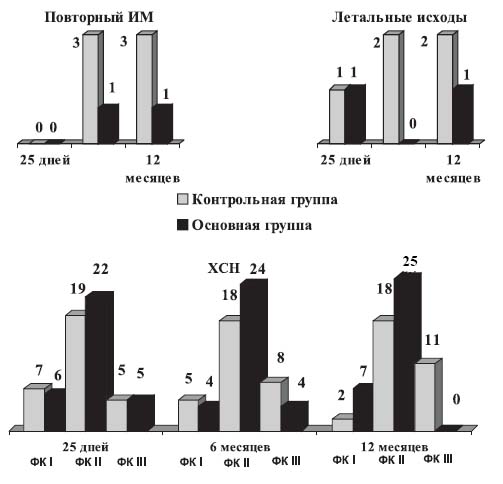
Рисунок. Годовые исходы у больных, получавших тритаце, и у пациентов контрольной группы
Как видно из данных рисунка, число больных с различными ФК ХСН в обеих группах больных к моменту выписки из стационара было примерно одинаковым. В то же время к концу 6-месячного наблюдения в контрольной группе увеличилось количество пациентов с III ФК (NYHA), что составило 25,9% (n=8) и уменьшилось количество больных с I ФК на 6,4% и II ФК– на 3,3%. Наиболее существенное увеличение количества пациентов с III ФК в контрольной группе наблюдалось к концу 12-месячного наблюдения. Так, количество больных с III ФК увеличилось на 19,4% и составило 35,6% (n=11), с I ФК уменьшилось на 18,1% (n=2), со II ФК– на 3,3% (n=18).
В группе пациентов, получавших в течение года тритаце в индивидуально подобранных дозах, наблюдалась положительная динамика: к концу года наблюдение не регистрировались больные с III ФК, у 21,8% (n=7) имела место ХСН I ФК, у 78,2% (n=25) – II ФК ХСН.
Как видно из рисунка, почти в 2,5 раза реже наблюдались летальные исходы и в 3 раза – повторные ИМ в группе больных, регулярно в течение года получавших тритаце, чем у пациентов контрольной группы.
Благоприятное влияние иАПФ на выживаемость больных с ХСН, перенесших ИМ, было убедительно подтверждено в исследованиях AIRE, AIREX, HEART и др. В целом влияние иАПФ на смертность и течение ХСН изучено у 99 022 пациентов с ИМ [1]. В результате лечения отмечено снижение смертности и частоты прогрессирования ХСН на 8–34% и снижение скорости ремоделирования миокарда ЛЖ.
Как свидетельствуют многочисленные исследования, одним из неблагоприятных прогностических факторов и предвестником внезапной смерти у больных, перенесших инфаркт миокарда, является безболевая ишемия миокарда, при этом в конце первого года наблюдения у данной группы пациентов была в 3 раза выше, чем при стенокардии, и составила 30% [3]. В то же время доказана связь эпизодов безболевой ишемии миокарда с жизненно опасными нарушениями ритма – желудочковой тахикардией и фибрилляцией желудочков. Однако до настоящего времени отсутствуют убедительные доказательства надежности современной антиангинальной терапии безболевой ишемии миокарда. В связи с этим остается актуальным своевременное выявление безболевой ишемии и подбор рациональной лечебной тактики в соответствии с выраженностью как болевой, так и безболевой ишемии миокарда [4].
Таблица 1. Динамика показателей СМЭКГ у больных, получавших тритаце, и в контрольной группе (М ± m)
|
Показатель
|
Сутки ИМ, группы больных
|
|
1-е сутки
|
25-е сутки
|
Через 12 мес.
|
|
тритаце (n = 32)
|
контроль (n = 31)
|
тритаце (n = 32)
|
контроль (n = 31)
|
тритаце (n = 32)
|
контроль (n = 31)
|
|
Количество эпизодов:
|
|
безболевых
|
5,7 ± 0,21
|
5,5 ± 0,42
|
4,6 ± 0,16
|
5,6 ± 0,41
|
3,1 ± 0,12
|
4,6 ± 0,16
|
|
болевых
|
2,4 ± 0,37
|
2,7 ± 0,27
|
1,6 ± 0,30
|
1,7 ± 0,21
|
1,0 ± 0,22
|
2,0 ± 0,21
|
|
Амплитуда смещения сегмента ST, мм:
|
|
безболевые эпизоды
|
2,1 ± 0,05
|
2,1 ± 0,04
|
1,9 ± 0,11
|
2,0 ± 0,12
|
1,4 ± 0,07*
|
2,0 ± 0,03
|
|
болевые эпизоды
|
1,8 ± 0,04
|
1,9 ± 0,03
|
1,6 ± 0,09
|
1,9 ± 0,04
|
1,3 ± 0,09*
|
1,9 ± 0,04
|
|
Средняя длительность эпизодов, мин.:
|
|
безболевых
|
17,0 ± 1,51
|
18,0 ± 1,71
|
14,9 ± 1,02
|
17,9 ± 1,12
|
5,0 ± 1,12*
|
14,9 ± 1,13
|
|
болевых
|
12,7 ± 0,39
|
12,6 ± 0,36
|
9,8 ± 0,14
|
12,4 ± 0,21
|
2,6 ± 0,21*
|
10,4 ± 0,32
|
|
Общая продолжительность, мин:
|
|
безболевые эпизоды
|
51,7 ± 4,12
|
52,0 ± 3,60
|
44,3 ± 2,09
|
64,7 ± 9,8
|
24,8 ± 2,04*
|
59,7 ± 1,11
|
|
болевые эпизоды
|
13,2 ± 1,09
|
12,7 ± 1,12
|
10,1 ± 2,61
|
18,3 ± 1,04
|
4,1 ± 0,19*
|
12,5 ± 0,16
|
|
Суммарная ишемия миокарда, мин
|
64,9 ± 2,98
|
64,7 ± 2,71
|
54,4 ± 1,94*
|
83,0 ± 2,02
|
28,9 ± 1,17*
|
72,2 ± 1,18
|
Как видно из табл. 1, у всех больных основной группы, получавших тритаце, наблюдалось благоприятное влияние препарата на частоту возникновения и продолжительность как безболевых, так и болевых эпизодов ишемии в период госпитализации и через год после выписки из стационара.
В обеих группах больных на 1-е сутки инфаркта миокарда зарегистрированы эпизоды безболевой и болевой ишемии миокарда, однако, достоверных различий в показателях СМЭКГ между ними не наблюдалось. На 25-е сутки ИМ в основной группе наблюдалась тенденция к снижению безболевых и болевых эпизодов ишемии на 19 и 33%, соответственно, амплитуды смещения сегмента ST, а также средней длительности, общей продолжительности безболевых и болевых эпизодов на 12,3, 14,5, 22,8 и 23,4% соответственно. Суммарная ишемия миокарда на 25-е сутки ИМ в основной группе снизилась на 16,1%. В контрольной группе пациентов за этот период наблюдалось увеличение общей продолжительности безболевой ишемии на 24,4%, болевой – на 44,1%, суммарной ишемии миокарда – на 22,%.
Таким образом, результаты СМЭКГ в остром периоде ИМ свидетельствуют об антиишемическом эффекте иАПФ, в частности тритаце. В литературе имеются единичные работы по изучению влияния иАПФ на ишемию миокарда у больных ИМ на госпитальном этапе. В работе В.А. Рябинина и соавт. (1997) изучался антиишемический эффект иАПФ у больных острым инфарктом миокарда, начиная с 12 часов от начала заболевания до конца стационарного периода. Результаты СМЭКГ в подостром периоде ИМ свидетельствовали о тенденции к снижению частоты всех видов нарушений сердечного ритма и степени отклонения сегмента ST у больных основной группы, получавшей тритаце [8]. Антиишемический эффект иАПФ в раннем постинфарктном периоде, по-видимому, обусловлен вазодилатацией, стимуляцией анаэробного гликолиза и увеличением тканевого уровня АТФ, влиянием иАПФ на α-адренорецепторы, продукцией ангиотензина II в коронарных сосудах, снижением систолического АД, ингибированием образования нейтрофилами свободных кислородных радикалов, препятствующих агрегации форменных элементов крови, снижая микроваскулярное повреждение и пролиферацию клеток [8, 9].
Через год наблюдения в основной группе больных выявлено снижение количества безболевых эпизодов на 45,6%, болевых – на 58,3%; средней длительности безболевых эпизодов на 70,4%, болевых – на 79,5%; общей продолжительности безболевых эпизодов на 52,0%, болевых – на 68,9%, а суммарной ишемии миокарда – на 55,4%. В контрольной группе пациентов отмечалось лишь умеренное уменьшение количества безболевых эпизодов на 16,0%, болевых – на 25,7%; средней длительности безболевых эпизодов на 17,2%, болевых – на 17,4%; увеличение общей продолжительности безболевых эпизодов на 14,8% и суммарной ишемии миокарда на 11,5%.
Достоверное снижение как количества эпизодов ишемии, так их общей и средней длительности в отдаленном периоде у больных, постоянно принимавших тритаце в течение года, свидетельствует о долговременном антиангинальном эффекте иАПФ. По-видимому, это может указывать на наличие долговременного эффекта иАПФ, который обусловлен не только вазодилатирующим эффектом на артериолы, но и влиянием их на структуру и функцию крупных артерий [12].
В настоящее время высказывается предположение, что благоприятное воздействие иАПФ на сердце заключается в торможении накопления коллагена в сердечной мышце и последующего развития фиброза сердца, а также в уменьшении гипертрофии ЛЖ, сопровождающейся улучшением перфузии, снижением потребности миокарда в кислороде, что естественно дополняет антиишемический эффект иАПФ, тем самым ослабляя ремоделирование сердца после ИМ [10].
Нами выявлено влияние тритаце на показатели внутрисердечной гемодинамики и сократительную способность ЛЖ у больных ИМ, как в подостром периоде, так и через 12 мес. наблюдения (табл. 2). В первые сутки инфаркта миокарда в группах больных не было выявлено достоверных различий в изучаемых показателях ЭхоКГ. Лишь через 25 дней наблюдения в группе пациентов, получавших тритаце, наблюдалась тенденция к снижению КДР, КДОИ, КСОИ, а в контрольной группе – тенденция к увеличению данных показателей.
Таблица 2. Показатели ЭхоКГ у больных, получавших тритаце, и в контрольной группе (М ± m)
|
Показатель
|
Сутки ИМ, группы больных
|
|
1-е сутки
|
25-е сутки
|
Через 12 мес.
|
|
тритаце (n = 32)
|
контроль (n = 31)
|
тритаце (n = 32)
|
контроль (n = 31)
|
тритаце (n = 32)
|
контроль (n = 31)
|
|
ТМЖП, см
|
1,08 ± 0,01
|
1,0 ± 0,02
|
1,08 ± 0,02
|
1,0 ± 0,03
|
1,18 ± 0,01
|
0,9 ± 0,01
|
|
ТЗСЛЖ, см
|
1,07 ± 0,01
|
1,0 ± 0,01
|
1,07 ± 0,02
|
1,0 ± 0,02
|
1,16 ± 0,01
|
1,0 ± 0,01
|
|
КДР, см
|
4,9 ± 0,12
|
4,7 ± 0,07
|
4,7 ± 0,13
|
5,0 ± 0,04
|
5,12 ± 0,02
|
5,22 ± 0,04
|
|
КДОИ мл/м2
|
92,3 ± 2,11
|
91,4 ± 3,01
|
88,2 ± 1,18
|
97,2 ± 2,81
|
79,1 ± 1,42*
|
137,0 ± 3,12
|
|
КСОИ мл/м2
|
41,7 ± 1,65
|
42,4 ± 1,07
|
38,6 ± 1,55
|
44,5 ± 1,12
|
33,8 ± 0,82*
|
74,3 ± 1,16
|
|
ФВ, %
|
48,3 ± 0,78
|
49,1 ± 0,87
|
50,4 ± 0,82
|
47,3 ± 0,68
|
51,4 ± 0,46*
|
45,0 ± 1,1
|
|
2 Н/Д
|
0,43 ± 0,02
|
0,42 ± 0,03
|
0,45 ± 0,01
|
0,40 ± 0,01
|
0,45 ± 0,01*
|
0,36 ± 0,01
|
|
ИММЛЖ, г/м2
|
139,8 ± 6,05
|
140,2 ± 7,01
|
136,5 ± 5,11
|
146,3 ± 6,08
|
126,3 ± 5,08*
|
166,1 ± 1,12
|
Через год наблюдения выявлены достоверные различия между группами больных в показателях внутрисердечной гемодинамики и сократительной способности ЛЖ.
В основной группе пациентов, в течение года получавших тритаце, наблюдалось улучшение внутрисердечной гемодинамики и сократимости ЛЖ: уменьшение КДОИ, КСОИ и ИММЛЖ на 14,3, 18,9 и 9,6% соответственно; ФВ увеличилась на 6,4%, а 2 Н/Д – на 4,6%. В то же время у больных контрольной группы произошло увеличение КДОИ, КСОИ и ИММЛЖ на 49,9, 75,2 и 17,6% соответственно при одновременном снижении ФВ, 2 Н/Д на 8,3 и 14,2%.
Влияя на объемные показатели ЛЖ, прием тритаце способствовал уменьшению КДОИ, КСОИ в госпитальном периоде ИМ и достоверно уменьшал эти показатели через год наблюдения (p<0,05). Оказывая положительный эффект на сократительную функцию миокарда, тритаце незначительно повышал ФВ в госпитальном периоде и достоверно увеличивал ФВ через год наблюдения. Существенной динамики значений ИММЛЖ на госпитальном этапе не наблюдалось. Через 12 мес. наблюдения ИММЛЖ в основной группе достоверно снизился, а в контрольной зарегистрировано его повышение. Установлено положительное влияние тритаце на индекс относительной толщины стенки ЛЖ (2 Н/Д), характеризующий соответствие гипертрофии сердечной мышцы растяжению камер сердца. Этот индекс возрастал лишь в группе больных, принимавших тритаце, и достиг достоверных (p < 0,05) значений через год наблюдения.
Влияние иАПФ на ремоделирование ЛЖ освещено в работах других авторов [2, 5, 6, 8, 11].
Результаты нашей работы не противоречат результатам проведенных исследований, в которых изучались различные аспекты ремоделирования после ИМ, а также уже известным многоцентровым исследованиям, посвященным изучению постинфарктного ремоделирования, но более длительное наблюдение за больными (1 год), позволяет подтвердить долговременный эффект иАПФ, в том числе тритаце.
Таким образом,наше исследование дополняет информацию об эффектах влияния иАПФ, связанных с воздействием на процессы постинфарктного ремоделирования. Выявленное нами благоприятное влияние тритаце на параметры ремоделирования ЛЖ подтверждает значение иАПФ в прогнозе ИМ, на что указывали многие исследователи [2, 5, 6, 8, 11]. Нами выявлен антиишемический эффект тритаце у больных в раннем и позднем постинфарктном периоде. Достоверное уменьшение количества летальных исходов, повторных ИМ, снижение прогрессирования ХСН у пациентов, принимавших тритаце, позволяют считать, что назначение этого препарата с первых суток острого ИМ имеет благоприятное прогностическое значение.
Л И Т Е Р А Т У Р А
1. Арутюнов Г.П., Вершинин А.А., Степанов Л.В. и др. // Клиническая фармакология и терапия.– 1998.– №2.– С.36–40.
2. Беленков Ю.Н., Мареев В.Ю., Орлова Я.А. и др. // Кардиология.– 1996.– №4.– С.15–22.
3. Верткин А.Р., Мартынов И.В., Гасилин В.С. Безболевая ишемия миокарда.– М.,1995.– 103с.
4. Жаров Е.И., Элконин А.Б., Верткин А.Р., Мартынов А.И. // Кардиология.– 1992.– №4.– С.32–34.
5. Корочкин И.М., Чукаева И.И., Аронов Л.С. и др. // Сб. науч. трудов к 60-летию ГКБ № 13. «Актуальные вопросы практической медицины».– М.,2000.– С.224–245.
6. Орлова Я.А., Мареев В.Ю., Беленков Ю.Н. // Кардиология.– 1996.– №10.– С.57–62.
7. Полонецкий Л.З., Полонецкий И.Л., Виноградова Н.Е. Применение ингибиторов ангиотензинпревращающего фермента при инфаркте миокарда: Пособие для врачей.– Минск, 2004.– 19с.
8. Рябинин В.А., Голиков А.П., Руднев Д.В. и др. // Кардиология.– 1997.– №5.– С.48–51.
9. Шабалин А.В., Никитин Ю.П. // Кардиология.– 1999.– №3.– С.4–11.
10. Шляхто Е.В., Конради Д.В., Рудоманов О.Г. // Кардиология.– 1999.– №2.– С.49–55.
11. Флоря В.Г. // Кардиология.– 1997.– №5.– С.63–70.
12. Bossaller C., Auch-Schwelk W., Grafe M. et al. // Agents Actions.– 1992.– Vol.38 (Suppl.2).– P.171–177.
13. Devereux R.B., Alonso D.R., Lutas E.M. // Am. J. Cardiol.– 1986.– Vol.57.– Р.450–458.
Медицинские новости. – 2010. – №10. – С. 71-74.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Содержание »
Архив »
|
|