Хроническая сердечная недостаточность (ХСН) относится к распространенным, неуклонно прогрессирующим заболеваниям. По результатам эпидемиологических исследований в странах Европы и США, распространенность хронической сердечной недостаточности варьируется от 0,4 до 2,5% [1]. В Российской Федерации, согласно исследованию ЭПОХА-ХСН и ЭПОХА-О-ХСН, распространенность ХСН I–IV функционального класса (ФК) в популяции составила 7%, за 10-летний период наблюдения отмечен рост встречаемости случаев в среднем на 1,2 человека на 1000 населения в год, часто обусловленный неадекватным лечением ишемической болезни сердца (ИБС) и артериальной гипертензии (АГ) [2].
Медико-социальное значение хронической сердечной недостаточности определяют показатели годовой смертности, достигающей 6% и превышающей смертность в популяции (более 50% пациентов погибают в течение 4 лет), а также финансовые затраты на лечение, составляющие 2–3% бюджета здравоохранения развитых стран мира [3]. Наибольший объем затрат в структуре лечения пациентов с хронической сердечной недостаточности занимает стационарное лечение. Отмечено, что у каждого второго госпитализированного в кардиологическое отделение больного (49%) диагностирована декомпенсация ХСН. При этом около 40% пациентов, госпитализированных по поводу хронической сердечной недостаточности, в течение первого года умирают либо требуют повторной госпитализации [4].
Разработка рекомендаций, основанных на результатах клинических исследований, с унифицированным подходом к лечению, современные лекарственные средства для лечения ХСН, несомненно, привели к существенному улучшению качества жизни пациентов и прогнозу, вместе с тем заболевание по-прежнему является прогностически неблагоприятным.
Поскольку для хронической сердечной недостаточности характерно повреждение миокарда и дисбаланс вазоконстрикторных и вазодилатирующих нейрогуморальных систем, ухудшающих способность сердца к наполнению или опорожнению, блокаторы ренин-ангиотензин-альдостероновой системы (ингибиторы АПФ и блокаторы рецепторов ангиотензина II), а также симпатоадреналовой системы (бета-адреноблокаторы) включены в группу основных лекарственных средств для лечения пациентов с сердечной недостаточностью [1]. Обоснованием к назначению бета-адреноблокаторов явились доказательства хронической гиперактивации симпатоадреналовой системы у пациентов с прогрессирующей и тяжелой (ФК II–IV) ХСН, а также успешное применение препаратов группы бета-адреноблокаторов, снижающих риск внезапной смерти, смерти от прогрессирования хронической сердечной недостаточности и уменьшающих число госпитализаций. Изучение действия бета-адреноблокаторов показало, что значительное влияние на симптомы и прогноз при хронической сердечной недостаточности оказывает вызываемое ими снижение частоты сердечных сокращений (ЧСС) как фактора риска смерти и осложнений сердечно-сосудистых заболеваний [5]. Вместе с тем в условиях реальной медицинской практики уменьшения ЧСС до целевых значений нередко не достигают.
Новые подходы к медикаментозной терапии хронической сердечной недостаточности с целью достижения улучшения качества жизни и прогноза, замедления прогрессирования заболевания стали возможными благодаря созданию нового лекарственного препарата ингибитора If-каналов ивабрадина (Кораксан®, LesLaboratoiresServier, Франция).
В 2005 г. ивабрадин – первый ингибитор If-каналов – получил разрешение Европейского медицинского агентства по оценке лекарственных средств (European Medicines Evaluation Agency – EMEA) на клиническое использование в качестве симптоматического антиангинального и антиишемического препарата при хронической стабильной стенокардии [6]. Препарат специфически связывается с f-каналами, когда каналы находятся в открытом состоянии, и селективно ингибирует If-поток. Его действие, таким образом, направлено на уменьшение скорости диастолической деполяризации и снижение ЧСС, при этом чем более активированы каналы, тем сильнее связывание препарата с каналом и проявление ингибирующих свойств. Это приводит к уменьшению потребности миокарда в кислороде и увеличению доставки кислорода к миокарду (за счет удлинения диастолы), а также позволяет сохранять вазодилатацию коронарных артерий даже на пике нагрузки, обеспечивая прямой антиангинальный эффект ивабрадина. Благодаря избирательному действию на If-поток препарат не влияет на другие ионные потоки в клетках синусового узла, не замедляет атриовентрикулярную проводимость, сохраняет сократимость миокарда и его электрофизиологиче-ские свойства. Применение препарата не сопровождается синдромом «рикошета» или «отмены», обеспечивает оптимальное соотношение эффективность/переносимость [6, 7].
В многоцентровом рандомизированном контролируемом исследовании BEAUTIFIL (Morbidity-mortality evaluation of the If inhibitor in patients with coronary disease left ventricular function) оценили эффективность и безопасность применения ингибитора If-каналов синусового узла ивабрадина со стандартной терапией пациентов со стабильной стенокардией, систолической дисфункцией левого желудочка и синусовым ритмом сердца [8]. Результаты исследования доказали, что у пациентов с документированной ИБС и сниженной систолической функцией левого желудочка ивабрадин оказывал антиангинальный и антиишемический эффекты. На фоне приема ивабрадина увеличивалась общая продолжительность физической нагрузки, снижалась частота приступов стенокардии и потребление нитратов, на ЭКГ увеличивалось время до появления депрессии сегмента ST.
Результаты исследования показали, что у пациентов с ишемической болезнью сердца и синусовым ритмом при ЧСС более 70 уд/мин достоверно более высокий риск смерти (на 34%). В подгруппе больных со стенокардией и ЧСС ³ 70 уд/мин, получавших ивабрадин на фоне стандартной терапии, включавшей b-адреноблокатор, отметили снижение частоты конечных точек в отношении ИБС: госпитализация в связи с фатальным и нефатальным острым инфарктом миокарда (относительное снижение на 73%, p = 0,002) по сравнению с группой контроля, получавших стандартную терапию. Медикаментозное лечение с применением ингибитора If-каналов ивабрадина в этой подгруппе способствовало уменьшению частоты коронарной реваскуляризации на 59% (p = 0,04) [8, 9].
Эффективность и безопасность ивабрадина явились обоснованием для рекомендаций по применению препарата в виде монотерапии или в комбинации с бета-адреноблокатором для лечения стабильной стенокардии [10]. Результаты BEAUTIFIL и других исследований показали, что применение ивабрадина при сниженной систолической функции левого желудочка у лиц с ишемической болезнью сердца и синусовым ритмом, обуславливает развитие следующих благоприятных эффектов: за счет увеличения длительности диастолы и улучшения доставки кислорода к миокарду, снижается потребление кислорода миокардом, улучшается диастолическое расслабление миокарда, уменьшается прогрессирование и снижается риск разрыва атеросклеротических бляшек, уменьшается количество и интенсивность эпизодов стенокардии, улучшается переносимость физической нагрузки, улучшается прогноз [11, 12, 13].
Достижения в лечении ивабрадином пациентов с ишемической болезнью сердца и хронической сердечной недостаточностью (систолической дисфункцией), продемонстрированные в исследовании BEAUTIFIL, позволили продолжить клиническое изучение уникального препарата. В августе 2010 г. опубликованы результаты исследования SHIFT (Systolic Heart Failure Treatment with the If Inhibitor Ivabradine Trial) – проспективного исследования, оценивающего влияние ивабрадина на прогноз пациентов с ХСН, синусовым ритмом свыше 70 уд/мин и фракцией выброса (ФВ) левого желудочка менее 35% [14]. Исследование выполнялось с октября 2006 г. по май 2010 г.
SHIFT – крупнейшее рандомизированное двойное слепое контролируемое исследование, в котором приняли участие 6505 пациентов в 677 центрах 37 стран мира. В исследование включали больных с умеренной и тяжелой хронической сердечной недостаточностью, ФВ левого желудочка £35%, ЧСС ³ 70 уд/мин, принимавших современную стандартную терапию (ингибиторы АПФ или блокаторы рецепторов ангиотензина II, бета-адреноблокаторы, петлевые диуретики, дигоксин, ингибиторы спиронолактона).
Критерии включения в исследование: возраст мужчин и женщин (с эффективной контрацепцией) старше 18 лет; II–IV ФК ХСН (по NYHA); ишемическую и не-ишемическую этиологию ХСН; систолическую дисфункцию левого желудочка (ФВ £?35%); ЧСС ³ ?70 уд/мин, зафиксированную на ЭКГ в 12 стандартных отведениях в течение 5-минутной записи при рандомизации; синусовый ритм; стабильную симптоматику сердечной недостаточности в течение 4 недель; документированную госпитализацию по поводу ХСН не ранее чем за 12 мес. до начала исследования.
Критерии исключения: недавний инфаркт миокарда, желудочковая или предсердная стимуляция либо оперативное лечение аритмии, фибрилляция предсердий, симптомная гипотензия. В период исследования не применяли недигидропиридиновые блокаторы кальциевых каналов, антиаритмические препараты I класса и сильные ингибиторы цитохрома P450 3А4.
После 14-дневного «отмывочного» периода, в течение которого не назначали исследуемых препаратов, и рандомизации, пациенты в дополнение к стандартному лечению хронической сердечной недостаточностью в одной группе получали ивабрадин в начальной дозе 5 мг 2 раза в сутки, в другой группе – плацебо. После 14-дневного применения ивабрадина начальную дозу увеличивали до 7,5 мг 2 раза в сутки, в случае снижения ЧСС до 50–60 уд/мин дозу препарата не увеличивали. При снижении ЧСС менее 50 уд/мин и/или клинических признаках брадикардии доза ивабрадина составляла 2,5 мг 2 раза в сутки. Длительность наблюдения составила 3,5 года (рис. 1).
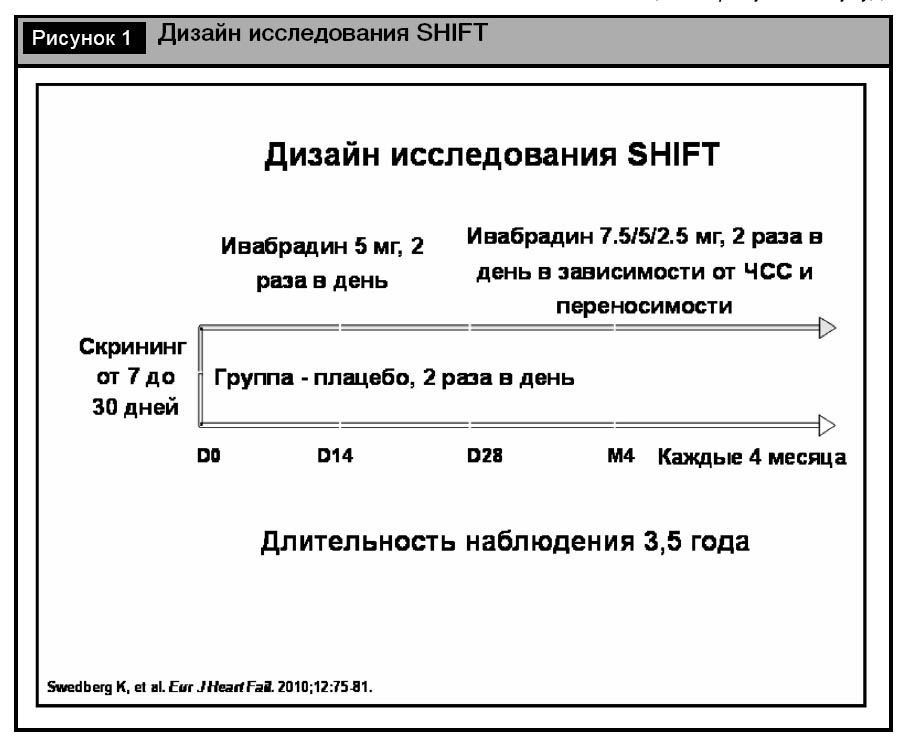
К конечным точкам исследования относили следующие события: первичная комбинированная конечная точка – смертность от сердечно-сосудистых событий, госпитализация в результате ухудшения течения хронической сердечной недостаточностью; другие конечные точки – общая смертность, смертность от сердечно-сосудистых событий и/или вследствие ХСН; госпитализация в результате сердечно-сосудистого заболевания/сердечной недостаточности; смертность от сердечно-сосудистых событий и госпитализации по поводу сердечной недостаточности или нефатального инфаркта миокарда; изменение ФК сердечной недостаточности по NYHA/общая оценка состояния пациентом и врачом.
Для включения в исследование ото-браны 7411 пациентов, рандомизировано 6558 человек, в том числе 3268 – в группу ивабрадина, остальные – в группу плацебо. Средняя длительность лечения составила 22,9 мес., максимальная – 41,7 мес.Во время исследования несколько человек из обеих групп были исключены, результаты проанализированы у 3241 больного группы ивабрадина и 3264 группы плацебо. Клиническая характеристика пациентов обеих групп представлена в табл. 1.
Таблица 1 Клиническая характеристика пациентов, включенных в исследование SHIFT
|
Параметр
|
Группа
|
|
ивабрадин
(n = 3241)
|
плацебо
(n = 3264)
|
|
Средний возраст
|
60,7 ±1 1,2
|
60,1 ± 11,5
|
|
Мужчины, %
|
76
|
77
|
|
Индекс массы тела, кг/м2
|
28,0 ± 5,1
|
28,0 ± 5,0
|
|
Ишемическая этиология, %
|
68
|
67
|
|
ФК II NYHA, %
|
49
|
49
|
|
ФК III NYHA,%
|
50
|
50
|
|
ФК IV NYHA,%
|
2
|
2
|
|
Длительность течения ХСН, годы
|
3,5 ± 4,2
|
3,5 ± 4,2
|
|
Предшествующий инфаркт миокарда, %
|
56
|
56
|
|
Диабет, %
|
30
|
31
|
|
Артериальная гипертензия, %
|
67
|
66
|
|
Средняя ЧСС, уд/мин
|
79,7 ± 9,5
|
80,1 ± 9,8
|
|
Средняя ФВ левого желудочка, %
|
29 ± 5,1
|
29 ± 5,2
|
|
Среднее АД систолическое, мм рт. ст.
|
122 ± 16,1
|
121,4 ± 15,9
|
|
Среднее АД диастолическое, мм рт. ст.
|
75,7 ± 9,6
|
75,6 ± 9,4
|
Ивабрадин или плацебо добавляли к стандартной терапии хронической сердечной недостаточности, включавшей ингибиторы АПФ или блокаторы рецепторов ангиотензина II, бета-адреноблокаторы, диуретики, антагонисты альдостерона, дигоксин и другие препараты (изосорбида динитрат и т.д.) в одинаковом соотношении в обеих группах пациентов (рис. 2). Фоновая терапия ХСН отражала истинную картину клинической практики.
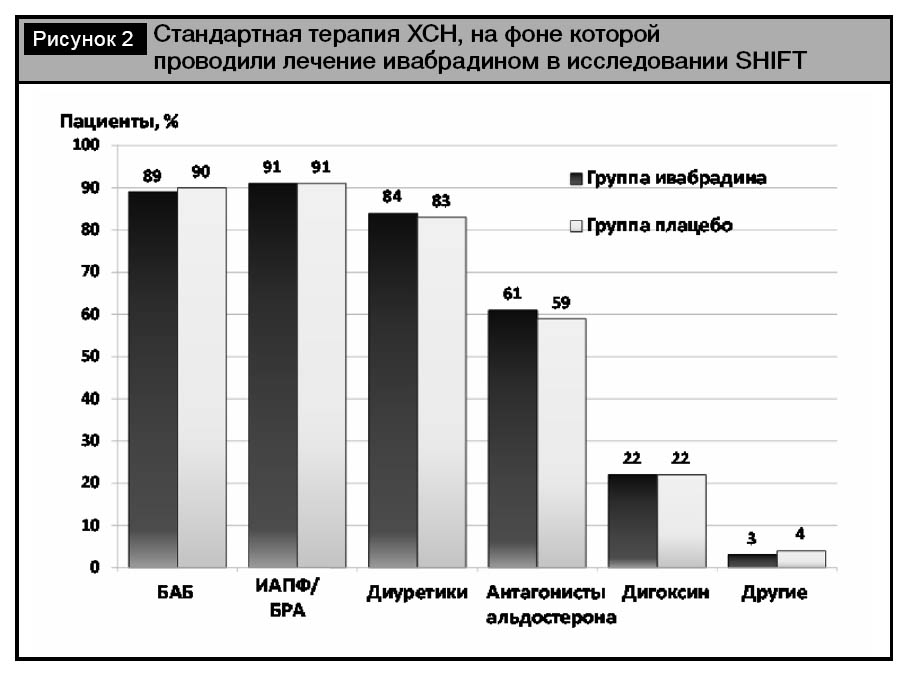
После рандомизации бета-адреноблокаторы получили 89% пациентов группы ивабрадина и столько же – группы плацебо. В каждой из исследуемых групп при лечении ХСН целевой дозы бета-адреноблокаторов достигли 26% больных, при этом как минимум 50% от целевой дозы b-адреноблокатора получали 56% пациентов.
Через месяц от начала лечения ЧСС составила: в группе ивабрадина при средней дозе препарата 6,4 ± 1,6 мг 2 раза в сутки – 64 уд/мин, в группе плацебо – до 75 уд/мин. Через 32 мес. лечения средняя ЧСС составила 67 и 75 уд/мин соответственно.
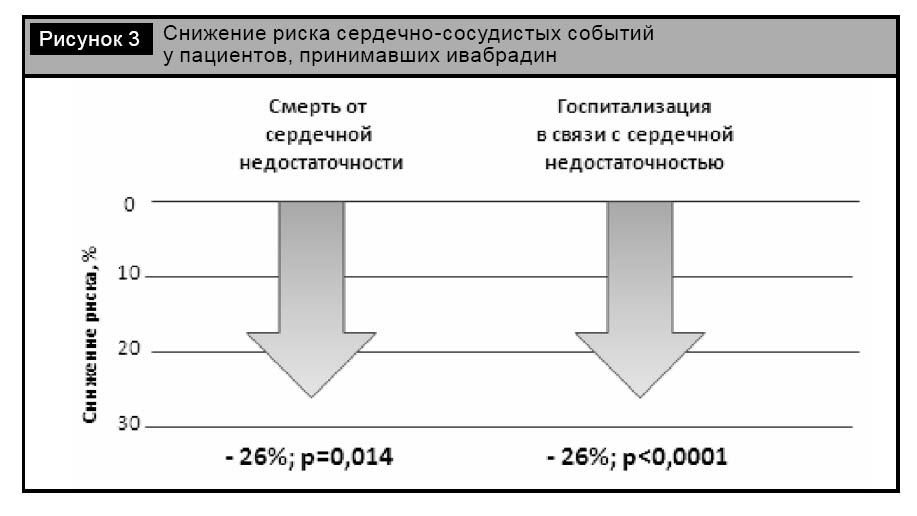
События первичной конечной точки (смертность от осложнений сердечно-сосудистых заболеваний или госпитализация по поводу обострения ХСН) наблюдали у 793 пациентов в группе ивабрадина (24%) и у 937 (29%) – в группе плацебо (отношение рисков 0,82; 95% ДИ 0,75–0,90; p < 0,0001). События в основном были обусловлены госпитализацией больных в связи с ухудшением течения сердечной недостаточности: 16% в группе ивабрадина, 21% – в группе плацебо (p < 0,0001); и случаями смерти от сердечной недостаточности: 3% против 5% соответственно (p = 0,014).
Таким образом, в группе ивабрадина оказалась меньшей частота смерти от сердечной недостаточности (–26%; р = 0,014) и госпитализаций в связи с ухудшением течения сердечной недостаточности (–26%; р < 0,0001) (рис. 3). Расчеты показали, что для предотвращения одной смерти от осложнений сердечно-сосудистых заболеваний или одной госпитализации по поводу утяжеления ХСН 26 пациентов в течение одного года должны принимать ивабрадин.
Важно отметить, что положительный эффект ивабрадина наблюдали у пациентов с хронической сердечной недостаточностью ишемического и неишемического генеза. Влияние в группе ивабрадина на сердечно-сосудистую смертность по сравнению с группой плацебо достоверно не отличалось, вместе с тем смерт-ность от ХСН снижалась статистически значимо (отношение риска 0,74 при 95% ДИ от 0,58 до 0,94; р = 0,014).
Следует отметить, что в группе ивабрадина снижение риска смерти и госпитализаций в связи с сердечной недостаточностью наблюдали в ранние сроки – через 3 мес. от начала лечения. Несмотря на сложность и комбинацию медикаментозного лечения умеренной и тяжелой хронической сердечной недостаточности, больные отмечали хорошую переносимость препарата.
Лечение хронической сердечной недостаточности в группе ивабрадина достоверно положительно влияло и на другие конечные точки (см. табл. 2).
Таблица 2 Результаты лечения ивабрадином по другим конечным точкам
|
Конечнаяточка
|
Относительныйриск
|
95% ДИ
|
Достоверность
|
|
Первичная комбинированная конечная точка
|
0,82
|
[0,75; 0,90
|
p < 0,0001
|
|
Общая смертность
|
0,90
|
[0,80; 1,02]
|
p = 0,092
|
|
Смертность в связи с ХСН
|
0,74
|
[0,58; 0,94]
|
p = 0,014
|
|
Госпитализация по поводу любой причины
|
0,89
|
[0,82; 0,96]
|
p = 0,003
|
|
Госпитализация по поводу сердечно-сосудистых заболеваний
|
0,85
|
[0,78; 0,92]
|
p = 0,0002
|
|
Сердечно-сосудистая смертность/ госпитализация в связи с ХСН или нефатальным инфарктом миокарда
|
0,82
|
[0,74; 0,89]
|
p < 0,0001
|
Изменения (снижение) ФК ХСН наблюдали через 6 недель от начала лечения ивабрадином, при этом значительное улучшение отметили пациенты в случае тяжелой сердечной недостаточности: из подгруппы с ФК IV остался 1 из 7%; ФК III – 53% из 93%; ФК II – 44% ранее относившихся к ФК III. Среди всех больных в группе ивабрадина и группе плацебо на фоне лечения улучшение отметили 28 и 24% соответственно, стабильность состояния – 68 и 70% соответственно, ухудшение состояния – 5 и 6% соответственно.
Побочные и нежелательные эффекты в группе ивабрадина развивались реже по сравнению с группой плацебо (р = 0,025). Фотопсии отметили у 3% пациентов, брадикардия клинически симптомная или бессимптомная послужила причиной отмены препарата у 1% больных в группе ивабрадина и у менее 1% – в группе плацебо. В обеих группах на фоне лечения не выявлено различий по лабораторным показателям.
Результаты исследования SHIFT продемонстрировали существенное снижение риска развития осложнений, связанных с ХСН, в случае применения ивабрадина дополнительно к стандартной терапии у пациентов с ишемической болезнью сердца и систолической дисфункцией левого желудочка. Использование ивабрадина привело к уменьшению на 18% (p < 0,0001) риска развития смертности в результате осложнений сердечно-сосудистых заболеваний и госпитализаций по поводу ХСН. Эффективное влияние ивабрадина на частоту развития исходов (смерть или госпитализация по поводу ХСН) проявлялось у различных по полу и возрасту больных в ранние (через 3 мес.) сроки лечения и поддерживалось в течение всего периода наблюдения.
Таким образом, улучшения клинического состояния у пациентов с хронической сердечной недостаточностью можно добиться с помощью применения ингибитора If-каналов ивабрадина. На основании данных, полученных в исследовании SHIFT, ивабрадин включен в Национальные рекомендации по диагностике и лечению хронической сердечной недостаточности.
Л И Т Е Р А Т У Р А
1. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). // Eur. Heart J. – 2008. – Vol. 29, N 19. – P. 2388–2442.
2. Диагностика и лечение хронической сердечной недостаточности. Национальные клинические рекомендации. Сб. / Под ред. Р.Г. Оганова. – 3-е изд. – М., 2010. – C. 67–160.
3. The European health report 2009: health and health systems 2010 // www.euro.who.int
4. Cleland J.G., Swedberg K., Follath F. et al. // Eur. Heart J. – 2003. – Vol. 24, N 5. – P. 442–463.
5. Fox K., Borer J.S., Camm J. et al. // J. Amer. Coll. Cardiol. – 2007. – Vol. 50. – P. 823–830.
6. Fox K., Garcia M.A., Ardissino D. et al. // Eur. Heart J. – 2006. – Vol. 27. – P. 1241–1381.
7. Mulder P., Barbier S., Chagraoui A. et al. // Circulation. – 2004. – Vol. 109. – P. 1674–1679.
8. Fox K., Ferrari R., Tendera M. et al. // Am. Heart J. – 2006. – Vol. 152, N 5. – P. 860–866.
9. Tardif C., Berry C. // Eur. Heart J. – 2006. – Vol. 8 (suppl. D). – D24–D29.
10. Steg P.G. // Medicographia. – 2009. – Vol. 4, N 31. – P. 371–376.
11. Drouin A, Gendron M.E., Thorin E. et al. // Br. J. Pharmacol. – 2008. – Vol. 154, N 4. – P. 749–757.
12. Ferrari R., Nesta F., Boraso A. // Eur. Heart J. – 1999. – Vol. 1 (suppl H). – H24–H28.
13. Custodis F., Baumhäkel M., Schlimmer N. et al. // Circulation. – 2008. – Vol. 117, N 18. – P. 2377–2387.
14. Swedberg K., Komajda M., Bohm M. et al. // Lancet. – 2010. – Vol. 376, N 9744. – P. 847–849.
Медицинские новости. – 2011. – №4. – С. 35-38.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.