Karpov I.A., Kachanko E.F.
Belarusian State Medical University, Minsk, Republican Clinical Medical Center of the Presidential Administration of the Republic of Belarus, Minsk
Clarithromycin: opportunities for clinical use
Резюме. Кларитромицин является полусинтетическим 14-членным макролидом, производным эритромицина. Наличие метоксигруппы в позиции 6 лактонного кольца придает ему повышенную кислотостабильность и улучшенные, по сравнению с эритромицином, антибактериальные и фармакокинетические свойства. Важной особенностью кларитромицина является образование в организме активного метаболита – 14-гидрокси-кларитромицина, который также обладает антибактериальной активностью.
Ключевые слова: макролиды, кларитромицин, внебольничная пневмония, минимальная подавляющая концентрация, резистентность, внебольничные инфекции дыхательных путей, бактериальный синусит.
Summary. Clarithromycin is a 14-membered macrolide antibiotic, derivative of erythromycin. The presence of metoxgroup in position 6 lactones ring gives it increased acid stability and improved, compared with erythromycin, antibacterial and pharmacokinetic properties. An important feature of clarithromycin is education in the body of the active metabolite – 14-hydroxy-clarithromycin, which also has antibacterial properties.
Keywords: macrolides, clarithromycin, community-acquired pneumonia, minimum inhibitory concentration, resistant, community-acquired respiratory tract infections, bacterial sinusitis.
Кларитромицин – 14-членный полусинтетический макролидный антибиотик (по числу атомов углерода в химической структуре препарата). Наличие метоксигруппы в позиции 6 макроциклического лактонного кольца придает ему повышенную кислотостабильность, а также улучшенные по сравнению с эритромицином фармакодинамические и фармакокинетические свойства [1–3].
Патент на кларитромицин был получен японской фирмой Taisho в 1979 году, в 1985 году было подписано соглашение с фирмой Abbot о правах распространения антибиотика за пределами Японии. В 1991 г. кларитромицин получил одобрение FDA.
Препарат создавался с целью расширения спектра активности эритромицина, а также усиления устойчивости к механизмам рефлюкса макролидов, поскольку к тому времени уже существовали макролидустойчивые микроорганизмы. Внедрение в практику кларитромицина практически совпало с интенсивными исследованиями по выяснению клинической роли атипичных микроорганизмов в формировании патологии дыхательного и урогенитального тракта. Таким образом, более 25 лет данный антибиотик широко используется в клинической практике большинства стран мира. Кларитромицин – наиболее распространенный и актуальный макролид. В Республике Беларусь он представлен как брендовой формой, так и целым рядом дженериковых форм, также широко применяемых в клинике. Одни из хорошо известных и часто назначаемых кларитромицинов – Фромилид и Фромилид Уно (KRKA, Словения).
Принято считать, что вся группа макролидов (на рис. 1 представлена классификация макролидов) обладает бактериостатическим эффектом. Может быть, это и правильно с формальных позиций. Однако быстрое создание высоких концентраций препарата в бактериальной клетке приводит к немедленной гибели клетки-мишени. Естественно, что механизм действия, отличный от бета-лактамов, не предполагает воздействия на формирование пептидогликана клеточной стенки и массивного лизиса микроорганизма. Однако подчеркнем, что совместное клиническое использование препаратов этих двух групп эффективно, предусмотрено целым рядом протоколов и доказало свою клиническую состоятельность, например при пневмониях.
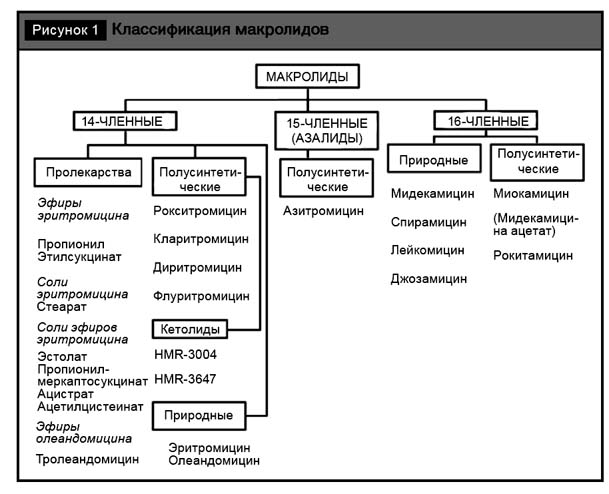
Механизм воздействия кларитромицина на бактериальную клетку состоит в эффективном блокировании синтеза белковых структур на уровне разобщения полипептидной цепочки в бактериальных рибосомах [4, 5]. Соответственно, и характерные для макролидов механизмы резистентности заключаются или в формировании измененной мишени, на которую воздействует антибиотик, или в активизации механизмов клеточного эффлюкса, позволяющего выводить антибактериальное вещество из клетки-мишени. Последний механизм особенно актуален для восточноевропейского региона и, как правило, в клинической практике преодолевается высокой внутриклеточной концентрацией препарата. Особенностью кларитромицина является то, что в организме он подвергается биотрансформации с образованием основного метаболита – 14-гидроксикларитромицина (14-ГКМ), также обладающего антимикробной активностью, что имеет значение при лечении инфекций, вызванных H. influenzae [1–3].
Спектр активности кларитромицина в целом сходен с другими макролидными антибиотиками. Однако он характеризуется наиболее высокой среди макролидов активностью в отношении стрептококков, в том числе S. pneumoniae и S. pyogenes, метициллинчувствительных штаммов St. aureus, превосходя таковую эритромицина в 2–4 раза [6]. Кларитромицин также высокоактивен против атипичных возбудителей – хламидий, микоплазм, легионелл. По уровню активности в отношении H. pylori он превосходит другие макролидные антибиотики и метронидазол [7, 8]. Кларитромицин также обладает клинически значимой активностью в отношении бактерий комплекса Mycobacterium avium и Toxoplasma gondii, причем его активность в отношении атипичных микобактерий в четыре раза превосходит таковую азитромицина [6, 9, 10]. Клинически значимо также действие кларитромицина на ряд других грамположительных и грамотрицательных бактерий – Bordetella pertussis, Campylobacter jejuni, Moraxella catarrhali [6]. Бактерии семейства Enterobacteriaceae и неферментирующие грамотрицательные микроорганизмы обладают природной устойчивостью к кларитромицину [6].
Об иммуномодулирующих и противовоспалительных свойствах макролидов заговорили в основном в последнем десятилетии XX века, эта тема активно изучалась исследователями в различных странах мира (Япония, Франция, США, Германия и др.) и обсуждалась на специальных международных конгрессах, посвященных новым макролидам, азалидам и стрептограминам. Установлено, что кларитромицин способен взаимодействовать с иммунной системой макроорганизма. Так, он повышает фагоцитарную активность нейтрофилов и макрофагов, причем в большей степени, чем эритромицин и джозамицин. Выявлен синергидный бактерицидный эффект при сочетании кларитромицина с комплементом сыворотки. Кроме того, в присутствии кларитромицина увеличивается активность Т-киллеров, что, вероятно, имеет значение при лечении бактериальных инфекций, осложненных вирусными суперинфекциями.
Предполагается, что положительный эффект кларитромицина при хронических синуситах может быть связан не только с антибактериальной активностью, но и с местным противовоспалительным действием, которое обусловлено ингибированием продукции цитокинов и устранением интраназальной гиперсекреции.
У больных с респираторными инфекциями кларитромицин тормозит образование мокроты и улучшает ее реологические свойства. Он ингибирует выработку и высвобождение NО альвеолярными макрофагами, что может иметь значение для купирования воспаления дыхательных путей. Эта способность выражена у кларитромицина в значительно меньшей степени, чем у дексаметазона, а у амоксициллина и цефаклора она отсутствует вообще.
Резистентность к макролидам, в частности к эритромицину, была очень редким явлением в конце 1970-х – начале 80-х гг. Однако уже в конце 80-х гг. исследования в ЮАР показали высокую частоту эритромицинрезистентных штаммов в сочетании с полирезистентностью пневмококков, выделенных от здоровых детей. В Восточной Европе пока сохраняется высокий уровень чувствительности пневмококка к макролидам, что делает возможным их широкое использование в клинической практике.
По частоте встречаемости макролидрезистентных пневмококков можно выделить следующие группы (рис. 2):
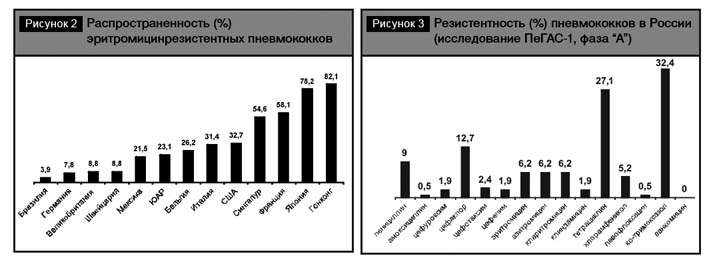
- страны со сравнительно низкой частотой резистентности: Бразилия, Германия, Великобритания, Швейцария;
- страны с умеренно высокой частотой резистентности: Мексика, ЮАР, Бельгия;
- страны с очень высокой частотой резистентности: США, Сингапур, Франция, Япония, Гонконг.
Мониторинг антибиотикорезистент-ности пневмококков в Российской Федерации проводится с 1999 г. НИИ антимикробной химиотерапии и Научно-методическим центром Минздрава России по мониторингу антибиотикорезистентности г. Смоленска и является составной частью многоцентрового исследования ПеГАС-1 – ПеГАС-2 (2004–2005 гг.). В этом исследовании изучались уровень, структура и фенотипы резистентности к антимикробным препаратам в различных регионах России в динамике за период с 1999 по 2005 г. [11–13]. Фаза «А» проекта ПеГАС-1 была проведена в 1999–2000 гг. с включением 15 центров Центрального, Приволжского, Южного, Уральского и Сибирского федеральных округов. По данным этого исследования (рис. 3), умеренно резистентные к пенициллину штаммы S.pneumoniae составили 7%, при этом 2% штаммов имели МПК (минимальная подавляющая концентрация) пенициллина ³2 мг/л. Все штаммы с промежуточной устойчивостью к пенициллину сохраняли чувствительность к цефалоспоринам. Частота резистентности к эритромицину составила 6,2%. Наиболее существенна проблема устойчивости S. pneumoniae к тетрациклину (27,1%) и ко-тримоксазолу (32,4%). В фазе «Б» (2001–2002 гг.) участвовали 25 центров Центрального, Северо-Западного, Приволжского, Южного, Уральского, Сибирского и Дальневосточного федеральных округов.
В настоящее время все макролиды сохраняют высокую активность в отношении S. pneumoniae. В 1999–2003 гг., нечувствительными к эритромицину были 8,2% штаммов, к азитромицину – 8,1%, к кларитромицину – 8%. Отмечена некоторая тенденция к снижению этих показателей в 2004–2005 гг., когда соответствующие величины составили 6,6%, 6,4% и 6,4%, однако различия между двумя периодами были статистическими недостоверными [11–13].
Существует ряд показаний к применению кларитромицина. Это очень важно, так как дает возможность использовать относительно недорогой, эффективный препарат с небольшим количеством побочных эффектов в клинической практике как амбулаторно, так и стационарно. Всегда проблематично выбрать макролид для лечения инфекций, вызванных палочкой Пфейфера. Следует однозначно сказать, что применение кларитромицина, как и 15-членных макролидов, имеет как клиническую, так и бактериологическую эффективность. Это позволяет эффективно использовать препараты у пациентов с острыми и хроническими заболеваниями респираторного тракта (в частности, отиты, синуситы).
Макролиды, в частности кларитромицин, используются для лечения острого тонзиллита/фарингита. Данная патология практически в половине случаев имеет вирусную природу (в большинстве случаев рино- и аденовирусы). Бактериальная патология представлена, главным образом, пиогенным стрептококком и стрептококками групп С и G. Клинические признаки, позволяющие высказаться именно за бактериальную природу заболевания, с возрастом становятся все менее и менее убедительными. В ряде клинических исследований показана невозможность установить этиологическую природу заболевания без бактериологического подтверждения. Все это делает актуальным использование антибактериальных препаратов как ведущего лечебного фактора при данной патологии. Современные протоколы лечения признают ключевую роль бета-лактамов, к которым до настоящего времени не сформировалась резистентность [14, 15]. Однако в качестве основной альтернативы предусматривается применение макролидов, в том числе кларитромицина. Препарат создает высокие концентрации в миндалинах и отличается хорошим профилем безопасности [16, 17]. В исследовании E.L. Kaplan и соавт. у пациентов ³12 лет с острым тонзиллитом/фарингитом и положительным результатом культурального исследования на наличие S. pyogenes 10-дневный курс лечения кларитромицином в дозе 250 мг два раза в день превосходил по бактериологической эффективности 5-дневный курс лечения азитро-мицином, который применялся по 500 мг в первый день, далее по 250 мг один раз в сутки (частота эрадикации возбудителя составила 91 и 82% соответственно) [18]. В ряде исследований 5-дневный курс кларитромицина по клинической и микробиологической эффективности был сопоставим со стандартным 10-дневным курсом лечения феноксиметилпенициллином [19, 20]. Столь длительный курс антибактериальной терапии целесообразен для минимизации развития осложнений (паратонзиллярный абсцесс, ревматизм). Следует отметить, что тенденция к широкому распространению макролид-резистентности пиогенного стрептококка в значительной мере затронула многие азиатские и западноевропейские страны [21, 22–26] и не имеет широкого распространения в Западной части России, Прибалтике и Беларуси.
Большую часть бактериальных синуситов вызывают пневмококки и палочка Пфейфера (H. Influensae). Редко, но встречается также заболевание, вызванное M. cataralis. Последний микроорганизм практически всегда продуцирует бета-лактамазы, однако сохраняет чувствительность к макролидам. Макролиды остаются одной из самых эффективных групп антибиотиков, воздействующих на пневмококки. В ходе клинических исследований показана сравнимая с пенициллинами, цефалоспоринами и фторхинолонами клиническая эффективность кларитромицина при остром синусите. Кроме того, в исследовании J. Dubois и соавт. кларитромицин не уступал амоксициллину/клавуланату по бактериологической эффективности (частота эрадикации составила 87 и 90% соответственно) [27].
У пациентов с острой внебольничной пневмонией также используются макролиды, в том числе кларитромицин. У молодых пациентов без сопутствующих заболеваний и факторов риска возможно альтернативное применение этих антибиотиков с учетом эффективности воздействия на пневмококк, палочку Пфейфера, моракселлу, а также на атипичные возбудители (микоплазму, хламидию, легионеллу) [28–31]. При этом предпочтение отдается современным макролидным антибиотикам – кларитромицину и азитромицину. Возрастает практическое использование макролидов в эмпирической терапии тяжелых форм внебольничной пневмонии [28–31]. Это объясняется обязательным в этом случае сочетанным назначением антибиотиков (бета-лактам + макролид). Макролид добавляется для того, чтобы дополнить действие бета-лактамного антибиотика на атипичные возбудители, резистентные к воздействию бета-лактамного препарата, но способные вызвать тяжелые формы внебольничной пневмонии (прежде всего легионелла). Показано альтернативное использование бета-лактамного препарата с макролидом или респираторными фторхинолонами, также отличающимися широтой антибактериального спектра и клинической эффективностью. При тяжелой респираторной патологии предпочтительно использование кларитромицина. Во-первых, особенность его фармакокинетики позволяет антибиотику быстро накапливаться в клетках респираторного эпителия и альвеоцитах. Во-вторых, подавляется гиперпродукция слизи бронхо-альвеолярного дерева, механизм которой сводится к некоторому подавлению экспрессии соответствующего гена и, в большей степени, снижению диффузии ионов хлора, а также соответственно и воды в мелких бронхах. Это дополнительные, не основные, свойства антибиотика. Основное – создание высоких внутриклеточных концентраций и широкий антибактериальный спектр воздействия на типичные и атипичные возбудители респираторных заболеваний.
Кларитромицин, как и другие макролиды, эффективен в лечении инфекций, передающихся половым путем (ИППП). В настоящее время большое внимание уделяется микоплазмам, хламидиям и уреоплазмам, как возбудителям острых и хронических инфекционных заболеваний малого таза. Настоящая работа не предполагает всестороннего рассмотрения этой проблемы. Подчеркнем только, что существует много клинических гипотез по этому поводу, которые, за недоказанностью, остаются только гипотезами. Однако следует отметить, что макролиды, в частности кларитромицин, – это протокольные средства для лечения ИППП. При этом сведения о макролид-резистентности, формирующейся у атипичных микроорганизмов, вызывающих ИППП, единичны и малоубедительны.
Клиническими исследованиями показана преимущественная эффективность кларитромицина при заболеваниях желудка и 12-перстной кишки, требующих элиминации Helicobacter pylori. В этом случае кларитромицин является наиболее эффективным антибактериальным средством [32, 33].
Нами было исследовано 256 неинвазивных штаммов пневмококка с целью изучения чувствительности к наиболее распространенным антибактериальным препаратам. После забора материала сразу производился посев площадкой на чашки Петри с 5% колумбийским агаром (bioMerieux, Франция) c добавлением 5% дефибринированной лошадиной крови. Инкубация проводилась в атмосфере с повышенным содержанием СО2 (5%) при температуре +35°С в течение 24 ч. Реидентификация пневмококков осуществлялась на основе морфологии колоний на кровяном агаре, наличия альфа-гемолиза, чувствительности к оптохину, лизиса в присутствии солей желчных кислот c 10% раствором дезоксихолата натрия (Sigma, США) и/или положительных результатов латекс-агглютинации с использованием набора «Slidex Pneumo-Kit» (bioMerieux, Франция). После реидентификации штаммы хранили в пробирках с триптиказо-соевым бульоном (bioMerieux, Франция) с добавлением 30% стерильного глицерина (Sigma, США) при температуре –70°С.
В соответствии с рекомендациями CLSI/NCCLS, исследование чувствительности S. рneumoniae с определением МПК проводили методом микроразведения в катион-сбалансированном бульоне Мюллера–Хинтон (BBL, США) с добавлением лизированной лошадиной крови (итоговая концентрация 5%).
Определялась чувствительность S. pneumoniae к 22 антимикробным препаратам: пенициллину, амоксициллину, цефтриаксону, цефиксиму, цефтибутену, эритромицину, азитромицину, кларитромицину, мидекамицину ацетату, клиндамицину, джозамицину, спирамицину, левофлоксацину, моксифлоксацину, ципрофлоксацину, гемифлоксацину, тетрациклину, хлорамфениколу, триметоприму/сульфаметоксазолу, ванкомицину, линезолиду и эртапенему.
При тестировании использовали двойные серийные разведения химически чистых субстанций антибиотиков: пенициллин (Sigma, Германия), амоксициллин (GlaxoSmithKline, Великобритания), цефтриаксон (Lek, Словения), цефиксим (Fujisawa, Япония), цефтибутен (Shionogi, Япония), эритромицин (Polfa, Польша), азитромицин (Roussel, Япония), кларитромицин (KRKA, Словения), мидекамицин ацетат (KRKA, Словения), спирамицин (Rhone-Poulenc Rorer, Франция), клиндамицин (Pfizer, США), джозамицин (Rhone-Poulenc Rorer, Франция), спирамицин (Rhone-Poulenc Rorer, Франция), левофлоксацин (Fluka, Германия), моксифлоксацин (Bayer, Германия), ципрофлоксацин (KRKA, Словения), гемифлоксацин (LG Life Sciences, Корея), тетрациклин (Sigma, Германия), хлорамфеникол (Fluka, Германия), триметоприм/сульфаметоксазол (Sigma, Германия), ванкомицин (Eli Lilly, США), линезолид (Pfizer США), эртапенем (MSD, США).
Контроль качества с использованием контрольных штаммов S. pneumoniae ATCC 49619 при каждой постановке чувствительности проводили в соответствии со стандартами CLSI (2009).
Кроме необходимости учета данных по чувствительности, важная роль в прогнозировании ситуации с резистентностью принадлежит распределению штаммов по значениям МПК.
Распределение пневмококков по значениям МПК 14- и 15-членных макролидов представлено на рис. 4.
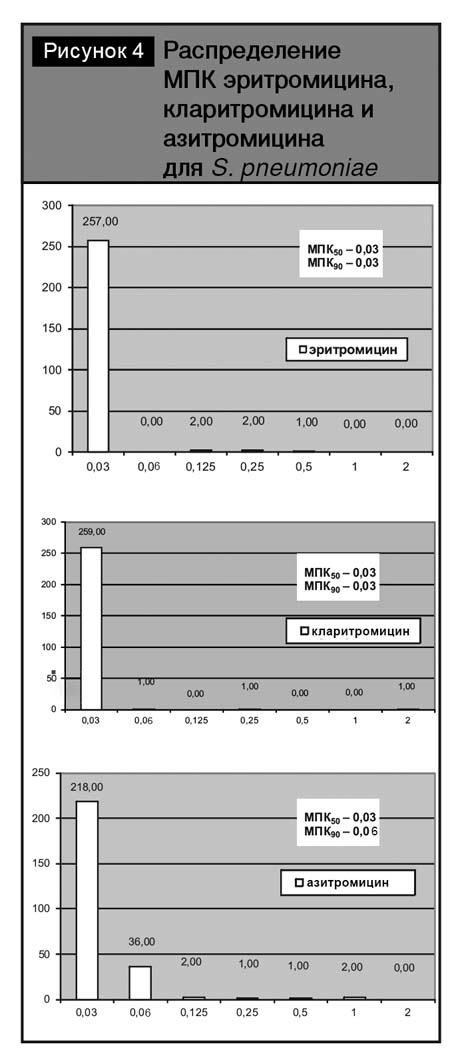
Следует отметить, что эритромицин in vitro был более активен в отношении тестированных изолятов по сравнению с кларитромицином и азитромицином. Так, эритромицин был активен в отношении 99,6% тестированных штаммов (МПК90–0,03 мг/л). Нечувствительными к кларитромицину и азитромицину были 2% тестированных штаммов, МПК90 кларитромицина составила 0,03 мг/л, МПК90 азитромицина – 0,06 мг/л.
Таким образом, кларитромицин, как и другие современные макролиды, может широко использоваться в терапии внебольничных инфекций дыхательных путей.
Мониторинг антибиотикорезистентности S. pneumoniae позволяет оценить состояние антимикробной резистентности и прогнозировать ее дальнейшее развитие, что диктует необходимость его проведения на национальном и региональном уровнях с целью рационализации фармакотерапии внебольничных инфекций дыхательных путей.
Полученные данные – объективная основа для создания и обновления национальных руководств по терапии пневмококковых инфекций.
Таким образом, кларитромицин – распространенный, эффективный препарат, который применяется при многих заболеваниях, в частности при инфекциях респираторного тракта, инфекциях, передаваемых половым путем, лечении хеликобактерной инфекции.
Л и т е р а т у р а
1. Forrest G.N., Oldach D.W. Macrolides and clindamycin // ed. S.L. Gorbach, J.G. Bartlett, N.R. Blacklow Infectious Diseases. – Lippincott Williams and Wilkins. – 3d ed. – 2004. – Р. 213–233.
2. Bryskier A., Butzler J.-P. Macrolides // ed. R.G. Finch, D. Greenwood, S.R. Norrby, R.J. Whitley Antibiotic and Chemotherapy. Anti-infective agents and their use in therapy. – Churchill Livingstone. – 8th ed. – 2003. – Р. 310–325.
3. Neu H.C. // J. Antimicrob. Chemother. – 1991. – Vol. 27 (Suppl. A). – P. 1–9.
4. Mazzei T., Mini E., Novelli A., Periti P. // J. Antimicrob. Chemother. – 1993. – Vol. 31 (Suppl. C). – P. 1–9.
5. Carbon C.J., Rubinstein E. Macrolides, ketolides, lincosamides and streptogramins. In: J. Cohen, W.G. Powderly, S.M. Opal et al. editors. Infectious Diseases. – Elsevier Limited. – 2nd ed. – 2004. – P. 1791-1803.
6. Sivapalasingam S., Steigbigel N.H. Macrolides, clindamycin, and ketolides. In: G.L. Mandell, J.E. Bennett, R. Dolin, editors. Pronciples & Practice of Infectious Diseases. – Churchill Livingstone. – 6th ed. – 2004. – P. 396-417.
7. Bergeron M.G., Bemier M., L‘Ecuyer J. // Infection. – 1992. – Vol. 20. – P. 164-167.
8. Malanoski G.J., Eliopoulos G.M., Ferraro M.J., Moellering R.C. Jr. // Eur. J. Clin. Microbiol. Infect. Dis. – 1993. – Vol. 12. – P. 131–133.
9. Doucet-Populaire F., Capobianco J.O., Zakula D. // J. Antimicrob. Chemother. – 1998. – Vol. 41. – P. 179–187.
10. Doucet-Populaire F., Buriankova K., Weiser J., Pernodet J.L. // Curr. Drug. Targets. Infect. Disord. – 2002. – Vol. 2. – P. 355–370.
11. КозловР.С. Пневмококки: прошлое, настоящее и будущее. – Смоленск: ГМА, 2005. – 128 с.
12. Страчунский Л.С., Козлов С.Н. Современная антимикробная химиотерапия. Руководство для врачей. – М.: Боргес, 2002. – C. 107–110.
13. Козлов Р.С. и соавт. Резистентность S. pneumoniae в России в 1999–2005 гг. // КМАХ. 2006. – Vol. 8(1). – C. 33–48.
14. Bisno A.L., Gerber M.A., Gwaltney J.M. et al. // Clin. Infect. Dis. – 2002. – Vol. 35. – P. 113–125.
15. Brink A.J., CottonM.F., Feldman C. et al. // S. Afr. Med. J. – 2004. –Vol.94. – P. 475–483.
16. Rodvold K.A. // Clin. Pharmacokinet. – 1999. – Vol. 37. – P. 385–398.
17. Abbott Laboratories. Biaxin® Prescribing Information. Available from http: // biaxin.com/bixhome/bixhome.htm.
18. Kaplan E.L., Gooch III W.M., Notario G.F., Craft J.C. // Clin. Infect. Dis. – 2001. – Vol. 32. – P. 1798–1802.
19. McCarty J., Hedrick J.A. Gooch W.M. Adv. Ther. – 2000. – Vol. 17. – P. 14–26.
20. Takker L.I., Dzyublyk O., Busman T., Notario G. // Curr. Med. Res. Opin. – 2003. – Vol. 19. – P. 421–429.
21. Farrell D.J., Morrissey I., Bakker S., Felmingham D. // J. Antimicrob. Chemother. – 2002. – Vol. 50 (Suppl. S1). – P. 39-47.
22. Kaplan E.L., Johnson D.R., Del Rosario M.C., Horn D.L. // Pediatr. Infect. Dis. J. – 1999. – Vol. 18. – P. 1069–1072.
23. Canton R., Loza E., Morosini I., Baquero F. // J. Antimicrob. Chemother. – 2002. – Vol. 50 (Suppl. Sl). – P. 9–24.
24. Richter S.S., Heilmann K.P., Beekmann S.E. et al. // Clin. Infect. Dis. – 2005. – Vol. 41. – P. 599–608.
25. Kataja J., Huovinen P., Skurnik M., Seppala H. // Antimicrob. Agents. Chemother. – 1999. – Vol. 43. – P. 48–52.
26. Ho P.L., Johnson D.R., Yue A.W. et al. // J. Clin. Microbiol. – 2003. – Vol. 41. – P. 937–942.
27. Dubois J., Saint-Pierre C., Temblay С. // Ear. Nose. Throat. J. – 1993. – Vol. 72. – P. 804–810.
28. Niederman M.S., Mandell L.A., Anzueto A. et al. // Am. J. Respir. Crit. Care. Med. – 2001. – Vol. 163. – P. 1730–1754.
29. Mandell L.A., Marrie T.J., Grossman R.F. et al. // Clin. Infect. Dis. – 2000. – Vol. 31. – P. 383–421.
30. Mandell L.A., Bartlett J.G., Dowell S.F. et al. // Clin. Infect. Dis. – 2003. – Vol. 37. – P. 1405–1433.
31. Чучалин А.Г., Синопальников А.И., Яковлев С.В. и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике. – М., 2003. – 39 с.
32. Malfertheiner P., Megraud F., O’Morain C. et al. // Aliment. Fharmacol. Ther. – 2002. – Vol. 16. – P. 167–180.
33. Megraud F. // Drugs. – 2004. – Vol. 64. – P. 1893–1904.
Медицинские новости. – 2012. – №1. – С. 68-72.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.