Ponomarev V.V.1, Shabalina U.S.2, Brileva E.V.2
1 Belarusian Medical Academy of Post-Graduate Education, Minsk
2 Minsk City Emergency Hospital, Belarus
Dose-dependent effectiveness of neyromidin for correction
of aphasia in acute period of cerebral stroke
Резюме. Представлены результаты комплексного неврологического, нейровизуализационного и ультразвукового обследования 60 пациентов с мозговым инсультом с ведущим синдромом в виде различных афазий. Приведено сопоставление имеющихся клинических данных с результатами КТ (МРТ) и ультразвуковой доплерографии. Показано, что включение нейромидина способствует более быстрому регрессу афазии и двигательных нарушений. Продемонстрирован лучший эффект от двойной дозы (1,5% 2 мл/сут) препарата.
Ключевые слова: мозговой инсульт, диагностика, лечение.
Summary. There are the results of complex neurologic, neuroimaging and ultrasound examination of 60 patients with cerebral stroke and different aphasias as the leading syndrome. There is the comparison of the available clinical data with the results of CT (MRI) and ultrasound Doppler echocardiography. It was shown that neyromidin leads to faster regression of aphasia and movement disorders. There was demonstrated the better effect of double dose of the drug (1.5% 2 ml/day).
Keywords: cerebral stroke, diagnostics, treatment.
Мозговой инсульт (острое нарушение мозгового кровообращения) – быстро возникающие очаговые или общемозговые нарушения функций головного мозга сосудистого генеза. Их причины связаны в основном с артериальной гипертензией, атеросклерозом вне- и внутримозговых сосудов, сахарным диабетом, различной кардиальной патологией. Значительно реже (в 5% случаев) этиологическими факторами развития инсульта являются первичные и вторичные васкулиты, аномалии сосудистой системы мозга, антифосфолипидный синдром и др. Традиционно все мозговые инсульты подразделяют на ишемические и геморрагические [4, 6, 7]. Ишемические инсульты (инфаркты мозга) вызваны локальной ишемией участка головного мозга со стойкими (более 24 ч) либо приводящими к летальному исходу нарушениями его функций. В зависимости от патогенетического подтипа по международной классификации TOAST выделяют атеротромботический, кардиогенный (кардиоэмболический), гемодинамический, гемореологический, лакунарный и криптогенный инфаркты мозга [3]. Геморрагические мозговые инсульты обычно делят на кровоизлияния в мозг (паренхиматозное кровоизлияние), субарахноидальные (под-оболочечные) кровоизлияния, спонтанные (нетравматические) эпидуральные и субдуральные кровоизлияния. В структуре мозговых инсультов преобладают инфаркты мозга (до 80% всех случаев). Соотношение между ишемическим и геморрагическим инсультом в различных регионах мира составляет 4–5:1 [9].
Диагностика и лечение мозговых инсультов остается одной из самых острых проблем здравоохранения, что связано с их высокой частотой и значимыми последствиями для пациентов и общества. Эта патология приводит к высокому уровню инвалидизации и смертности. Значимость инсульта как медико-социальной проблемы растет с каждым годом, что связано с неуклонным ростом заболеваемости инсультом [1–9]. Несмотря на проводимую демографическую программу в нашей стране частота и смертность от инсульта также значимо не уменьшается, особенно среди лиц трудоспособного возраста. К сожалению, сохраняется крайне низкий (13%) процент реабилитации среди пациентов, перенесших инсульт, что обосновывает дальнейшие исследования для улучшения эффективности оказания специализированной помощи при данной патологии.
Наиболее значимыми последствиями мозгового инсульта наряду с центральными парезами и параличами (50–80%), нарушениями статики и походки (20–25%), расстройствами чувствительности (25%) являются различные изменения речи, которые отмечаются у 30–45% всех пациентов [10]. Среди них преобладают различные виды афазии (моторная, сенсорная, амнестическая, семантическая и др.), обусловленные поражением корковых центров речи в доминантном полушарии. Восстановление речевых функций при афазиях – чрезвычайно сложный и длительный процесс, преследующий цель возвращения этих пациентов к общественной и социальной жизни, труду, общению с окружающими. Продолжительность восстановления речи при мозговых инсультах индивидуальна, зависит от множества факторов: объема и топографии очага поражения, возраста, зрелости мозга, состояния коллатерального кровообращения, срока начала реабилитации и др. [1, 8]. Регресс афазии существенно снижается по мере отдаления от острого периода заболевания. Механизмы улучшения речевых функций напрямую связаны с нейропластичностью – способностью нервной системы адаптироваться путем оптимальной структурно-функциональной перестройки. В настоящее время выделяют функциональную (обратимую) и постоянную пластичность, которая приводит к стойкому увеличению количества синаптических контактов в головном мозге [2, 5].
С целью стимуляции нейропластичности головного мозга и достижения регресса афазии при инсультах в клинической практике широко используют методики логопедической реабилитации, транскраниальной магнитной стимуляции и лекарственной коррекции. В рандомизированных исследованиях отмечен положительный эффект применения пирацетама (Piracetam in Aute Stroke Stydy) в высоких дозах (12 г/сут), церебролизина (20 мл/сут), мадопара и пронорана (в малых дозах), декстроамфетамина, вазопрессина [1, 8]. Поиск новых медикаментов, улучшающих нейротрансмиссию, продолжается на доклинических стадиях.
Среди зарегистрированных препаратов с похожим механизм действия внимание исследователей привлек ипидакрин (Нейромидин®). Известно, что в основе его фармакологической активности лежат два молекулярных эффекта: блокада калиевой проницаемости мембраны и ингибирование холинэстеразы. Нейромидин влияет на все звенья передачи возбуждения в холинергических нейронах, способствует увеличению выброса медиатора в синаптическую щель, уменьшает метаболизм ацетилхолина вследствие ингибирования холинэстеразы и бутирилэстеразы, повышает активность постсинаптической мембраны. Ранее проведенными клиническими и экспериментальными исследованиями показано влияние препарата на церебральную гемодинамику, биоэлектрическую активность мозга, способность увеличивать нейропластичность и регресс двигательных и речевых нарушений у пациентов с инфарктами мозга и внутримозговыми кровоизлияниями [4–7]. Однако остается до конца не ясным выбор адекватных дозовых программ и сроки начала назначения нейромидина в остром периоде мозгового инсульта.
Цель исследования – изучение динамики неврологических нарушений (в частности, различных видов афазий) у пациентов в остром периоде инфарктов мозга и внутримозговых кровоизлияний в доминантном полушарии головного мозга при проведении комплексных лечебно-реабилитационных мероприятий с использованием различных доз инъекционной формы нейромидина и учет его переносимости и безопасности.
Задачи исследования:
– изучение роли нейровизуализации и ультразвуковых методов с целью уточнения состояния головного мозга и сердечно-сосудистой системы в формировании острого периода инсультов;
– изучение динамики речевых и двигательных нарушений в остром периоде инфарктов мозга и внутримозговых кровоизлияний в доминантном полушарии головного мозга и определение их корреляции с результатами инструментальных исследований;
– оценка эффективности двух доз нейромидина (1,5% 1 мл/сут и 1,5% 2 мл/сут) в комплексе терапии, направленной на регресс неврологической симптоматики при этой патологии;
– сравнительный анализ переносимости и побочных эффектов различных доз данного препарата.
Материалы и методы
С ноября 2011 г. по май 2012 г. на базе профилизированного неврологического отделения Городской больницы скорой медицинской помощи Минска проведено параллельное открытое клиническое исследование. Обследованы 60 пациентов с острым мозговым инсультом (женщин 37, мужчин 23, средний возраст 65,1 ± 2,6 лет) и благоприятным исходом заболевания. Критерии включения в исследование: сохранность сознания; наличие явных клинических признаков афазии. Критерии исключения: возраст 85 лет и старше; когнитивные нарушения умеренной и выраженной степени; декомпенсированные соматические заболевания (бронхиальная астма, стенокардия и др.).
По специально разработанному нами протоколу изучали жалобы, анамнез течения основного сосудистого заболевания, сопутствующую патологию, определяли темп развития инсульта и сроки госпитализации в неврологическое отделение. Объективный соматический и неврологический статус оценивали традиционно. Дизайн исследования включал количественную оценку основных неврологических симптомов в баллах и оценку в динамике на 1–2-е и 8–10-е сутки от начала заболевания. Определение степени нарушений двигательных функций конечностей (объем движений, мышечная сила) проводили по 5-балльной шкале инсульта Национального института здоровья: 0 – отсутствие движений (плегия), 1–2 балла – выраженный парез, 3 балла – умеренный парез, 4 балла – легкий парез, 5 баллов – нормальная мышечная сила. Мышечный тонус оценивали по модифицированной по 5-балльной шкале спастичности: 0 – низкий тонус, 2 балла – нормальный тонус, 5 баллов – резко выраженное повышение тонуса. Проводили количественную оценку афазии в соответствии с классификацией А.Р. Лурия по 8-балльной шкале: выраженные афатические нарушения оценивали 5–8 баллами, умеренные – 3–4 баллами, легкие – 1–2 баллами, 0 – отсутствием афазии. Для выделения патогенетического подтипа инфарктов мозга использовали общепринятую классификацию TOAST (Trial of Organization in Acute Stroke Treatment).
С целью уточнения диагноза проводили комплексное лабораторное и инструментальное исследования. Выполняли рутинные анализы крови, мочи, сахар крови, биохимические исследования крови (холестерин, липидный спектр, мочевина, креатинин, коагулограмма). Наличие, объем и локализацию поражения головного мозга оценивали с помощью нейровизуализации в первые сутки поступления всем пациентам и по показаниям в динамике на 2–3-и сутки. Использовали МРТ-аппарат «Magnitom-Simmens» (1,5 тесла) и КТ-аппарат «Lait Speed 16 Pro» (Германия). Для определения локализации очага внутримозгового кровоизлияния применяли классификацию Н.Н. Верещагина и соавт. (1997). При подтверждении диагноза инфаркта мозга выполняли ультразвуковую доплерографию (УДЗГ) в сочетании с транскраниальной доплерографией (25 чел.) на аппарате «Acuson Cypres» (США). Оценивали скорость линейного кровотока по магистральным артериям, его асимметрию, степень стенозирующего поражения, состоятельность вилизиевого круга и коллатерального кровообращения. При подозрении на кардиоэмболический подтип инфаркта мозга выполняли трансторакальную эхокардиографию (ЭхоКГ).
После подтверждения диагноза методом случайной выборки все пациенты были разделены на три группы (две основные и контрольная) по 20 человек в каждой группе, сопоставимых по возрасту, полу и исследуемым нозологическим формам, которым проводились общепринятые схемы базисной терапии. Они включали стабилизацию жизненно важных функций, по показаниям – антиагреганты и непрямые антикоагулянты (аспирин, гепарин) и противоотечную терапию (сормантол, лазикс), гипотензивную терапию, нейропротекторы (эмоксипин). В трех наблюдениях выполнен системный тромболизис (альтеплаза). Всем пациентам с нормальным уровнем сознания с первых дней поступления проводилась логопедическая коррекция. Кроме перечисленного больным первой и второй основных групп в комплекс терапии с 1–2-го дня поступления был включен Нейромидин® в инъекциях (с учетом известных противопоказаний), который назначали в дозе 1,5% 1 мл внутримышечно один раз в сутки (1-я группа) и 1,5% 1 мл внутримышечно два раза в сутки (2-я группа). Контрольная группа получала только базисную терапию.
Переносимость, побочные реакции, осложнения нейромидина и его эффективность регистрировали при помощи анкет. Результаты лечения по количественным оценочным шкалам обработаны с помощью программ Exсel и Statistica 6.0. Рассчитывали среднее арифметическое и стандартное отклонения. Степень достоверности определяли с помощью t-критерия Стьюдента. За уровень статистической достоверности принимали результаты при p < 0,05.
Результаты и обсуждение
На основании клинико-инструментального исследования у 45 (75%) пациентов диагностированы инфаркты мозга, локализация которых преобладала в бассейне левой среднемозговой артерии, а у 15 (25%) – внутримозговые кровоизлияния в левую гемисферу головного мозга. Соотношение ишемических и геморрагических инсультов в обследуемой группе составило 3:1.
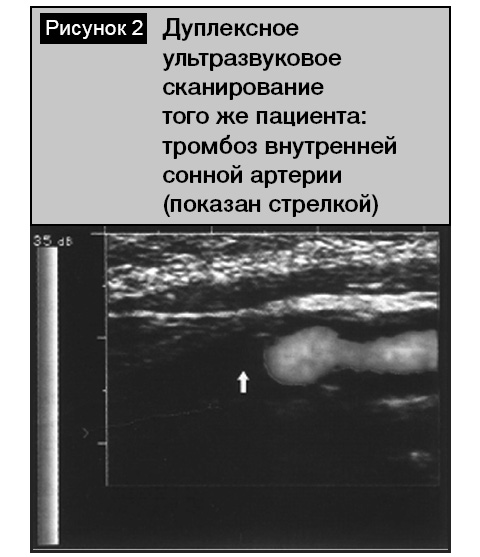
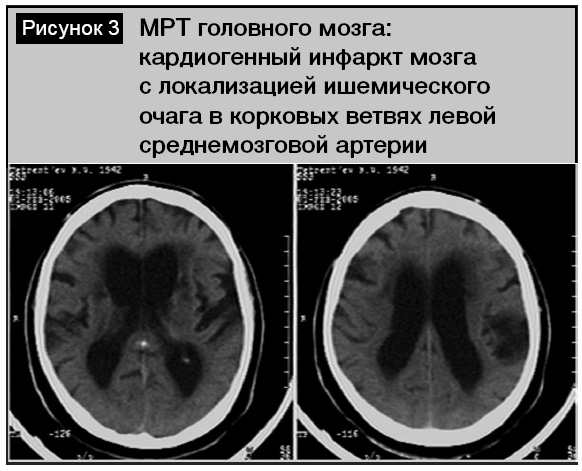
Среди пациентов с инфарктами мозга (по классификации TOAST) преобладал кардиоэмболический (23 человека, 38,3%) и атеротромботический (16 пациентов, 26,6%) патогенетический подтипы. Подобное превалирование кардиогенного подтипа инфаркта мозга было нетипичным среди лиц пожилого и старческого возраста, так как в этой возрастной группе всегда существенно преобладает атеротромботический тип [3, 6]. В нашем исследовании этот факт объясняется анатомо-топографическими особенностями обследованной группы пациентов, связанный с тем, что внутренняя сонная и среднемозговая артерии, кровоснабжающие речевые зоны коры, являются прямым продолжением сосудов из выходящих отделов сердца. Значительно реже в обследованной группе встречался лакунарный (3 человека, 5%), гемодинамический (1 больной, 1,6%) и криптогенный (2 человека, 3,3%) подтипы инфаркта мозга. У 4 (6,6%) пациентов инфаркт мозга носил повторный характер. Всем этим больным при поступлении выполнена МРТ (КТ) головного мозга. Наиболее типичными изменениями (у 32 человек, 53,3%) было обнаружение одного (реже нескольких) очага пониженной плотности, которые локализовались в бассейне левой внутренней сонной артерии кортикально либо субкортикально. Размеры инфарктных очагов отличались в зависимости от диаметра питающей артерии. При атеротромботическом типе очаг чаще носил более обширный характер, локализуясь в лобно-височно-теменной области доминантного полушария (рис. 1), что указывало на окклюзию левой внутренней сонной артерии. Проведение УЗДГ у этих пациентов в 8 случаях позволило подтвердить этот факт (рис. 2). У остальных обследованных имело место асимметричное (S > D) стенозирующее поражение брахиоцефальных артерий с утолщением их стенок (КИМ 1,2–1,5 мм) со снижением скорости кровотока и непрямолинейностью хода. Для кардиоэмболического подтипа инфаркта очаг был чаще локализован кортикально в левой височной доле в зоне кровоснабжения левой среднемозговой артерии (рис. 3). Основной причиной его развития была мерцательная аритмия. При ЭхоКГ выявлен тромбоз ушка левого предсердия (2 человека) и изменения аортального клапана (1 пациент). Следует отметить, что при наличии очаговых симптомов в первые сутки у 13 человек не было обнаружено инфарктных очагов, а изменения в головном мозге касались только гидроцефально-атрофических нарушений и лейкоареоза. Повторные исследования через 1–2 дня у 7 пациентов позволили обнаружить формирующиеся инфарктные очаги.
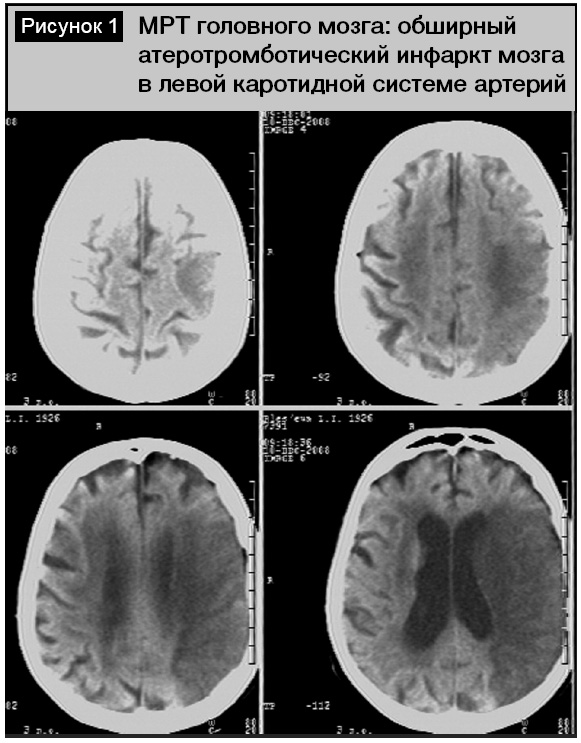
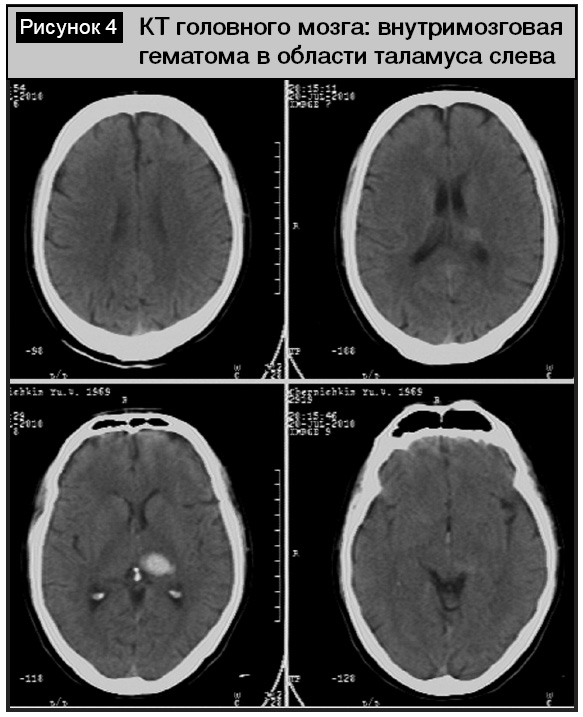
Среди пациентов с внутримозговыми кровоизлияниями преобладали латеральные кортикально-субкортикальные гематомы (11 человек, 18,3%), реже (у 3 больных) гематомы носили медиальный характер, локализуясь в области внутренней капсулы или таламуса (рис. 4). Гематомы были различного объема – от 4,8 до 54,7 см3, всегда сопровождались перифокальным отеком. Прорыв крови в желудочковую систему отмечен у 4 пациентов, из них в одном случае (женщина, 29 лет) при проведении ангиографии выявлена мешотчатая аневризма, пациентка была оперирована (аневризма укутана тахокомбом).
При поступлении у всех пациентов двух основных и контрольной группы в клинической картине преобладали афатические нарушения, которые носили полиморфный характер, различаясь по степени выраженности. Преобладала комплексная сенсомоторная афазия (28 человек, 46,6%), при которой нередко превалировал моторный либо сенсорный компонент. Тотальная афазия отмечена в 14 случаях, как правило, при массивных атеротромботических инфарктах мозга либо умеренных кортикальных гематомах. Реже встречались «чисто» моторная (10 пациентов), сенсорная (4), акустико-амнестическая (2), амнестическая (1) и семантическая (1 человек) афазия. Данные речевые нарушения преобладали при небольших размерах инфарктов мозга либо кортикально-субкортикальных гематомах локализованных в соответствующих речевых зонах лобной и височной областей. Однако обращало на себя внимание несовпадение локализации очага у 7 пациентов с имеющимися речевыми нарушениями. Так, при небольших внутримозговых гематомах в области базальных ганглиев или внутренней капсулы отмечали выраженную моторную либо сенсомоторную афазию. По нашему мнению, это могло быть связано с разрывом ассоциативных связей между корковыми центрами речи и формированием так называемой «подкорковой» афазии, которая по своим клиническим характеристикам напоминает афазию Вернике–Кожевникова.
Вторым по частоте неврологическим синдромом был пирамидный синдром (33 пациента, 55%), который различался по выраженности от легкого гемипареза или монопареза руки либо ноги до гемиплегии. Последние отмечались не только при массивных атеротромботических полушарных инфарктах мозга или кортикальных гематомах, но и при относительно малых размерах инфарктов либо гематомах, локализованных в области базальных ганглиев. В 27 случаях (45%), несмотря на наличие афазии, двигательные нарушения в конечностях у пациентов отсутствовали. Причиной этого, по нашему мнению, мог быть меньший объем повреждения мозговой ткани. Такой тип афазии в литературе получил название афемии, или малого синдрома Брока [3].
Третьим изучаемым нами клиническим проявлением был мышечный тонус в контр-латеральных от доминантного полушария конечностях. Отмечено, что в остром периоде инсультов тонус в этих конечностях остается нормальным (33 пациента, 55%) или сниженным (23 человека, 38,3%), что объясняют состоянием диашиза мозговой ткани [6]. Лишь у 3 (5%) пациентов в пораженной руке и ноге мышечный тонус был значительно повышен по пирамидному типу, наблюдаясь исключительно при обширных очагах поражения и всегда сопровождаясь плегией конечностей. В последующие дни после инсульта мышечный тонус чаще повышался, иногда формируя мышечные контрактуры в суставах в раннем восстановительном периоде.
Представляла интерес динамика неврологических симптомов и результаты комплексной терапии, которые мы анализировали раздельно по группам. В первой группе пациентов различные виды афазии были умеренно выражены (5,3 ± 0,5 балла), двигательные нарушения носили характер выраженных гемипарезов (силу в конечностях оценивали в 1,1 ± 0,4 балла), мышечный тонус у них был не изменен (2,1 ± 0,2 балла). На фоне проводимой терапии спустя 8–10 дней отмечали регресс афазии до ее умеренной выраженности (3,6 ± 0,6 балла, p < 0,05, рис. 5). Возросли мышечная сила и тонус в конечностях, однако эти изменения не были достоверными (рис. 6, 7).
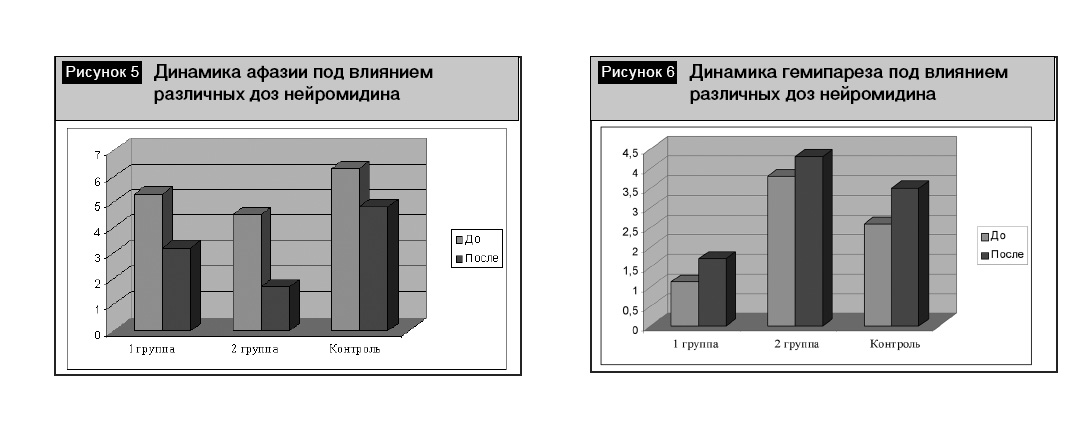
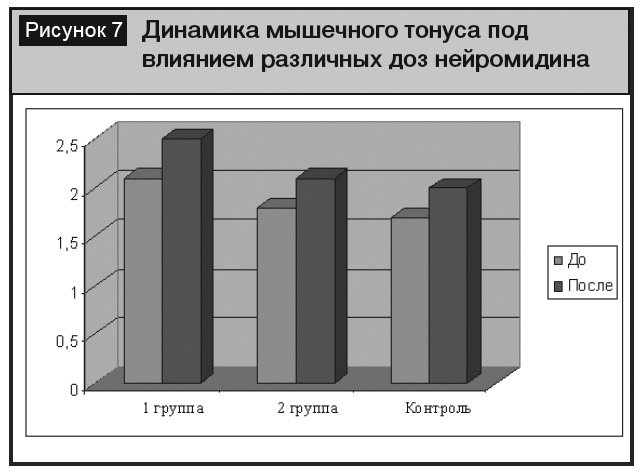
Во второй группе пациентов различные виды афазии были также умеренно выражены (4,5 ± 0,4 балла), двигательные нарушения носили характер умеренных гемипарезов (силу в конечностях оценивали в 3,8 ± 0,5 балла), мышечный тонус был не изменен (2,1 ± 0,2 балла). На фоне проводимой терапии спустя 8–10 дней отмечали более значимый регресс афазии до ее легкой степени (1,7 ± 0,6 балла, p < 0,05, рис. 5). Возросла мышечная сила до степени легкого гемипареза 4,3 ± 0,3, p < 0,05, рис. 6), мышечный тонус в конечностях повысился до 2,5 ± 0,2 балла, однако эти изменения не были достоверными (рис. 7). Полученные нами данные об отсутствии влияния Нейромидина® в дозе 1,5% 2 мл/сут на повышение мышечного тонуса имеют практическое значение, так как часть ангионеврологов опасаются именно этого негативного эффекта Нейромидина® в остром периоде лечения инсульта.
Полученные нами результаты применения Нейромидина® в комплексном лечении мозговых инсультов подтверждены в ранее опубликованных исследованиях. А.А. Козелкин и соавт. [6] отметили эффективность Нейромидина® в таблетированной форме в суточной дозе 60–80 мг (3–4 таблетки) с первых дней мозгового инсульта в сочетании с прозерином 0,5 мл два раза в сутки. Т.С. Мищенко и С.А. Козелкина [7] назначали 0,5%-ный раствор Нейромидина® по 2 мл два раза в сутки внутримышечно при внутримозговых гематомах на 3–5-й день заболевания и отметили лучшее восстановление двигательных нарушений, регресс афатических расстройств и повышение уровня самообслуживания пациентов. По нашему мнению, инъекционная форма, концентрация 1,5% и двукратность назначения в течение дня более предпочтительны, повышая приверженность больных к продолжению терапии.
Положительная динамика в плане регресса афазии и двигательных нарушений нами также отмечена и в контрольной группе пациентов, однако эти изменения не были достоверными (рис. 5–7). Однако следует учитывать, что в контрольной группе выраженность афазии до назначения лечения была более грубой, чем у больных двух основных групп, поэтому этот факт требует дальнейшего изучения в большем количестве наблюдений.
Переносимость комплексной терапии во всех группах пациентов была хорошей. В первой группе результаты терапии, по мнению врача и пациента (результаты анализировали раздельно), 8 больных оценили как удовлетворительные, 12 – как хорошие. Во второй группе результаты терапии 3 пациента оценили как удовлетворительные, 17 – как хорошие. Осложнение от применения нейромидина отмечено нами только у одного пациента во второй группе в виде кожной сыпи на 3-й день назначения. Препарат был отменен, что сопровождалось регрессом сыпи.
Таким образом, результаты комплексной терапии у пациентов с мозговыми инсультами в остром периоде заболевания показали, что включение Нейромидина® способствует более быстрому регрессу основных неврологических симптомов. Двойное увеличение дозы Нейромидина® приносит больший позитивный эффект, не приводит к негативным последствиям и легко переносится.
Л И Т Е Р А Т У Р А
1. Белопасова А.В., Шахпаронова Н.В., Кадыков А.С. // Неврол. журн. – 2011. – № 1. – С. 37–41.
2. Боголепова А.Н., Чуканова Е.И. // Журн. неврологии и психиатрии. – 2010. – № 8. – С. 72–75.
3. Болезни нервной системы: рук-во для врачей / под ред. Н.Н. Яхно. – 4-е изд. – М.: Медицина, 2005. – Т. 1. – С. 179–181, 232–272.
4. Даценко И.В., Кузнецова С.М. // Пробл. старения и долголетия. – 2007. – № 1. – С. 55–61.
5. Живолупов С.А., Самарцев И.Н. // Журн. неврологии и психиатрии. – 2009. – № 4. – С. 78–85.
6. Козелкин А.А., Сикорская М.В., Козелкина С.А. // Укр. вестн. психоневрологии. – 2004. – № 2. – С. 12–14.
7. Мищенко Т.С., Козелкина С.А. // Укр. вестн. психоневрологии. – 2006. – № 2. – С. 21–24.
8. Прокопенко С.В., Можейко Е.Ю., Никольская О.Н. // Неврол. журн. – 2008. – № 4. – С. 48–51.
9. Суслина З.А., Максимова М.Ю., Федорова Т.Н. // Неврол. журн. – 2007. – № 4. – С. 4–8.
10. Ali M., Bath P., Lyden P. // Eur. J. Neurol. – 2012. – Vol. 19 (Suppl. 1). – P. 484.
Медицинские новости. – 2012. – №10. – С. 45-49.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.